基于三苯基膦修飾的線粒體靶向7-羥基香豆素納米粒的制備及其性質*
葉 琳,徐鳳男,何 流,羅斌華
(湖北科技學院藥學院,湖北 咸寧 437100)
香豆素類(coumarins)為α-吡喃酮結構化合物,其生物活性較多,主要有抗腫瘤、抗炎、熒光效應[1-2]。7-羥基香豆素(7-HC)作為香豆素類化合物,具有共軛基團,可以發生電荷轉移,具有很強的熒光,曾被作為熒光探針,通過化學反應間接測量某些化學元素的含量或者顯示細胞內定位效果[2-3]。
納米粒作為一種靶向給藥系統,粒徑在100nm以內,可聚集在肝、脾、骨髓等靶部位以及通過高滲透滯留效應(EPR)或者胞吞作用滯留腫瘤細胞內[4-5]。
本研究選取的載體材料三苯基膦-聚乳酸(TPP-PLLA)為實驗室自制,對腫瘤細胞無明顯毒副作用。采用乳化-溶劑揮發法制備7-HC納米粒(7-HC/T-P NPs),提高7-HC的體外穩定性;考察不同因素對納米粒粒徑、包封率、載藥量的影響,在此基礎上采用響應面Box-Behnken法優化處方工藝,最后探討其熒光效果,從而為7-HC/T-P NPs在線粒體靶向定位中的應用提供理論依據。
1 材料與方法
1.1 儀器與試藥
FA224電子分析天平(上海舜宇恒平儀器);DF-Ⅱ集熱式恒溫磁力攪拌器(江蘇金壇億通電子有限公司);真空干燥箱(上海精宏實驗設備);TGL-16低溫冷凍高速離心機(四川蜀科儀器有限公司);CARY 50 Conc紫外分光光度計(中國瓦里安);KQ3200DB數控超聲波清洗儀(昆山市超聲儀器有限公司);超聲細胞破碎儀(江蘇天翎儀器);ZEN3700激光粒度儀(英國馬爾文);SA3000光學顯微鏡(北京泰克儀器有限公司制造);BX-53熒光顯微鏡(中國奧林巴斯)。
7-HC、十二烷基硫酸鈉(SDS)、聚乙二醇,泊洛沙姆(上海阿拉丁生化科技股份有限公司);二氯甲烷、無水乙醇(國藥集團化學試劑有限公司,分析純);TPP-PLLA為實驗室自制;司盤80、吐溫20、吐溫80(天津市百世化工有限公司);大鼠C6膠質瘤(C6)細胞購自上海生命科學研究所細胞資源中心(中國上海)。
1.2 7-HC含量測定
1.2.1 7-HC標準曲線的繪制
采用UV法測定。精密稱取0.002 0g干燥7-HC對照品,置于50mL容量瓶中,甲醇稀釋至刻度,得到0.040 0mg/mL 7-HC對照品母液。準確吸取0.10、0.25、0.5、1.00、3.00、5.00mL母液,分別置于10mL容量瓶中,甲醇稀釋至刻度,得到濃度為0.000 4、0.001 0、0.002 0、0.004 0、0.012 0、0.020 0mg/mL樣品。甲醇作空白對照調零,200~800nm波長掃譜,以對照品溶液濃度為橫坐標,吸光度為縱坐標,繪制標準曲線,得回歸方程。
1.2.2 包封率和載藥量的測定
用移液槍精密移取1mL 7-HC/T-P NPs溶液,于超濾管內管(截留分子量3kDa)中,10 000rpm離心2次,10min/次,收集超濾管外管中游離7-HC。用甲醇稀釋至10mL后,用移液槍從中移取0.5mL稀釋液于試管中,繼續加入2.5mL甲醇稀釋至3mL,用紫外分光光度計測定其吸光度,計算樣品中藥物濃度。根據公式(1)、公式(2)計算7-HC/T-P NPs的包封率和載藥量。

(1)

(2)
(M總:7-HC/T-P NPs中總投藥量;M游離:游離藥物含量;M納米粒:7-HC/T-P NPs中所載的藥物和輔料量總和)
1.2.3 精密度
取7-HC對照品母液適量配成低(0.003 0mg/mL)、中(0.005 0mg/mL)、高(0.007 0mg/mL)濃度溶液,紫外測定,5次/d,5遍/次,連續測5d,計算其質量濃度,考察日內和日間精密度。
1.2.4 重復性
取7-HC對照品母液,平行配成0.005 0mg/mL濃度溶液5份,紫外測試吸光度,每份測試5遍,計算其吸光度的RSD值。
1.2.5 穩定性
取0.005 0mg/mL濃度7-HC對照品母液,分別在0、4、12、24、48、72h測定吸光度,每個時間點測試5遍,計算其吸光度的RSD值。
1.2.6 準確度
取7-HC對照品母液適量配成低、中、高濃度溶液(0.003 0、0.005 0、0.007 0mg/mL),紫外測定吸光度,每份測試5遍,測得的吸光度代入標準曲線計算其濃度,考察與真實濃度的比,計算準確的RSD值[6]。
1.3 7-HC/T-P NPs制備
7-HC易溶于乙醇和水的混溶液,制備油包水型單乳時藥物易析出,復乳法可以幫助減少析出情況,提高包封率和載藥量。故采用乳化-溶劑揮發法中的復乳法幫助制備載藥7-HC/T-P NPs。取TPP-PLLA載體材料0.030 0g,溶解于3mL二氯甲烷中,加入0.250 0g司盤80,混合溶液作為油相;取7-HC 0.003 0g溶于0.5mL無水乙醇中,再加入1mL純水,作為內水相;將油相置于磁力攪拌器上攪拌,緩慢將內水相滴加入油相中,繼續攪拌3min,形成W/O型初乳。然后將5mL SDS溶液(1%,m/v)緩慢滴加到初乳中,攪拌5min形成W/O/W型復乳。復乳超聲(195W)15min,固化4h后得到7-HC/T-P NPs。
1.4 單因素篩選
1.4.1 外乳化劑類型篩選
按1.3制備條件,固定處方中其他因素不變,將1%的吐溫20、吐溫80、SDS、泊洛沙姆作為外乳化劑類型進行篩選。
1.4.2 外乳化劑濃度篩選
按1.3制備條件,固定處方中其他因素不變,將外乳化劑濃度按照1%、2%、3%進行篩選。
1.4.3 內乳化劑用量篩選
按1.3制備條件,固定處方中其他因素不變,將內乳化劑用量分為0.125 0g、0.1875g、0.250 0g進行篩選。
1.4.4 載體材料質量篩選
按1.3制備條件,固定處方中其他因素不變,載體材料質量按照0.010 0、0.025 0、0.050 0、0.075 0、0.100 0g進行篩選。
1.4.5 有機相與內水相體積比篩選
按1.3制備條件,固定處方中其他因素不變,有機相與內水相體積比按照3∶2、2∶1、3∶1比例篩選。
1.5 Box-Behnken試驗設計
在單因素實驗的基礎上,進行Box-Behnken響應面優化[7-8]。選擇載體質量(A)、SDS濃度(B)、有機相體積(C)作為因素,粒徑(x)、包封率(y)、載藥量(z)作為響應值。根據因素對7-HC/T-P NPs制備的影響進行擬定權重,以綜合評分作為評價指標。綜合評分=20×粒徑/最大粒徑+40×包封率/最大包封率+40×載藥量/最大載藥量。因素水平分為-1、0、1,見表1。

表1 Box-Behnken實驗因素水平表
1.6 7-HC/T-P NPs處方驗證
利用Design-Expert.V8.0.6軟件得到納米粒的最優處方工藝及其綜合評分的預測值。將最優處方進行3次處方驗證,分析所得結果是否與預測值符合。
1.7 7-HC/T-P NPs的穩定性
取適量7-HC/T-P NPs溶液,加蒸餾水稀釋后,激光粒度儀對其水化粒徑與電位進行測量,記錄粒徑以及Zeta電位大小。通過記錄20d的粒徑和Zeta電位變化,判斷納米粒是否穩定。
1.8 7-HC/T-P NPs的熒光試驗
將神經膠質瘤(C6)細胞接種于細胞爬片上,37℃孵育24h后,加入適量7-HC/T-P NPs溶液,繼續37℃孵育10h后,將細胞爬片倒置于載玻片上;同時另取適量7-HC/T-P NPs溶液滴于載玻片上,皆置于熒光顯微鏡下,觀察兩者熒光效果。
1.9 統計學方法

2 結 果
2.1 7-HC對照品標準曲線
如圖1(封二)所示,藥物在波長325nm處有最大吸光度,而輔料無干擾吸收。以吸光度A對濃度C進行線性回歸,得到標準曲線為A=98.863 C+0.006 7,r=0.999 6。在0.000 4~0.020 0mg/mL濃度范圍內呈良好的線性關系。
2.2 方法學驗證
2.2.1 精密度
結果如表2,表明多個樣品在同一天測定時,誤差較小,精密度良好。

表2 精密度(n=5)
2.2.2 重復性
結果如表3,7-HC溶液吸光度的RSD值為2.414%,表明儀器方法重復性較好。

表3 重復性(n=5)
2.2.3 穩定性
結果如表4,72h內的7-HC溶液吸光度RSD值為1.946%,表明在此時間段,穩定性良好。

表4 穩定性(n=5)
2.2.4 準確度
結果如表5,三種濃度的準確度RSD值皆小于2%,表明此方法的準確度良好。

表5 準確度(n=5)
2.3 單因素試驗
2.3.1 外乳化劑類型對7-HC/T-P NPs的影響
結果如表6,7-HC/T-P NPs外觀如圖2(封二)所示,選擇外觀有藍色乳光,包封率和載藥量相對較高的SDS作為外乳化劑。

表6 外乳化劑類型對7-HC/T-P NPs的影響
2.3.2 外乳化劑濃度對納米粒的影響
結果如表7,粒徑皆小于100nm,包封率和載藥量也相對較高,考慮到SDS的細胞溶血以及生物安全性,故濃度范圍控制在3%以內,在此之內皆可作為較好的外乳化劑濃度選擇。
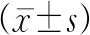
表7 外乳化劑濃度對7-HC/T-P NPs的影響
2.3.3 內乳化劑用量對7-HC/T-P NPs的影響
結果如表8,粒徑皆小于100nm,且包封率和載藥量較高。考慮到乳化劑的生物安全性,故選擇0.125 0~0.250 0g作為響應面設計的內乳化劑用量因素范圍,進行進一步優化。
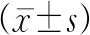
表8 內乳化劑用量對7-HC/T-P NPs的影響
2.3.4 載體材料質量對7-HC/T-P NPs的影響
結果如表9,5個質量得到的粒徑均在100nm以內,載藥量隨著載體材料質量的增加而降低,綜合考慮,選擇0.010 0~0.050 0g作為進一步篩選的范圍。
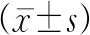
表9 載體材料質量對7-HC/T-P NPs的影響
2.3.5 有機相與內水相體積比對7-HC/T-P NPs的影響
結果如表10,有機相與內水相體積比例的改變影響著7-HC/T-P NPs的粒徑和包封率大小,載藥量變化不明顯。綜合考慮,調整體積大小,選擇2、3、4mL作為響應面有機相體積因素篩選范圍。

表10 有機相與內水相體積比對7-HC/T-P NPs的影響
2.4 Box-Behnken試驗設計結果
采用Design-Expert.V8.0.6軟件設計實驗方案,其擬合結果見表11,響應面試驗結果方差分析見表12。
利用方差分析對表11數據結果進行回歸分析,得到回歸方程:綜合評分=101.854 57-1 274.885 93A+40.730 99B-36.99 301C+89.458 02AB+126.661 82AC-1.73 630BC+1 685.553 80A2-7.005 00B2+5.512 08C2。回歸方程系數r=0.936 4,表明回歸模型擬合較好。

表11 Box-Behnken實驗設計與結果


表12 響應面回歸模型方差分析
2.5 處方驗證
最優處方為:0.0100g載體材料質量(A)、2.63%SDS濃度(B)、2mL有機相體積(C),根據實際情況調整處方,即0.0100g TPP-PLLA,2.5%SDS,2mLCH2Cl2,預測綜合評分為91.7571。結果見表13,綜合評分的預測值和實測均值的偏差約為0.7,RSD值為0.9%,相差較小,表明處方工藝重復性良好,可行性較好。

表13 處方工藝的驗證結果(n=3)
2.6 7-HC/T-P NPs外觀及其穩定性
結果如圖4(封二)所示,7-HC/T-P NPs帶有明顯的藍色乳光,其平均粒徑為(67.60±0.19)nm,Zeta電位為(-40.14±4.01)mV,兩者在35d內無明顯變化,說明7-HC/T-P NPs在體外有較好的穩定性。
2.7 7-HC/T-P NPs熒光效果
結果如圖5(封二)所示。7-HC/T-P NPs在熒光顯微鏡下呈現密集分布的藍色“小點”(圖5a);在神經膠質瘤(C6)細胞中,7-HC/T-P NPs分布在核周圍,呈現藍色熒光,間接實現細胞成像(圖5b)。
3 討 論
納米粒制備方法多采用超聲乳化-溶劑揮發法。其中超聲雖然可以制備粒徑較小的納米粒,但是水溶性的藥物容易從內水相中泄漏出來,得到較低的包封率和載藥量,不能滿足制備的要求。將超聲換成磁力攪拌,得到復乳后,再進行超聲分散,這樣在攪拌過程中團聚的粒子會被分散開,粒徑也會變小,在得到較高包封率的同時還滿足了納米粒的粒徑要求。
作為膠體分散體系的納米粒,粒子周邊會攜帶電荷,電荷斥力大時,粒子不易團聚。所以納米粒的穩定性不僅可通過外觀的性狀來分辨,還可以通過Zeta電位大小變化來分析,Zeta電位的絕對值越大,一般越穩定[9]。7-HC/T-P NPs水合Zeta電位為(-40.14±4.01)mV,絕對值大于30,并且其一個月的電位和粒徑變化較小,說明7-HC/T-P NPs的穩定性能力較好。
納米粒的包封率、載藥量和粒徑是其主要評價指標,篩選了外乳化劑類型、外乳化劑濃度、內乳化劑用量、載體材料質量、有機相與內水相體積比幾個處方因素,其中載體材料質量和外乳化劑濃度對7-HC/T-P NPs的制備效果影響顯著,其他因素影響較小。攪拌轉速和超聲功率一般對粒徑的大小影響較大,控制了攪拌轉速和超聲功率后,處方中粒徑只由上述因素決定。納米粒粒徑較小,采用常用的高速離心法、微柱離心法等方法測量包封率費時且分離不完全,而超濾管離心分離是一種膜分離技術,小分子能透過膜的孔隙,大分子納米粒則不能通過,能實現游離藥物和納米粒的良好分離[10-12],故本實驗采用超濾管法測量7-HC/T-P NPs的包封率和載藥量。
作為納米粒內相所包載的物質時,需要水和乙醇的混合溶劑溶解,來與有機相形成穩定的初乳。載體材料包載7-HC后,在紫外激發波長下,納米粒發出較強的藍色熒光,可以根據不同功能的載體材料實現在細胞里的定位成像。同時,本研究還發現在藍色和綠色激發波長下,7-HC/T-P NPs溶液也能分別發出較強的綠色和紅色熒光,只是熒光效果不如藍色熒光。
綜上所述,本研究成功制備了穩定的7-HC/T-P NPs,方法簡單準確可行,其藍色熒光效果在細胞內外都較為顯著。本文為7-HC的開發應用提供了新的研究思路,并為神經膠質瘤線粒體靶向臨床應用提供研究基礎,同時為其制劑研究提供參考。

