微生物細胞工廠碳流調控進展
高聰,郭亮,胡貴鵬,陳修來,劉立明
(1 江南大學食品科學與技術國家重點實驗室,江蘇 無錫 214122;2 江南大學藥學院,江蘇 無錫 214122)
微生物細胞工廠是實現可持續發展的重要突破口。利用微生物細胞工廠生產化學品具有多種優勢,使用可再生資源替代石化原料,緩解石油依賴困境;反應條件更加綠色溫和,降低環境負荷。構建高效微生物細胞工廠的核心是通過基因調控增加目標化合物的產量、生產強度和得率。雖然過去30 年時間里,利用代謝工程手段改造微生物細胞生產材料單體[1]、藥物中間體[2]、生物燃料[3]等領域取得了許多突破,但是仍存在許多問題。
首先,傳統的基因操作,如基因過表達和基因敲除,在增強目標化合物轉化率的同時,常會導致宿主細胞生長速率下降;其次,微生物細胞代謝網絡中許多生化反應存在反饋調控和多層級調節現象。因此,在構建微生物細胞工廠的過程中需要進行大量試錯實驗,增加了研發周期和成本;最后,由于缺乏精細的調節工具,微生物細胞工廠的實際合成效率遠遠低于化學品的理論合成路線得率,增加了化學品生物合成成本,阻礙了微生物細胞工廠的規模化生產應用[4]。隨著系統生物學和合成生物學的進步,更多理性計算和工程設計方法[5]被引入到微生物細胞工廠的構建過程中。通過選擇關鍵代謝流調控靶點,降低目標化學品合成與菌株生長、副產物積累之間的代謝競爭,優化合成路徑整體催化效率,可以最大程度提高工程菌株的生產潛能。因此,發展碳代謝流調控策略是強化微生物細胞工廠合成效率的重要手段。
在微生物細胞的碳代謝流調控過程中,主要涉及4個關鍵瓶頸,具體包括:①如何確定關鍵調控靶點?②如何平衡細胞生長和產物合成?③如何降低副產物對產物合成的分流?④如何提高長路徑的催化效率?圍繞上述瓶頸,本文依次分析了關鍵影響因素和潛在解決策略,并針對最新研究進展,提出未來構建高效微生物細胞工廠的潛在切入點和技術展望。
1 選擇代謝流調節關鍵靶點
代謝流調控的第一個關鍵科學問題是如何選擇關鍵調節靶點。在微生物從頭發酵過程中,底物到目標產品的轉化通常涉及許多內部之間存在緊密關聯的生化反應。因此,開發高效的改造靶點預測技術,可更加理性地指導代謝工程,節約時間成本和人力成本。為了快速優化從底物到目標產品合成的代謝流分配,目前主要有基于模型指導和基于實驗室適應性進化指導的兩類策略。
1.1 基于模型指導的靶點選擇
傳統微生物細胞工廠改造往往涉及基因組學、轉錄組學、蛋白組學和代謝物組學等數據的分析。借助上述組學分析,可獲得影響產物合成的關鍵靶點。例如,在枯草芽孢桿菌中,綜合運用全基因組和轉錄組分析,鑒別了提高核黃素產量的7個關鍵突變位點。將上述位點引入野生型菌株中,并借助代謝工程手段削弱嘌呤從頭合成途徑,增強核黃素合成代謝途徑,可使核黃素產量較野生型提高3.4倍[6]。
在組學技術基礎上建立和發展起來的代謝網絡模型可實現更加理性化的關鍵靶點選擇。在應用代謝網絡模型指導代謝工程菌種改造過程中,針對改造目的不同,可以將其分為“從無到有”的代謝工程菌株改造靶點選擇(例如在工程菌株中尋找表達生物堿和萜類化合物等植物次級代謝產物改造靶點[7])和“從有到優”的代謝工程改造靶點選擇(針對某些自然狀態下難以過量積累的產品,如脂肪酸甲酯[8]、衣康酸[9]等代謝靶點的選擇)。例如,通過將酶學性質引入大腸桿菌代謝模型iML1515中,構建了大腸桿菌酶約束模型ec_iML1515。基于該模型,預測出20 個影響賴氨酸合成的代謝改造靶點。實驗驗證表明,過量表達二氫硫辛酰胺脫氫酶基因lpdA、黃素還原酶基因fre、乙酰輔酶A合成酶基因acs、二氨基二甲酸脫羧酶基因lysA 和天冬氨酸激酶基因lysC,賴氨酸產量分別提高了63.8%、108.7%、55.6%、50.0%和123.6%[10]。值得注意的是,在模型預測改造靶點的過程中,網絡模型質量和數據精度會影響預測準確性。因此,構建基于干濕實驗結合[10]或整合細胞完整生命活動過程的細胞模型[11]將有助于提高靶點預測的準確性。
1.2 基于適應性實驗室進化的靶點選擇
適應性實驗室進化是獲得表型優良菌株的重要途徑。其工作原理是,通過在基因組水平上對出發菌株的遺傳物質進行突變或者重組,建立群體多樣性文庫,最終在高效篩選系統的輔助下獲得目標性狀菌株。常用的方法主要包括以物理/化學誘變方法[12]、基因改組、易錯PCR[13]等為代表的傳統策略和以重組酶、CRISPR 介導的多位點進化[14]和連續自動進化[15]等為代表的新型技術。通過對出發菌株與篩選菌株進行基因組比較分析,最終獲得代謝改造靶點。例如,通過構建一種基于轉錄調節因子Lrp 的纈氨酸傳感器,可以檢測支鏈氨基酸含量并將其轉化為熒光信號輸出。將傳感器引入丙酮酸脫氫酶失活的產纈氨酸谷氨酸棒狀桿菌中,可篩選獲得具有更高生長速率、纈氨酸產量提升1倍、副產物積累減少2/3~3/4 的突變菌株。基因組測序結果表明,該纈氨酸高產突變菌株的脲酶附屬蛋白UreD 和全局轉錄因子GlxR 發生突變。在野生型菌株中引入上述突變,可使菌株的纈氨酸產量提高100%,并降低副產物丙氨酸的積累[16]。
2 平衡細胞生長與產物合成碳流
利用代謝工程改造微生物生產化學品的過程中,細胞生長與產物合成之間碳代謝流競爭是代謝流調節中最常見的科學問題(圖1)。當代謝流集中于細胞生長相關途徑,目標產品的得率會降低;當胞內代謝流集中于產物合成途徑,細胞生長也會受到影響[17]。因此,在適當的時機分配生長必須代謝流和產物合成代謝流,可以實現細胞生長與目標產物合成之間的平衡,提高菌株化學品生產能力。根據具體調控過程,可以歸納為以下三類:①靜態調節技術;②單次動態調節技術;③連續動態調節技術。

圖1 如何解決菌體生長與目標產物合成競爭的問題
2.1 靜態調節
靜態調控是指對目標代謝通路進行靜態優化的代謝工程改造策略。這種改造方式具有設計簡單、改造周期短、效果穩定等優勢。目前,靜態調控的主要技術有基因的過表達和基因插入和敲除等。例如,最近發展的重組酶與CRISPR/Cas9組合基因編輯技術,利用重組酶RecT 將合成的單鏈寡脫氧核苷酸通過同源重組作用插入基因組,而Cas9 與單鏈向導RNA(sgRNA)復合物則通過引入不可修復的雙鏈斷裂區來阻止未編輯細胞的存活,大幅提高了基因編輯效率。基于RecT+CRISPR基因編輯技術,可在谷氨酸棒狀桿菌中無痕敲除一個或多個基因,快速構建多種突變體,加速菌株代謝工程進程[18]。雖然靜態調節技術成熟,但是靜態調控往往難以一步實現菌株生長和產物合成之間的平衡,需要多輪、多靶點的組合優化才能獲得最佳的工程菌株。
2.2 單次動態調節
單次動態調節技術是指當外源輸入信號時,系統僅進行一次針對靶基因表達/關閉的調控。采用單次動態調節技術,可將發酵過程分為前期生長階段和后期產物生成階段,以改善細胞生長,增加最終產物產量。其代表技術包括一系列的生物開關,如化學物誘導型開關(如LacI-IPTG、AraCARA[19]、TetR-ATC[20])、溫度敏感型開關[21-22]、pH響應型開關[23]、溶氧響應開關[24]等。除了上述生物開關,具有非侵入性和快速可調性的光信號[25-26]和磁信號[27]響應生物開關,也逐步被應用于微生物細胞工廠代謝流調控中。例如,利用光敏性轉錄因子在光誘導下激活轉錄的原理,通過控制外源藍光的開啟或關閉,可改變酵母細胞中碳代謝流方向,實現細胞生長和產物合成之間的解偶聯,使工程菌株的異丁醇產量達到8.5g/L,較對照菌株提高了5倍,2-甲基-1-丁醇產量達到2.4g/L[25]。
2.3 連續動態調節
連續動態調節技術的優勢在于可根據環境和代謝流的變化,動態控制細胞響應。隨著新的調控機制的闡明,越來越多新型調控元件被開發,并應用于系統調控微生物的代謝流。根據調控原理,常見的連續動態調控技術可分為三類:①代謝物響應型;②細胞密度響應型;③細胞狀態響應型。
通過挖掘響應終產物或者中間代謝物濃度變化的轉錄蛋白[28]、核糖開關[29]等元件,可構建出代謝物反饋動態調控開關。例如,利用來源于枯草芽孢桿菌FapR 調控蛋白響應脂肪酸合成前體丙二酸輔酶A濃度的原理,在大腸桿菌中構建了雙功能代謝開關,實現在胞內高丙二酸輔酶A濃度條件下,激活PGAP啟動子轉錄,同時抑制T7啟動子轉錄。含有代謝開關的工程菌株能夠根據丙二酰輔酶A 的濃度,動態調節其上下游基因的表達水平,使代謝流量高效導向脂肪酸的合成,產量較野生菌株提高了15.7倍[30]。雖然動態調控策略已有許多成功應用的例子,但是尋找合適傳感器和執行器可能費時費力。因此,開發路徑/菌株普適性的動態調控工具是未來的重要方向[31]。
第一種路徑普適性的自誘導信號是細胞密度。細胞密度是微生物細胞工廠的一個重要的參數,反映了細胞的整體生長狀況和代謝能力。借助細菌本源的群體感應(QS)系統[32]或者異源引入QS 系統[33]控制目標基因表達,可實現基因表達水平隨著細胞密度的增加而持續動態調節。例如,在以木聚糖為唯一底物合成莽草酸的過程中,以莽草酸激酶AroK為調控靶點,引入來源于費氏弧菌的QS系統和重組酶Cre 系統,可構建一個QS 依賴的新型動態調控開關,通過優化RBS 強度和篩選LuxR 突變體,該動態開關展示出良好的系統可調性和可移植性。利用該技術,工程大腸桿菌以25g/L 木聚糖為底物,可生產3.2g/L莽草酸[34]。
第二種路徑普適性的自誘導信號是細胞狀態。由于環境營養條件的差異,微生物細胞在不同的生長階段會有不同的生長速率和細胞狀態。最常見的兩種狀態是處于對數生長期的細胞狀態和進入穩定期的細胞狀態。通過對兩種狀態下的細胞進行轉錄組分析,可獲得兩類具有完全不同轉錄特征的啟動子:生長期關聯啟動子(growth phase promoter,簡寫GPP)[35],其轉錄活性在菌株處于對數生長期時極強,處于穩定期時受抑制;穩定期關聯啟動子(stationary phase promoter,簡寫SPP),其轉錄活性在菌株處于對數生長期時受抑制,處于穩定期時激活[36]。在此基礎上,設計GPP 負責轉錄控制具有N端隱藏降解子的靶蛋白,設計SPP負責轉錄控制的蛋白酶,構建動態調控基因回路。應用該基因回路,工程菌株可實現在外源不添加必需氨基酸和化學誘導劑的無機鹽培養基中,積累12.6 g/L 莽草酸[37]。
再進一步,為了實現精確的自動控制,上述策略可以組合使用。例如,分別將響應細胞狀態的PrpoS啟動子和響應細胞密度的QS系統設置為兩個信號輸入端,構建與邏輯門(AND)。在該邏輯門中,僅當微生物密度和細胞生理狀態同時達到響應閾值時,才能實現目標基因的輸出,以協同提高化學品的合成能力。基于該邏輯門控制系統,工程大腸桿菌生產聚羥基丁酸酯的產量較對照菌株提高了近2倍[38]。
3 降低副產物路徑與產物合成競爭
副產物路徑與目標產物合成的競爭是另一類常見的科學問題(圖2)。微生物在發酵生產過程中通常會伴隨著副產物的積累,導致目標產品生產指標降低。在這種情況下,就需要開發出更精密的代謝流調控手段,從而更有效地解決副產物路徑與目標產物合成的競爭問題。針對這一問題,主要涉及三種解決思路:①基于基因編輯的調控技術;②基于基因表達抑制的調控技術;③基于復雜基因回路的調控技術。
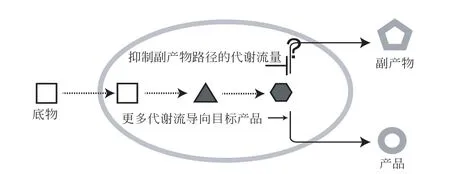
圖2 如何解決副產物路徑與目標產物合成競爭的問題
3.1 基因編輯技術
基因編輯是改變代謝流分布、降低副產物積累和提高目標產物得率最直接的技術[39]。目前常用的基因編輯方法有FLP/FRT[40]和Cre/Loxp 技術、鋅指核酸酶(ZFN)技術[4]、轉錄激活因子樣效應物酸酶(TALEN)技術和CRISPR-Cas9/Cpf1 技術[41]等。例如,野生型大腸桿菌W3110 僅可積累5.54g/L 丙酮酸,但是卻可以積累6.34g/L 乳酸、4.72g/L 乙酸和2.34g/L 甲酸。為了提高菌株丙酮酸的積累量,利用FLP/FRT基因編輯技術,組合敲除編碼乳酸脫氫酶(LdhA)、丙酮酸氧化酶(PoxB)、丙酮酸甲酸裂解酶(PflB)、磷酸轉乙酰酶(Pta)和乙酸激酶(AckA)的基因,可大幅降低副產物的積累,使目標產物丙酮酸的積累量達到20.9g/L[40]。相較于FLP/FRT基因編輯技術,CRISPR-Cas9基因編輯技術編輯周期短、準確率高、操作便捷、成本低,目前應用更為廣泛。例如,在己二酸的合成中,乳酸和丁酸等副產物的積累降低了己二酸得率,利用CRISPR-Cas9 技術分別刪除了編碼乳酸脫氫酶(LdhA)和乙酰輔酶A 乙酰轉移酶(AtoB)的基因,使己二酸的得率由49.5%提升至61.7%[42]。
3.2 基因表達抑制
盡管基因組水平操作通量越來越高,但是普遍存在可調性差的問題。在某些情況下,副產物的合成也是微生物細胞維持自身穩態的一種機制。例如,大腸桿菌在厭氧條件下會同時生產乳酸、乙酸、甲酸和琥珀酸等混合酸,以維持氧化還原平衡[43]。完全阻斷副產物代謝路徑碳流量,會對菌株生理代謝造成不利影響。基因表達抑制技術較好地解決了上述問題。根據調控層面,這些技術可以劃分為DNA 水平調控技術、RNA 水平調控技術和蛋白水平調控技術等。
應用最廣泛的DNA 水平調控技術之一是CRISPR 干擾系統(CRISPRi)。在該系統中,喪失DNA切割能力的Cas9核酶突變體(dCas9蛋白)仍保留了其DNA結合能力,因此,當sgRNA靶向結合到目標DNA序列時,dCas9蛋白會與RNA聚合酶形成空間上的物理阻遏,降低目標基因的轉錄強度,實現基因表達抑制[44]。同時,設計不同的sgRNA靶向序列,實現不同的結合位阻,可獲得不同水平的抑制強度[20]。例如,利用CRISPRi 技術,分別組合抑制大腸桿菌副產物乙酸合成基因pta,琥珀酸合成基因frdA,乳酸合成基因ldhA 和乙醇合成基因adhE,產物正丁醇的得率提高了5.4倍[45]。
代表性RNA 調控技術主要包括小RNA(sRNA)干擾[46]和反義RNA(asRNAs)調控[47]兩大類。合成sRNA 序列包含支架序列和靶標結合序列,這種雙重結構使其可以在招募Hfq 蛋白的同時,完成與目標mRNA的雜交,促使目標mRNA降解,實現表達抑制。例如,基于大腸桿菌本源Hfq蛋白,分別設計了靶向酪氨酸和戊二胺合成代謝路徑的sRNA庫。通過組合優化,確定影響目標產品合成的關鍵基因和最優表達抑制水平,使大腸桿菌的酪氨酸產量達到2g/L,尸胺產量達到12.6g/L[46]。不同于sRNA干擾,小分子RNA可以通過與目標基因的mRNA形成互補雙鏈而抑制基因的表達。利用這種原理,設計asRNAs 降低競爭路徑基因的表達水平,可使代謝流集中分配到目標產品。例如,通過設計抑制基因fabD(編碼丙二酰輔酶A-ACP 轉酰基酶)表達的反義RNA,使胞內的丙二酰輔酶A濃度提高4.5倍,產物4-羥基香豆素、白藜蘆醇和柚皮素的產量分別提高2.53 倍、1.70 倍和1.53倍[47]。
蛋白調控技術主要通過改變目標蛋白的N 末端[48]或C末端氨基酸序列[49],使其穩定性發生改變,從而調整目標蛋白豐度。例如,利用蛋白降解原理,構建了兩種調節工具。首先,對靶蛋白的N末端進行修飾,依次添加上蛋白酶TEVp的切割識別位點和蛋白降解子。由于靶蛋白的N末端降解子被切割位點隱藏,靶蛋白處于初始穩定狀態。當蛋白酶表達后,蛋白酶識別位點被切割,降解子裸露,靶蛋白轉為不穩定狀態,從而調整靶蛋白豐度從高水平轉換到低水平(OFF 開關)。相反,也可以對靶蛋白的C 末端進行修飾,依次添加上蛋白酶TEVp 的切割識別位點和蛋白降解標簽。由于靶蛋白的C末端降解標簽初始處于裸露狀態,靶蛋白會被胞內蛋白降解機器識別并被持續降解。當蛋白酶表達后,靶蛋白的C末端降解標簽會被切除,被切割降解標簽的靶蛋白轉變為穩定狀態,從而實現靶蛋白豐度由低水平到高水平的轉換(ON開關)[37]。蛋白水平的調控相較轉錄水平的調控具有更短的響應時間,但是該過程是一個高ATP 消耗的過程,例如降解一個模式底物(肌聯蛋白)需要600 個ATP分子[50]。同時,多個靶蛋白的降解往往會造成排隊效應[51],降低元件的初始參數,進而影響基因回路系統的輸出。最近的文獻指出可以采用亮氨酸拉鏈裂解蛋白的方式控制蛋白酶活性[52],靶蛋白無需完全降解即可行使生物學活性,在構建蛋白開關時展示出良好的應用前景。
3.3 復雜基因回路
代謝網絡中的碳流分布是多維度相互影響的,單一靶點或信號的改變難以實現最優的化學品合成。因此,借助包含兩層以上的動態調控系統,實現多維度胞內生物信息的輸入、分析和輸出,可以更加有效的提高工程菌株目標化學品的合成能力。不同于AND 邏輯門中相互獨立的兩層輸入端,在分層動態調控系統中,不同層級動態調控系統之間可利用轉錄調控蛋白[53],代謝物的積累[54],細胞密度[55]等條件實現耦合。例如,在對多種革蘭氏陽性和陰性菌株中QS 系統的正交性和動態調控范圍進行評價后,選擇了來源于費氏弧菌(Vibrio fischeri)和來源于糞腸球菌(Enterococcus faecalis)的QS 系統,分別用于控制中鏈脂肪酸路徑酶的合成和內切核糖核酸酶MazF 的表達,實現第一層調控系統由細胞密度控制,第二層調控系統由mRNA全局降解控制,最終改變細胞代謝資源全局分布的目的。在5-L發酵罐水平上,實驗菌株較沒有引入動態調控系統的對照菌株,中鏈脂肪酸產量提高了5.4 倍,同時副產物乙酸積累量由12g/L 降低至2g/L,乳酸和琥珀酸積累量分別由6g/L、4g/L降低至0.5g/L[55]。發展多層級調控系統是理解細胞復雜調控網絡的途徑之一,同時可為未來構建執行復雜生命活動功能的智能微生物細胞奠定研究基礎[56]。
4 強化產物合成路徑效率
碳流調控的最后一個關鍵科學問題是如何解決目標產物合成路徑效率低的問題(圖3)。在代謝流調節中,合成路徑較長,或者調控靶點下游合成路徑酶活性較低時,僅僅依靠改道代謝流,難以有效的增加目標產品的合成效率。為了解決合成路徑效率低的問題,近年來文獻報道了許多策略,可以粗略歸為四類:①降低胞內代謝干擾;②優化路徑催化效率;③強化路徑代謝通量;④實施代謝路徑分工。

圖3 解決目標產物合成路徑效率低的問題
4.1 降低胞內代謝干擾
長路徑合成過程中酶與酶之間較低的協同催化效率,常會導致代謝中間產物積累。這些中間代謝產物會參與到胞內代謝環境中,進而對宿主產生毒性,或被競爭途徑消耗。解決這些問題的重要思路有主要兩類:①空間工程,通過縮短目標合成路徑中多個路徑酶的空間距離,構建底物催化通道;②亞細胞定位工程,將目標產物合成相關的途徑定位于特定的亞細胞結構(如線粒體[57],過氧化物酶體[58]和液泡[59])中,實現代謝反應隔離,降低胞質反應對路徑合成效率的影響。
空間工程的代表性技術包括多酶復合物和腳手架技術。構建多酶復合物可以將途經中的酶共定位,以形成最優比例的復合物,增加途徑代謝產物和酶的局部濃度,限制途徑中間體的積累。例如,通過將木糖轉運與異構化反應級聯,可構建人工合成酶-膜轉運蛋白的多酶復合物,強化底物木糖用于生產乙醇的代謝途徑,在提高乙醇合成的同時降低副產物木糖醇的積累,最終使產物中乙醇/木糖醇比例由3 倍提到至6 倍[60]。常用的腳手架技術包括利用鋅指蛋白與DNA 特異性結合原理的DNA 腳手架、利用含有蛋白結合域適體的RNA 腳手架和基于蛋白結合配體的蛋白腳手架等。例如,在合成葡萄糖二酸的三步級聯催化中,肌醇加氧酶(MIOX)的活性受到中間代謝物肌醇濃度的強烈抑制,利用鋅指蛋白絞手架特異性結合DNA的特點,分別將3 種路徑酶(Udh、Ino1 和MIOX)靶向到3種不同的鋅指蛋白(GBD、SH3和PDZ)中,經過比例優化,降低中間代謝物肌醇的積累,可使大腸桿菌葡萄糖二酸的產量相比對照提高5倍[61]。
亞細胞定位工程可以避免代謝途徑中間物的損失,減少與其他細胞成分之間發生的不必要反應,有利于整個途徑行使更加復雜的功能。在酵母細胞中,將異丁醇合成路徑下游關鍵酶α-酮酸脫羧酶(α-KDC)和醇脫氫酶(ADH)共定位于線粒體中,避免纈氨酸合成路徑(支鏈氨基酸轉氨酶BAT1和BAT2)的干擾。最終,工程酵母的異丁醇產量相比出發菌株提高260%[62]。最近的研究表明,路徑中多個關鍵酶也可以被分別分配到多種亞細胞結構中,以實現代謝協同,提高長路徑的合成效率。例如,利用模塊化區室的概念,可將曼陀羅素和天仙子胺兩種生物堿的合成路徑分別共定位于細胞質、線粒體、過氧化物酶體、液泡和內質網等亞細胞結構中,最終實現了兩種藥用生物堿的從頭合成[59]。
4.2 優化路徑催化效率
為了提高路徑催化效率,可以從兩個方面進行解決。第一,實現途徑中不同酶的催化協同,降低中間代謝物積累;第二,對具有反饋/負反饋效應的酶進行蛋白質工程改造,提高路徑催化效率。
對于一條長合成路徑中,每種酶的表達水平、催化性能和變構調節作用不同,均會影響整體路徑的合成效率。為了解決這一問題,可采用模塊路徑工程直接優化下游合成路徑中多個酶的表達水平,提高限速酶的相對豐度,以提高合成路徑催化效率。例如,在釀酒酵母中,將葡萄糖到鳥氨酸的合成路徑的酶,按照代謝節點或者酶的催化性能劃分為3 個模塊,通過優化這些模塊中酶的相對表達量,使L-鳥氨酸產量達到5.1g/L[63]。
除了協同表達水平,路徑酶的催化性能也是影響長路徑合成效率的關鍵點。某些酶可以催化多種底物,導致副產物積累和較低的產物得率。利用蛋白質工程改造酶對目標底物的親和性,可提高代謝流再分配到目標產物的效率。例如,在N-乙酰-d-葡萄糖胺(GlcNAc)生物生成N-乙酰-d-神經氨酸(Neu5Ac)的過程中,N-乙酰葡萄糖胺2-差向異構酶(AGE)可同時催化GlcNAc 和N-乙酰-d-甘露胺(ManNAc)之間的雙向反應。運用蛋白質工程策略改造AGE 酶活性位點,可提高其對Neu5Ac 的親和性。最終,突變體C372A 對GlcNAc的Km值比野生型低50%,對ManNAc 的Km值比野生型高130%,使Neu5Ac 產量提高5.9%[64]。另外,對于有些輔因子依賴型酶,不匹配的輔因子會嚴重影響酶催化性能。利用蛋白質工程優化其輔因子的偏好性,可提高路徑催化效率。例如,賴氨酸的生產過程是一個高消耗NADPH的過程,胞內NADPH豐度下降會影響NADPH 依賴型二氫二吡啶酸還原酶(DHDPR)的性能。通過對DHDPR輔因子結合域進行定向突變,DHDPR突變體R13A的輔因子偏好從NADPH 轉變為NADH,進而使賴氨酸產量增加21.4%[65]。
4.3 強化路徑代謝通量
路徑代謝通量的強化可以在多種調控水平上實現。例如,在轉錄水平調控上,可通過質粒拷貝數優化[42]、目標基因表達框的啟動子替換[28]、轉錄激活蛋白引入[66]等手段,強化代謝路徑的通量;在翻譯水平調控上,可借助核糖體結合位點替換[10]、翻譯起始區序列調節[67]等技術,提高目標代謝路徑通量;在蛋白水平調控上,基于蛋白降解速率控制[37]、蛋白二聚化活性控制[68]等策略,優化代謝路徑酶的豐度與活性;在細胞水平調控上,發展壓力代謝進化[69]、細胞形態工程[70]等方法,調節細胞對底物和目標產物的物質傳遞效率。其中,針對代謝流通量很低的路徑,可采用壓力代謝進化的方式,驅使代謝流量進入目標路徑。這種環境壓力和細胞自適應進化的組合,可加快微生物的改造進程,賦予微生物原本不具備的生理性狀和化學品合成能力。例如,在大腸桿菌中引入核酮糖-1,5-二磷酸羧化酶、磷酸核糖激酶和甲酸脫氫酶,同時敲除磷酸果糖激酶和葡萄糖-6-磷酸脫氫酶(分別阻斷細胞的糖酵解和戊糖磷酸途徑),可驅使細胞利用卡爾文循環固定和還原CO2。然后,在適應性進化過程中,逐步降低混合碳源中木糖的比例并增加CO2比例,經過350天的適應性進化后,最終在異養微生物大腸桿菌中成功實現了完全自養[69]。實際上,代謝進化策略是強化低代謝流通量路徑的有效策略,已廣泛應用在多種一碳資源(CO2[71]、甲醇[72]、甲酸[73]等)利用途徑強化中。
4.4 實施代謝路徑分工
在單一宿主內同時表達多個路徑酶會造成代謝負荷,影響細胞生產性能。為了提升長路徑的整體催化效率,可以利用合成群落系統,實施代謝路徑分工。一方面,利用共培養技術,在實現菌種間代謝物的交換的同時,降低完整路徑在單一菌株表達所造成的生產負荷;另一方面,借助不同菌株的固有優勢,如大腸桿菌生長迅速,酵母具有完善的真核蛋白表達系統,可以優化路徑的整體合成效率。例如,在生產氧化紫杉烷類化合物時,以木糖為碳源,設計了大腸桿菌/釀酒酵母雙菌共生系統。其中,大腸桿菌代謝木糖會外源分泌乙酸,不能利用木糖的釀酒酵母利用乙酸作為唯一碳源進行生長,而不積累會抑制大腸桿菌生長的乙醇。將紫杉烯合成路徑分配到大腸桿菌細胞中,而將大腸桿菌難以表達的P450-CPR酶分配到釀酒酵母中表達,通過菌株比例優化和乙酸積累路徑改造,氧化紫杉烷產量達到33mg/L[74]。通過構建更為復雜的微生物群落,可以實現多種化學品的集成式生產。例如,以纖維素為底物,首先利用里氏木霉(Trichoderma reesei)和戊糖乳桿菌(Lactobacillus pentosus)搭建“乳酸”生產平臺,當向群落系統中引入第三種菌時,可生產不同化學品。例如,引入酪丁酸梭菌(Clostridium tyrobutyricum)生產丁酸,引入倉鼠韋榮球菌(Veillonella criceti)生產乙酸和丙酸,引入埃氏巨型球菌(Megasphaera elsdenii)生產戊酸和正己酸[75]。
5 革新性技術的興起
受益于近年來合成生物學元件的挖掘、組學分析技術的發展和多學科之間的技術融合,越來越多的革新技術展示出其在提升精確度、智能化和時效性等領域的應用潛力(圖4)。

圖4 未來代謝調控工具發展方向
5.1 高精度調控工具
目前部分調控工具存在調控對象不精細、調控幅度較窄、調控研究手段粗糙等限制。以傳統技術為基礎,借助交叉學科技術,可提高目前調控改造精度。例如,在調控對象上,傳統CRISPR/Cas9基因組編輯技術難以實現單堿基的精確編輯。最近建立的包括C到T[76],A到T和G到C[77],C到A和C到G[78]等單堿基定向編輯技術,可為基因組水平的精確編輯和表達調控提供便利。在調控幅度上,傳統的誘導劑-阻遏蛋白表達技術的調控倍數普遍低于100倍。而最新建立的基于反式RNA控制翻譯起始的Toehold開關,其調控幅度可達到400倍[79];基于類球紅細菌光感二聚體RsLOV 構建的單組分光激活系統,其調控幅度達到500 倍[66];組合藍光響應T7 RNA 聚合酶表達調控系統和光敏感型四環素系統,使其調控幅度達到700 倍[80];通過在起始密碼子和蛋白編碼區之間優化不同前導序列,可實現約1000倍的表達水平控制[67]。在調控研究手段上,傳統研究尺度集中于細胞群體水平,難以明確細胞本身生理變化和個體表達差異。借助微流控技術,可以實現對單細胞生理變化的觀測[81]和群體異質性的評估[82]。
5.2 仿生學調控工具
受限于理論和技術水平,人類還無法完全重復出許多植物、動物已有的生物體系。利用仿生學原理,一方面,可以直接借助自然界已存在但是目前難以人工重建的生物系統;另一方面,可以啟發于自然界中已存在的物質能量轉化模塊,實現人工體系的高效合成。例如,直接提取葉綠體類囊體膜并封存于區室化的液滴中,可以構建仿生葉綠體結構,完成光驅動CO2固定[82]。類似地,將光轉換器PR、PSII 和ATP 合酶整合到脂質囊泡中,可以構建人工光合細胞器,實現ATP合成與CO2固定之間的耦合[83]。
5.3 智能化調控工具
傳統的代謝調控策略,普遍存在人工參與度高、理性設計不足的問題。因此,借助多學科交叉領域技術,可提高調控手段的智能性。借助生物傳感器,可降低人工參與度,構建出具有自動調節細胞代謝負荷[84]、自動適應性進化[85]、自動消除群體異質性[86]功能的基因回路。利用計算機輔助系統,可以快速實現海量數據的分析,降低人工試錯成本。例如,借助計算機算法和軟件,已開發了針對大腸桿菌和酵母的基因回路自動化設計平臺[87-88],利用該平臺可以構建出類似電子顯示屏的復雜基因回路[89];借助機器學習預測,可以快速實現基因型到表型的精準預測,提高工程菌株色氨酸產量74%[90]。
5.4 多任務調控工具
傳統的代謝調控策略,普遍存在任務單一的瓶頸。借助納米材料技術,可構建具有復雜空間排布的結構,執行多種任務。例如,為了在大腸桿菌中構建多種酶共存的催化微環境,傳統策略是引入腳手架技術,但是引入的路徑酶個數較少(<4),且難以特異性改變酶活,而利用細胞相容性高的納米超分子結構作為載體,借助DNA 鏈特異性招募路徑酶和酶抑制蛋白,可實現多種酶/酶抑制劑的順序聚集(蛋白復合體)和解聚[91],實現調控手段的多功能性。
5.5 快響應調控工具
目前的代謝調控手段,普遍集中于轉錄水平,具有響應時間長、調控精度差的限制。挖掘細胞本源調控機制,在后翻譯水平或蛋白水平建立調控策略,可有效降低響應時效。例如,利用蛋白酶的級聯降解原理,首次構建了蛋白振蕩器[37]。該振蕩器的振蕩周期較傳統轉錄振蕩器的(160±40)min[92]縮短到90min。同時,組合響應時效不同的調控手段,可實現大范圍的響應時間精細優化。例如,在酵母細胞中,通過結合磷酸化調控(快響應)和轉錄調控(慢響應),構建了雙時間尺度的動態調控工具,實現細胞生命活動的可調控制[93]。
6 結語
在微生物代謝流調節中,首先需要確定調節靶點,然后確定代謝流調節的類型,挖掘關鍵調控元件,發展適宜的調控工具。最后,提高路徑中酶與代謝物的催化協同,優化代謝流調節效果。隨著越來越多生物元件被挖掘與標準化,同時,結合先進的生物技術,如高通量篩選平臺[94]、自動化工作站[95]、DNA快速合成及測序等,預期微生物細胞工廠的設計-構建-測試循環將實現短周期、智能化、高效率的革命性突破[96]。

