BMSCs來源的外泌體對髁突軟骨細胞蛋白多糖表達的影響
邢超 徐靈巧 葉鐘泰 張志光
1深圳市寶安區人民醫院口腔科 518101;2中山大學光華口腔醫學院附屬口腔醫院口腔頜面外科,廣州 510055
由于軟骨缺乏血管營養供應,特殊的生理特性一旦發生表層缺損難以自愈,導致骨關節病的發生[1]。隨著病變的不斷進展,關節功能退化、咀嚼功能受損,嚴重影響生活質量。當前修復顳下頜關節軟骨缺損尚無有效的治療手段,如保守治療緩解疼痛,阻止病程進展,但在恢復軟骨再生方面作用有限[2-4]。自體軟骨移植,開辟第二術區造成供區缺損,且來源有限;人工關節費用高,存在并發癥,嚴格適應癥選擇[5-6]。目前,再生醫學的發展為關節軟骨的修復再生提供新的選擇,間充質干細胞(mesenchyme stem cell,MSCs)來源于體內多種組織,包括骨髓腔、關節滑膜組織、牙周膜、牙髓組織等,在體內外均具有軟骨分化潛能[7]。外泌體是一類直徑40~100 nm 的細胞外囊泡,攜帶核酸和蛋白質等多種生物活性內容物,參與細胞間信號傳遞、信號轉導和信息交流。已有研究表明干細胞來源的外泌體具有與干細胞相似功能,可以輔助組織修復再生、抑制細胞凋亡、發揮免疫調節和抗炎作用[8]。干細胞來源的外泌體在腦與神經系統損傷、心血管系統、肝臟損傷、腎臟損傷、骨骼與肌肉系統等方面表現出強大的修復和再生能力,甚至能夠替代干細胞開啟“無細胞”治療[9-12]。蛋白多糖是軟骨細胞生長代謝、發揮功能的一個重要指標[13]。本研究旨在探索外泌體與髁突軟骨細胞蛋白多糖之間的關系,觀察在外泌體的作用下,髁突軟骨細胞單位DNA 中氨基聚糖(glycosaminoglycan,GAG)的含量及基因表達,從而為外泌體修復髁突軟骨缺損提供實驗基礎。
1 資料與方法
1.1、 材料與試劑 研究時間為2019年1月至2021年1月(其中動物實驗部分2014年做)。實驗用100 g左右SPF級雄性SD 大鼠,動物由中山大學北校區動物中心提供,許可證號SCXK(粵)2011-0029,實驗方法符合動物倫理學要求。鯊魚硫酸軟骨素(Sigma,美國);FBS(Gibico,美國);Anti-Collagen Type I Rabbit pAb(Calbiochem?,德國);Anti-Collagen II(SIGMA-ALDRICHTM,美國);DyLight 488 AffiniPure Goat Anti-Rabbit gG(H+L)( EARTHoX.LLC,美國);小牛胸腺 DNA(Sigma,美國);L-cysteine(Sigma,美國);Hoechst 33258(Sigma,美 國);TRIzol? Reagent(Ambion,美國);cDNA 逆轉錄試劑盒(Roche,瑞士);SYBR Green Mix(Roche,瑞 士);RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific,美國);倒置顯微鏡下(Axiovert 40,Zeiss,德國)RT-PCR Primer(Invitrogen,美國);Real-time PCR 儀(Roche,德國);全自動酶標儀(Tecan Infinite200,瑞士)。
1.2 細胞獲取與鑒定
1.2.1 大鼠骨髓間充質干細胞(BMSCs)的獲取及鑒定 從大鼠腹腔注入1%戊巴比妥鈉麻醉劑0.5 ml,手術分離雙側下肢股骨,去除骨頭兩側的骨骺端,使用含10%FBS的a-MEM 沖洗骨髓腔,將沖洗出的液體置于25 cm2無菌的培養瓶中,48 h 后換液將未貼壁的血細胞沖洗去掉。每隔3~4 d換液1次,細胞長滿培養瓶的80%后1∶3傳代。分別進行成骨、成脂及成軟骨誘導,驗證其多向分化能力。
1.2.2 大鼠髁突軟骨細胞的獲取及鑒定 在麻醉狀態下,將髁突及其附著物取出[14]。切取半透明的軟骨中央部分,放入0.25%的胰酶的培養瓶中消化30 min(每5~10 min震蕩混勻1 次),0.2%II 型膠原酶消化3 h,將所有收集的細胞轉移至25 cm2無菌的培養瓶中,10% FBS 的低糖型培養基(L-DMEM)培養,每隔3~4 d 換液,待細胞長滿培養瓶80%后傳代。將獲取的細胞進行II型膠原抗體免疫熒光染色,激光共聚焦顯微鏡下觀察。
1.3 外泌體的提取、鑒定及分組 培養皿中骨髓間充質干細胞量達到80%時,去除上清液并加入無血清培養基培養72 h,收集上清液。在4 ℃條件下,進行差速離心:2 000 g離心 30 min,20 000 g 離心60 min,100 000 g 離心60 min,收集離心管底部沉淀,PBS 稀釋,100 000 g 離心 60 min,100 μl PBS 重懸沉淀物,放入-80 °C 冰箱保存備用。透射電子顯微鏡觀察外泌體形態,納米顆粒追蹤分析外泌體粒徑,蛋白印跡檢測外泌體標記物。取P1 代髁突軟骨細胞置于不含FBS 的 L-DMEM 培養 24 h,實驗組加入 100 μl 包含外泌體的PBS,對照組加入100 μl PBS,分別置于37 ℃,含5%二氧化碳,95%空氣飽和濕度的細胞培養箱中培養,每周換液2~3次。
1.4 髁突軟骨細胞GAG 含量測定 取100 μl 質量濃度分別為:20 μg/ml、40 μg/ml、60 μg/ml、80 μg/ml 鯊魚硫酸軟骨素標準液,空白對照組加入ddH2O,每孔各加入2 ml 二甲基亞甲藍(DMMB)混勻,酶標儀525 nm下測吸光度值,繪制GAG 含量的標準曲線[15]。以鯊魚硫酸軟骨素標準液的濃度為Y,吸光度值為X,做線性回歸得一標準曲線方程(Y=a·X+b,a、b為常數)。
取兩組髁突軟骨細胞,加入1 ml 的木瓜蛋白酶60 ℃水浴箱過夜(>16 h)。取100 μl消化液(每個樣本設置3個平行對照組),加入2 ml DMMB,酶標儀525 nm下測吸光度值。根據標準曲線方程計算出細胞內GAG 含量,細胞內GAG 含量=a·吸光度值+b。
1.5 髁突軟骨細胞DNA 含量測定 取牛胸腺DNA 作為標準液分別稀釋成0、10 μg/ml、20 μg/ml、40 μg/ml溶解于TNE緩沖液中,取40 μl不同濃度的牛胸腺DNA標準液加入到 96 孔板。室溫避光條件下加入 Hoechst 33258(10 μg/ml)160 μl,熒光酶標儀下測 excitation 358 nm 、emission 458 nm吸光度值[16]。以牛胸腺DNA 標準液的濃度為Y,吸光度值為 X,做線性回歸得一標準曲線方程(Y=a·X+b,a、b 為常數)。
取兩組髁突軟骨細胞,加入1 ml 的木瓜蛋白酶60 ℃水浴箱過夜(>16 h)。取40 μl 消化液,加入160 μl Hoechst 33258(10 ug/ml),熒 光 酶 標 儀 下 測 excitation 358 nm 、emission 458 nm 吸光度值,根據標準曲線方程計算出細胞內DNA含量(細胞內DNA含量=a·吸光度值+b)
1.6 反轉錄聚合酶鏈反應(RT-PCR) 按2×105/瓶接種P1 代髁突軟骨細胞至25 cm 培養瓶,Trizol 分別提取培養7、14 d 髁突軟骨細胞RNA 并測定濃度。使用RevertAid First Strand cDNA Synthesis Kit 試劑盒進行反轉錄合成cDNA,SYBRGreen QPCR Master Mix 試劑盒進行定量PCR。結果分析按照Livak 等[17]的方法計算實驗組與對照組相對CT 值(2-△△Ct),每個樣本重復 3 次,采用 GAPDH 作為管家基因,分析GAG 基因表達情況,基因引物由英濰捷基(上海)貿易有限公司合成(表1)。

表1 反轉錄聚合酶鏈反應引物序列
1.7 統計學方法 用SPSS 17.0 軟件對實驗結果進行統 計 分 析 ,計 量 資 料 以 均 數 ±標 準 差()表 示 ,Shapiro-wilk 檢驗數據正態性,若方差齊、符合正態分布采用獨立樣本t檢驗,方差不齊或偏態分布采用Mann.Whitney test 非參數檢驗法。每組實驗重復3 次,檢驗水準為雙側α=0.05,P<0.05說明差異有統計學意義。
2 結 果
2.1 BMSCs 的培養及多向分化能力鑒定 利用干細胞貼壁生長的特性,可見部分小圓形細胞漂浮于培養基表面,貼壁細胞大小不等,多為短梭形,核橢圓形,有的可呈雙核(圖1-A)。成骨誘導組細胞周圍可見有鈣化結節形成,茜素紅染色可見紅色鈣化結節形成(圖1-B)。成脂誘導組細胞周圍可見大量脂滴形成,油紅O 染色低倍鏡下觀察可見大量紅色脂滴形成(圖1-C)。軟骨誘導液培養3周后,可見有乳白色軟骨塊形成(圖1-D)。

圖1 骨髓間充質干細胞形態學觀察及三向分化能力。A 為顯微鏡下BMSCs 形態(50 倍放大);B 為成骨誘導茜素紅染色(50 倍放大);C 為成脂誘導油紅O 染色(50 倍放大);D 為成軟骨誘導形成的軟骨塊
2.2 大鼠髁突軟骨細胞的培養及鑒定 髁突軟骨細胞成簇分布,形態多角形,隨著細胞數量密集,細胞形態成圓形或多邊形,逐漸融合形成“鋪路石”樣結構(圖2-A)。激光共聚焦顯微鏡下,可見細胞質內II 型膠原呈綠色熒光表達,藍色為細胞核DAPI染色(圖2-B)。

圖2 髁突軟骨細胞形態學觀察及II 型膠原熒光染色。A 為大鼠髁突軟骨細胞形態(50 倍放大);B 為II 型膠原免疫熒光(200倍放大)
2.3 外泌體鑒定 透射電鏡下觀察BMSCs-外泌體形態和大小(圖3 A):外泌體結構完整,呈圓形囊泡狀,伴有“茶托樣”特征外形。納米顆粒追蹤分析(圖3 B):所提取的BMSCs-外泌體粒子直徑眾數87 nm,平均直徑100 nm,提示成功提取到BMSC-外泌體。Western blot 檢測(圖3 C):外泌體特異性標記蛋白CD9 和TSG101 的表達,但不表達3-磷酸甘油醛脫氫酶。

圖3 外泌體的鑒定。A 為透射電鏡下觀察外泌體結構完整;B為納米顆粒追蹤分析;C為Western blot顯示,外泌體表面標志物CD9、TSG101呈陽性表達,但不表達3-磷酸甘油醛脫氫酶
2.4 細胞GAG 含量測定 鯊魚硫酸軟骨素標準溶液的質量濃度X 對其吸光度Y 作線性回歸,擬合一標準曲線方程Y=0.01X-0.3814,相關系數R2=0.996 7。結果表明吸光度總變異的99.67%與標準品的濃度有關,具體見圖4。根據標準曲線方程計算出細胞內GAG含量,實驗組GAG含量在第3天高于對照組[(0.95±0.03)μg/ml 比(0.58±0.02)μg/ml],差異有統計學意義(t=10.36,P<0.001);第7 天實驗組高于對照組[(2.68±0.06)μg/ml 比(1.63±0.04)μg/ml],差異有統計學意義(t=12.01,P<0.001);第14 天實驗組高于對照組[(3.59±0.07)μg/ml 比(1.86±0.07)μg/ml],差異有統計學意義(t=10.61,P<0.001)。

圖4 硫酸軟骨素標準曲線
2.5 細胞DNA 含量測定 牛胸腺DNA 溶液的質量濃度X 對其吸光度Y 作線性回歸,擬合一標準曲線方程Y=1.929 9X-727.77,相關系數R2=0.971 3。結果表明,吸光度總變異的97.13%與標準品的濃度有關,具體見圖5。根據標準曲線方程計算出細胞內DNA含量,第3天實驗組DNA含量顯著高于對照組[(30.14±9.59)μg/ml比(23.45±3.33)μg/ml],差異有統計學意義(t=3.625,P=0.037);第7 天實驗組與對照組基本一致[(42.82±3.74)μg/ml 比(40.46±7.01)μg/ml],差異無統計學意義(t=0.447,P>0.05);第14 天實驗組與對照組基本一致[(54.70±1.36)μg/ml 比(54.70±1.80)μg/ml],差異無統計學意義(t=0.286,P>0.05)。
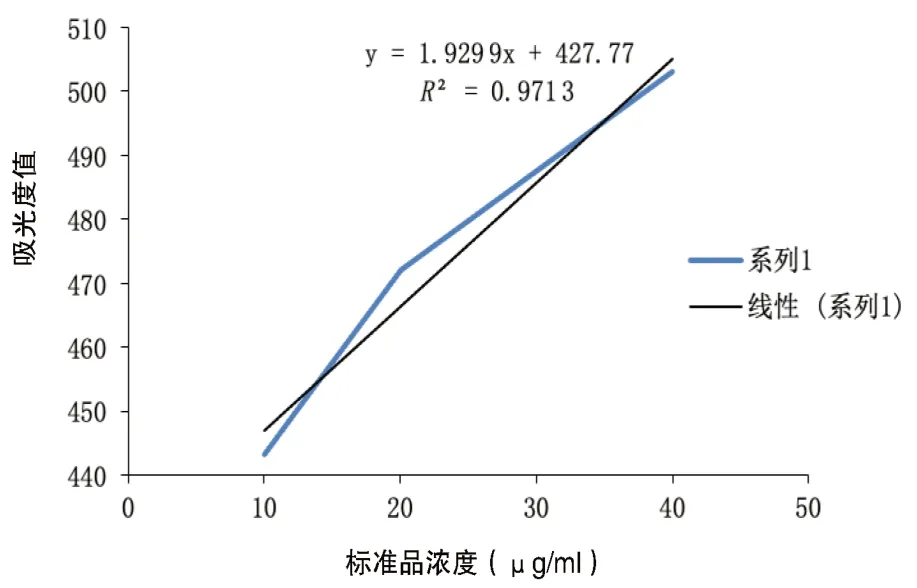
圖5 牛胸腺DNA標準曲線
2.6 單位DNA 中GAG 含量測定(GAG/DNA) 第 3 天GAG/DNA 含量實驗組高于對照組[(0.0320 ±0.007 1)比(0.023 0±0.003 5)],差異有統計學意義(t=4.921,P=0.018);第 7 天實驗組高于對照組[(0.063 0±0.006 5)比(0.039 0±0.006 7)],差異有統計學意義(t=17.78,P<0.001);第14 天實驗組高于對照組[(0.063 0±0.007 3)比(0.032 0±0.005 8)],差異有統計學意義(t=15.59,P<0.001)。結果表明實驗組中的外泌體可以促進軟骨細胞單位DNA中GAG含量表達。
2.7 RT-PCR 檢測細胞中GAG 基因的表達水平 第7 天GAG mRNA 的含量表達水平實驗組高于對照組[(2.610±0.018)比(1.000±0.150)],差異有統計學意義(t=12.31,P<0.001);第14天實驗組高于對照組[(5.560±0.018)比(2.550±0.090)],差異有統計學意義(t=14.78,P<0.001)。結果表明實驗組中的外泌體可以促進軟骨細胞GAG 基因表達。
3 討論
干細胞來源的外泌體在各個領域均有應用,作為MSCs分泌物的主要成份,在組織修復中發揮重要作用。目前外泌體的提取方法主要有:超速離心法、密度梯度離心法、聚合沉淀法、超濾法、免疫捕獲法等。這些方法均具有含量低或純度低等缺點,缺乏統一的鑒定標準。提取方法并非本實驗的研究重點,因此按照國際細胞外囊泡協會提出方法為指導提取外泌體[18-19]。
蛋白多糖是一類由核心蛋白與GAG 以共價和非共價鍵所組成的糖復合物,其含糖量可高達95%以上。氨基聚糖通過一個或多個共價鍵與羧基(-COOH)、硫酸基(-OSO3H)和磺基(-SO3H),重要的GAG 有透明質酸(HA)、硫酸軟骨素、硫酸角質酸、硫酸皮膚素、硫酸肝素等[13]。按照蛋白聚糖的組織分布和功能分為3 類:(1)細胞膜PG,各種組織均有表達,與生理功能合病理變化有關;(2)基底膜結合PG,主要在血管上皮細胞基底膜,調節血管分化和調控腫瘤發展有關;(3)細胞外基質PG,主要功能維持細胞外基質結構,最常見的是多聚蛋白聚糖(aggrecan,AG),與HA充填于軟骨細胞間隙,是關節軟骨主要成份[20]。
通過RT-PCR 檢測軟骨相關基因的表達水平,GAG 的含量在第7、14 天時,實驗組均明顯高于對照組,表明BMSCs-外泌體中含有的生物活性因子通過促進GAG 基因的表達。有學者在兔子骨關節病模型中,通過關節腔注射骨髓間充質干細來源的外泌體聯合HA,術后進行組織學和免疫組化分析,發現外泌體可以促進蛋白聚糖的合成進而加快軟骨損傷的修復,并且新形成的軟骨組織與天然軟骨具有相近的機械性能[21]。
為了進一步檢測軟骨細胞中GAG 含量的表達情況,我們通過分析細胞內的蛋白多糖含量,實驗組第3、7、14 天均明顯高于對照組,說明BMSCs-外泌體促進蛋白多糖表達,這些結果與上述RT-PCR 結果一致。為了排除細胞數量增加的干擾,我們檢測單位DNA 中GAG 含量表達的變化,結果顯示第7、14 天時實驗組GAG/DNA 含量明顯高于對照組。所有的這些證實了BMSCs-外泌體促進軟骨細胞GAG含量的表達,對維持軟骨的表型發揮重要的作用。這與Zhang 等[22]將 MSCs 來源的外泌體與軟骨共培養,促進軟骨基質合成,植入動物缺損模型后促進軟骨缺損愈合結果一致。有學者發現外泌體中的一些miRNA 可以調控軟骨基質合成,比如 miR-125b 和 miR-320 通過下調 aggrecanse 和MMP-13 表達,從 而 減 輕 ECM 破壞,miR-92a 可以通過PI3K/AKT/mTOR 通路靶向noggin 3 上調軟骨基質合成,介導MSC外泌體促進軟骨修復[23-24]。
綜上所述,干細胞來源的外泌體增加單位DNA 中GAG含量表達,有助于增加髁突軟骨細胞的蛋白多糖表達,這將為顳下頜骨關節病的治療開辟新的思路。
利益沖突:所有作者聲明無利益沖突。

