硫利達嗪協同二甲雙胍對肺癌細胞的抑制作用及其機制*
王 芳,劉星吟,王攀琦,劉 洋,劉復興,寧志豐**
(1.湖北科技學院藥學院,湖北 咸寧 437100;2.湖北科技學院基礎醫學院)
肺癌分為小細胞肺癌和非小細胞肺癌, 非小細胞肺癌又分為肺鱗癌和肺腺癌。肺癌的發病率在各類癌癥中位居第二,死亡率在所有類型的癌癥中遙遙領先[1]。目前,肺癌主要以化療和放療為主。但化療藥物易產生耐藥性,且對患者傷害較大,因此,尋找新的抗腫瘤藥物成為治療肺癌的研究熱點。二甲雙胍是治療2型糖尿病的口服降糖藥,Evans等[2]首次發現二甲雙胍可以降低糖尿病患者的癌癥發病率,此后,二甲雙胍的抗癌作用受到廣泛關注。研究表明[3-4],二甲雙胍對肺癌、子宮內膜癌等均有抑制作用,具有潛在抗癌價值。硫利達嗪是一種常見的吩噻嗪類抗精神病藥物,近年來研究[5-6]發現硫利達嗪對多種癌癥如膠質瘤、黑色素瘤等有抑制作用。因此,我們將二甲雙胍與硫利達嗪作為新的抗腫瘤藥進行研究。
1 材料與方法
1.1 材料
人肺腺癌細胞H1975細胞株為研究模型。主要試劑:鹽酸硫利達嗪和鹽酸二甲雙胍、二甲基亞砜(DMS0)購自美國Sigma公司;四甲基偶氮唑鹽(MTT)購自碧云天生物技術研究所;RPMI-1640培養基購自美國 Hyclone公司;胎牛血清(FBS)、青霉素-鏈霉素購自美國Gibico公司;Matrigel膠購自美國Corning公司;Akt、p-Akt、PI3K、p-PI3K、mTOR、p-mTOR和β-actin抗體購自武漢愛博泰克(ABclonal)生物科技有限公司。
1.2 方法
1.2.1 細胞培養
人肺腺癌細胞H1975細胞的培養條件為5%CO2、37℃。配制含10%胎牛血清和1%雙抗的RPMI-1640培養基培養細胞,細胞密度達到90%時進行實驗。
1.2.2 MTT細胞增殖實驗
將消化后的H1975細胞調整細胞密度至7×104個/mL,96孔板每孔加入100μL的細胞懸液,放置培養箱內培養。細胞密度達70%以上時給藥設硫利達嗪組(THZ)濃度為0、2.5、5、10、20、40 μmol/L,二甲雙胍組(MET)濃度為0、2.5、5、10、20、40mmol/L,聯合給藥組(COM)濃度為0、2.5+2.5、5+5、10+10、20+20、40+40(μmol/L硫利達嗪+mmol/L二甲雙胍),每組藥物做4個復孔,加藥后繼續培養24h和48h。每孔加入10μL MTT(5mg/mL),培養4h。每孔加入DMSO 150μL,使用酶標儀在490nm處測定吸光度(OD)。細胞存活率=(實驗組OD值-對照組OD值)/對照組OD值,設定對照組存活率為1。
1.2.3平板克隆形成實驗
將H1975細胞調整細胞密度至500個/mL,每孔1mL鋪至6孔板內培養24h后給藥。對照組(CON)給藥濃度為0、THZ組1μmol/L、MET組1mmol/L、COM組1μmol/L硫利達嗪+1mmol/L二甲雙胍,培養至克隆形成。結晶紫染色后拍照并計數。克隆形成率=實驗組克隆數/對照組細胞數。設定對照組克隆形成率為1。
1.2.4 細胞遷移實驗
預先將細胞饑餓24h。將細胞消化下來用無血清培養基調整細胞密度為2.5×105個/mL。用含20%血清的1640培養基配制藥物,CON組給藥濃度為0、THZ組5μmol/L、MET組5mmol/L、COM組5μmol/L硫利達嗪+5mmol/L二甲雙胍。上室加入200μL細胞懸液,下室加入500μL藥物。培養24h后,用結晶紫將小室進行染色晾干后拍照并計數。細胞遷移率=實驗組細胞數/對照組細胞數。設定對照組遷移率為1。
1.2.5 細胞侵襲實驗
預先將細胞饑餓24h。將Matrigel膠與1640按1∶8比例混合均勻,每個小室加入100μL的混合液,以上步驟冰上操作。放置培養箱30min使膠凝固,將未凝固的培養基吸出。用無血清培養基調整細胞密度至2.5×105個/mL。用含20%血清的1640培養基配制藥物,CON給藥濃度為0、THZ組5μmol/L、MET組5mmol/L、COM組5μmol/L硫利達嗪+5mmol/L二甲雙胍。上室加入200μL細胞懸液,下室加入500μL藥物。放置培養箱培養24h后,使用結晶紫染色晾干后拍照并計數。細胞侵襲率=實驗組細胞數/對照組細胞數。設定對照組侵襲率為1。
1.2.6 Western blot實驗
將COM組0、THZ組10μmol/L、MET組10mmol/L及COM組10μmol/L硫利達嗪+10mmol/L二甲雙胍作用8h的細胞提取蛋白。配制裂解液:加入RIPA裂解液、EDTA、磷酸化蛋白酶抑制劑、總蛋白酶抑制劑。用PBS將細胞潤洗3次,加入裂解液使細胞充分裂解后開始離心(12 000r/min,4℃,15min),離心后取上清液并記錄體積,使用BCA試劑盒檢測蛋白濃度;在各蛋白中加入一定體積的5×SDS-PAGE Loading buffer后進行煮沸變性。制備不同濃度的凝膠,每孔上樣量不低于50μg;電泳至底部。PVDF膜用甲醇激活后與膠放置在轉膜夾內開始轉膜(270mA,70min)。5%脫脂牛奶封閉1h;在抗體孵育盒內加入對應的一抗放置4℃冰箱內的搖床上搖床過夜,將條帶用TBST 潤洗3次,加入對應種屬的二抗室溫孵育1h,再將條帶用TBST潤洗3次,每次10min,顯影。
1.3 統計學方法
所有實驗均重復3次,組間比較采用t檢驗,以P<0.05為差異有統計學意義。樣本均數用Graphpad prism 8.0的非配對t檢驗,兩藥聯合指數采用CompuSyn軟件進行計算,CI>1表示拮抗,CI=1表示相加,CI<1表示協同/增敏,CI<0.4表示強協同/增敏。
2 結 果
2.1 二甲雙胍聯合硫利達嗪增強對肺癌細胞增殖能力的抑制作用
通過觀察二甲雙胍和硫利達嗪對H1975細胞的影響,在給藥時間相同的條件下,隨著給藥劑量的增加,細胞活性下降;在給藥濃度相同的條件下,隨著給藥時間延長,細胞活性下降但下降不明顯;在相同的給藥時間條件下,與MET組和THZ組相比,COM組的細胞活力顯著降低(P<0.05),計算聯合指數CI<1,在低濃度給藥24h時CI可達0.24,因此,二甲雙胍與硫利達嗪具有強協同/增敏作用。見圖1。
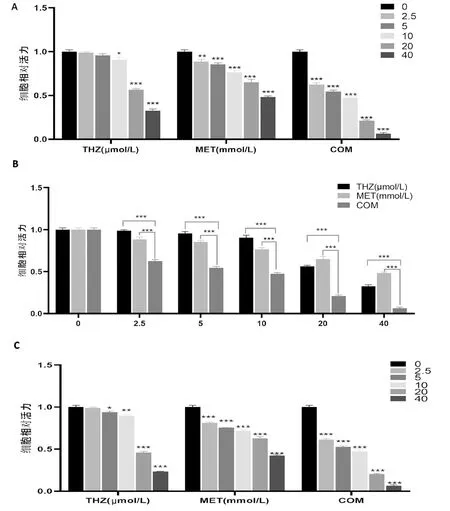
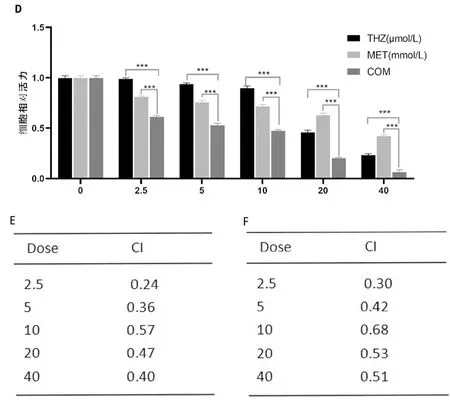
A、B.給藥24h細胞活力;C、D.給藥48h細胞活力;E.給藥24h各組聯合指數;F.給藥48h各組聯合指數(*P<0.05,**P<0.01,***P<0.001)
2.2 二甲雙胍聯合硫利達嗪增強對肺癌細胞克隆形成能力的抑制作用
觀察H1975細胞的克隆形成率,與CON組相比,MET組降低34.7%,THZ組降低23.2%,COM組降低96.4%;COM組較之MET組克隆形成率降低61.7%,比THZ組降低73.2%。見圖2。
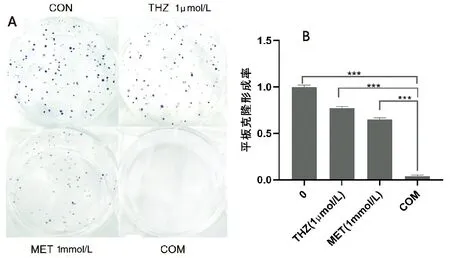
A.克隆形成圖;B.克隆形成率比較(***P<0.001)
2.3 二甲雙胍聯合硫利達嗪增強對肺癌細胞遷移能力的抑制作用
觀察H1975細胞的細胞遷移率,與CON組相比,MET組降低42.3%,THZ組降低8.6%,COM組降低92.1%;COM組較MET組細胞遷移率降低49.8%,比THZ組降低83.5%。見圖3。
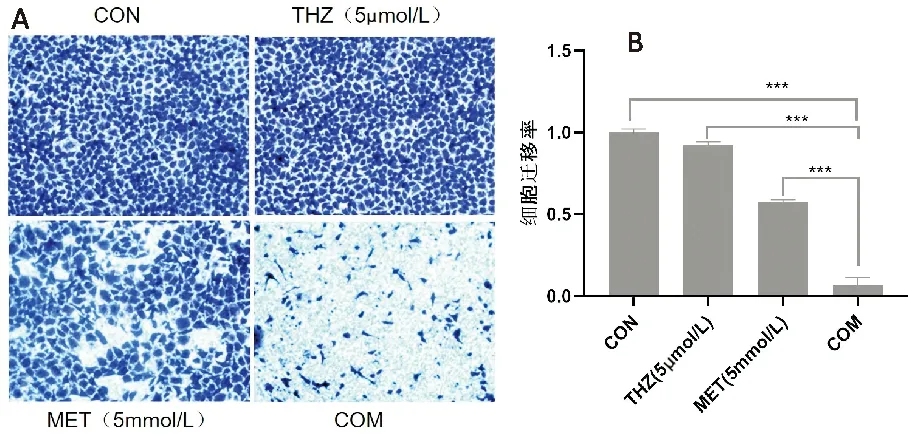
A.細胞遷移圖片(×100);B.細胞遷移率比較(***P<0.001)
2.4 二甲雙胍聯合硫利達嗪增強對肺癌細胞侵襲能力的抑制作用
觀察H1975細胞的細胞侵襲率,與CON組相比,MET組降低40.5%,THZ組降低5.7%,COM組降低71.3%;COM組較MET組細胞遷移率降低30.8%,比THZ組降低65.6%。見圖4。
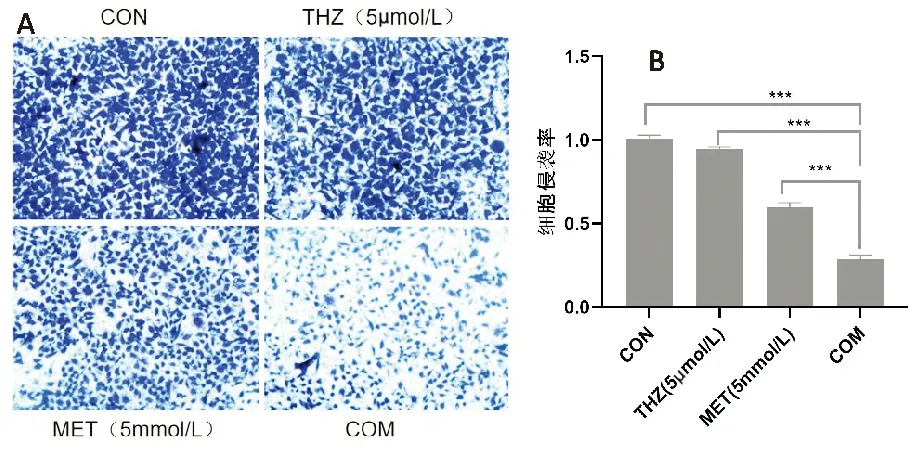
A.細胞侵襲圖片(×100);B.細胞侵襲率比較(***P<0.001)
2.5 二甲雙胍聯合硫利達嗪對肺癌細胞PI3K/Akt/mTOR信號通路相關蛋白表達的影響
觀察H1975細胞的總的Akt、PI3K、mTOR蛋白表達水平,3組間沒有明顯差異,無統計學意義(P>0.05)。與CON組相比,MET、THZ組和COM組P-Akt蛋白表達水平均明顯下降(P<0.01);與MET組和THZ組相比,COM組p-Akt蛋白表達量明顯下降(P<0.01)。與CON組相比,MET、THZ組和COM組P-PI3K蛋白表達均下降(P<0.05);與單藥組相比,COM組P-PI3K蛋白表達量顯著下降(P<0.001)。與CON組相比,MET、THZ組和COM組p-mTOR蛋白表達均顯著下降(P<0.001);與單藥組相比,COM組p-mTOR蛋白表達量明顯下降(P<0.01)。見圖5。
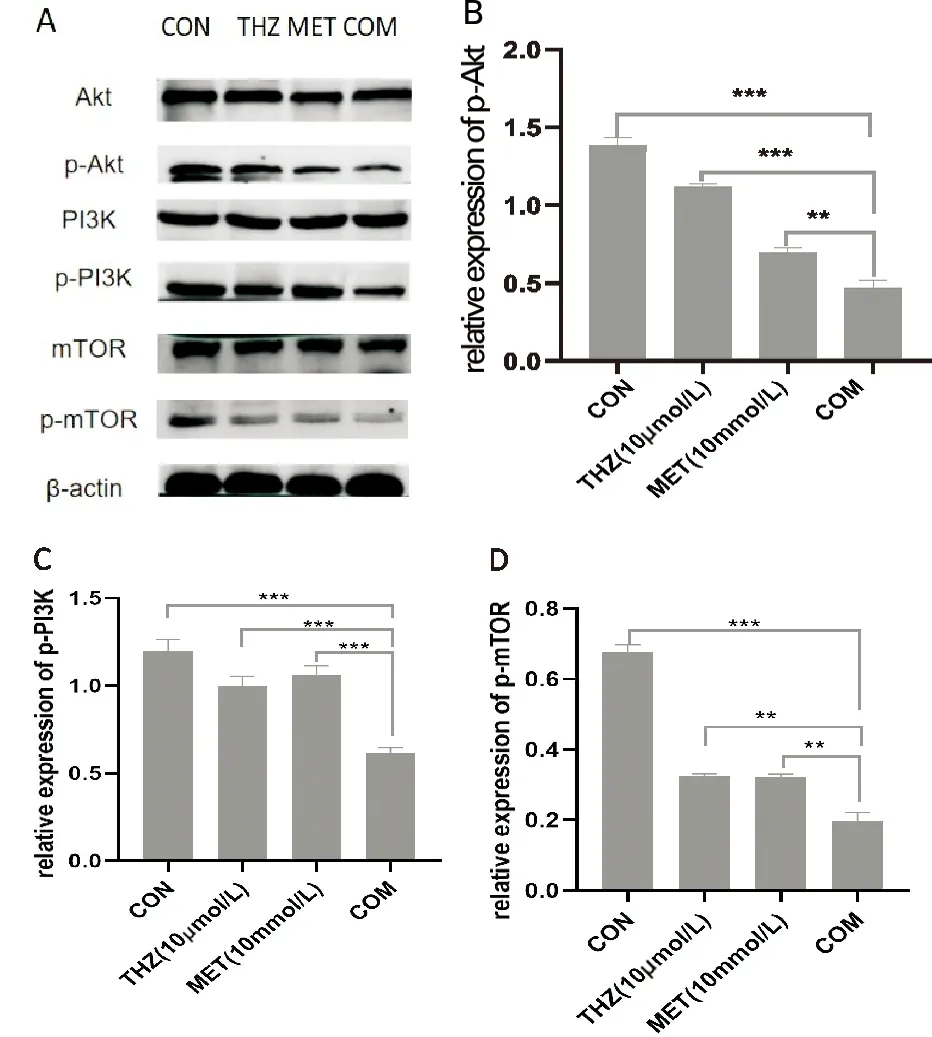
(**P<0.01;***P<0.001)
3 討 論
二甲雙胍是治療2型糖尿病的一線用藥,具有穩定、高效、安全性高等特點。二甲雙胍的降糖機制主要包括減少肝臟糖異生,增加外周葡萄糖的攝取和利用,改善胰島素的敏感性等[7]。近年來,大量研究發現二甲雙胍能夠抑制肺癌、胃癌、乳腺癌、甲狀腺癌、子宮內膜癌等癌細胞增殖[8]。
硫利達嗪是靶向于多巴胺受體 (DR2) 抗精神病藥,已有報道硫利達嗪對肝癌干細胞[9]和胃腸腫瘤[10]有抑制作用。研究發現[11],在卵巢癌中,硫利達嗪通過PI3K下游的信號分子的磷酸化,包括Akt和mTOR,抑制卵巢腫瘤的生長。
二甲雙胍聯合其他藥物用于抗腫瘤已有研究,如克唑替尼[12]、IL-12[13]以及放療藥物等[14]。硫利達嗪與順鉑[14]、姜黃素、白藜蘆醇[16]等聯合用于抗腫瘤已見報道。本研究首次將二甲雙胍與硫利達嗪聯合使用用于抗癌。細胞的增殖和凋亡失去平衡是腫瘤形成的主要原因。因此,本研究采用MTT法檢測肺癌細胞活力,并計算兩藥的聯合指數。實驗結果發現,兩藥均能抑制肺癌細胞增殖,且具有協同增效作用。此外,本研究也做了平板克隆實驗檢測肺癌細胞增殖能力的影響,結果與MTT實驗結果一致。腫瘤細胞的遷移侵襲是腫瘤惡化的主要原因。因此,本研究采用遷移侵襲實驗檢測兩藥對肺癌細胞遷移侵襲能力的影響。實驗結果表明,兩藥能夠協同抑制肺癌細胞的遷移侵襲能力。因此,協同使用硫利達嗪與二甲雙胍有望成為治療癌癥的新方法。
PI3K是一種胞內磷脂酰肌醇激酶,與細胞增殖、分化、調亡等過程密切相關。Akt是PI3K的下游基因,活化的PI3K能夠激活Akt,從而調控細胞的各種生命活動,促進細胞凋亡[17]。mTOR是一個289kDa絲氨酸/蘇氨酸蛋白激酶,在細胞生長、增殖和存活中起調節作用。mTOR有不同的復合物,mTOR復合物1(mTORC1)和mTOR復合物2(mTORC2),mTORC1主要參與細胞凋亡[18]。 本研究通過Western blot實驗檢測到協同使用硫利達嗪和二甲雙胍后,H1975細胞內p-Akt/p-PI3K/p-mTOR蛋白的表達水平均降低,且聯合給藥組明顯低于單藥組,這些實驗結果表明硫利達嗪協同二甲雙胍抑制肺癌細胞可能是通過阻斷PI3K/Akt/mTOR信號通路的激活發揮作用,且聯合使用兩藥對PI3K/Akt/mTOR信號通路激活的阻斷作用優于單獨使用兩藥。
本研究尚有許多后續問題待解決,且未涉及動物實驗,因此,硫利達嗪聯合二甲雙胍抑制肺癌在動物體內的作用還未可知。此外,兩藥協同使用是否對其它癌癥也有效還有待研究。在作用機制方面,兩藥是否也可調控其它癌癥相關信號通路發揮作用也未可知。因此,本研究尚存在許多問題,有待進一步研究。

