低氧低溫對大鼠骨骼肌細胞脂代謝關鍵酶及解耦聯蛋白1的影響#
關 璐,劉川川,張瑞霞*
(1.青海大學研究生院,青海 西寧 810016;2.青海大學附屬醫院,青海 西寧 810001;3.青海大學高原醫學研究中心,青海 西寧 810001)
目前學者們多關注平原狀態下的骨骼肌的糖代謝,對高原脂代謝的研究并不多見且研究結論不一。因此,本研究擬通過對高原低氧低溫條件下骨骼肌細胞內脂代謝關鍵酶HSL和CPT1A及棕色脂肪線粒體內產熱基因UCP1的表達水平的研究,觀察低氧低溫對大鼠骨骼肌細胞脂代謝關鍵酶及解耦聯蛋白1的影響。
1.材料與方法
1.1 材料及動物
胰蛋白酶、DMEM、離心管購于西格瑪生物公司;SABC免疫組化染色試劑盒購于博士德生物公司;油紅O染色試劑盒購于索萊寶公司。RNA提取試劑盒、BCA蛋白定量試劑盒購于賽默飛世爾科技公司;cDNA反轉錄試劑盒、PCR反應試劑盒購于天根生物公司;抗體購于愛博泰克公司。
大鼠購于上海杰思捷實驗動物有限公司,體重約140~160g,動物合格證號:20180004012817。
1.2 方法
1.2.1 骨骼肌細胞的分離與培養方法
腹腔注射1.5%戊巴比妥鈉(0.2mL/100g),麻醉后脫頸處死大鼠,浸泡于含75%酒精的容器內,充分消毒后于超凈工作臺分離骨骼肌。取1 cm3腓腸肌剪碎至1 mm3,用PBS洗滌后離心,去除上清后加2 mL 0.1%Ⅱ型膠原酶消化(37.0℃,20min),期間吹打混勻,重懸細胞并接種在25 cm2的培養瓶中,細胞約2 h貼壁,鏡下觀察細胞形態。
1.2.2 骨骼肌細胞的鑒定方法
1.2.3 細胞分組方法
隨機分為對照組(nature group,N。氧濃度:21%。37℃)、低氧組(hypoxia group,HO。氧濃度:1%。37℃)、低溫組(hypothermia group,HT。氧濃度:21%。28℃)、低氧低溫組(hypoxia and hypothermia group,HOHT。氧濃度:1%。28℃)。
1.2.4 RNA分離、逆轉錄PCR和RT-qPCR方法
用TRIZOL法分離和提取細胞總RNA,在分光光度計上測定總RNA的濃度和純度,在1%瓊脂糖凝膠上進行RNA電泳,通過觀察28S RNA及18S RNA以評估RNA的完整性。根據說明將800 ng總RNA逆轉錄為cDNA。特異性擴增引物(表1)由上海生工生物公司合成。配制20 μL的RT-qPCR反應液:2×SuperReal Color PreMix 10 μL,正、反向引物各0.6 μL,cDNA模板2 μL,50×ROX Reference Dye 0.4 μL,RNase-free ddH2O 6.4 μL。在ABI Q5序列檢測系統上進行兩步法擴增:預變性95 ℃,15 min;變性95 ℃,10 s;退火及延伸60 ℃,32 s。共40個循環,以2-△△CT法對mRNA進行相對定量。

表1 RPS18與目的基因的特異性引物序列
1.2.5 Western-Blot方法
1.2.6 統計學方法

2.結果
2.1 骨骼肌細胞形態
以酶消化法分離骨骼肌細胞,圖為已貼壁的梭形骨骼肌細胞(圖1)。

圖1 骨骼肌細胞鏡下圖(20×)
2.2 骨骼肌細胞的鑒定結果
以SABC免疫組化法鑒定骨骼肌細胞(ACTA1蛋白在骨骼肌細胞陽性表達)(圖2)。
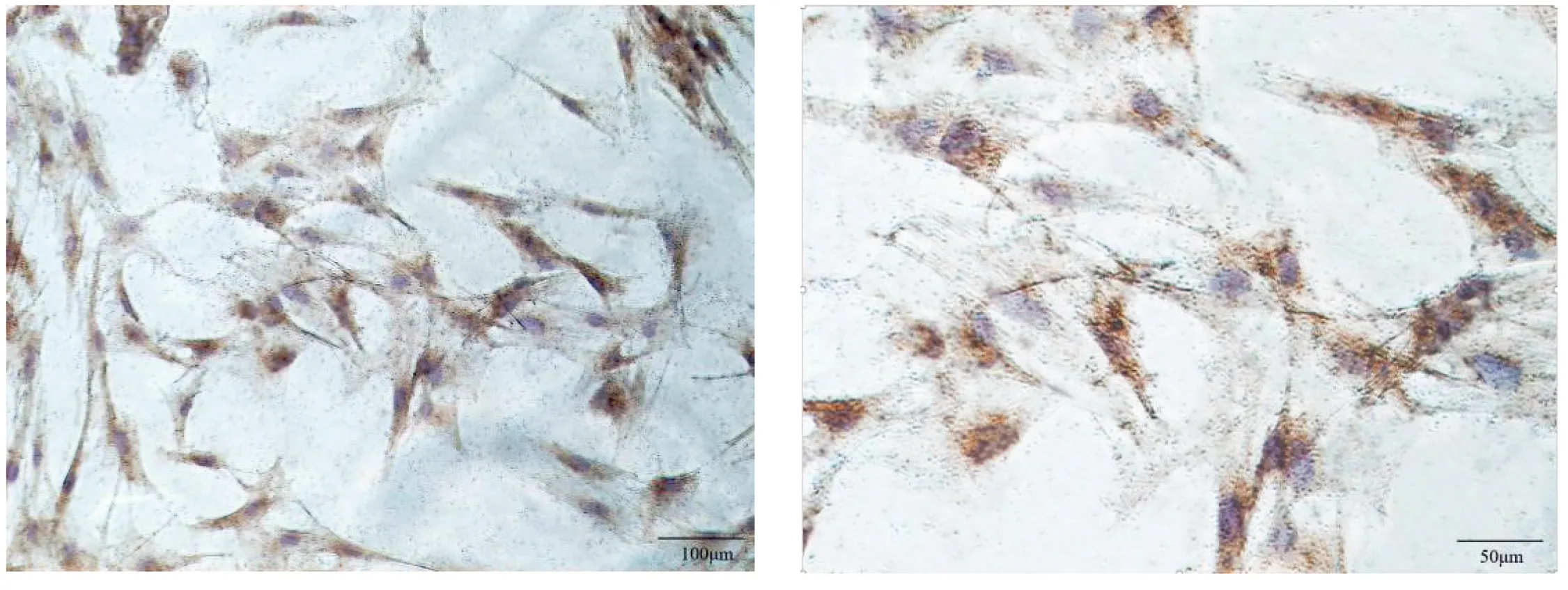
圖2 免疫組化法測定ACTA1蛋白圖
2.3 HSL、CPT1A、UCP1 mRNA表達差異
為研究低氧低溫對骨骼肌細胞脂代謝相關基因表達的影響,采用RT-qPCR法檢測HSL、CPT1A、UCP1 mRNA表達水平。與對照組、低氧組、低溫組比,低氧低溫組HSL mRNA表達增多(P<0.05)。與低溫組比,低氧低溫組CPT1A mRNA表達減少(P<0.05)。與對照組和低氧組比,低氧低溫組UCP1 mRNA表達增多(P<0.05)。
表2 各組目的基因mRNA表達水平
2.4 HSL、CPT1A、UCP1蛋白表達差異
為進一步詳細研究低氧低溫對骨骼肌細胞脂代謝相關蛋白表達的影響,采用Western-Blot法檢測HSL、CPT1A、UCP1蛋白表達水平(圖3)。與前三組比,低氧低溫組HSL蛋白表達水平升高(P<0.05)。與對照組、低氧組比,低氧低溫組CPT1A表達水平降低(P<0.05),與低溫組比,表達水平升高(P<0.05)。與對照組比,三組UCP1蛋白表達均減少(P<0.05)(表3)。
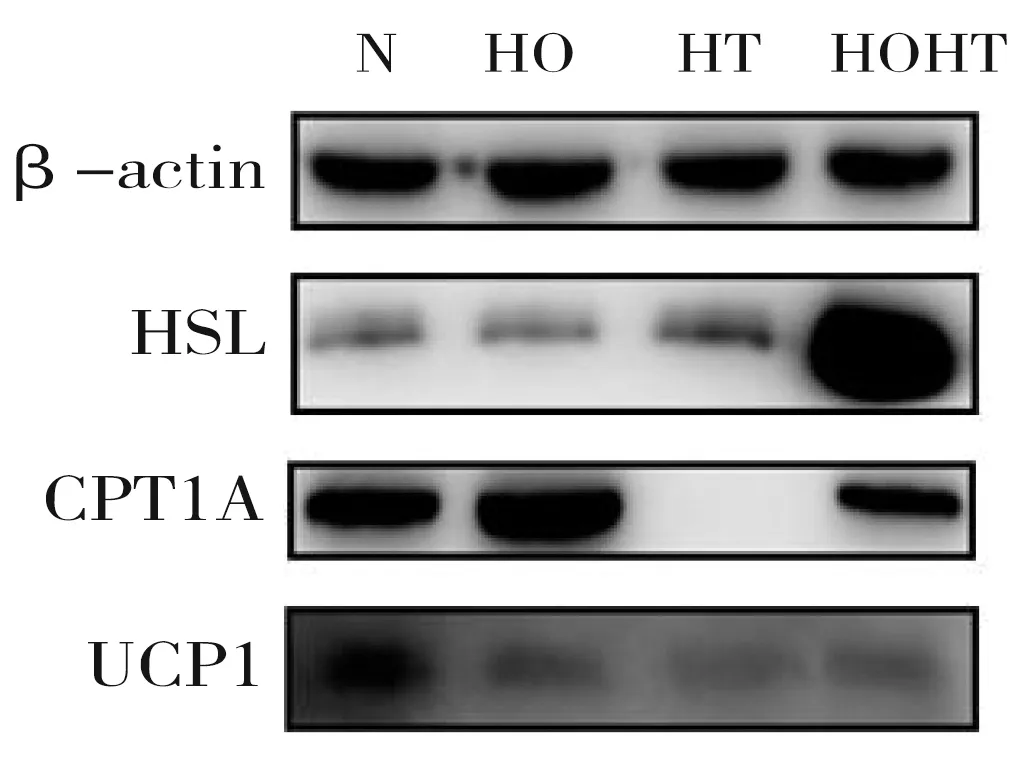
圖3 Western-Blot法檢測各目的蛋白表達水平圖

表3 各組目的蛋白表達水平
3.討論
對急進高原人群來說,機體能量代謝不同于平原地區。在這個過程中糖利用率降低,脂肪利用率升高,血液中游離脂肪酸和甘油含量增多,提示高原習服過程中脂肪分解占優勢[1]。有學者發現,高原地區人群棕色脂肪組織多于漢族人群[2]。高原地區糖脂代謝是近年來的研究熱點,骨骼肌的能量代謝逐漸被關注。低氧低溫條件下骨骼肌細胞內脂代謝關鍵酶的改變情況未知。我們通過在低氧低溫環境下培養骨骼細胞,檢測脂代謝關鍵酶HSL、CPT1A及UCP1的表達情況,發現低氧低溫雙重因素對骨骼肌細胞脂代謝水平有一定的影響,低氧低溫促進脂代謝關鍵酶HSL mRNA及蛋白表達,抑制CPT1A mRNA及蛋白表達,低氧低溫促進骨骼肌細胞UCP1 mRNA表達,抑制骨骼肌細胞UCP1蛋白表達。
我們發現,低氧低溫雙重因素促進HSL mRNA及蛋白表達。HSL的C端有一個含200個氨基酸的調節區[3],該區是PKA的主要靶點。缺氧時cAMP/PKA信號通路被激活,進而激活HSL,使其表達升高[4]。低氧間接激活糖酵解途徑產生大量的丙酮酸,丙酮酸進入線粒體通過三羧酸循環產生大量ATP,為脂肪分解供能,促進HSL合成,這與我們的研究一致。低溫環境還可直接刺激脂肪分解,誘導HSL產生,加速脂肪動員,使甘油三酯分解為甘油與游離脂肪酸[5],從而促進脂肪酸β氧化而產生ATP,刺激了骨骼肌細胞的生長代謝。寒冷條件下促進HSL磷酸化,其磷酸化水平越高,脂肪分解速率越高[6],被激活的HSL水解甘油三脂的酯鍵產生游離脂肪酸,而游離脂肪酸是激活棕色脂肪組織內UCP1的燃料[6,7]。對于哺乳動物,缺氧及低溫均可激活cAMP/PKA/HSL途徑,促進HSL的合成及活化以增加能量消耗,這也是維持體重、避免肥胖的原因[7]。
與低溫組比,低氧低溫組CPT1A mRNA表達減少,提示骨骼肌細胞內CPT1A的減少主要受低氧誘導因子(HIF)的誘導。而低溫組CPT1A表達減少的原因可能是,基因到蛋白水平存在著復雜的轉錄后修飾及翻譯等過程,CPT1A合成減少可緩解線粒體因脂質過多導致的損傷和氧化應激[8,9]。低氧環境促進CPT1A的表達,在肝細胞內,CPT1A的轉錄上調利于線粒體內脂肪酸的攝取及氧化[8,10],研究發現,低氧環境促進哺乳動物體內HIF的合成,HIF通過誘導CPT1A啟動子轉錄沉默而抑制CPT1A的產生[11],從而減少脂肪酸向線粒體的轉運,使得脂肪酸以脂滴的形式儲存,利于高海拔地區人群御冷[12]。骨骼肌細胞內的變化也是如此,與低溫組比,低氧低溫組CPT1A mRNA合成減少,推測這種情況下細胞內糖酵解占主要地位,糖酵解過程的加強促進乳酸合成,導致ATP生成減少、 CPT1A合成抑制,使脂肪酸的β氧化被進一步抑制。在蛋白水平,與對照組比,低氧低溫組CPT1A合成明顯減少,提示低氧低溫雙重因素會抑制CPT1A合成。低溫促進CPT1A mRNA合成,而敲除CPT1A基因后,脂質積累面積增大[11]。
多數學者認為冷暴露誘導棕色脂肪中UCP1 mRNA的合成[13],與我們的結果一致。而與低氧組比,低氧低溫組UCP1 mRNA合成減少,提示低溫環境抑制UCP1合成,這可能是由于UCP1是棕色脂肪組織特異基因,在骨骼肌內該基因的表達不一定增多,也可能是低溫可激活HIF通路使CPT1A沉默,影響了脂肪酸氧化而抑制線粒體內UCP1的表達[11]。低氧促進AMPK的表達[14],AMPK/PGC-1α信號通路也參與調控骨骼肌脂肪酸氧化代謝,PGC-1α與PPARα、PPARγ、ERRα等結合促進UCP1的表達,進一步促進脂肪分解[15],這與Du W等[11]的研究不一致,即低氧時HIF通過誘導轉錄抑制物的產生而抑制PGC-1α的合成,PGC-1α進一步抑制UCP1的合成,這是實驗組UCP1蛋白表達減少的原因。
綜上所述,低氧低溫對骨骼肌細胞的脂代謝水平有一定的影響,低氧低溫促進脂代謝關鍵酶HSL mRNA及蛋白表達,抑制CPT1A mRNA及蛋白表達,低氧低溫促進骨骼肌細胞UCP1 mRNA表達,抑制骨骼肌細胞UCP1蛋白表達,這可能是高海拔地區肥胖患病率、非酒精性脂肪肝患病率低于平原的原因[16]。

