Torin1、Nutlin-3a促進人誘導多能干細胞來源早期心肌細胞成熟的初步研究
陳穎 楊禮 宮藝其 譚瑤 王會景 劉明璐 盧婷婷 羅潤嬌 王偉 付煒
心血管疾病是全球范圍造成死亡的主要原因。2019年超過1 850萬人死于心血管疾病,占死亡人數的32.8%;2020年全球心衰患者估計為6 330萬人,5年生存率與癌癥相似[1]。治療困難、缺乏有效的疾病模型等問題,限制了心血管疾病研究領域的進展。2006年,Yamanaka通過在成體細胞中過表達Oct4、Sox2、Nanog、KLF4等4個轉錄因子,將這些細胞轉變成為了誘導多能干細胞(Human induced pluripotent stem cell,hiPSC)[2]。iPSCs避免了破壞胚胎獲取胚胎干細胞存在的倫理問題,成為心肌細胞的理想來源。利用iPSCs可以進行心臟疾病模型、藥物篩選、細胞治療等一系列研究,極大推動了心臟疾病領域的研究。然而,hiPSC誘導的心肌細胞(Human induced pluripotent stem cell-cardiomyocyte,hiPS-CM)依然存在一些問題,比如成熟度低,更接近胎兒期細胞[3]。大量研究通過延長培養時間、細胞共培養、機電刺激、添加生物活性分子等方法,試圖促進心肌細胞成熟[4],但是這些方法或過于復雜,或效果有限。因此,需要進一步研究以獲得簡單有效的促進iPSCs來源心肌細胞成熟的方法。
雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)是細胞生長和代謝狀態的主要調節劑,可以響應營養物質、生長因子和許多細胞外信號[5]。mTOR在心臟中起著重要作用,mTOR信號的異常激活可導致病理性心臟肥大[6]。mTOR的抑制在心臟意外損傷時可起到一定的保護作用。研究發現,mTOR抑制劑雷帕霉素應用于心肌梗死中減少了細胞凋亡[7]。mTOR已被證明與其他類型細胞的成熟相關,包括紅細胞、胰腺細胞和自然殺傷細胞[8-9]。然而,mTOR是否以及如何影響心肌細胞的成熟尚不清楚。胚胎發育過程中心臟的生長主要通過心肌細胞的增殖,然而心肌細胞在出生后不久就退出細胞周期,心臟生長主要是通過細胞體積的增大而不是細胞增殖來實現的[10]。研究表明,在小鼠早期發育過程中,胚胎內細胞團增殖需要mTOR,而出生后小鼠心臟中的mTOR表達水平非常低[11]。
已有研究證實,Torin1可以抑制mTOR通路并且上調p53,Nutlin-3a抑制Mdm2/p53相互作用和誘導p53上調,并抑制mTOR通路。我們嘗試通過上調p53蛋白的表達,伴隨mTOR通路的抑制,可能誘導細胞退出細胞周期,促進cTnT等心肌相關成熟標志物的表達,以期增加iPS細胞分化來源早期心肌細胞的成熟度。
1 材料與方法
1.1 實驗試劑及儀器
TESR-E8培養基(Stemcell,加拿大),EDTA(Thermo,美國),Y-27632(Stemcell,加拿大),基質膠(Corning,美國),ACCUTASE消化酶(Stemcell,美國),RPMI1640(Thermo,美國),B27-INSULIN(Thermo,美國),CHIR99021(Stemcell,加拿大),心肌細胞消化液(賽貝,中國),流式細胞固定破膜液(Invitrogen,美國),cTnI抗體(Proteintech,美國),cTnT抗體(Proteintech,美國),p53抗體(Proteintech,美國),ki67抗體(Abcam,英國),α-actin抗體(Sigma,美國),TRIZOL(Thermo,美國),SYBR PCR試劑盒(Qiagen,德國),RT REAGENT KIT試劑盒(TaKaRa,日本),胰酶(Thermo,美國),雙抗(Hyclone,美國),FBS(Bioind,以色列),DMSO(Sigma,美國),驢抗兔/鼠IgG二抗(Abcam,英國),DAPI(翊圣,中國),PCR引物訂購于上海生工生物科技有限公司,4× Tris-HCl濃縮膠配膠緩沖液pH 6.8 0.5 mol/L、4× Tris-HCl濃縮膠配膠緩沖液pH 8.8 1.5 mol/L(生工,中國),Amersham Hybond P 0.45 PVDF(GE Healthcare,美國),non-fat powder milk(BBI Life Science,美國),Tris-Glycine-SDS緩沖液(生工,中國),10×印跡轉膜緩沖液(生工,中國),Tween-20、TEMED、APS、10% SDS(Sangon Biotech,美國),PMSF、RIPA裂解液(強)、30% Acr-Bis(29∶1),5× SDS-PAGE蛋白上樣緩沖液(碧云天,中國),Immobilon Western HRP底物(Merk,德國),Pageruler prestained protein ladder(Life Technologies,美國)。
流式細胞分析儀(FACSCantoTMFlow Cytometer,BD,美國),激光掃描共聚焦顯微鏡(TSC SP8,Leica,德國),倒置熒光顯微鏡(DMI3000B,Leica,德國),NanoDrop 2000(Thermo,美國),qPCR儀(CFX-Connect,BIO-RAD,美國),化學發光成像儀(Amersham Imager 600,美國)。
1.2 實驗方法
1.2.1 細胞培養
hiPSC細胞系由上海兒童醫學中心李彥欣教授課題組建系、鑒定,為臍帶血細胞來源,捐獻者簽署了相關知情同意書。
在Matrigel鋪板的6孔板中,使用TeSR-E8培養基進行hiPSCs的維持和擴增。
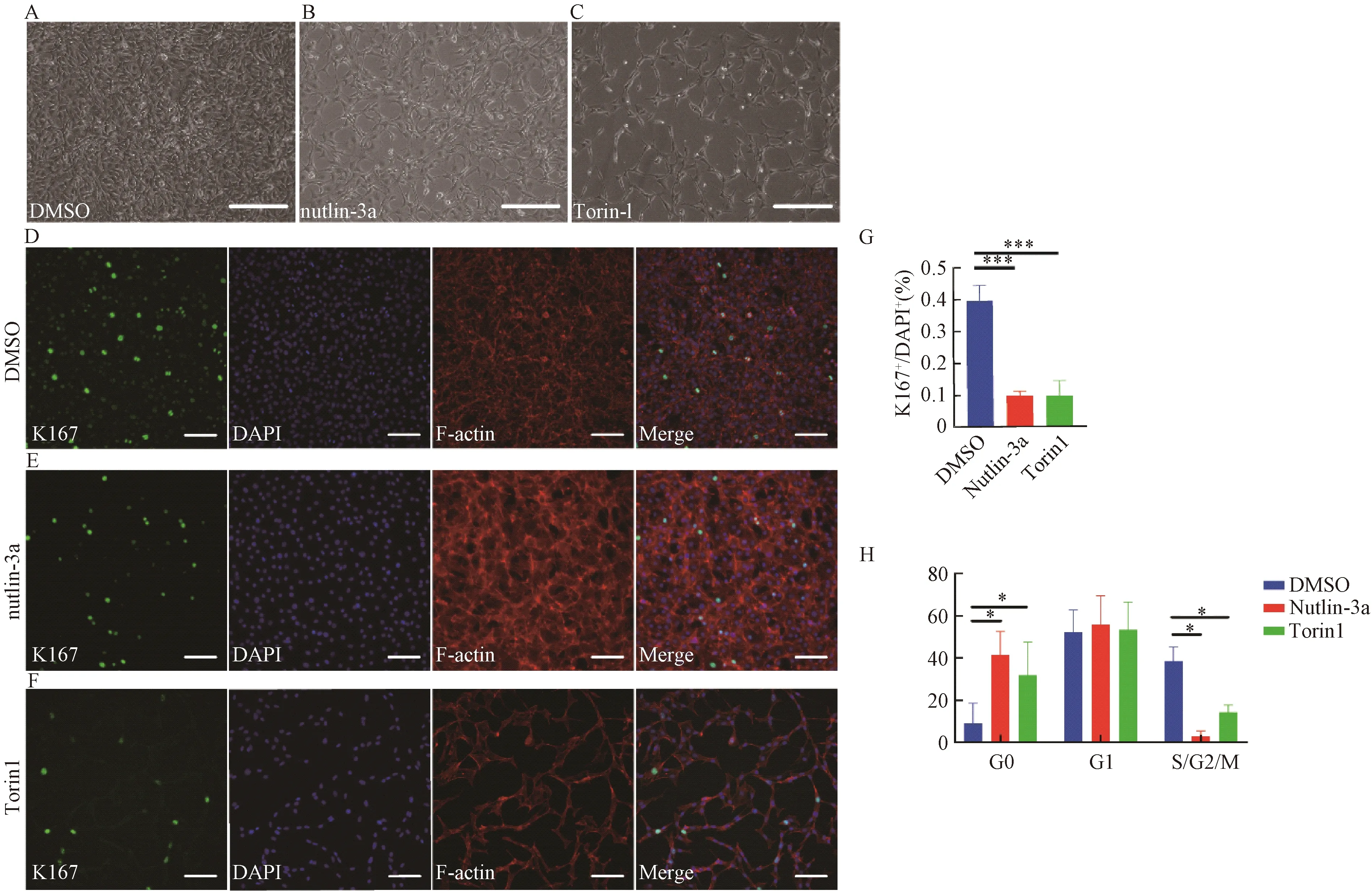
采用GiWi方案分化得到心肌細胞,具體流程為:分化前2 d,將iPS細胞以100萬/孔的密度接種于12孔板上,分化第0天加入12 μmol/L CHIR99021(用B27-Insulin配制),2 mL/孔,36 h后吸棄,加入B27-Insulin培養基,2 mL/孔,分化第3天棄培養基,加入5 μM IWP2(用B27-Insulin配制),2 mL/孔,分化第5天吸棄,加入B27-Insulin培養基,分化第7天吸棄,加入B27+Insulin培養基,此后每2天換一次液。分化第9天細胞開始搏動。
將人誘導多能干細胞分化到第11天,即細胞開始跳動后2 d,作為起點,將實驗分為3個組:DMSO組(陰性對照組);10 μmol/L Nutlin-3a處理24 h(Nutlin-3a組);200 nmol/L Torin1處理7 d(Torin1組),每2天換一次新鮮的培養基。
3T3細胞培養在6孔板中,30萬/孔,用高糖DMEM(包含10%FBS)維持細胞生長,細胞生長至90%融合時以胰酶消化傳代。將3T3細胞分為3個組:DMSO組(陰性對照組);10 μmol/L Nutlin-3a處理24 h(Nutlin-3a組);200 nmol/L Torin1處理3 d(Torin1組)。以30萬/孔接種于6孔板上,24 h后分別加入DMSO、Nutlin-3a、Torin1,3 d后進行細胞學的相關鑒定。
1.2.2 免疫熒光實驗
將細胞以合適的密度接種于共聚焦小皿上,繼續培養24 h,待細胞貼壁后,吸去培養液,PBS清洗細胞,4%多聚甲醛固定15 min,0.5% Triton-100破膜通透5 min,5%BSA室溫封閉2 h,一抗4 ℃孵育過夜,PBS漂洗3次,二抗室溫避光孵育2 h,DAPI染色5 min后PBS漂洗3次,避光保存激光共聚焦顯微鏡下觀察。
1.2.3 定量反轉錄聚合酶鏈式反應(Real-time quantitative PCR,qRT-PCR)
吸棄培養液,PBS清洗細胞,每孔加入1 mL細胞裂解液trizol,室溫作用5 min,收集細胞,吹打混勻。用氯仿、苯酚等有機溶液提取RNA,用PrimeScript RT reagent Kit進行反轉錄,得到cDNA,具體操作參照試劑使用說明。使用SYBR Green PCR試劑和相關引物,在bio-rad CFX96實時熱循環儀上完成RNA定量實驗,以TBP(tata結合蛋白基因)作為管家基因,PCR引物序列如表1所示,依據2-ΔΔCt計算RNA相對表達量。
1.2.4 免疫蛋白印跡(Western blot)
用裂解緩沖液(RIPA、蛋白酶抑制劑混合物)裂解細胞,用BCA蛋白檢測試劑盒測定總蛋白含量。將樣品與loading混合,95 ℃變性10 min,將樣品總蛋白量稀釋至相同濃度,以同體積加入配制好的10%凝膠樣品孔中,80 V電泳3 h,隨后以200 mA、90 min轉移到PVDF膜,用5%的脫脂牛奶室溫封閉2 h,一抗在4 ℃下孵育過夜。然后用辣根過氧化物酶偶聯二抗室溫下孵育1 h。采用ECL Western blotting檢測試劑盒以化學發光法檢測蛋白信號,譜帶密度使用AI600軟件進行量化。

1.2.5 流式細胞分析技術
將106個3T3細胞在70%預冷乙醇中-20 ℃固定過夜,用Hoechst 33342和pyronin Y室溫孵育30 min,用于區分G0、G1、S-G2-M期細胞,數據通過流式細胞分析儀器獲取,并使用FlowJo進行分析。
1.2.6 膜片鉗電生理技術
將細胞消化成單細胞,細胞計數后按2.5×105個/孔的密度將細胞種植在預先鋪好基質膠的共聚焦小皿上,繼續培養48 h至細胞完全貼壁。利用消化液消化細胞收縮變圓,隨后通過灌流裝置灌流10 min動作電位電極外液。選取單個完整心肌細胞作為記錄細胞。當記錄電極尖端與細胞膜表面形成高阻封接后,吸破細胞膜,補償細胞膜電容,使用電流鉗模式記錄心肌細胞自發產生的動作電位。
1.3 統計學分析
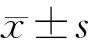
2 結果
2.1 Torin1、Nutlin-3a對3T3細胞增殖的影響
為了驗證Torin1、Nutlin-3a對細胞增殖的影響,我們首先在3T3細胞系里進行了驗證。3 d后光鏡下觀察顯示:Torin1組和Nutlin-3a組細胞數量比DMSO組明顯減少(圖1A-C)。免疫熒光染色結果顯示:增殖標志物Ki67陽性細胞的比例在DMSO組(32.8%±15.4%)高于Nutlin-3a組(8.2%±3.6%)和Torin1組(8.8%±3.9%),差異有統計學意義(P<0.001,圖1D-G)。流式細胞分析顯示:Torin1組(31.8%±15.7%)和Nutlin-3a組(41.3%±11.4%)比DMSO組(9.0%±9.5%),有更多的細胞進入G0期(P<0.05),說明Nutlin-3a和Torin1對細胞周期有一定的調控作用(圖1H)。上述實驗結果說明,Nutlin-3a和Torin1可以通過調控細胞周期而抑制細胞增殖。
A-C: 3t3細胞光鏡圖(標尺=400 μm);D-F:各組3t3細胞ki67、DAPI、F-actin、Merge免疫熒光(標尺=100 μm);G: ki67陽性3t3細胞統計分析;H: 3t3細胞周期流式分析;*:P<0.05;***:P<0.001。A-C: Light microscopic view of 3t3 cells (bar=400 μm); D-F: Immunofluorescence of Ki67, DAPI, F-actin, Merge (bar=100 μm) in 3t3 cells of each group; G: Statistical analysis of Ki67 positive 3t3 cells; H: Cell cycle analyzed by flow cytometry; *: P<0.05; ***: P<0.001.圖1 Torin1、Nutlin-3a對3T3細胞增殖的影響Fig. 1 Effect of Torin1、Nutlin-3a on proliferation of 3T3 cells
2.2 hiPS細胞鑒定及hiPS細胞向心肌細胞分化
hiPS細胞呈克隆樣生長,邊緣整齊,細胞小,呈圓形,排列緊密,核質比高。免疫熒光染色結果顯示:hiPS細胞高表達干性標志物Nanog、Oct4、Sox2、Tra-1-60(圖2)。在hiPS細胞向心肌細胞誘導分化過程中,細胞形態逐漸發生改變,由橢圓形變為多邊形的心肌細胞,第9天可以觀察到跳動的心肌細胞(圖3B-E)。免疫熒光結果顯示:分化的心肌細胞高表達心肌特異性標志物cTnT、α-actinin,肌節明顯且排列較規整(圖3F)。流式細胞分析技術顯示:分化的心肌細胞高表達心肌特異性標志物cTnT,效率超過70%(圖3G)。

A:Nanog、DAPI、Merge免疫熒光;B:Oct4、DAPI、Merge免疫熒光;C:Sox2、DAPI、Merge免疫熒光;D:TRA-1-60、DAPI、Merge免疫熒光。A: Immunofluorescence of Nanog, DAPI and Merge; B: Immunofluorescence of Oct4, DAPI and Merge; C: Immunofluorescence of Sox2, DAPI and Merge; D: Immunofluorescence of TRA-1-60, DAPI and Merge.圖2 hiPS細胞特異性標志物鑒定(標尺=400 μm)Fig. 2 Pluripotency identification of hiPSC (bar=400 μm)
A:hiPS細胞誘導分化為心肌細胞過程模式圖;B:hiPS細胞形態;C-E:hiPS細胞誘導分化過程形態變化圖(標尺=400 μm);F:分化第35天cTnT、α-actin、DAPI、Merge免疫熒光(標尺=10 μm);G:分化第15天cTnT表達流式分析。A: The process of inducing differentiation of hiPS cells into cardiomyocytes; B: Morphological observation of hiPS; C-E: Morphological changes of hiPS cells during differentiation (bar=400 μm); F: Immunofluorescence of cTnT, α-actin, DAPI and Merge on the 35th day of differentiation (bar=10 μm); G: Flow analysis of cTnT on the 15th day of differentiation.圖3 hiPS細胞向心肌細胞分化的過程及心肌細胞鑒定Fig. 3 Differentiation of hiPS cells into cardiomyocytes and identification of cardiomyocytes
2.3 Torin1、Nutlin-3a對hiPS-CM成熟相關蛋白表達的影響
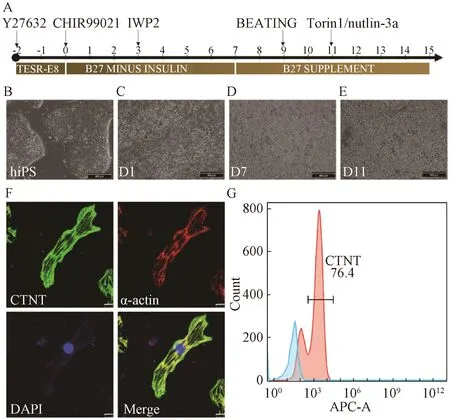
為了評估Torin1和Nutlin-3a對iPS細胞誘導的早期心肌細胞成熟的影響,我們在早期心肌細胞中分別添加Torin1和Nutlin-3a,通過Western blot實驗對心肌特異性蛋白cTnT、cTnI以及p53總蛋白含量進行鑒定(圖4A)。結果顯示:以GAPDH作為內參蛋白,DMSO組、Nutlin-3a組、Torin1組cTnT條帶灰度值分別為34 161± 6 679、52 402±10 376、51 274±10 325(圖4B),DMSO組、Nutlin-3a組、Torin1組cTnI條帶灰度值分別為149 862±60 900、397 738±147 167、470 233±222 324(圖4C)。Nutlin-3a組和Torin1組cTnT、cTnI蛋白表達量相比DMSO組有增加的趨勢,p53蛋白在DMSO組和Nutlin-3a組表達最高,在Torin1組表達有下降的趨勢,與預期不符(圖4D)。Western blot結果初步表明,Torin1和Nutlin-3a作用于iPS細胞誘導的早期心肌細胞,在蛋白水平上可能促進心肌細胞成熟。
A:WB結果;B:cTnT蛋白條帶灰度值統計圖;C:cTnI蛋白條帶灰度值統計圖;D:p53蛋白條帶灰度值統計圖。A: The result of Western blot; B: Histogram of the gray value of cTnT protein bands; C: Histogram of the gray value of cTnI protein bands; D: Histogram of the gray value of p53 protein bands.圖4 hiPS-CM成熟相關蛋白的表達Fig.4 Expression of maturation related protein of hiPS-CM
2.4 Torin1、Nutlin-3a對hiPS-CM成熟相關mRNA表達的影響
為了進一步驗證Torin1和Nutlin-3a對iPS細胞誘導的早期心肌細胞成熟的影響,我們對心肌成熟相關分子的RNA表達情況進行了分析。qRT-PCR結果顯示:以TBP為內參,心肌特異性標志物TNNI3在Torin1組表達最多(P<0.000 1)。增殖標志物CCNB1在Torin1組表達相比DMSO組有降低的趨勢。鈣離子通道標志物CACNA1c在Torin1組和Nutlin-3a組表達相比DMSO組有增高的趨勢。鉀離子通道標志物KCNJ2的表達在3組間未顯示出統計學差異,鈉離子通道標志物SCN5A在Nutlin-3a組表達有增高的趨勢。糖代謝標志物SLC2A1在Torin1組和Nutlin-3a組的表達相比DMSO組有降低的趨勢。脂代謝標志物SLC27A6在Nutlin-3a組有表達增加的趨勢。脂代謝標志物PPARGC1a在Torin1組表達最高,與DMSO組(P<0.001)以及Nutlin-3a組(P<0.05)相比有統計學差異。進一步表明Torin1處理過后的心肌細胞增殖可能減少,并且可能更多地以脂代謝為能量代謝方式,心肌特異性標志物表達量增高提示心肌細胞內結構可能更加成熟(圖5)。
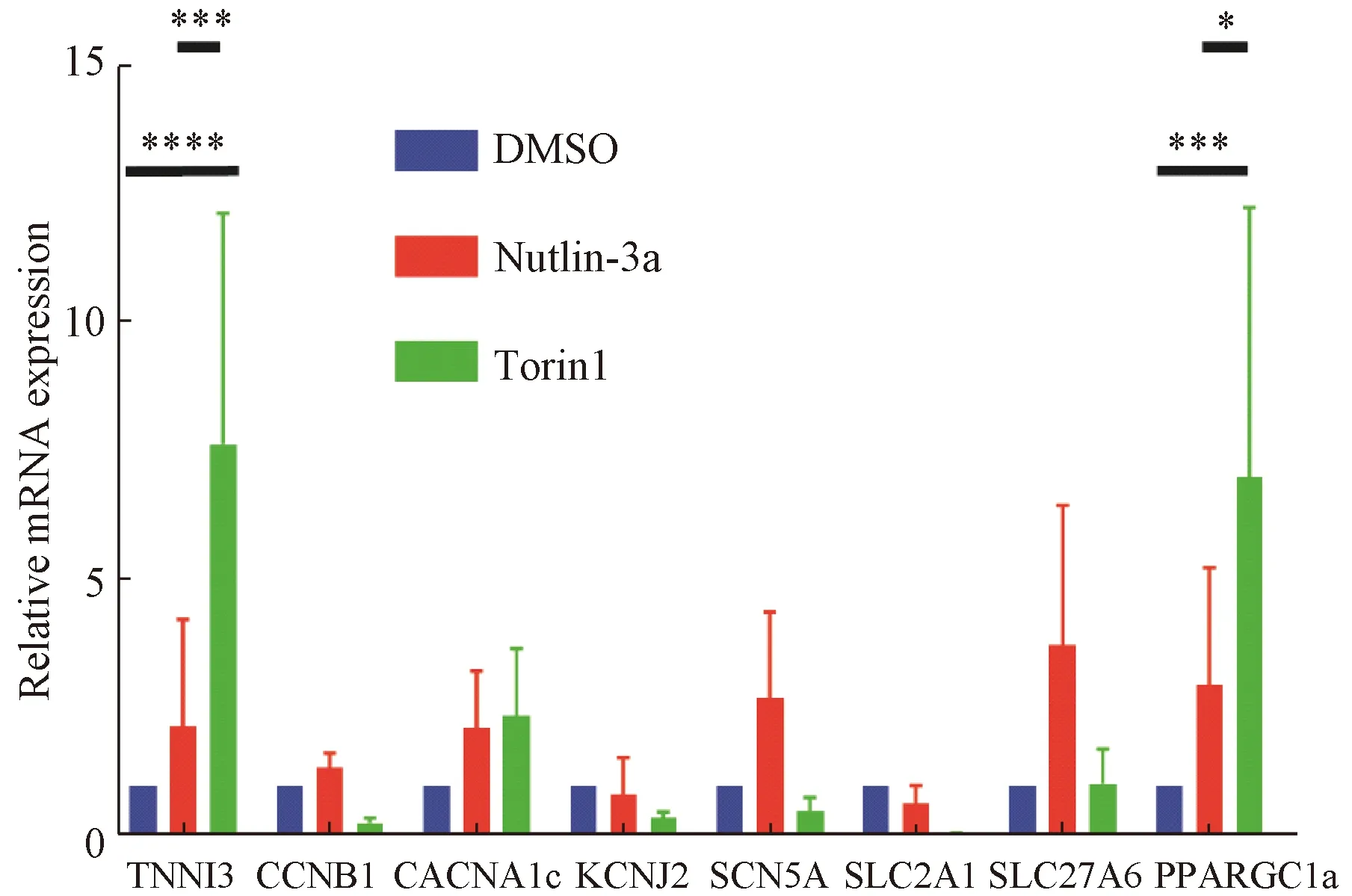
圖5 hiPS-CM成熟相關mRNA的表達(*:P<0.05;***:P<0.001;****:P<0.000 1)Fig. 5 Expression of maturation related mRNA of hiPS-CM (*: P<0.05; ***: P<0.001; ****: P<0.000 1)
2.5 Torin1、Nutlin-3a對hiPS-CM形態的影響
為了進一步探究Torin1、Nutlin-3a對iPS細胞誘導的早期心肌細胞形態的影響,我們對Torin1、Nutlin-3a處理后1周的hiPS-CM進行了細胞免疫熒光染色,結果顯示:各組細胞表達心肌特異性標志物cTnT,與對照組相比,實驗組細胞形態趨近長棒型,其中Torin1組心肌細胞肌節更加豐富,排列更加規整,更加接近成熟心肌細胞形態。該結果表明,Torin1和Nutlin-3a作用于iPS細胞誘導的早期心肌細胞,可能促進hiPS-CM形態的成熟(圖6)。
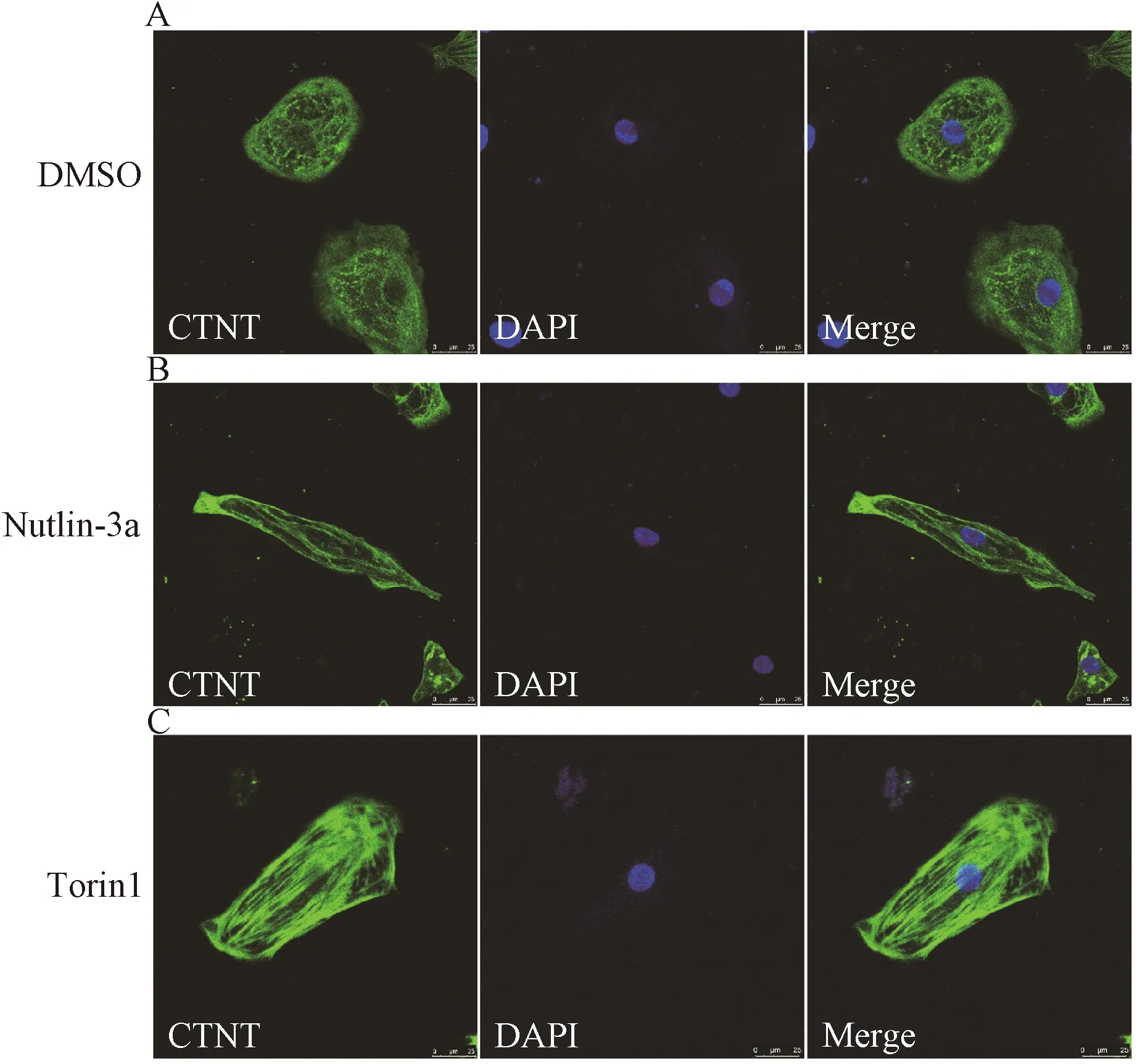
圖6 hiPS-CM形態鑒定:hiPS-CM cTnT、DAPI、Merge免疫熒光(標尺=25 μm)Fig.6 Morphological identification of hiPS-CM: Immunofluorescence of cTnT, DAPI, Merge (bar=25 μm)
2.6 Torin1、Nutlin-3a對hiPS-CM動作電位形態的影響
我們對Torin1、Nutlin-3a處理后1周的hiPS-CM進行了動作電位測定,結果顯示:Torin1組(23+12.7)和Nutlin-3a組(22.2+2.2)動作電位頻率相比DMSO組(28.7+8.1)有降低的趨勢(圖7B)。3組間的振幅大小無明顯差異(圖7C)。Torin1組0期最大去極化速率相比DMSO組有增大的趨勢(圖7 D)。Torin1組和Nutlin-3a組動作電位平臺期、APD30、APD70、APD90、閾電位絕對值相比DMSO組有增大的趨勢(圖7E-I),表明Torin1和Nutlin-3a作用于iPS細胞誘導的早期心肌細胞,可能促進心肌細胞動作電位成熟。
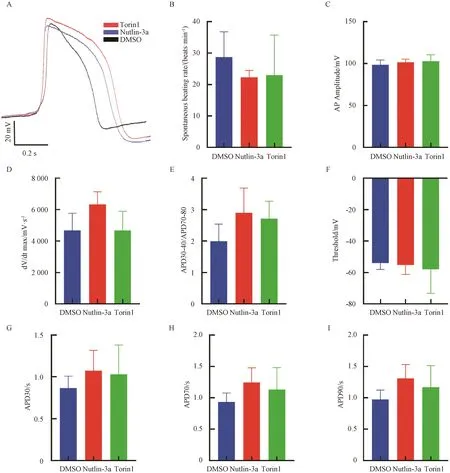
A:動作電位模式圖;B:動作電位頻率;C:動作電位振幅;D:0期最大去極化速率;E:動作電位平臺期;F:域電位;G:30%復極化動作電位時程;H:70%復極化動作電位時程;I:90%復極化動作電位時程;AP:動作電位;dV:電壓;dt:時間;APD:動作電位時程。A: Action potential pattern diagram; B: Action potential frequency; C: Action potential amplitude; D: Maximum depolarization rate at phase 0; E: Action potential plateau; F: Domain potential; G: 30% repolarized action potential duration; H: Time history of 70% repolarized action potential; I: 90% repolarized action potential time history; AP: Action Potential; dV: Voltage; dt: Time; APD: Action Potential Duration.圖7 膜片鉗電生理動作電位分析Fig. 7 Analysis of electrophysiological action potential of patch clamp
3 討論
hiPSC來源的心肌細胞成熟度不足,不能很好地模擬在體的心肌細胞,成為心血管相關研究發展的一個重要障礙。目前,促進干細胞來源的早期心肌細胞成熟的方法包括延長培養時間、細胞共培養、機電刺激、添加生物活性分子等[12-13],但是這些方法效果有限或者操作復雜,因此需要進一步研究,以獲得簡單有效的促進iPSCs來源心肌細胞成熟的方法。我們通過Torin1、Nutlin-3a,調控細胞周期,誘導細胞停止增殖,在一定程度上促進了iPS分化來源的早期心肌細胞的成熟。
已有研究證明,心肌細胞在出生后不久便退出細胞周期,停止增殖。成熟的心肌細胞處于靜止狀態,與心肌細胞代謝方式轉變、動作電位時程的延長、細胞的結構和功能的完善相符合[14]。研究表明,Torin1和Nutlin-3a可能抑制mTOR通路,促使細胞退出細胞周期,停止增殖。我們觀察到在Torin1和Nutlin-3a作用下,靜止期的3T3細胞數量增加并抑制了增殖標記物ki67的表達。
肌節是心肌細胞收縮的基本單位。監測肌節相關蛋白(如cTnT、cTnI等)的表達水平可以對iPS-CM的成熟進行初步評價。與成人心臟組織相比,iPS-CM 的肌節相關基因以及蛋白表達較低[15]。在hiPSC誘導的早期心肌細胞中,可以觀察到Torin1和Nutlin-3a在一定程度上促進了心肌細胞肌節相關蛋白和基因的表達。
在細胞形態和結構方面,實驗組的細胞形態更趨近長棒型,長寬比增大,肌節豐富且排列規整。心肌細胞的形態對心肌功能的發揮具有重要影響。在體內,心肌細胞是棒狀的,但在體外培養時,未成熟的心肌細胞呈扁平狀并向各個方向伸展。在心肌細胞發育過程中,肌節結構也變得更有條理[16]。
心肌細胞動作電位的產生需要各種離子通道之間的協調活動。未成熟心肌細胞中鈉通道和鈣通道蛋白水平較低,分別會導致較慢的0期去極化速度以及缺乏或較短的平臺期[17-18]。實驗組在動作電位的形態上,表現為頻率減慢、0期去極化最大速率增大、動作電位平臺期、動作電位時程延長的趨勢,類似成熟心肌細胞動作電位的特征。q-PCR結果顯示實驗組鈉離子和鈣離子通道相關蛋白的表達相比對照組有增高的趨勢,與電生理結果相一致。
研究表明,p53與細胞周期的調控密切相關,伴隨mTOR抑制的p53上調導致細胞進入靜止狀態[19],不伴mTOR抑制的p53上調導致細胞衰老[20]。此外,大量p53的激活可以直接抑制mTOR通路,促使細胞進入靜止狀態[21]。本實驗結果表明,僅僅利用Nutlin-3a直接激活p53,也能起到一定的促成熟效果。但是,Torin1組和Nutlin-3a組p53蛋白的表達沒有呈現出預期的上升趨勢。可能是由于p53蛋白本身表達量低且易降解,且真正起作用的是活化的p53蛋白。因此,總p53蛋白表達量只能作為參考指標,更準確的評價應該依靠活性p53蛋白的表達量檢測。
綜上所述,利用Torin1和Nutlin-3a處理iPS分化來源的早期心肌細胞可能誘導細胞靜止并改善細胞成熟的相關指標。初步表明mTOR信號通路可能是心肌細胞成熟的關鍵調節因子,后續還需要進一步通過心肌細胞代謝、細胞亞結構等進一步驗證細胞的成熟程度。

