同型半胱氨酸通過上調Rap1A表達促進小鼠巨噬細胞增殖及M1極化*
楊亞麗 , 田 榮 , 袁 茵 , 王艷佳 , 楊曉玲 △
(1寧夏醫科大學基礎醫學院,2國家衛生健康委員會代謝性心血管疾病研究重點實驗室,3寧夏血管損傷與修復研究重點實驗室,寧夏銀川750004)
同型半胱氨酸(homocysteine,Hcy)是體內甲硫氨酸和蛋氨酸循環的代謝產物,在正常情況下一般維持在較低的水平。目前研究已證實,高同型半胱氨酸血癥(hyperhomocysteinemia,HHcy)可以作為多種疾病如心腦血管疾病、腎損傷和腦卒中等的獨立危險因素[1],尤其是冠心病和腦卒中等,其致病機制與促進血管平滑肌細胞增殖、增加血小板聚集、損傷血管內皮和激活免疫反應等有關[2-3]。Ras 相關蛋白1(Ras-related protein 1,Rap1)是小分子 G 蛋白 Ras超家族成員之一,在各種因子刺激下,與細胞膜上的受體結合,對細胞的增殖、遷移和分化等進行調控,已成為疾病防治的新靶標[4]。Pei 等[5]發現,腫瘤壞死因子 α(tumor necrosis factor-α,TNF-α)通過觸發腺苷酸環化酶激活gp91phox,而該過程涉及Rap1A 激活,提示Rap1A 通過免疫炎癥反應參與了疾病的調控。但Rap1A 在Hcy 致巨噬細胞增殖及其在免疫應答中的作用尚不清楚。本研究以ANA-1小鼠巨噬細胞為研究對象,探討Rap1A 在Hcy 致ANA-1 細胞增殖及M1 極化中的作用,為Hcy 相關疾病的預防和治療提供理論依據。
材料和方法
1 主要試劑
ANA-1 小鼠巨噬細胞購自中國醫學科學院細胞培養中心。Hcy(Sigma);胎牛血清購自 Gibco;蛋白提取試劑盒和蛋白定量試劑盒(江蘇凱基生物技術有限公司);總RNA 提取試劑盒(天根生化科技有限公司);逆轉錄試劑盒和熒光定量PCR 試劑盒(TaKa-Ra);抗Rap1A 單克隆抗體和抗p27 單克隆抗體(Abcam);抗增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)單克隆抗體(Affinity);EdU 染色試劑盒(廣州市銳博生物科技有限公司);小鼠ELISA 檢測試劑盒(伊萊瑞特生物科技股份有限公司);Rap1A干擾腺病毒(Ad-shRNA/Rap1A)由漢恒生物科技有限公司提供;引物由上海生工生物工程有限公司設計并合成。
2 實驗儀器
超凈工作臺(江蘇安泰);CO2培養箱(Heraeus);5415D 型微量臺式離心機(Eppendorf);BS110S 型精密天平(Sartorius);熒光定量PCR 儀、垂直電泳儀和Model 680全自動酶標儀(Bio-Rad)。
3 實驗方法
3.1 細胞培養 將ANA-1 細胞以1×106個接種于25T透氣培養瓶中,用含10%胎牛血清及1%青-鏈霉素的 RPMI-1640 培養液,于 37 ℃、含5% CO2的培養箱中常規培養,隔日換液,根據細胞的生長狀態,當細胞數約每瓶2×106個時傳代。用含終濃度100 μmol/L 的 Hcy 培養液干預細胞 24 h,建立 HHcy 細胞模型,用于后續實驗。
3.2 細胞分組及Rap1A 干擾腺病毒轉染 將3.1培養的處于對數生長期的細胞鋪于6 孔板,用100 μmol/L 的 Hcy 干預 24 h 后,記為 Hcy 組;正常對照(control)組僅加入等量的完全培養基;將10 μL 感染復數為100 的Ad-shRNA/Rap1A 及其陰性對照(AdshRNA/GFP),分別轉染至ANA-1 巨噬細胞后用100 μmol/L Hcy 處理,分別記為Hcy+Ad-shRNA/Rap1A組和Hcy+Ad-shRNA/GFP組;6 h后換正常培養基,由于腺病毒載體中含有GFP基因,48 h 后熒光顯微鏡觀察轉染效率,實驗重復3次。
3.3 CCK-8 檢測ANA-1 細胞活力 取指數增殖期的ANA-1 細胞接種于96 孔板(每孔3×103個)。將培養板放在37 ℃、5% CO2培養箱內培養孵育過夜,待細胞密度達60%~70%時,用100 μmol/L Hcy 刺激24 h 后,分別向 96 孔板每孔加入 10 μL 的 CCK-8 溶液,繼續培養2 h,用酶標儀測定在450 nm 處的吸光度(A)值,實驗重復3次。
3.4 EdU 染色法檢測細胞增殖 細胞處理方法同3.3,將處理后的細胞按照每孔1×104的密度接種到24 孔板,刺激24 h 后,根據EdU 染色試劑盒檢測DNA 增殖活性,向細胞中加入 50 μmol/L EdU 試劑,孵育 2 h 后,PBS 洗掉未滲入 DNA 的 EdU 并加入 4%多聚甲醛固定細胞30 min,PBS 洗除固定液,加入Apollo 染液室溫避光孵育30 min,PBS 洗除染液并用Hochest染核30 min。于熒光顯微鏡觀察并隨機獲取5個視野的熒光圖像,采用ImageJ軟件對EdU陽性細胞計數,實驗重復3次。
3.5 RT-qPCR 檢測 mRNA 表達 細胞培養 24 h 后,收集細胞,按照試劑盒說明書提取細胞總RNA,測定樣品純度與濃度后將RNA逆轉錄為cDNA。在NCBI查詢各基因的CDS,用Primer Premier 5.0 軟件設計引物,序列見表1。以cDNA 為模板擴增各目的基因,反應條件為:95 ℃預變性2 min;95 ℃變性10 s,60 ℃退火30 s,72 ℃延伸 30 s,40 個循環,最后延伸10 min。目的基因的相對表達用2-ΔΔCt法分析。

表1 CD80、CD86、CD163、CD200R、Rap1A、PCNA、p27及GAPDH的引物序列Table 1. Primer sequences of CD80,CD86,CD163,CD200R,Rap1A,PCNA,p27 and GAPDH
3.6 Western blot 檢測 p27、PCNA 和 Rap1A 蛋白的表達 細胞培養24 h 后提取細胞總蛋白,BCA 法檢測樣品中的蛋白濃度,取50 μg蛋白進行SDS-PAGE,再將蛋白轉移至PVDF 膜,用5%脫脂奶粉封閉2 h,PBST洗膜10 min×3次,加入Ⅰ抗(p27、PCNA、Rap1A和β-actin 抗體,均按1∶1 000 稀釋)4 ℃孵育過夜,次日回收Ⅰ抗,PBST 洗膜 10 min×3 次,再加入 HRP 標記的Ⅱ抗(1∶5 000)室溫孵育2 h,充分洗膜后,加入ECL 發光液,顯色、曝光,保存圖片,以β-actin 為內參照,Image Lab軟件進行定量分析。
3.7 ELISA法檢測炎癥因子IL-6和TNF-α濃度 收集細胞培養上清液,按照ELISA 說明書,在包被IL-6和TNF-α 抗體的96 孔板中前2 列每孔依次加入100 μL 標準工作液,其他每孔加入 100 μL 待測樣品,給酶標板覆膜,37 ℃孵育90 min。將25×的濃縮洗滌液用雙蒸水稀釋后進行洗滌,隨后每孔加入100 μL 生物素抗體工作液,37 ℃孵育60 min,洗滌后每孔加入100 μL酶結合工作液,進行孵育和洗滌,加入顯色劑90 μL,混勻后37 ℃孵育30 min,最后每孔加終止液50 μL,終止反應,450 nm波長處檢測各孔吸光度(A)值,根據標準曲線計算細胞內IL-6和TNF-α的濃度。
4 統計學處理
用GraphPad Prism 6.0 軟件進行統計學分析,所有數據均以均數±標準差(mean±SD)表示。先評估數據是否為正態分布,再進行正態分布數據的方差齊性檢驗,方差齊的兩組數據采用非配對t檢驗,多組數據的單因素比較采用單因素方差分析(one-way ANOVA)。以P<0.05為差異有統計學意義。
結 果
1 Hcy對ANA-1細胞增殖的影響
ANA-1 細 胞 經 100 μmol/L Hcy 刺 激 24 h 后 ,CCK-8 實驗結果顯示,Hcy 組的吸光度顯著高于control組(P<0.05),見圖1A;EdU 染色結果顯示,Hcy 組EdU 摻入 ANA-1 細胞核的量最多(P<0.01),見圖1B。
2 ANA-1 細胞中 p27 和 PCNA 的 mRNA 及蛋白表達變化
RT-qPCR 及 Western blot 結果顯示,與 control 組相比,Hcy 組 p27 的 mRNA 及蛋白水平明顯降低(P<0.05),PCNA 的 mRNA 及蛋白表達水平均顯著升高(P<0.01),見圖2。以上數據均表明Hcy促進ANA-1巨噬細胞增殖。
3 ANA-1細胞培養上清液中IL-6和TNF-α濃度
ELISA 結果顯示,與 control 相比,Hcy 組 ANA-1細胞分泌IL-6 和TNF-α 水平顯著升高(P<0.05),見圖3。這提示Hcy 促進ANA-1 細胞分泌炎癥細胞因子IL-6和TNF-α。
4 Hcy對ANA-1細胞M1和M2極化標志物的影響
RT-qPCR 結果顯示,與 control 相比,Hcy 組細胞的 M1 表型標志物 CD80 和 CD86 的 mRNA 表達顯著增加(P<0.05),見圖4A、B,而M2 表型標志物CD163和CD200R 的 mRNA 表達顯著減少(P<0.05),見圖4C、D,提示Hcy可有效促進ANA-1細胞M1極化。
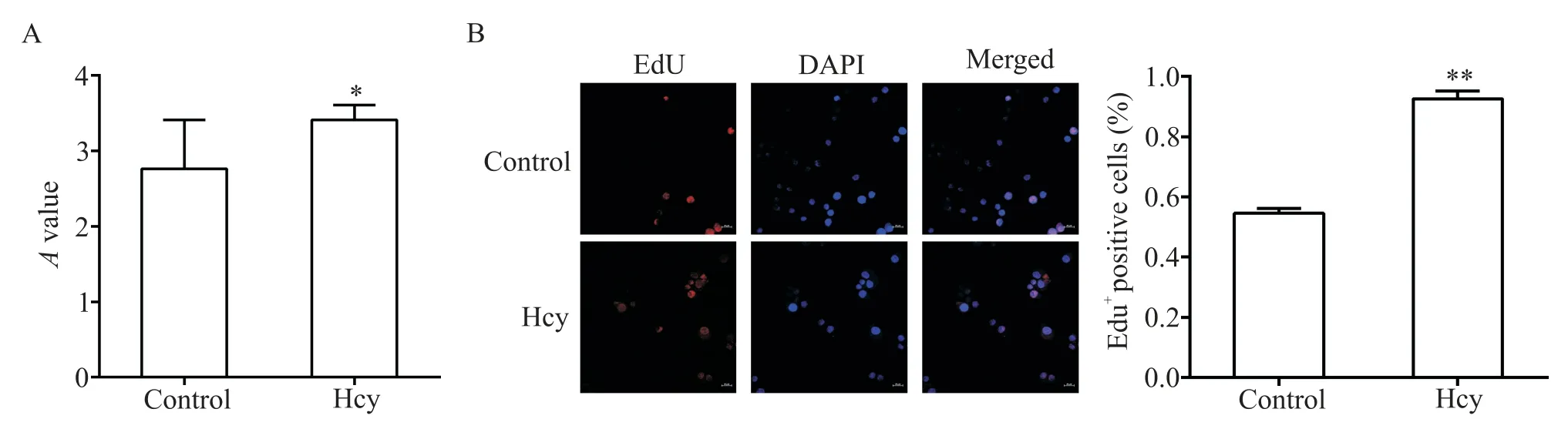
Figure 1. Effects of Hcy on the proliferation of ANA-1 cells were detected by CCK-8 assay(A)and EdU staining(B;×200). Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.圖1 Hcy對ANA-1細胞增殖能力的影響
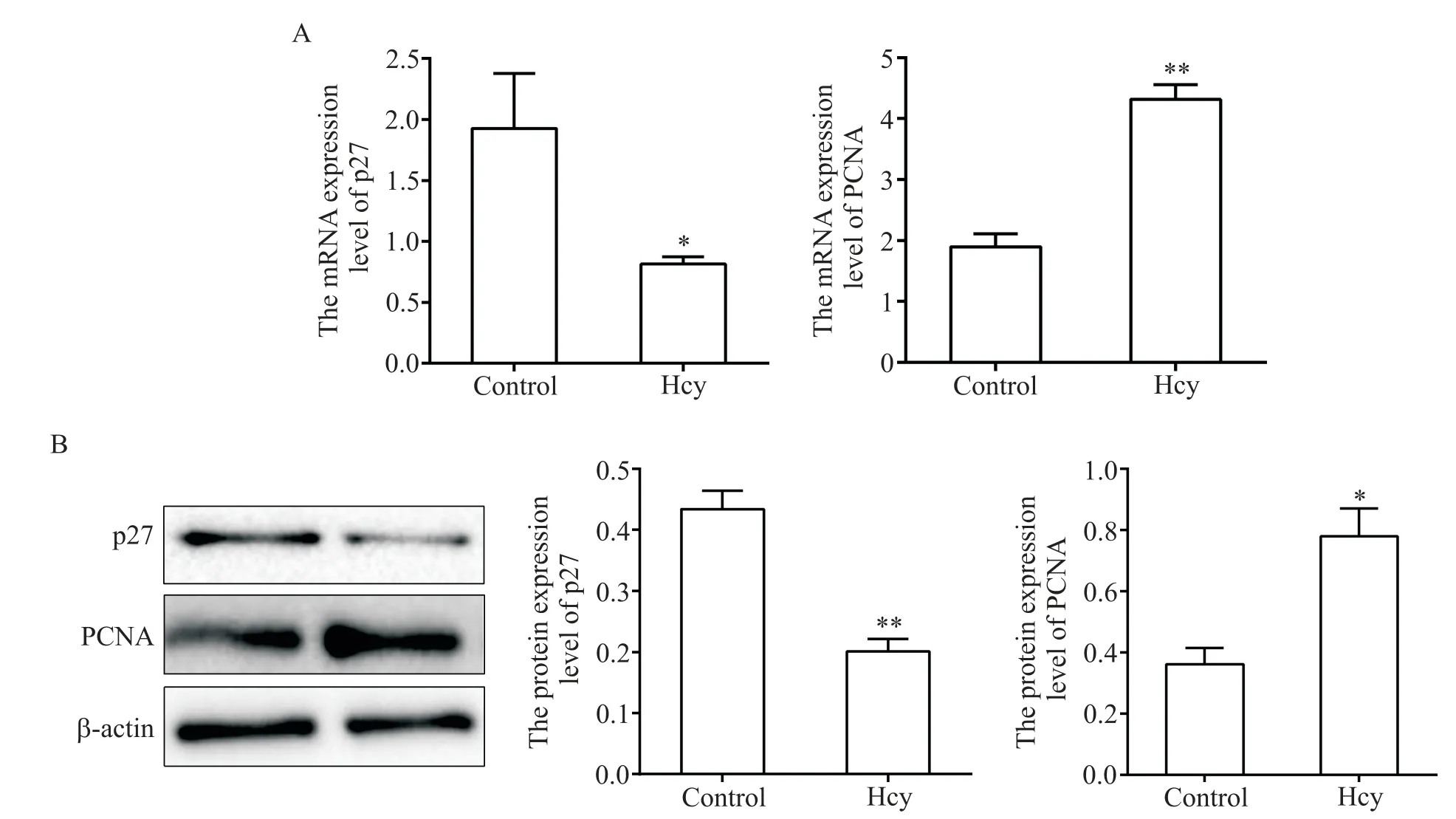
Figure 2. Expression of p27 and PCNA in Hcy-treated ANA-1 macrophages. RT-qPCR(A)and Western blot(B)were used to detect the expression of p27 and PCNA. Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.圖2 Hcy處理的ANA-1細胞中p27和PCNA的表達情況
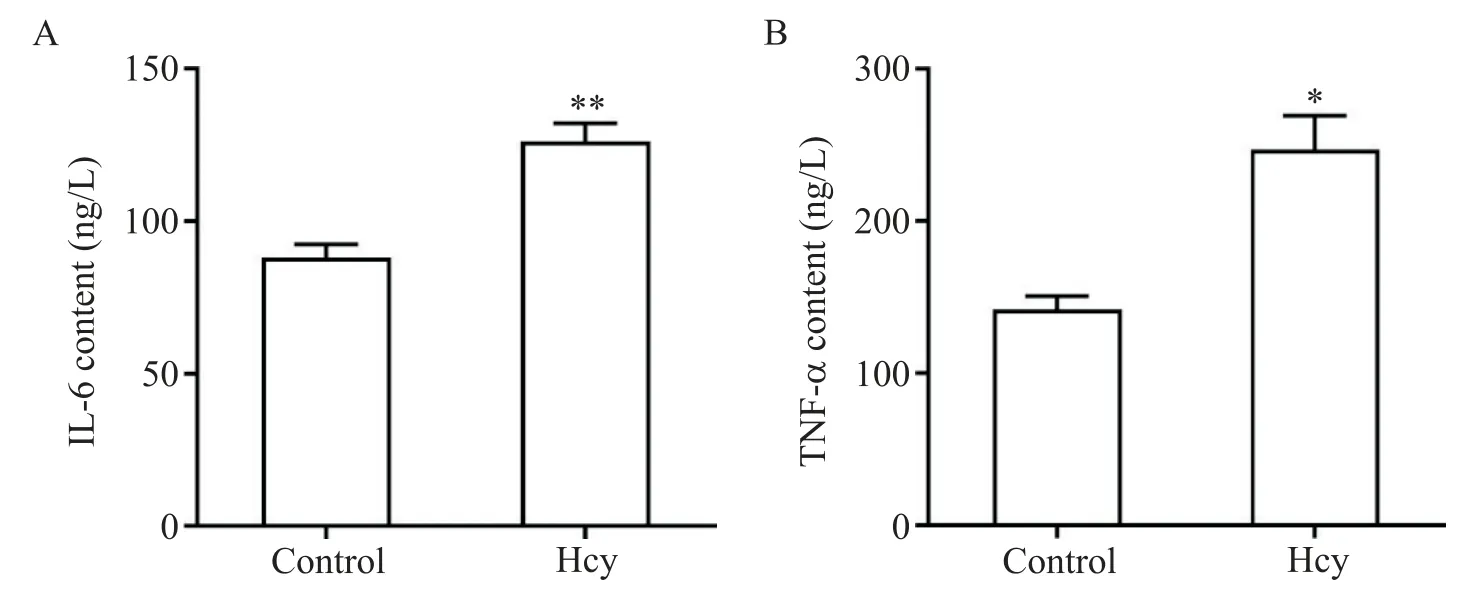
Figure 3. Effects of Hcy on the production of inflammatory cytokines from ANA-1 cells. A:the level of interleukin-6(IL-6);B:the level of tumor necrosis factor-α(TNF-α). Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.圖3 Hcy對ANA-1細胞產生炎性細胞因子的影響
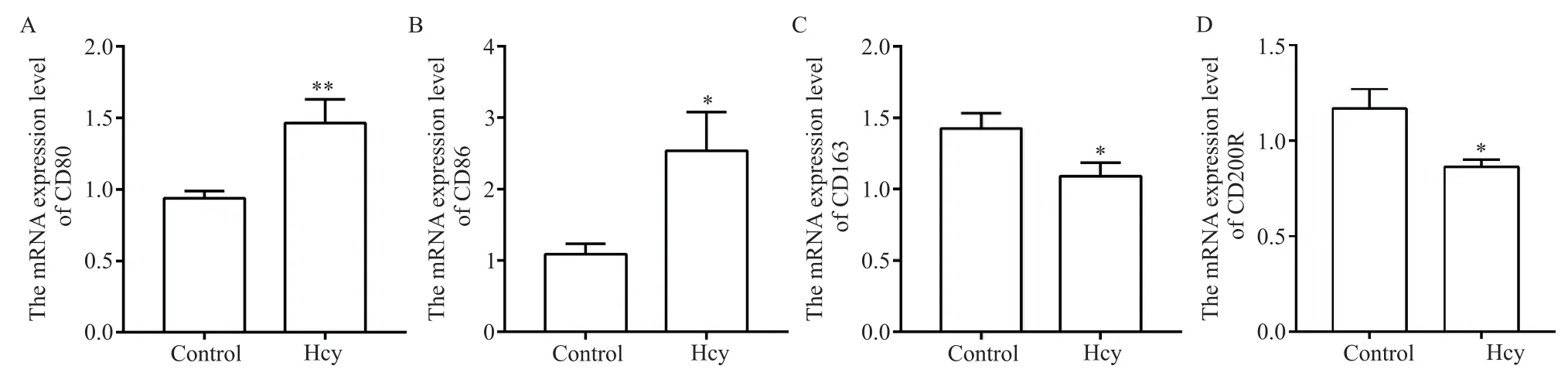
Figure 4. Effects of Hcy on the polarization of ANA-1 cells. A and B:the mRNA levels of CD80 and CD86(M1 polarization markers);C and D:the mRNA levels of CD163 and CD200R(M2 polarization markers). Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.圖4 Hcy對ANA-1細胞M1和M2極化標志物的影響
5 Rap1A在ANA-1細胞中的表達變化
RT-qPCR 和 Western blot 結果顯示,與 control 組相比,Hcy組Rap1A的mRNA和蛋白表達均顯著增加(P<0.05 或P<0.01),見圖5。以上結果說明,Hcy 能夠促進Rap1A在ANA-1巨噬細胞中表達。
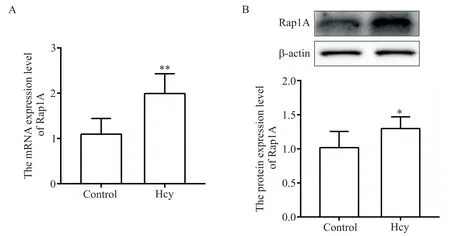
Figure 5. Effects of Hcy on the expression of Rap1A in ANA-1 cells. RT-qPCR(A)and Western blot(B)were used to detect the expression of Rap1A. Mean±SD. n=3.*P<0.05,**P<0.01 vs control group.圖5 Hcy對ANA-1細胞中Rap1A表達的影響
6 Rap1A在Hcy誘導的ANA-1細胞增殖中的作用
為進一步驗證Rap1A 是否調控Hcy 誘導的ANA-1 細胞增殖過程,將ANA-1 巨噬細胞轉染AdshRNA/Rap1A,熒光顯微鏡觀察感染效率達80%以上收集細胞進行下一步實驗(圖6A);RT-qPCR 和Western blot 檢測ANA-1細胞中Rap1A被干擾后自身表達的改變,結果如圖6B、C 所示,ANA-1 細胞AdshRNA/Rap1A 轉染成功。通過 CCK-8 實驗和 EdU 染色檢測ANA-1 細胞的增殖情況,結果顯示,與Hcy+Ad-shRNA/GFP 組相比,Hcy+Ad-shRNA/Rap1A 組細胞增殖能力減弱,EdU 陽性細胞摻入量減少(P<0.01),見圖6D、E。進一步使用RT-qPCR 和Western blot 檢測增殖相關蛋白p27 和PCNA 的表達改變,結果顯示,與Hcy+Ad-shRNA/GFP 組相比,Hcy+AdshRNA/Rap1A 組細胞中 p27 的表達增加,PCNA 的表達降低(P<0.05 或P<0.01),見圖7。該結果表明敲減Rap1A表達可緩解Hcy引起的ANA-1細胞增殖。
7 敲減Rap1A表達后ANA-1細胞M1及M2極化標志物的變化情況
為進一步明確Hcy 通過Rap1A 調控ANA-1 細胞的M1 極化,在ANA-1 細胞轉染Ad-shRNA/Rap1A后,RT-qPCR 檢測 M1 和 M2 極化標志物的 mRNA 水平。檢測結果顯示,與Hcy+Ad-shRNA/GFP 組相比,Hcy+Ad-shRNA/Rap1A 組的 M1 極化標志物 CD80 和CD86 表達水平顯著降低(P<0.01 或P<0.05),見圖8A、B,M2 極化標志物CD200R 的表達水平顯著升高(P<0.05),而 CD163 表達無明顯變化,見圖8C、D。該結果表明敲減Rap1A表達能夠抑制ANA-1 細胞發生 M1 極化,說明 Hcy 通過 Rap1A 調控 ANA-1 細胞的M1極化。
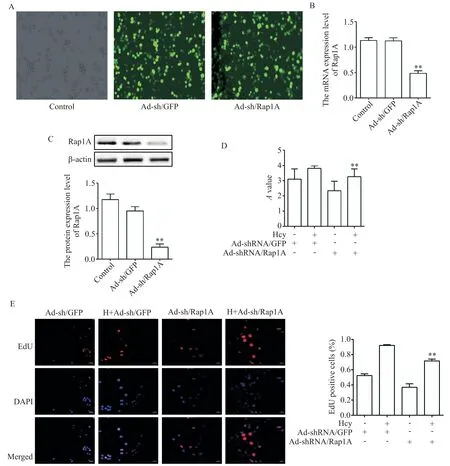
Figure 6. Effect of Rap1A knockdown on the proliferation of ANA-1 cells. A:fluorescence microscopic observation of Ad-shRNA/Rap1A infection efficiency(×200);B and C:RT-qPCR and Western blot were used to detect the expression of Rap1A in ANA-1 cells transfected with Ad-shRNA/Rap1A;D and E:CCK-8 assay and EdU staining(×200)were used to detect the effect of Rap1A on the proliferation of ANA-1 cells. Mean±SD. n=3.*P<0.05,**P<0.01 vs Hcy+Ad-shRNA/GFP group.圖6 敲減Rap1A表達對ANA-1細胞增殖的影響
討 論
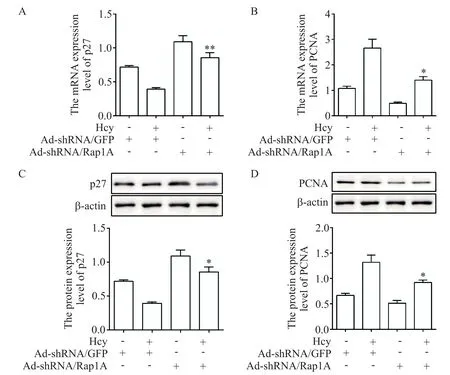
Figure 7. Effects of Rap1A knockdown on the expression of proliferation-related proteins in ANA-1 cells. RT-qPCR(A and B)and Western blot(C and D)were used to detect the expression of p27(A and C)and PCNA(B and D). Mean±SD. n=3.*P<0.05,**P<0.01 vs Hcy+Ad-shRNA/GFP group.圖7 敲減Rap1A的表達對ANA-1細胞增殖相關蛋白表達的影響
Hcy 是一種在必需氨基酸甲硫氨酸代謝過程中形成的含硫氨基酸。正常情況下,血清Hcy 水平低于 5 μmol/L,當血清 Hcy 水平超過 15 μmol/L 時被稱為HHcy[6]。Hcy 被認為是動脈粥樣硬化和心血管疾病的獨立危險因素[7-8]。Hcy有2種代謝途徑,即轉硫途徑和轉甲基途徑,這也是Hcy 致病的病理生理學基礎,其中,Hcy 通過轉硫途徑引起的氧化應激和免疫應答是Hcy 的致病機制之一[9]。由于巨噬細胞增殖和吞噬脂質變成泡沫細胞是As 的重要環節[10],因此探討Hcy 在巨噬細胞增殖中的機制具有重要的意義。本研究以ANA-1 巨噬細胞細胞為研究對象,以100 μmol/ L Hcy 刺激 ANA-1 巨噬細胞 24 h,成功構建巨噬細胞增殖模型。巨噬細胞增殖能力的增強與多種增殖基因表達的變化有關。p27 是細胞周期的負性調控分子,能夠阻礙多種cyclin分子與激酶形成復合體,進而阻礙細胞周期進程、抑制細胞增殖[11],PCNA 既是細胞核內DNA 多聚酶δ的輔因子、也是細胞周期發展的正性調控蛋白,能夠加速DNA 復制及細胞周期進程,進而促進細胞增殖[12]。結果顯示Hcy刺激ANA-1巨噬細胞后,p27的mRNA及蛋白表達水平顯著降低,而PCNA的mRNA及蛋白表達水平顯著升高,與文獻報道一致。
巨噬細胞是免疫系統的重要組成部分,可通過吞噬外來微生物并提呈抗原[13],在維持機體的內穩態平衡、對抗炎癥反應、防御修復等過程中發揮重要作用,巨噬細胞表現出顯著的可塑性,在不同的局部微環境下極化為不同的亞型,促炎的M1 型,即經典活化巨噬細胞;抗炎的M2型,即替代活化巨噬細胞。巨噬細胞這種不同表型的轉換調控者炎癥相關疾病的發生、發展和轉歸[14]。CD80、CD86 和MHCⅡ等細胞表面分子在M1 型巨噬細胞高表達,M1 型細胞激活后可以分泌TNF-α 和IL-6 等炎癥因子,通過產生趨化因子激活Th1 型免疫反應,誘導炎癥反應[15];而CD200R、CD163 和 CCL13 等細胞表面分子在 M2 型巨噬細胞高表達,M2 型細胞激活后釋放大量抑炎型細胞因子如IL-4 和IL-10 等,激活Th2 型免疫反應,促進炎癥的消除和組織損傷修復[16],本研究結果顯示,M1 型巨噬細胞表面分子CD80 和CD86 的表達也明顯增加,而M2 型細胞表面分子CD200R 和CD163表達顯著降低,表明Hcy 能夠促進ANA-1 巨噬細胞釋放炎癥因子,并誘導其發生M1極化。
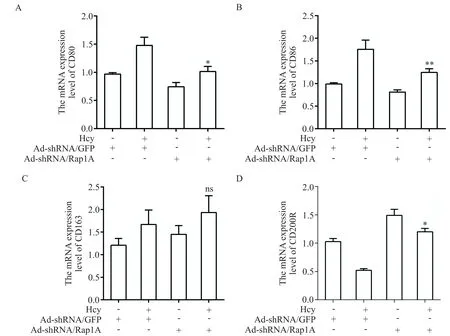
Figure 8. Effects of Rap1A knockdown on M1 and M2 polarization of ANA-1 cells. A and B:the mRNA levels of CD80 and CD86(M1 polarization markers);C and D:the mRNA levels of CD163 and CD200R(M2 polarization markers). Mean±SD. n=3.*P<0.05 vs Hcy+Ad-shRNA/GFP group.圖8 敲減Rap1A表達對ANA-1細胞M1及M2極化標志物表達的影響
Rap是腫瘤基因家族成員之一,廣泛分布于各種組織細胞中,與細胞的增殖、極性的形成、分化、粘附、運動等多種生物學功能密切相關[17-18]。Rap 是一種小GTP酶,可以通過活性改變調控其功能[19]。Rap家族有兩個亞類,Rap1 和Rap2,其中Rap1 有含有2個亞型,Rap1A 和Rap1B,二者序列存在95%的同源性[20]。研究發現,miRNA 抑制 Rap1A 的表達則能促進肝癌細胞凋亡,表明Rap1A 參與細胞的增殖過程[21]。另有研究發現,PI3 激酶 γ 促進 Rap1A 介導的髓系細胞整合素α4β1 活化,導致腫瘤炎癥和生長[22];HBV 感染通過上調 miR-203a 從而靶向抑制Rap1A 的表達,影響 PI3K/ERK/p38/NFκB 通路,誘發肝炎,提示Rap1A 參與了機體的免疫應答過程[23]。本研究結果顯示:Hcy 干預ANA-1 巨噬細胞后,Rap1A 的表達明顯增加,表明Rap1A 可能參與Hcy導致的巨噬細胞免疫應答過程。為了進一步明確Rap1A 在Hcy 誘導的巨噬細胞增殖和極化中的作用,我們將Rap1A干擾腺病毒轉染至ANA-1 巨噬細胞,結果發現,干擾Rap1A的表達不僅可以逆轉由Hcy 誘導的巨噬細胞增殖,還可以使M1 型巨噬細胞表面分子CD80 和CD86 的表達減少,M2 型細胞表面分子CD200R 表達顯著增加,但M2 標志物CD163 表達無明顯變化,表明Rap1A 是Hcy 致巨噬細胞增殖及M1極化的重要機制。
綜上所述,Hcy 能夠促進ANA-1 巨噬細胞增殖和M1 極化,其機制可能與Hcy 上調Rap1A 的表達有關,我們的研究提示,以Rap1A 為靶標調控巨噬細胞的增殖與炎癥反應,可能對臨床HHcy相關疾病的治療提供理論依據。

