GMP基本管理思路以及引申研發(fā)質(zhì)量管理
高潔



摘要:研發(fā)階段的質(zhì)量管理近年來愈來愈被國家以及制藥企業(yè)所關(guān)注,本文從GMP基本管理思路引申研發(fā)質(zhì)量管理,闡述質(zhì)量管理的基本原則,風(fēng)險管理的基本思路以及方法,并從人機料法環(huán)幾個方面分別闡述了研發(fā)分階段質(zhì)量管理的要點。
關(guān)鍵詞:研發(fā)質(zhì)量管理;分階段質(zhì)量管理;風(fēng)險管理
【中圖分類號】G644.5 【文獻標(biāo)識碼】A 【文章編號】2107-2306(2021)14-02
制藥企業(yè)如果想做大做強,其核心競爭力是藥品研發(fā),隨著我國制藥行業(yè)的發(fā)展,近年來各大藥企紛紛增加藥品研發(fā)投入,國內(nèi)新藥研發(fā)發(fā)展迅速;另一方面國家藥監(jiān)局對于藥品研發(fā)階段的質(zhì)量管理也愈來愈關(guān)注,2015年針對數(shù)據(jù)完整性的722風(fēng)暴,就是要對研發(fā)階段的弄虛作假進行嚴(yán)懲,之后有80%的品種主動撤回,對整個行業(yè)進行了一次洗禮;2016年藥品注冊現(xiàn)場檢查,依舊主要關(guān)注數(shù)據(jù)完整性問題;2017年藥品注冊現(xiàn)場檢查,數(shù)據(jù)完整性問題已經(jīng)不再突出,研發(fā)質(zhì)量管理問題成為重點[1];2018年藥品注冊現(xiàn)場檢查發(fā)現(xiàn)的主要問題中與2017年類似,數(shù)據(jù)無法溯源、申報資料不真實等問題不再是主要問題,主要問題包括批量放大研究、驗證方面存在不足,對驗證過程中產(chǎn)生的偏差或OOS調(diào)查不充分,工藝驗證不充分,清潔驗證不科學(xué)等問題[2]。從以上趨勢可以看出,藥品研發(fā)質(zhì)量管理重點已經(jīng)從數(shù)據(jù)完整性逐漸過渡到質(zhì)量管理體系的建立與完善。GMP自從1998年發(fā)布第一版,在我國已經(jīng)有20多年的發(fā)展歷史,相對已經(jīng)比較成熟,但是藥品研發(fā)階段的質(zhì)量體系目前不論從國家法規(guī)還是企業(yè)實踐都相對薄弱,本文從GMP基本質(zhì)量管理思路引申研發(fā)質(zhì)量管理,系統(tǒng)闡述研發(fā)分階段質(zhì)量管理的重點要求。
1.GMP質(zhì)量管理與風(fēng)險管理
根據(jù)國際標(biāo)準(zhǔn)化組織ISO9000的定義,“質(zhì)量”為一組固有特性滿足要求的程度[3]。對于藥品這種特殊的商品來說,一組固有特性一般指藥品的安全、有效、質(zhì)量可控等特性,滿足要求指滿足客戶的要求,在這里客戶既包括患者也包括使用藥品的醫(yī)院等,例如大輸液產(chǎn)品需滿足醫(yī)院配液中心的配置使用需求也屬于藥品質(zhì)量控制范疇。
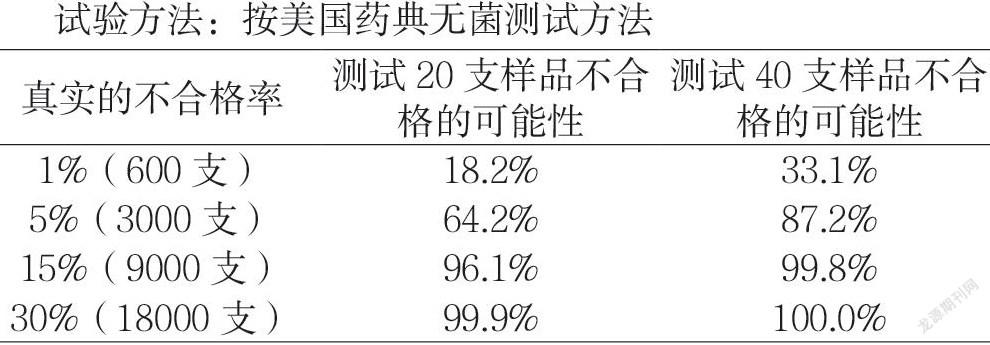
藥品質(zhì)量管理的發(fā)展經(jīng)歷了三個階段:第一階段為在上世紀(jì)60年代之前,業(yè)內(nèi)認為質(zhì)量源于檢驗,因此當(dāng)時各大藥企對于藥品質(zhì)量的把控主要通過實驗室對于產(chǎn)品的檢驗結(jié)果進行判定,即使當(dāng)時在全世界最領(lǐng)先的美國FDA官員也忙于到各個藥企進行抽樣,帶回藥監(jiān)局進行檢驗;但是從以下實驗可以看出,依靠產(chǎn)品檢驗結(jié)果并不能完全體現(xiàn)產(chǎn)品真實的質(zhì)量情況:
美國USP注射劑無菌測試結(jié)果:
當(dāng)真實的不合格率為1%時,也就是批量60000支中有600支產(chǎn)品不合格,取樣檢驗20支產(chǎn)品,能夠檢到不合格產(chǎn)品的概率只有18.2%,而如果600支不合格的產(chǎn)品流入市場使用在病患身上,那后果是十分嚴(yán)重的。由此可見,依靠檢驗進行質(zhì)量控制是不可信的。
1961年,“反應(yīng)停”事件的發(fā)生在制藥界引起強烈震動,促使了GMP的誕生。1963年,美國FDA頒布了世界上第一部《藥品生產(chǎn)質(zhì)量管理規(guī)范》(GMP)。從此藥品質(zhì)量管理進入到第二階段:“質(zhì)量源于過程控制”,此階段的基本理念為:任何藥品質(zhì)量的形成是設(shè)計和生產(chǎn)出來的,而不是檢驗出來的。
進入新的世紀(jì),藥品質(zhì)量管理進入第三階段即“質(zhì)量源于設(shè)計(QbD)”QbD(ICHQ8R1)質(zhì)量源于設(shè)計強調(diào)在研發(fā)設(shè)計階段基于科學(xué)和質(zhì)量風(fēng)險管理建,充分考慮對于產(chǎn)品和工藝的控制,將風(fēng)險盡早進行識別和控制,避免后期風(fēng)險的產(chǎn)生。 研發(fā)階段的質(zhì)量管理也日益凸顯,目前對于研發(fā)的質(zhì)量管理法規(guī)在國內(nèi)主要有以下法規(guī):
《藥物非臨床研究質(zhì)量管理規(guī)范》
《藥物臨床試驗質(zhì)量管理規(guī)范》
《臨床試驗用藥物生產(chǎn)質(zhì)量管理規(guī)范》
《藥品注冊管理辦法》
《藥品注冊現(xiàn)場核查管理規(guī)定》
《藥品數(shù)據(jù)管理規(guī)范》
《仿制藥質(zhì)量與療效一致性評價》
《藥品檢查管理辦法》
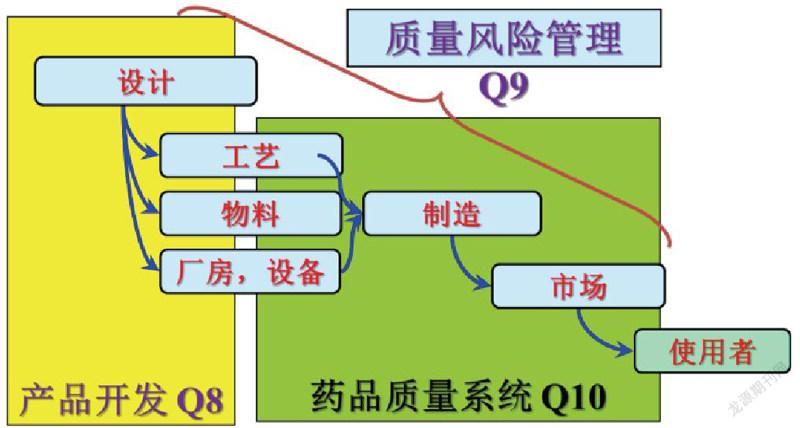
在《藥品注冊管理辦法》第15條,89條以及167條;《藥品檢查管理辦法》第46條;《臨床試驗用藥物生產(chǎn)質(zhì)量管理規(guī)范》第4條;《藥品數(shù)據(jù)管理規(guī)范》第2條等法規(guī)條款均提出企業(yè)需建立完善的藥品研發(fā)質(zhì)量管理體系,保證研發(fā)質(zhì)量。那么如何建立研發(fā)質(zhì)量管理體系。在ICH Q9《質(zhì)量風(fēng)險管理》中強調(diào)在產(chǎn)品開發(fā)以及生產(chǎn)過程中均要基于風(fēng)險進行質(zhì)量管理,見下圖:
從ICH的規(guī)定可以看出,建立質(zhì)量管理體系需基于質(zhì)量風(fēng)險管理,而在ICH Q9中對于質(zhì)量風(fēng)險管理,提出使用基本的風(fēng)險管理工具進行風(fēng)險評估,風(fēng)險控制以及風(fēng)險審閱,而在整體的風(fēng)險管理管理過程中強調(diào)風(fēng)險溝通的重要性:
那對于具體工作而言,如何進行風(fēng)險管理,在此介紹幾種常用的工具:當(dāng)需要對風(fēng)險進行分級,量化或半量化評估時,可以使用:“失敗模式和影響分析(FMEA)、危害分析與關(guān)鍵控制點”等工具,若不需要對于風(fēng)險進行分級,非量化的評估時,可以使用:流程圖、檢查表、魚骨圖,故障樹等工具:
1、失敗模式和影響分析(FMEA)
在人們在工作生活中,我們經(jīng)常會遇到這種情況: 一個簡單的細節(jié)事先沒有想到,而導(dǎo)致事情最終失敗,后悔不已;或做一個復(fù)雜的項目時,有很多事情要做,沒有很好的排列優(yōu)先順序,導(dǎo)致事倍功半。如果我們可以提前識別風(fēng)險進行把控,將避免以上問題的發(fā)生,而“失敗模式和影響分析”工具就起到這個作用,使用此工具可以使你確定某一過程或系統(tǒng)的變化過程中: 哪里會出錯; 這些錯會有哪些影響; 這些影響是否重要以及采取哪些行動來保證不會出錯。下面舉例一個“失敗模式和影響分析”的表單:
“失敗模式和影響分析”大部分情況下用于識別工藝和系統(tǒng)過程中哪些步驟會失敗,失敗的原因有哪些,通過事先識別風(fēng)險并將相關(guān)風(fēng)險進行量化,根據(jù)風(fēng)險量化級別制定相應(yīng)的風(fēng)險防控措施,從而預(yù)先制定措施控制風(fēng)險。
2、檢查表
檢查表是以固定表單的方式列出系統(tǒng)內(nèi)可能發(fā)生的危害,因為檢查表中涵蓋已有的經(jīng)驗知識,可以幫助工作人員避免風(fēng)險識別的遺漏,得到規(guī)避風(fēng)險的意見。例如:《藥品注冊研制現(xiàn)場核查要點及判定原則》節(jié)選,其實就是一份檢查表,在此表單中列出核查的要點,既可以作為企業(yè)質(zhì)量管理工作的標(biāo)準(zhǔn)又作為核查人員進行核查的標(biāo)準(zhǔn):
檢查表廣泛用于質(zhì)量審計,產(chǎn)品放行,試制生產(chǎn)之前的風(fēng)險評估,通過表單的形式將需要考慮的因素列成標(biāo)準(zhǔn)條款表單,避免不同人員考慮不周或標(biāo)準(zhǔn)不統(tǒng)一。
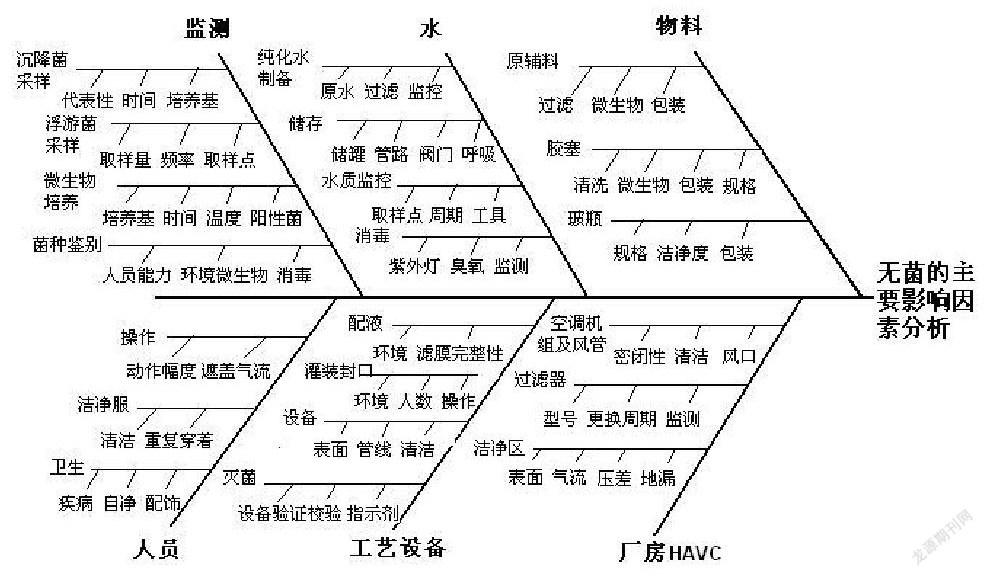
3、魚骨圖(又稱因果圖,石川圖)
魚骨圖廣泛用于偏差調(diào)查等糾因過程中,一般會從人機料法環(huán)等方面尋找所有可能的因素,通過對于所有因素的分析最終找到根本原因,使用魚骨圖的工具可以幫助分析人員更加系統(tǒng)和全面的分析和尋找問題,例如下面舉例:
通過以上介紹,風(fēng)險管理要點為:1、風(fēng)險評估報告往往可以是幾種工具的聯(lián)合使用;2、風(fēng)險管理的意義在于損失前的預(yù)防勝于損失后的補償,也就是我們說的:“預(yù)則立,不預(yù)則廢”;3、風(fēng)險管理程序的投入水平、形式和文件應(yīng)與風(fēng)險的級別相適應(yīng),也就是我們說的:“好鋼用在刀刃上”。同時在這里需要要強調(diào)的一點是:不能以經(jīng)過風(fēng)險評估而作為不符合法規(guī)要求的理由。
2.研發(fā)質(zhì)量管理
以上為風(fēng)險管理的介紹,質(zhì)量體系要基于風(fēng)險進行建立,那么對于研發(fā)質(zhì)量體系,同理也依據(jù)此基本思路進行搭建,在質(zhì)量管理過程中,總體思路為:首先調(diào)研相關(guān)法規(guī)要求,在合規(guī)的基礎(chǔ)上,具體做法可以通過風(fēng)險級別決定,那么對于研發(fā)的質(zhì)量管理總體原則為:研發(fā)的不同階段應(yīng)該遵守不同的質(zhì)量要求,越往后要求越高,GMP覆蓋范圍越多,在整個過程中要防止過度與不足,過度會束縛研發(fā)效率,不足會出現(xiàn)質(zhì)量管理失控與數(shù)據(jù)不可靠。而基于數(shù)據(jù)完整性要求研發(fā)與商業(yè)化生產(chǎn)質(zhì)量管理要求的相同點包括:設(shè)備以及儀器的的校正與維護(不包括IQ,OQ,PQ,驗證視情況而定);分析實驗室管理,例如分析方法驗證,穩(wěn)定性研究,試劑,標(biāo)準(zhǔn)品管理;執(zhí)行sop要求以及文件發(fā)放要求等。下面從GMP質(zhì)量管理人、機、料、法、環(huán)的基本原則引申研發(fā)質(zhì)量管理的具體做法進行闡述:
2.1人
人員是最重要的因素,也是影響質(zhì)量的最重要因素,據(jù)統(tǒng)計85%以上的錯誤都是由于人的因素造成的。對于無菌藥品的生產(chǎn),一個人平均每分鐘傳播20,000個微生物,8小時傳播100億個微生物,因此人是最大的污染源。
一般來說在藥品研發(fā)階段對于人員的管理建議按照以下分階段管理原則進行:
1、藥學(xué)研究階段:研發(fā)人員具備藥學(xué)知識與研發(fā)經(jīng)驗,真實從事過研制工作;關(guān)鍵操作需要經(jīng)過培訓(xùn);項目負責(zé)人與質(zhì)量人員不得兼任。
2、臨床研究階段:生產(chǎn)與質(zhì)量相關(guān)人員具有相應(yīng)的資質(zhì)并培訓(xùn)合格;生產(chǎn)和質(zhì)量管理的負責(zé)人員不得互相兼任。
3、商業(yè)化生產(chǎn)階段:藥品生產(chǎn)管理的職能部門的設(shè)置與職責(zé)明確;關(guān)鍵管理人員的資質(zhì)和職責(zé)明確;人員培訓(xùn)管理,人員衛(wèi)生管理等遵守GMP要求。
人員管理中,明確職責(zé)是質(zhì)量管理的關(guān)鍵(包括每一位研發(fā)人員和分析人員,交叉的職責(zé)要明確分工)。
2.2 機:
“機”包括廠房和設(shè)備,廠房和設(shè)備是硬件,硬件是實施藥品研發(fā)和生產(chǎn)的平臺和基礎(chǔ)。
對于廠房設(shè)施在藥品研發(fā)階段建議按照以下要點進行分階段管理:
1、藥學(xué)研究階段:研發(fā)相關(guān)的設(shè)備儀表需校驗;影響數(shù)據(jù)真實準(zhǔn)確的設(shè)備需驗證,例如分析實驗室的檢測設(shè)備;需進行清潔確認,無需清潔驗證。
2、臨床研究階段:廠房,設(shè)施,設(shè)備,防蟲等硬件方面的要求與商業(yè)化GMP要求一致。
2.3 物料管理
對于物料在藥品研發(fā)階段建議按照以下要點進行分階段管理:
1、藥學(xué)研究:原輔包須有合法來源,確保使用前物料合格,申報批使用的原輔包有檢驗報告書;委托檢驗需有委托證明材料,建議簽署具有數(shù)據(jù)完整性要求的質(zhì)量協(xié)議,檢驗報告為加蓋公章的原件;選取可以長期合作,符合要求的物料供應(yīng)商,進行初步的審計。
2、臨床研究:原輔包有供應(yīng)商檔案與供應(yīng)商管理,原輔包接收后的管理類似GMP要求。
2.4 法
企業(yè)的法包括外部法和內(nèi)部法兩種。外部法:如《藥品管理法》、《臨床試驗用藥GMP指南》、《數(shù)據(jù)管理規(guī)定》;內(nèi)部的法主要是形成文件的各種規(guī)章制度,標(biāo)準(zhǔn)操作規(guī)程等。因此內(nèi)部的法主要是以文件的形式存在,文件使企業(yè)管理由人制過渡到法制,由經(jīng)驗管理過度到標(biāo)準(zhǔn)化管理。
那么在研發(fā)階段,可以將可固化的流程生成sop并培訓(xùn);中試階段以及之后,產(chǎn)品質(zhì)量相關(guān)的流程生成初步的sop并審批,例如需要有初步的工藝規(guī)程。
對于法在藥品研發(fā)階段建議按照以下要點進行分階段管理:
1、探索性研究階段:重效率,保證試驗記錄真實,準(zhǔn)確,可追溯即可,例如偏差變更真實記錄即可;物料管理盡可能使用商業(yè)化生產(chǎn)批準(zhǔn)的供應(yīng)商,但不需物料放行;可以固化的流程生成sop并執(zhí)行到位。
2、中試批到IND:物料來源,實驗記錄與報告須一致;sop(分析方法,試驗操作,物料方法和標(biāo)準(zhǔn),工藝規(guī)程與中試批記錄)開始建立;設(shè)備,方法學(xué)驗證,變更,偏差適當(dāng)控制。
3、臨床研究:建立有效的質(zhì)量管理體系及完整的文件系統(tǒng);引入正式的變更,偏差管理,供應(yīng)商管理等。
2.5 環(huán)
這里所講的環(huán)是指藥品研發(fā)以及生產(chǎn)所處的整個環(huán)境。
在藥品研發(fā)前期主要需要考慮環(huán)境是否對研發(fā)產(chǎn)生影響,基于風(fēng)險對環(huán)境進行控制即可。至臨床樣品生產(chǎn)階段對于環(huán)境的要求類似于GMP要求。
3.總結(jié)
綜上所述,研發(fā)質(zhì)量管理雖然與GMP有較大差別,但是基本理念和原則是相同的,可以概括為:事先可控,事后追溯。只有建立一個完善的研發(fā)質(zhì)量體系作為支撐,才能為研發(fā)的項目保駕護航,保質(zhì)保量!
參考文獻:
[1]汪六英. 藥品研發(fā)質(zhì)量體系數(shù)據(jù)完整性的現(xiàn)狀及應(yīng)對措施 廣州化工,2019,2:162
[2]核查中心2018年度藥品注冊生產(chǎn)現(xiàn)場檢查報告

