豬ALAS1 基因內含子9 多態性檢測及其對繁殖性能指標的遺傳效應
吳華莉,曹建國,張鶯鶯,王洪洋,涂尾龍,黃 濟,談永松
(上海市農業科學院畜牧獸醫研究所,上海 201106;上海市種豬工程技術研究中心,上海 201302)
提高豬繁殖力一直是生豬養殖者追求的目標,國內外育種工作者不斷尋找可用于提高豬繁殖性能的遺傳標記。 5-氨基乙酰丙酸合成酶1(5-aminolevulinate synthase 1,ALAS1)是體內血紅素合成的第一限制酶[1]。 生物體內多種細胞都需要血紅素(heme),其功能是參與紅細胞成熟,在生物體內進行氧氣運輸、電荷傳遞,它作為一種重要的信號分子參與眾多的分子和細胞過程[2-4]。 人、小鼠和雞ALAS1 基因已經被克隆出來,該基因含有11 個外顯子和10 內含子[5-7]。 小鼠ALAS1 基因也稱ALAS-N。 小鼠ALAS1 基因被證實在卵泡發育和排卵過程中起作用[8]。 劉林清等檢測豬ALAS1 基因內含子9 存在MSPⅠ酶切位點,CC型的產仔數高于TT 型的產仔數[9]。 豬ALAS1 基因在卵泡的發育、排卵及黃體化過程發揮一定作用[10-11]。本研究檢測ALAS1 基因內含子9 在上海地區4 個豬種群體內的多態性,并分析該突變位點與長白豬和大白豬繁殖性狀的相關性,以期為該突變位點用于豬繁殖育種提供基礎數據參考。
1 材料與方法
1.1 動物樣品和試驗材料
4 個豬種的樣品包括杜洛克豬(94 頭),大白豬(144 頭)和長白豬(78 頭)來自上海祥欣畜禽有限公司,梅山豬(117 頭)來自于上海豬狀元牧場,共計433 頭。 采集豬耳組織塊,放在預先加有75%酒精的1.5 mL 離心管中,儲存在冰盒里盡快運回實驗室,放置-20 ℃冰箱保存備用。 AXYGEN 組織DNA 提取試劑盒購自上海軒略科技發展有限公司;PCR 引物由上海生工生物工程公司合成;PCR 試驗所用試劑、DL 2000 DNA Marker 和MSPⅠ購自寶生物工程(大連)有限公司。
1.2 試驗方法
1.2.1 組織中DNA 提取
按照AXYGEN 組織DNA 提取試劑盒的操作步驟,提取采集豬耳組織樣品中的基因組DNA,測定DNA 濃度,將組織樣品中的DNA 濃度統一稀釋至50.0ng∕mL,放置在-20 ℃冰箱內保存備用。
1.2.2 PCR 擴增所用引物及擴增條件
上游引物:5’-CACACCCCGCAGATGATGAC-3’; 下游引物:5’-AAATAGAAGTGCAGAGCCCAGC-3’[9]。 將所有樣品分20 組進行試驗,每組包含約24 個樣品,在1.5 mL 離心管內配置24 個樣品的反應體系為:2 × Taq PCR Master Mix 264.0 μL,上下游引物各 12.0 μL,RNase-Free ddH2O 168.0 μL 。 顛倒離心管上下混勻,將離心管放入離心機中,設置離心轉速為8 000 r∕min,離心1min,取0.2 mL 的PCR 8 聯管進行分裝,每管分裝19.0 μL 的混合液,根據豬耳組織的編號在8 聯管的管壁標記號碼,然后加入對應樣品編號的DNA 模板1.0 μL,使每個PCR 管內試驗反應的總體積為20.0 μL。 PCR 擴增條件如下:94 ℃預變性5 min;94 ℃變性30 s,62 ℃退火30 s,72 ℃延伸30 s,共30 個循環;72 ℃延伸5 min。 待PCR 反應結束后,將PCR 8 聯管放入4℃冰箱內保存,配置1.0%瓊脂糖凝膠,加入PCR 擴增產物,采用110 V 電壓的,電泳時間為15 min,將凝膠從電泳液中取出,放置在凝膠成像分析系統中拍照保存圖片。
1.2.3 PCR-RFLP 試驗
PCR 擴增產物經瓊脂糖電泳檢測目的條帶單一明亮的樣品,可以進行酶切反應試驗,酶切反應體系:PCR 產物 5.0 μL,10 × Buffer 2.0 μL,MSPⅠ0.5 μL,ddH2O 8.5 μL,總體積為 16.0 μL。 放入 37 ℃水浴中,酶切30 min 后進行瓊脂糖凝膠檢測。
1.3 基因型分析
PCR 預期擴增片段大小為359 bp。 酶切后產生3 種基因型:CC 型(277 bp,47 bp 和35 bp);TT 型(324 bp 和 35 bp);CT 型(324 bp,277 bp,47 bp 和 35 bp)。
1.4 統計分析
利用Excel 2010 統計分型結果,計算ALAS1 基因在4 個豬種群體的基因型頻率和基因頻率,并進行Hardy-Weinberg 平衡檢驗。。 采用SPSS 19.0 軟件進行豬ALAS1 基因不同基因型的TNB 和NBA 差異比較分析。Yijk=μ+gk+eijk,μ為群體均值,gk為基因效應,eijk為隨機殘差。 采用GENEPOP 3.1 軟件計算基因雜合度(Heterozygosity,He)、純合度(Homozygosity,Ho)、有效等位基因數(effective number of alleles,Ne)和多態信息含量(polymorphism information content,PIC)。
2 結果與分析
2.1 檢測豬ALAS1 基因PCR 擴增結果
采用1.0%瓊脂糖凝膠電泳檢測PCR 擴增的結果,PCR 產物條帶大小為359 bp,結果如圖1 所示。 檢測采集所有樣品豬ALAS1 基因的擴增結果,PCR 產物均得到單一目的條帶,符合后續酶切試驗的要求。
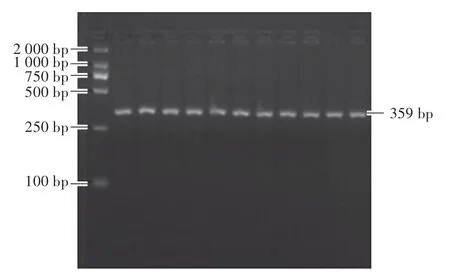
圖1 瓊脂糖凝膠電泳檢測豬ALAS1 基因PCR擴增結果Fig.1 Agarose detection of swine ALAS1 gene by PCR amplification
2.2 PCR-RFLP 檢測結果
PCR 產物按照PCR-RFLP 反應體系進行酶切試驗,采用1.5%瓊脂糖凝膠電泳檢測酶切試驗的結果。由于瓊脂糖凝膠電泳時45 bp 和35 bp 條帶較小,電泳檢測時無法顯示出來。 酶切試驗的檢測結果如圖2所示:TT 型顯示出324 bp 一條帶,CC 型顯示出277 bp 一條帶,CT 型顯示出324 bp 和277 bp 兩條帶。 檢測4 個豬種群體全部樣品的PCR-RFLP 結果,根據瓊脂糖凝膠電泳檢測結果統計樣品的個體基因型。
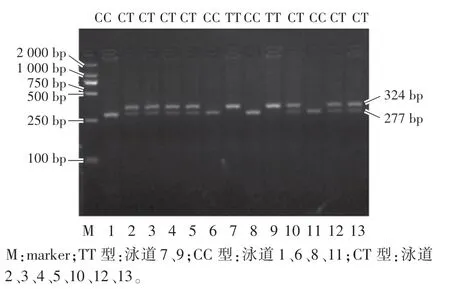
圖2 豬ALAS1 基因RFLP-PCR 瓊脂糖凝膠電泳檢測結果Fig.2 Agarose gel electrophoresis of RFLP-PCR of pig ALAS1 gene
2.3 ALAS1 基因在4 個豬種群體內的基因型頻率和基因頻率統計結果
根據PCR-RFLP 檢測結果統計4 個豬種群體的所有個體基因型,并計算ALAS1 基因在4 個豬種群體內的基因型頻率和基因頻率。 由表1 可見,ALAS1 基因在杜洛克豬、長白豬、大白豬和梅山豬群體內各基因型分布情況不同。 在杜洛克豬群體內只檢測出TT 型;在長白豬群體內TT 型最多,CT 型較少,僅檢測出一個CC 型;在大白豬群體內TT 和CT 中度分布,CC 型較少;在梅山豬群體內中CC 型最多,CT 型次之,TT 型最少。 在基因頻率方面,除了在梅山豬群體內C 等位基因比例較高,在其他3 個豬群體內T 等位基因比例高。
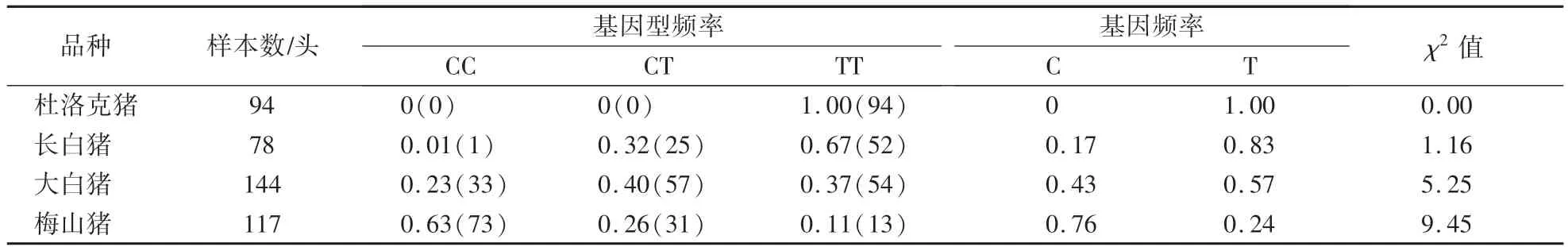
表1 ALAS1 基因在4 個豬種群體內的基因型頻率和基因頻率Table 1 Genotype and gene frequency of ALAS1 gene in four pig populations
2.4 ALAS1 基因的遺傳多態性分析
ALAS1 基因在杜洛克豬、長白豬、大白豬和梅山豬群體內的遺傳多樣性見表2。 大白豬和梅山豬的PIC 值為0.25—0.5,表現為中度多態;杜洛克和長白豬的PIC 值低于0.25,表現為低度多態。
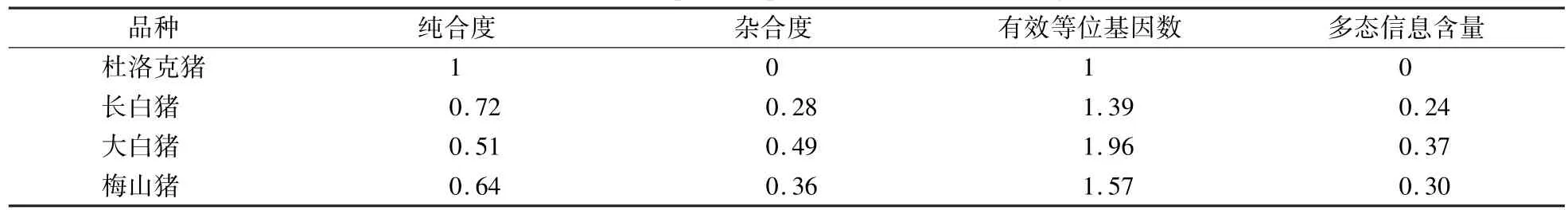
表2 ALAS1 基因的遺傳多態性分析Table 2 Genetic polymorphism analysis of ALAS1 gene
2.5 ALAS1 基因不同基因型在3 個豬種群體的TNB 和NBA 比較分析
ALAS1 基因在杜洛克豬群體內只檢測出1 種TT 基因型,TT 型的TNB 和NBA 平均值分別為9.49 頭和 8.43 頭(表 3)。
表3 ALAS1 基因在杜洛克豬群體的TNB 和NBA 平均值(±SD)Table 3 TNB and NBA mean value of ALAS1 gene in Duroc populations 頭

表3 ALAS1 基因在杜洛克豬群體的TNB 和NBA 平均值(±SD)Table 3 TNB and NBA mean value of ALAS1 gene in Duroc populations 頭
基因型 TNB NBA TT 9.49 ± 0.65 8.43 ± 0.66
由表4 可見,ALAS1 基因在長白豬群體內 CT 型的 TNB、NBA 比TT 型的分別高0.23 頭(P>0.05)、0.29 頭(P>0.05)。 由于在長白豬群體內只檢測出1 個CC 型,無法統計TNB 和NBA 值,無法與CT 型、TT 型TNB 和NBA 進行比較分析,因此數值未列出。
表4 ALAS1 基因不同基因型在長白豬群體TNB 和NBA 的數值(±SD)Table 4 TNB and NBA values of different genotypes of ALAS1 gene in Landrace populations 頭

表4 ALAS1 基因不同基因型在長白豬群體TNB 和NBA 的數值(±SD)Table 4 TNB and NBA values of different genotypes of ALAS1 gene in Landrace populations 頭
注:未標注表示差異不顯著(P >0.05)。
基因型 TNB NBA CT 12.21 ± 0.60 11.25 ± 0.50 TT 11.98 ± 0.75 10.96 ± 0.57
由表5 可見,ALAS1 基因在大白豬群體內的TNB 和NBA 均表現為CC >CT >TT 趨勢。 在大白豬群體內 CC 型的 TNB、NBA 比 CT 型的分別高 0.28 頭(P> 0.05)和 0.24 頭(P> 0.05);CC 型的 TNB、NBA 比TT 型的分別高1.63 頭和 1.58 頭(P< 0.01);CT 型的 TNB、NBA 比 TT 型的分別高 1.35 頭和 1.34 頭(P<0.01)。
表5 ALAS1 基因不同基因型在大白豬群體TNB 和NBA 的數值(±SD)Table 5 TNB and NBA values of different genotypes of ALAS1 gene in Large White populations 頭
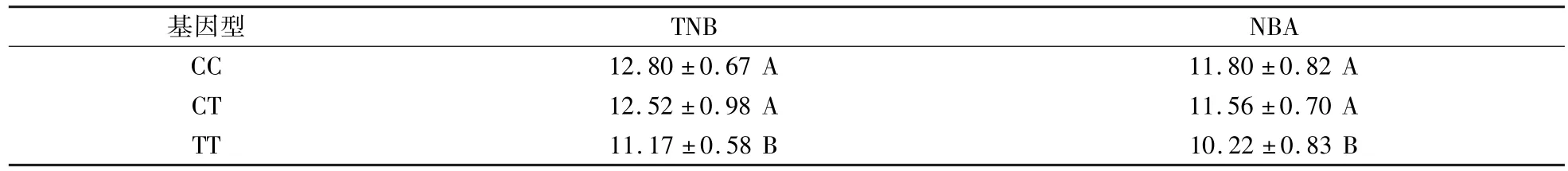
表5 ALAS1 基因不同基因型在大白豬群體TNB 和NBA 的數值(±SD)Table 5 TNB and NBA values of different genotypes of ALAS1 gene in Large White populations 頭
注:同列大寫字母不同表示差異極顯著(P <0.01),相同表示差異不顯著(P >0.05)。
基因型 TNB NBA CC 12.80 ± 0.67 A 11.80 ± 0.82 A CT 12.52 ± 0.98 A 11.56 ± 0.70 A TT 11.17 ± 0.58 B 10.22 ± 0.83 B
3 討論與結論
在哺乳動物細胞中有廣泛存在的ALAS1 和紅細胞中特異表達的ALAS2(又命名為ALAS-E),兩者屬于同工酶,ALAS 是血紅素合成的限速酶[1,12]。 人類和鼠ALAS1 基因已被證實在卵泡發育和排卵過程中發揮作用。 小鼠卵巢中注射HCG 試驗表明,小鼠ALAS1 基因在注射0.5—2.0 h 表達量增加,在卵泡破裂12 h 表達量迅速下降[13]。 小鼠ALASl 基因5’側翼序列存在2 個cAMP 應答元件CRE,它是cAMP 基礎表達和刺激表達必需的,cAMP 調節信號轉導通路在卵泡發育和黃體化過程中發揮作用[14]。 人類ALAS1 基因參與排卵過程有關的線粒體細胞色素P450、類固醇代謝和類固醇生成過程[15]。 豬ALAS1 基因在血清促性腺激素處理后,在卵泡發育2 h 和排卵過程12 h 期間表達量高,在卵泡黃體化的16—24 h 表達低。在大白豬群體內含子9 突變產生CC 型的產仔數高于TT 型的產仔數(P<0.01)[11]。 本試驗結果表明:豬ALAS1 基因在上海地區大白豬群體內CC 和CT 型的 TNB、NBA 均高于 TT 型的 TNB、NBA(P<0.01),但CC 型的 TNB、NBA 與 CT 型的 TNB、NBA 差異未達到顯著水平(P>0.05)。 這一結果與劉林清等證實ALAS1 基因CC 型在大白豬群體內具有較高產仔數的結果是一致的[9,11]。
有研究表明,內含子突變可以影響基因功能,影響mRNA 剪接和穩定性,也會影響基因的表達量[16-17]。 有研究證實ALAS2 基因位于增強子區域GATA1 轉錄因子綁定位點的突變可使啟動子失活,從而引起先天性鐵幼粒細胞貧血癥的發生[18-20]。 豬ALAS1 基因內含子9 突變位點影響豬產仔數的機制目前還不清楚。 本試驗檢測ALAS1 基因在杜洛克豬、大白豬和長白豬的TNB 和NBA 平均值對比結果發現:杜洛克豬群體TNB、NBA 均低于長白豬和大白豬的TNB 和NBA,這一結果與杜洛克豬檢測群體內只存在TT 型是否相關,需要進一步研究。 在梅山豬群體內的CC 型頻率較高(達到0.62),由于未有梅山豬群體的繁殖性狀數據進行關聯分析,CC 型的高比例是否與梅山豬高產仔數的遺傳性能有關,仍需收集繁殖性狀后進行相關分析加以證實。
本研究對ALAS1 基因內含子9 區域MSPⅠ酶切位點進行多態分析,確定在大白豬群體內CC 型為影響產仔數的優勢基因型,后續研究可擴大檢測品種,在不同品種進行驗證,從而確定ALAS1 基因該位點突變是否可以用于更多品種的分子育種實踐。

