禽法氏囊發育與免疫功能研究新進展
何 洋 施紅梅 杜彥麗 豆騰飛 王 坤 賈俊靜 葛長榮
(云南農業大學 動物科學技術學院,昆明 650201)
法氏囊最早由意大利解剖學家Hieronymus Fabricius于1621年發現,并因此而得名[1],它是禽類的腸道相關淋巴組織(Gut-associated lymphoid tissue,GALT),也是禽類特有的免疫器官,在抗原的刺激下,法氏囊能作為初級免疫器官為B細胞的發育成熟提供必要微環境,也能作為次級免疫器官參與機體的免疫應答[2]。目前,眾多學者已從解剖學與免疫學角度較為完整地揭示了法氏囊的結構發育過程[3-4]。如圖1所示,法氏囊的發育伴隨著造血干細胞的定植而始于胚胎早期,并在出生后發育完全,同時會隨著機體年齡的增長而發生不可逆的結構退化直至完全消失。法氏囊的免疫功能與其結構發育密切相關,其結構的損傷將會導致法氏囊免疫功能的紊亂,進而造成機體的免疫缺陷,不利于禽養殖業的經濟效益與健康發展。因此,從結構發育的角度對法氏囊的免疫功能進行剖析具有重要意義,而與之密切相關的問題如造血干細胞向法氏囊的定向遷移機制、法氏囊增齡性退化的發生機制以及法氏囊對淋巴B細胞的篩選與促進作用等還未得到全面的解答,這也成為現今法氏囊相關研究的焦點。本文基于這些問題的相關研究進行綜述,總結法氏囊結構發育與免疫功能的研究新進展,并對導致法氏囊免疫功能紊亂的因素進行概述,旨在為今后的法氏囊相關研究提供方向,對抗病育種進程以及高效疫苗的開發具有重要意義。

依據參考文獻[3-4]進行繪制。The figure was drawn according to the reference[3-4].圖1 禽法氏囊的發育與結構Fig.1 Development and structure of avian fabricius
1 法氏囊發育新進展
1.1 法氏囊原基的起源
法氏囊的發生發育包含2個關鍵步驟,首先是法氏囊原基出現,其次是不同批次的造血干細胞在法氏囊中的定植。對于法氏囊原基的起源是存有爭議的,早期研究認為法氏囊起源于內胚層,由內胚層空泡化形成的法氏囊腔是其最有利的證據,但是內胚層的標記分子—音猬因子(Sonic hedgehog,Shh)并未從法氏囊上皮中被檢測,這導致法氏囊原基的起源受到質疑。在后續的研究中,利用人工構建的“雞-鵪鶉”法氏囊原基嵌合體還原法氏囊的發育過程后,發現僅有鵪鶉外胚層尾芽與雞法氏囊間質進行重組的法氏囊原基在孵育的過程中會形成法氏囊濾泡,表明法氏囊原基應起源于外胚層[5]。而最新的研究表明,并不只是內胚層會發生空泡化現象,一些內卷的外胚層也出現了空泡化,即法氏囊原基的起源與內外胚層均存在聯系[6]。
1.2 造血干細胞在法氏囊中的定植
多數研究發現,至少有3個批次的造血干細胞在不同的時間內完成在法氏囊中的定植,它們能分化形成形態各異的功能細胞,并參與法氏囊的免疫功能。以雞為例,在造血功能發生的同時(孵育期2~3 d),卵黃囊血島內出現了3種形態及表面抗原存在差異的造血干細胞(圖1),分別是大而圓,具有CD45/51/61/Grl1/Grl2免疫活性的血小板前體細胞;體型小而不規則,具有CD45/Grl2/Lep100/AcPhos免疫活性的巨噬細胞前體細胞;外型分叉具有CD45/MHC II免疫活性的淋巴細胞前體細胞,這些細胞從主動脈簇及主動脈旁遷移至全身各處[7]。在孵育期第8天至出殼前,圓形細胞短暫聚集于法氏囊間質遠端,并在出殼后第二天完全消失。在孵育期第9~12天時,不規則型細胞及分叉型細胞先后定植于法氏囊間質,不規則型細胞可分化為網狀上皮細胞,巨噬細胞以及分泌樹突細胞等,它們一同構成法氏囊濾泡的髓質部分并為之后分叉型細胞的定植提供環境[8-10]。而分叉型細胞作為B淋巴細胞的前體向法氏囊遷移,并在遷移過程中伴隨著細胞表面免疫球蛋白(Surface immunoglobulin,SIg)V(D)J基因的重組[11]。
目前尚不清楚影響造血干細胞對法氏囊中定向遷移的具體因素,但普遍認為該過程與細胞因子(Cytokines)相關[12]。細胞因子是一組由多種細胞釋放的蛋白質,它們能作為細胞間的介質調控淋巴細胞增殖發育[13],并促進機體先天免疫反應與適應性免疫應答[14],而細胞在機體內的遷移也受其調控,該過程主要由趨化因子(Chemokines)負責。淋巴細胞表面7跨膜G蛋白伴侶受體(Seven transmembrane G protein coupled receptors)通過與趨化因子結合而被激活[15],從而促使免疫細胞發生遷移,如當法氏囊感染傳染性法氏囊病(Infectious bursa disease,IBD)時,會造成感染者法氏囊的嚴重損傷,導致法氏囊內的B細胞快速損耗從而引起機體強烈的免疫抑制[16],此時CC趨化因子19(CC chemokine ligand 19,CCL19)與其趨化因子受體CCR7(Chemokine receptor 7)能引起外周淋巴細胞向法氏囊遷移,導致法氏囊內T細胞的數量增加[17];CXCL12(也稱作間質衍生因子1(Stromal derived factor 1))與其受體CXCR4(Chemokine receptor)作為哺乳動物正常或非正常發育狀態下細胞遷移指標而受到關注[18-20],而禽類的CXCL12與哺乳動物相比,表現出高度保守性[21]。在法氏囊發育過程中,CXCL12的動態表達與B細胞的增殖分化及之后向外周淋巴組織的遷移相關[22],敲除雞脾臟B細胞的CXCR4受體則會抑制該細胞向法氏囊的遷移[23],這個結果一定程度上解釋了法氏囊發育過程不同批次造血干細胞的遷移機制,即CXCL12-CXCR4軸在禽法氏囊發育過程中扮演了重要角色。
1.3 法氏囊的增齡性退化
伴隨著禽類性成熟以及產蛋的開始,法氏囊出現增齡性退化,Bickfor等[24]詳細地描述了整個法氏囊退化的過程,法氏囊的退化按組織變化可分為早中晚3個時期,以雞為例,最早于公雞20周齡,母雞24周齡便可觀察到法氏囊退化的發生。法氏囊退化的早期(公雞20周齡,母雞24周齡)以褶皺結構變化及淋巴細胞的出逃為特征,具體表現為法氏囊褶皺上皮增厚,密度變大而導致法褶皺間發生粘連,部分褶皺上皮出現稀薄、折疊以及脫離現象,導致濾泡相關上皮(Follicle associated epithelium,FAE)失去屏障與吞噬能力,促使淋巴細胞從萎縮的法氏囊濾泡內溢出至法氏囊腔內,同時法氏囊濾泡的髓質區域發生液化性壞死,并伴隨著皮質碎片化,形成由一層立方上皮薄膜包覆的髓質腫塊;法氏囊退化中期(公雞24周齡,母雞26周齡)的顯著特征是濾泡間結締組織增多,此時法氏囊褶皺粘連導致上皮結構的完全喪失,同時肌層收縮擠壓致使法氏囊腔消失而形成肌層殘基,殘基內充斥萎縮的濾泡、浸潤的噬異性細胞、巨噬細胞以及纖維結締組織,而在萎縮的濾泡中,髓質腫塊周圍聚集大量不規則的壞死淋巴細胞,部分髓質腫塊中充斥著壞死殘基以及一些細胞碎屑和膽固醇結晶;在法氏囊退化晚期(公雞26周齡,母雞28周齡),殘基周圍的肌層收縮,此時的殘基由相對致密包含膽固醇結晶病灶與濾泡殘骸的結締組織組成。
關于法氏囊生理性退化的機制,目前主流的觀點均集中于機體內激素水平變化導致內環境改變而造成法氏囊不可逆退化的發生,但哪種激素起主導作用則尚存爭議。過往研究中普遍把法氏囊的退化與體內性固醇激素水平進行關聯,體內性固醇激素的上升導致FAE活性改變,引起法氏囊濾泡內的淋巴細胞大量溢出,特別是雄性法氏囊退化時間早于雌性,強調了性激素類型在法氏囊退化中的重要性[24]。另一種觀點則認為法氏囊的退化與體內生長激素水平相關[25-26]。生長激素主要由垂體分泌,參與機體蛋白合成、脂質降解等重要的生物過程。研究發現,除垂體外一些組織器官同樣能夠分泌生長激素,其中包括法氏囊[27]。對于體液循環中的生長激素總量,垂體外組織器官所分泌的生長激素占比不到1%,提示由它們分泌的生長激素更多參與自分泌與旁分泌功能。此外,生長激素能夠激活PI3K/AKT通路而發揮抗凋亡的功能[28-29],因而生長激素能抑制法氏囊內淋巴細胞與上皮細胞的凋亡,以維持法氏囊的結構與功能,但生長激素會隨著年齡增長而減少分泌,這會引起法氏囊內細胞的快速凋亡,導致法氏囊的退化。另外一些研究發現外源性糖皮質類固醇激素(Glucocorticoid)能夠引起雞法氏囊結構組織的萎縮,法氏囊內淋巴細胞的凋亡,并造成嚴重的免疫抑制[30]。在哺乳動物中,由胸腺分泌的內源性GC作為重要的旁分泌因子協同由腎上腺分泌的GC參與了胸腺器官的穩態以及T細胞的發育及選擇[31-32]。最近研究發現雞法氏囊自身也具有糖皮質類固醇激素合成所需的所有酶和輔助因子[33],屬于腎上腺外的糖皮質類固醇(Extra-adrenal glucocorticoid)激素合成組織[34]。雖然目前尚不清楚法氏囊合成GC的目的以及這些GG對法氏囊免疫功能的影響,但結合內外源性GC對免疫器官與細胞的雙向作用來看,推測法氏囊合成的GC應與對B細胞的篩選以及法氏囊增齡性結構組織變化存在聯系,但這需要進一步驗證。
2 法氏囊免疫功能研究新進展
2.1 法氏囊對B細胞的篩選
禽法氏囊對B淋巴細胞的成熟至關重要,幾乎完全參與了B細胞的整個發育階段,包括篩選、維持以及促進B細胞的增殖分化,而對B淋巴細胞的篩選又可分為2個階段。當B淋巴細胞前體遷移至法氏囊基質,依據其基因重組的形式,細胞表面會產生功能性SIg(SIg+)與非功能性(SIg-)2種受體復合物,其中SIg+型的細胞進入法氏囊濾泡繼續增殖,而SIg-型細胞則會被線粒體或FAS介導的凋亡途徑剔除[35]。SIg+型細胞進入法氏囊濾泡后,以不同尺寸同時存在,相較于小尺寸細胞,大尺寸細胞具有更強的增殖分化活性[36],并能維持較長的生命周期,而小尺寸細胞在短暫的分化后便快速凋亡。法氏囊在整個篩選過程中會剔除95%的B淋巴細胞,僅有5%的細胞能夠成熟并進入外周免疫器官。
研究表明,2個篩選階段具有完全不同的機制,法氏囊對SIg+型細胞篩選的關鍵點在于其表面IgM的表達。IgM能協助表面B細胞受體(B cell receptor,BCR)的信號傳導聚合物—Igα在SIg+型細胞表面表達,從而確保B淋巴細胞前體在法氏囊濾泡的定植[37]。而法氏囊對濾泡內淋巴細胞的篩選則與腸道抗原密切相關,當腸道抗原與法氏囊內B細胞的BCR結合后,能延長B細胞的壽命以完成之后的發育過程[38]。
由于腸道抗原對維持法氏囊濾泡內B細胞活力的必要性,因此法氏囊需要通過特定的結構—法氏囊褶皺,對腸道抗原進行識別、捕獲與轉運。法氏囊褶皺表面由90%濾泡間上皮(Interfollicular epithelium,IFE)及10%的FAE構成,FAE與IFE均由法氏囊褶皺上皮細胞分化形成,不同的FAE之間由IFE間隔。IFE由柱狀分泌細胞(Cylindrical-shaped secretory cell,SC)、立方基底細胞(Cuboidal basal cells,BCs)以及基底層薄膜(Basement membrane)構成[39-41],SC又分為SCI與SCII,SCII具有小窩蛋白(Caveolin-1)免疫活性,而SCI與BCs均能表達粘液蛋白對法氏囊腔及法氏囊管潤滑,提示BCs可能是SCI的前體[40]。與IFE不同的是,FAE不具有基底層薄膜結構,它由3~5層上皮支持細胞(Epithelium supporting cell)支撐,而FAE與ESC細胞之間則通過橋粒(Desmosomes)相連。ESC與髓質皮質上皮細胞(Corticomedullary epithelium cell)共同構成了法氏囊濾泡髓質上皮(Medullary epithelial)。FAE的功能類似于哺乳動物腸道上皮內的M細胞(Microfold cell)。M細胞能夠從腸管中識別、捕獲并轉運腸道抗原至淋巴細胞,因此在粘膜相關淋巴組織中扮演重要角色[42]。而在禽類中,FAE承擔了M細胞的功能,其表面分布一層由抗菌肽CATH-B1形成的保護性纖維網絡[43],并表現出酶促反應活性以及胞飲活性,它在識別抗原產生的IgA后對其進行捕獲,并在法氏囊支持細胞的協助下,將抗原轉入髓質,同時還能維持法氏囊內環境的穩定。此外,在FAE內還發現了部分能夠表達定植刺激因子受體(Colony-stimulating factor 1 receptor,CSF1R)的細胞群[44]。與其余的FAE細胞不同,這群細胞僅能協助轉運一定大小的微顆粒(0.02~0.10 μm),而無法轉運細菌這類較大的物質。有意思的是,在哺乳動物中CSF1R僅表達于巨噬細胞內[45],然而法氏囊內的巨噬細胞與FAE細胞具有不同的來源,這些具有CSF1R活性的FAE細胞,是否是為了刺激法氏囊褶皺上皮向FAE分化,亦或僅僅協助FAE完成抗原的轉運?隨著禽CSF1抗體的出現[46],將有助于這些問題的解決。
2.2 囊素肽促進B細胞的增殖分化
進入法氏囊濾泡的B淋巴細胞前體,在class II MHC+(Major histocompatibility complex,主要相容性組織復合物)分泌樹突型細胞以及囊素肽的刺激下快速增殖。囊素肽是由法氏囊濾泡內的網狀細胞分泌并局限于法氏囊濾泡內的一系列多肽物質[47],是促進B淋巴細胞成熟的重要因子。如表1所示,截至目前,已有大量的研究對法氏囊多肽物質進行鑒定。法氏囊囊素肽依據其氨基酸的序列進行命名,可分為BP家族、BPP家族和BSP家族,但需注意由于氨基酸序列的差異會造成相同命名的囊素肽在生物學上的功能差異,如Bursin與BP3[48-49],BSP與BP7[50-51]等。囊素三肽(Bursin)是從法氏囊中首先被分離到的活性肽物質,它能有效刺激B淋巴細胞前體的分化[52],并能作為法氏囊的信使促進松果體生物合成活性[53]。BP家族包括BPI-IV,它們能夠促進前體B細胞增殖,降低PU.1的表達水平[48],BPIV還能促進B細胞分化,提高特異性抗體的分泌水平[54]。BPP家族包括BPPI-VI,BPPI與BPPII能夠促進淋巴細胞增殖,修飾T細胞免疫表型,并參與機體抗腫瘤信號通路[55-56]。而BPPIII-VI則是通過反相高效液相色譜(RP-HPLC)從法氏囊提取物中得以分離,它們能夠促進抗體與細胞因子分泌[57]。BSP家族包括BSPI與BSPII,BSPI能夠抑制MCF與Hela腫瘤細胞的增殖,并能增強抗腫瘤因子p53的轉錄活性與蛋白表達水平[51]。BSPII涉及多種免疫應答,并與腫瘤細胞的增殖相關,且同樣能刺激p53的表達[58]。除此以外,后續的研究還鑒定出BP7、BP8、BP9、BP11以及Bursopentin。BP8可作為免疫調節劑參與B細胞的發育,并且由于它能夠激活ADH7與RDH10同維他命A結合蛋白的互作而調控維他命A在體內與體外的汲取,因此BP8也是B細胞發育與維他命A代謝的重要樞紐[59]。BP9能夠提升抗體分泌水平,調控細胞因子的產生與T細胞的激活,同時還與未成熟B細胞的自噬發生相關[54]。BP11能夠促進前體B細胞的形成,并調控B細胞的分化,因此與禽免疫系統的發育高度相關[60]。Bursopentin也稱作BP5,它參與對法氏囊樹突細胞的修飾,包括抑制受脂多糖刺激的樹突細胞前體炎性因子與抗炎因子的分泌,并能逆轉樹突細胞的形態改變與表面分子標記物的表達水平[61],但同時BP5能夠保護受脂多糖刺激的樹突細胞免于氧化應激的壓力[62]。而最新的研究表面,BP5能夠抑制癌細胞HCT116的增殖,它能通過上調p53與p21,并完全抑制E1-CDK2的表達而使細胞延滯在G1期,同時也能夠激活內質網介導的凋亡途徑促進癌細胞凋亡[63]。BP7則是最新被分離到的法氏囊活性肽,它能夠刺激鼠源B細胞WEHI-231的自噬,并能調控凋亡相關蛋白Bcl-2的表達,與其他法氏囊活性肽類似,BP7也能促進抗體分泌以及由細胞介導的免疫應答[50]。
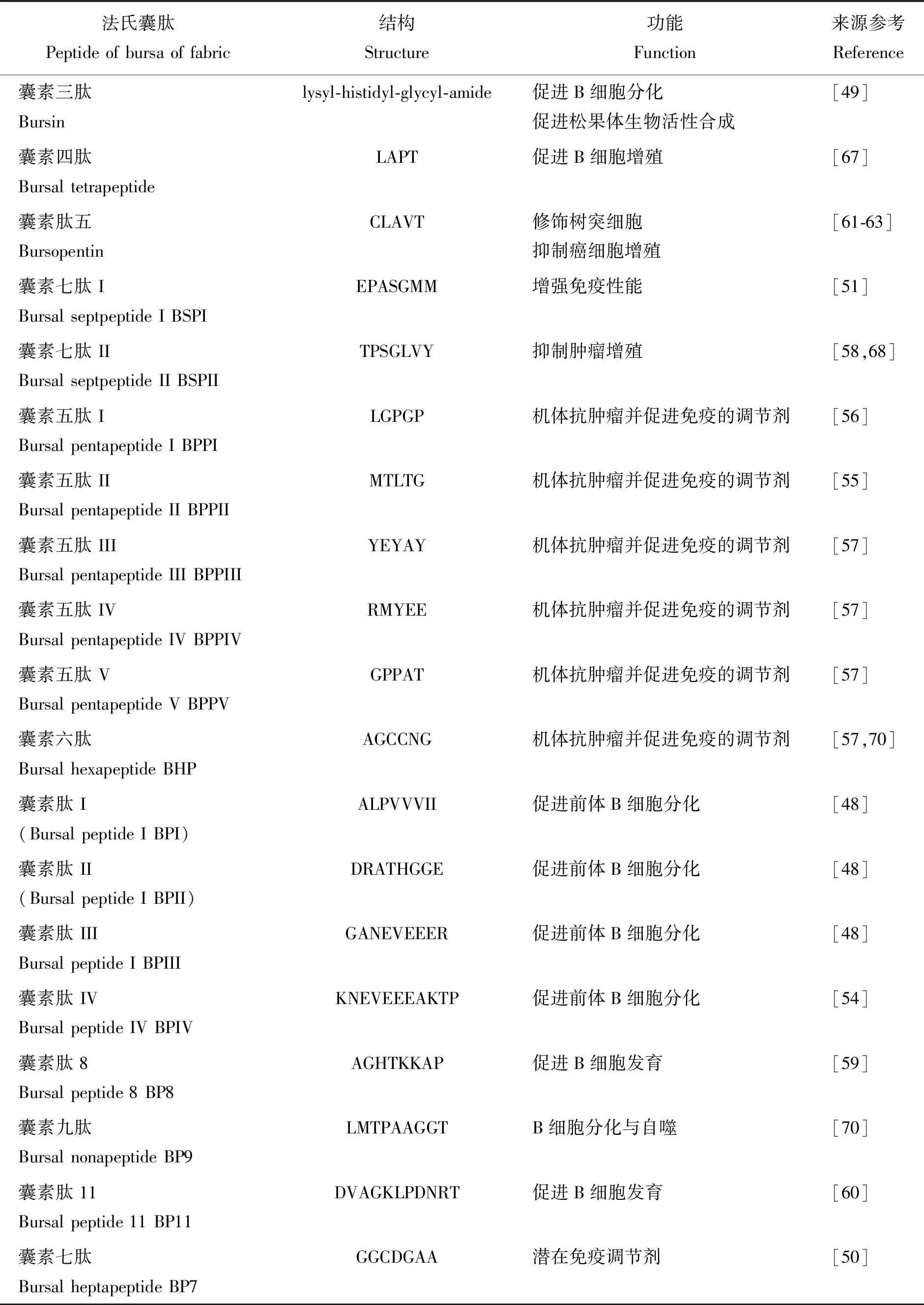
表1 法氏囊肽種類與功能Table 1 Types and function of peptide of bursa of fabric
在法氏囊內成熟的B細胞在禽出生前不具備明確的方向性與功能性,只有當它們從法氏囊遷移至其他外周免疫器官后,通過活化誘導的胞苷脫氨酶(Activation-induced cytidine deaminase,AID)介導的體細胞超突變(Somatic hypermutation)、類開關重組(Class switch recombination)以及基因轉換的形式才能實現B細胞功能的多樣化。而一些輔助因子也參與了這個過程,比如Bcl-6能介導B細胞的體細胞超突變與基因轉換[64];絲氨酸/精氨酸富集蛋白1(Serine/arginine-rich protein,SRSF1)對于體細胞超突變的維持[65]。而一些由法氏囊濾泡分泌的因子,比如B細胞活化因子(B Cell-activating factor,BAFF),也能以自分泌的形式刺激濾泡內B細胞的增殖成熟,并能短暫抑制其在體外的凋亡發生[66]。
2.3 影響法氏囊免疫功能的因素
法氏囊結構的改變會對法氏囊的免疫功能造成嚴重影響,包含2個關鍵環節,首先是FAE結構的改變,導致其無法限制淋巴細胞的溢出。其次是法氏囊濾泡的萎縮,致使其無法再為B淋巴細胞的增殖分化提供必要的微環境,而淋巴細胞的損耗則意味著法氏囊喪失了它作為免疫器官的功能。研究表明,目前廣泛流行并以法氏囊作為靶器官的病毒有傳染性法氏囊病病毒、新城疫病病毒(Newcastle disease virus,NDV)、馬立克病病毒(Marek’s disease virus,MDV)、禽白血病病毒(Avian leukosis virus,ALV)以及雞傳染性貧血病病毒(Chicken infectious anemia virus,CIAV)。如表2所示,不同病毒對法氏囊的侵入與損傷存在差異,但這些病毒幾乎都能造成法氏囊內淋巴細胞的快速損耗以及法式氏囊濾泡結構的損傷,導致法氏囊功能紊亂從而引起機體不同程度的免疫抑制。

表2 病毒對法氏囊免疫功能與結構的影響Table 2 The effects of virus to immune function and structure of bursa of fabric
除了直接作用于法氏囊本身,一些病原微生物也可通過機體自身的免疫應答,間接造成法氏囊免疫功能的紊亂。由NDV介導的HMGB1(High mobility group box 1)的釋放,會導致HMGB1與TLR2(Toll-like receptors2,TLR2),TLR4((Toll-like receptors4,TLR4)以及RAGE(Receptor for advanced glycation endproducts,RAGE)的互作而刺激NF-κB的激活從而促進炎性因子的釋放,最終造成嚴重的細胞凋亡與組織損傷[76]。禽類致病性大腸桿菌(Avian pathogenic escherichia coli,APEC)其外膜上的脂多糖(Lipopolysaccharide,LPS)能夠刺激TLR4-MAPK-NF-κB信號通路的激活而引發炎癥,導致法氏囊B細胞表面受體的表達抑制,并造成法氏囊上皮結構的完全毀滅以及淋巴細胞的凋亡從而導致法氏囊萎縮的發生[77]。
越來越多的研究表明,除病原微生物外,飼養過程中的一些應激源也是法氏囊免疫功能紊亂的原因。氨是常見的毒性刺激氣體,雞吸入氨氣后會引發由NF-κB信號通路介導的炎癥反應,并造成法氏囊器官指數的降低以及法氏囊濾泡結構的損傷[78]。飼料中的一些添加物也會對法氏囊的免疫功能造成威脅,銅是一種必需的微量營養素,它是許多催化反應中關鍵的輔助因子,而當雞暴露于過量的銅與砷時,會誘導法氏囊內B細胞線粒體功能紊亂,導致細胞凋亡與自噬的發生[79]。由于肉雞對環境溫度高度敏感,因此熱應激是家禽養殖業所面對的風險之一,熱應激會造成肉雞法氏囊濾泡結構的破壞,引起淋巴細胞的快速消耗造成機體的免疫抑制,增加傳染病暴發的風險[80]。除此以外,對于禽類生長性狀的選育,也在一定程度上對法氏囊的發育與免疫功能造成影響[81]。
3 展 望
法氏囊退化的過程中存在一個有趣的現象,在性成熟的母雞群中只有開始產蛋的母雞,其法氏囊才會發生退化,表明法氏囊的退化與產蛋母雞開產日齡存在較強的相關性[82],也提示禽生殖器官與免疫器官之間存在某種交流。器官與器官之間的交流已經在骨骼肌中得以充分證明,當骨骼肌受到刺激時(通常以運動為主)會釋放肌源性因子(Myokines),肌源性因子作為肌肉與其他器官組織交流的中介,能夠影響機體脂肪沉積、骨骼發育以及大腦認知等多個重要生物過程[83]。那么是哪些分子調控了其他器官組織與法氏囊的互作?得益于轉錄組學與蛋白質組學技術的普及與運用,使得篩選這些分子的效率極大提高。Han等[84]利用轉錄組學揭示了烏骨雞與肉雞法氏囊由色素沉積差異導致的淋巴細胞發育差異,共發現4 848個差異基因,其中326個非編碼基因與色素沉積、生長發育相關;Liu等[85]取SPF雞20胚齡與出生后2日齡的法氏囊,進行全轉錄組測序而建立cicRNA文庫,從文庫中共發現由4 565個基因產生的13 689個circularRNA,其中有27個circularRNA在不同的發育時期表達存在差異,對這些差異circularRNA的靶基因進行預測發現,這些靶基因主要涉及代謝與發育功能。McCarthy等[86]利用蛋白組學技術對法氏囊B細胞的功能進行注釋,揭示了42種此前未曾報道的對B細胞凋亡進行調控相關的因子,包括白細胞介素2(Interleukin 2),Notch 1蛋白等。
雖然目前已挖掘出大量與法氏囊發育及免疫功能相關的候選基因,但后續的驗證工作似乎成了新的難題。一方面,目前對禽候選基因的驗證方式普遍以體外實驗為主,但這種方式很難完全還原機體的內環境,這會造成驗證結果出現偏差甚至完全相反,比如基因mRNA表達水平與其蛋白豐度之間不對稱性所反映出的機體對轉錄翻譯過程的精密調控[87],卻很難在體外實驗中得于復現。另一方面,現有技術水平一定程度上也制約了候選基因在禽體內的驗證,CRISPR (Clustered regularly interspaced short palindromic repeats)/Cas9 (CRISPR associated protein 9 system)作為第三代基因編輯工具,因其高效、精確以及成本低廉的特性而應用于動物體內功能基因與表型的驗證。利用CRISPR/Cas9技術對雞體細胞(Somatic cell)與原始生殖細胞(Primordial germ cell,PGC)進行編輯從而構建轉基因雞是一種對候選基因驗證的理想方式,但是有限的編輯策略、較低的編輯效率以及難以保證的后期存活率都制約了該技術在禽類中的應用[88]。為解決這些問題,可行的方法包括編輯方式的優化[90]、編輯組件的開發[90]或者從一個更精確的角度即從單個細胞的視角解析完整的生物過程。傳統轉錄組學技術反映的是大量混合細胞的RNA平均變化情況,而單細胞RNA測序技術(Single-cell RNA-sequencing)作為傳統轉錄組學技術的革新,具有揭示單個細胞在生物過程中的屬性,能直接反映單個細胞基因表達的動態變化[91],這將有助于對法氏囊發育與執行免疫功能過程中關鍵細胞群體的定位,勢必會把法氏囊的研究帶入更深的層次。隨著對法氏囊免疫功能認識的深入,可將法氏囊的某些參數作為抗病育種的選育指標,以此加快選育進程,也將成為今后相關新型疫苗開發的助力。

