基于胃黏膜活檢對兒童幽門螺桿菌多重耐藥及毒力基因分型的關聯性分析
王教常 黃達棟 王榮 徐賢坐 林敏 林福旭 湯清清 孟飛 林李淼*
幽門螺桿菌(Hp)自1983年被發現后一直備受關注。眾多研究已證實其與胃炎,消化性胃潰瘍等一系列胃部疾病相關,甚至與胃癌的發生密切相關[1]。目前,Hp全球感染率已超50%,兒童Hp感染狀況不容樂觀[2-4]。兒童作為一個特殊群體,在Hp感染患兒中,僅部分有發病癥狀,且根除Hp效果也不盡相同。究其原因,可能與Hp毒力和抗生素耐藥有關。作者收集胃黏膜活檢組織標本,進行Hp分離培養鑒定,并進一步對其毒力基因分型及6種抗生素耐藥性進行檢測,分析兒童Hp毒力基因分型與耐藥情況的關聯性,為本地區兒童Hp臨床根除治療及預防提供參考。
1 資料與方法
1.1 臨床資料 招募2019年1~12月本院因上消化道癥狀就診且行胃鏡檢查的患兒430例。納入標準:(1)有腹痛、腹脹等消化道癥狀者;(2)4周內未使用抗生素、鉍劑、質子泵抑制劑或H2受體拮抗劑者;(3)經患兒監護人知情同意,胃鏡下取胃黏膜活檢標本。排除標準:(1)患有嚴重的肝、腎疾病;(2)對本研究中6種抗生素過敏者;(3)有精神疾病等不能正確表達主訴及不能合作者。胃黏膜組織Hp分離培養陽性患兒249例,其中男111例,女138例;年齡4~14歲,平均年齡(9.27±2.71)歲。
1.2 方法 (1)Hp分離培養:將胃黏膜組織充分研磨后,涂布于Hp專用培養基上,置于37℃微需氧環境(5% O2,10% CO2,85% N2)培養 3~5 d,挑選透明可疑菌落進行初步鏡檢,經尿素酶、氧化酶及過氧化氫酶反應均為陽性后,判定為Hp陽性菌株。(2)Hp耐藥檢測:采用瓊脂稀釋法,將6種抗生素(克拉霉素、左氧氟沙星、阿莫西林、甲硝唑、呋喃唑酮、鹽酸四環素)分別加入Hp專用培養基中稀釋成臨界濃度,制備含不同抗生素的平板。將鑒定后的Hp陽性菌株分別接種于含不同抗生素平板上,置于37 ℃微需氧環境(5%O2,10%CO2,85%N2)培養3 d。所選抗生素及其耐藥臨界點標準為:克拉霉素1 μg/mL、左氧氟沙星2 μg/mL、阿莫西林2 μg/mL、甲硝唑8 μg/mL、呋喃唑酮2 μg/mL、鹽酸四環素 2 μg/mL[5]。本研究質控菌株為:Hp ACTC11637。(3)毒力基因分型檢測:通過細菌基因組DNA提取試劑盒(天根生化科技(北京)有限公司)對所獲得的Hp菌株進行DNA提取。通過PCR擴增,對毒力基因VacA-s和VacA-m進行擴增。具體反應體系如下::2×T5 Super PCR Mix 15 μL,正反向引物(10 μmol/L)各1μL,模板DNA 2μL,5×Enhancer buffer 6μL,ddH2O 5μL。擴增條件為:98℃預變性3 min;98℃ 30 s,退火(退火溫度56℃)10 s,72 ℃延伸10 s,PCR循環30次;最后72℃后延伸5 min。PCR產物經2%瓊脂糖凝膠電泳檢測后,送至杭州擎科梓熙生物技術有限公司進行Sanger測序。PCR反應引物由杭州擎科梓熙生物技術有限公司合成,引物序列及擴增片段長度見表1。
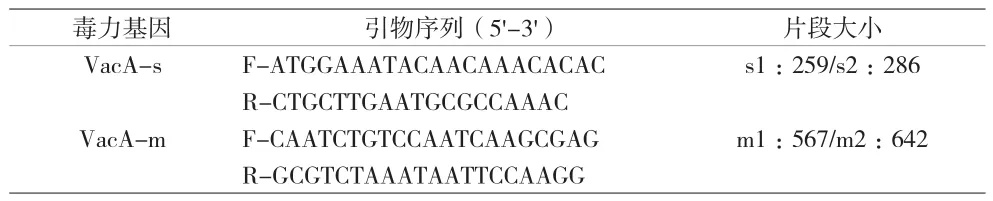
表1 Hp毒力基因VacA引物序列
1.3 統計學方法 采用SPSS22.0統計軟件。計數資料用卡方檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 Hp耐藥率 249例Hp陽性患兒對6種抗生素的耐藥率分別為:克拉霉素60.24%、左氧氟沙星42.17%、甲硝唑78.31%、阿莫西林0%、呋喃唑酮0%、鹽酸四環素0%。其中,對兩種抗生素組合耐藥66例,占比26.51%;對三種抗生素組合耐藥81例,占比32.53%。見表2。
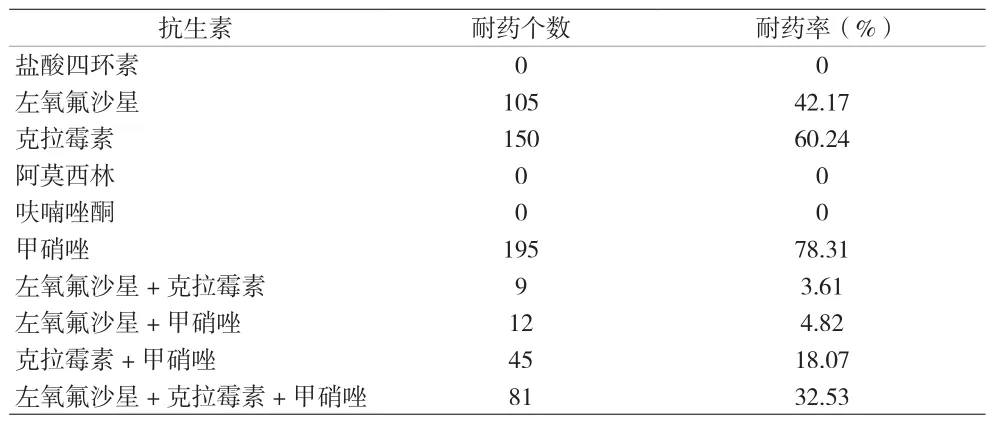
表2 兒童Hp對6種抗生素耐藥情況統計
2.2 Hp毒力基因分型結果 249例兒童Hp進行了毒力基因VacA(s1/s2、m1/m2)的檢測。VacA基因的檢出率為100%,其中VacAs1、VacAs2、VacAm1及VacAm2的檢出率分別為98.80%、1.20%(3/249)、38.55%及61.45%。VacA基因嵌合體中,基因亞型VacAs1m1占37.35%,基因亞型VacAs1m2占比最高,為61.45%,VacAs2m1為1.2%,VacAs2m2為0%。見表3。

表3 Hp毒力基因各基因型分型及其組合的檢出率統計
2.3 Hp毒力基因分型和耐藥情況的關聯性 單一耐藥和雙重耐藥型在毒力基因亞型VacAs1m1和VacAs1m2之間都表現為無差異,但三重耐藥型在毒力基因亞型VacAs1m1和VacAs1m2之間差異明顯(P<0.05)。見表4。在毒力基因亞型VacAs1m2中,單一耐藥、雙重耐藥及三重耐藥型之間無明顯差異(P>0.05)。在毒力基因亞型VacAs1m1中,單一耐藥、雙重耐藥及三重耐藥型之間差異明顯(P<0.05)。見表5。
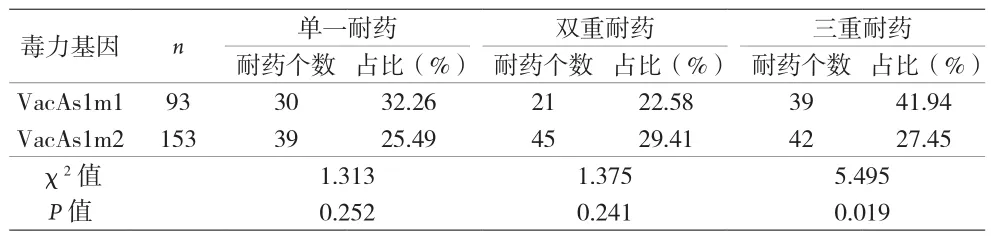
表4 不同耐藥型在毒力基因亞型VacAs1m1和VacAs1m2的關系

表5 毒力基因亞型在不同耐藥型之間的關系
3 討論
Hp是一種定植于人體胃黏膜上的革蘭氏陰性菌,可以導致兒童腸道疾病的發生[6]。兒童感染Hp后,其臨床根治效果主要受到Hp菌株耐藥和Hp毒力基因分型的影響。目前,臨床上常用于兒童感染Hp的藥物主要有克拉霉素、阿莫西林、甲硝唑等,但是隨著抗生素在食品及藥品方面的濫用,Hp耐藥現象愈發嚴重,影響兒童Hp的根除效果。本研究成功分離出249例患兒Hp陽性菌株,結果發現,克拉霉素、左氧氟沙星及甲硝唑的耐藥率分別為60.24%、42.17%及78.31%,尤其克拉霉素耐藥率普遍高于其他地區,如嘉興地區[7](克拉霉素14.81%,甲硝唑51.85%),臺州地區[8](克拉霉素20.94%,左氧氟沙星10.26%),蕭山地區[9](克拉霉素16.74%,左氧氟沙星5.02%,甲硝唑71.55%)。究其原因,可能于當地抗生素耐藥有關。經浙江省Hp監測大數據[5]分析發現,溫州地區克拉霉素耐藥率明顯高于嘉興、臺州及杭州等浙江省內地區。此外,本研究中雙重耐藥Hp菌株占比26.51%,三重耐藥Hp菌株占比達32.53%,可見本地區兒童Hp多重耐藥情況已十分嚴重,需引起足夠重視。
毒力基因VacA可通過編碼VacA蛋白釋放空泡毒素,引起細胞損傷及凋亡[10]。毒力基因VacA不同亞型中,VacAs1m1型可以產生大量毒素故而毒性最強具有高毒素活性,VacAs1m2型空泡毒性次于VacAs1m1型則具有次高毒素活性,VacAs2m2不能誘導空泡形成可視為無毒素活性[11-12]。本研究結果顯示,本地區兒童Hp感染VacA基因亞型以VacAs1m2為主(61.45%),其次為基因型 VacAs1m1(37.35%),VacAs2m1(1.20%),無毒素活性基因型VacAs2m2并未發現,與上海某三甲醫院Hp毒力研究得出的結論相一致(基因型VacAs1m1占39%,VacAs1m2占61%)[13]。不同國家、地區人群Hp菌株的VacA基因型各有不同,日本兒童[14]及中國東北地區[15]VacA基因亞型以VacAs1m1為主,美國VacAs1m1和VacAs2m2各占約50%。
目前,國內外開展較多關于Hp毒力基因分型和耐藥情況的關聯性研究[16-18]。本研究結果顯示,單一耐藥和雙重耐藥型在毒力基因亞型VacAs1m1和VacAs1m2間差異無統計學意義(P>0.05),但三重耐藥型Hp在毒力基因亞型VacAs1m1和VacAs1m2間差異有統計學意義(P<0.05)。表明毒力基因亞型VacAs1m1(高毒素活性)的Hp菌株出現對抗生素多重耐藥的幾率較大。原因可能與VacA可使Hp持續定植于胃黏膜相關[19],高毒素活性毒力基因致使Hp更易定植于胃黏膜從而加大Hp根除難度,加重多重耐藥的可能性。高毒素活性毒力基因亞型VacAs1m1中,單一耐藥、雙重耐藥及三重耐藥型間差異有統計學意義(P<0.05),三重耐藥比例明顯高于單一耐藥及雙重耐藥比例;而次高毒素活性基因亞型VacAs1m2中,三種耐藥型間無明顯差異。表明高毒素活性毒力基因型Hp菌株更容易產生多重耐藥的情況。
綜上所述,本研究地區兒童Hp毒力基因亞型以VacAs1m2為主,毒素活性相對較弱,然而Hp多重耐藥情況依然十分嚴重。本地區兒童Hp毒力基因VacA與耐藥型存在一定相關性,高毒素活性毒力基因型(VacAs1m1)Hp菌株更容易產生多重耐藥,為Hp根除提供新思路,對于本地區兒童抗生素用藥具有一定指導意義。

