中藥調控Toll樣受體4/核因子-κB通路改善非酒精性脂肪性肝炎的研究進展
田格格, 夏恩蕊, 張素妍, 張順貞, 徐福榮
云南中醫藥大學 中藥學院, 昆明 650000
非酒精性脂肪性肝炎(NASH)為非酒精性脂肪性肝病(NAFLD)的重要進程,其發病機制尚不明確,目前“多次打擊”學說正逐漸代替“二次打擊”學說,認為NASH是多重傷害共同作用的結果,包括肝脂肪堆積、營養因素、腸道微生物群和表觀遺傳因素等[1]。近年來大量研究[2]表明Toll樣受體4(toll like receptor4,TLR4)/核因子-κB(NF-κB)通路在NASH發生發展中起著重要作用,成為了現階段研究的熱點。已有研究證明中藥可通過阻斷TLR4/NF-κB通路來抑制肝臟炎癥反應,改善NASH。中醫藥治療肝病安全性高,效果好,在NASH治療中起重要作用,本文綜述了可調控TLR4/NF-κB通路改善NASH的中藥活性成分和復方,希望能為今后臨床用藥提供參考。
1 TLR4/NF-κB通路與NASH
TLR4是最早發現于TLRs(TLR1~10)家族的成員,作為先天免疫細胞上的模式識別受體(PRRs),能夠識別病原體相關分子模式(PAMPs)和損傷相關分子模式(DAMPs)從而激活宿主的免疫反應[3]。NASH患者多伴隨腸道菌群失衡以及腸道通透性增加,脂多糖(LPS)是TLR4的天然配體,腸道菌群失衡、腸道通透性增加會使LPS隨血流通過門靜脈從腸道進入肝臟,激活肝臟上的TLR4介導炎癥反應[4]。
NF-κB是由Rel家族五個亞單位RelA(p65)、RelB、cRel、p50/p105、p52/p100構成的二聚體蛋白[5]。NF-κB最常見且最主要的活性形式是由P65、P50組成的二源異聚體,正常情況下P65/P50異源二聚體處于靜息狀態且無活性,當此二聚體受到刺激被活化后進入細胞核,將介導炎癥因子的轉錄和釋放[6]。
TLR4/NF-κB是經典的炎癥通路,TLR4廣泛分布于肝臟中,此通路的過度活化可促進炎癥反應,導致肝臟脂質沉積、肝纖維化以及直接造成肝損傷。在NAFLD/NASH病程中,TLR4/NF-κB通路的相關分子,如TLR4、髓樣分化因子(MyD88)、NF-κB、IκB激酶(IKKs)、NF-κB抑制蛋白(IκB)等表達升高。研究[7]發現,在蛋氨酸-膽堿缺乏飲食和高脂飲食誘導的NASH小鼠模型中,TLR4基因敲除小鼠肝臟炎癥及肝纖維化明顯減輕。此外,TLR4基因敲除小鼠對于LPS誘導的肝損傷及炎癥反應明顯減輕[8]。NASH大鼠肝臟TLR4基因的表達與其甲基化水平呈負相關,若TLR4甲基化水平升高,TLR4基因表達量下降,NASH大鼠的肝臟炎癥反應會明顯減輕[9]。IRAK基因缺陷的小鼠可以耐受致死劑量的LPS[10]。轉化生長因子激酶(TAK)1、MyD88基因敲除小鼠肝臟炎癥和肝纖維化顯著減輕[11]。抑制IKKs和NF-κB的活化可減緩NASH的發生發展[12]。大量研究表明,抑制該通路相關分子活化或敲除該通路相關基因,NASH會得到顯著改善。
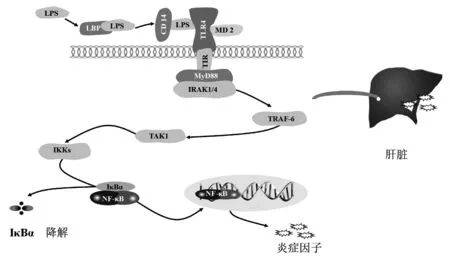
注:TRAF-6,腫瘤壞死因子相關因子。當肝臟中各類免疫細胞與非免疫細胞表面的TLR4被激活,MyD88適配子磷酸化,活化TRAF-6使得TAK1、IKKs被激活[13]。IκB在IKKs的作用下從靜息狀態下的NF-κB聚合體中分離,與IκB分離后的NF-κB進入細胞核,介導IL-6、IL-1β、TNFα等炎癥因子的基因轉錄和釋放[14]。
2 中藥活性成分調控TLR4/NF-κB通路改善NASH
2.1 黃酮類化合物 黃酮類化合物有保肝、抗炎等藥理活性。研究表明,楊梅素[15]、槲皮素[16]、黃芩苷[17]、胡桃苷[18]、銀杏黃酮[19]、豹皮樟總黃酮[20]干預能改善不同飲食誘導的脂肪肝動物的高血脂、肝功能受損情況,并減少肝臟脂質沉積和炎性浸潤,下調TLR4/NF-κB通路相關分子以及下游炎癥因子水平。細胞實驗顯示楊梅素能顯著下調LPS干預后RAW264.7細胞中p-NF-κB/NF-κB、p-IκBα/IκBα比值,抑制RAW264.7細胞M1極化。提示上述黃酮類化合物可通過調控TLR4/NF-κB通路,改善NASH。
2.2 萜類化合物 萜類化合物有抗炎、降脂等作用。研究發現白果內酯[21]、青蒿琥酯[22-23]、黃芪甲苷[24]、絞股藍總苷[25]干預可改善高脂飲食誘導的脂肪肝動物肝臟脂肪變性和炎性浸潤,降低血脂,改善肝功能,下調TLR4/NF-κB通路相關分子以及下游炎癥因子水平。絞股藍總苷能通過抑制TLR4/NF-κB通路改善游離脂肪酸誘導的THLE-2細胞脂肪變性。提示上述萜類化合物可通過調控TLR4/NF-κB通路,改善NASH。
2.3 醌類化合物 醌類化合物具有保肝、抗炎、抗肝纖維化等作用。研究表明,紫草素[26]、決明子蒽醌苷[27]、大黃酸[28]能改善不同飲食誘導的脂肪肝實驗動物的高血脂、肝損傷,減少肝臟脂質沉積和炎性浸潤,下調TLR4/NF-κB通路相關分子以及下游炎癥因子水平。提示上述醌類化合物可通過調控TLR4/NF-κB通路,改善NASH。
2.4 生物堿類化合物 生物堿有保肝、抗炎、降血脂等作用。小檗堿可減輕脂肪肝大鼠肝損傷,降低血脂,減少肝臟脂肪變性和炎性浸潤,抑制原代肝細胞NF-κB的活化[29]。有研究表明,槐果堿可防治NASH[30],油酸可誘導大鼠原代肝細胞脂肪變性,槐果堿干預可顯著改善油酸誘導的肝細胞脂肪變性,抑制TLR4/NF-κB通路,降低下游炎癥因子IL-6、TNFα水平[31]。提示上述生物堿類化合物可通過調控TLR4/NF-κB通路來減輕肝臟炎癥反應和脂肪變性。
2.5 多酚類化合物 多酚類化合物有保肝、降血脂、抗炎等作用。有研究表明姜黃素單獨或聯合用藥能夠改善NAFLD,通過TLR4/NF-κB通路調節機體免疫。姜黃素[32]、二苯乙烯苷[33]干預高脂飲食誘導的脂肪肝實驗動物,可上調腸道緊密連接蛋白ZO-1、occludin表達,改善腸屏障功能及肝功能,降低血脂,下調TLR4/NF-κB通路相關分子以及下游炎癥因子水平,此外,二苯乙烯苷還能調節腸道微生物平衡。提示上述多酚類化合物能夠通過改善腸屏障功能,調節肝臟TLR4/NF-κB通路來緩解肝臟炎癥。
2.6 多糖類化合物 多糖類化合物有保肝、抗氧化、免疫調節等作用。有研究表明枸杞多糖可改善NASH。枸杞多糖[34]、狗肝菜多糖[19]可改善肝炎大鼠肝功能,減少大鼠肝臟脂肪變性及炎性浸潤,下調TLR4/NF-κB通路相關分子以及下游炎癥因子水平,枸杞多糖干預還能降低大鼠血脂。提示上述多糖類化合物可通過調控TLR4/NF-κB通路,改善大鼠肝臟炎癥和脂肪沉積。
2.7 其他化合物 濱蒿內酯是從中藥茵陳蒿中分離出來的一種香豆素類化合物,具有抗炎、降血脂等作用。砂仁揮發油是砂仁中主要的化學成分,有抗炎、抗血小板凝聚等作用。丹參具有改善微循環、抗凝血等藥理作用。研究[35]發現濱蒿內酯能下調NASH小鼠肝臟TLR4/NF-κB通路相關分子的表達進而改善NASH,細胞實驗顯示濱蒿內酯能通過抑制TLR4/NF-κB通路阻止LPS誘導巨噬細胞向M1型極化。砂仁揮發油可通過調節腸道菌群,改善腸屏障功能,抑制肝臟TLR4/NF-κB通路,對高脂飲食誘導的脂肪肝大鼠起肝臟保護作用[36]。丹參提取物能上調NASH小鼠腸道ZO-1、Occludin、Claudin-1蛋白水平,阻斷脂多糖釋放,抑制小鼠肝臟TLR4/NF-κB通路相關分子蛋白表達,降低炎癥因子水平,改善NASH[37](表1)。
3 中藥復方調控TLR4/NF-κB通路改善NASH
中醫根據NAFLD的癥狀及體征,將其病因、病機歸于“脅痛”“痞滿”“積聚”等,NAFLD的中醫證型主要為肝郁脾虛證、濕熱蘊結證、痰濕內阻證、痰瘀互結證、肝郁氣滯證[38]。中藥復方在中醫理論的指導下通過疏肝健脾、健脾益氣、化痰祛濕、清熱利濕、活血化瘀、補益肝腎等治則治療NAFLD[39]。NAFLD的中醫證型以肝郁脾虛證比重最大,本病在肝,但與脾密不可分,故臨床多以疏肝健脾為治則治療NASH[40]。中醫“脾”包括大腸、小腸,中醫肝脾之間的關系與現代“腸肝軸”理論相似,TLR4/NF-κB通路是“腸肝軸”的重要內容[41],即腸道微生態失衡,腸屏障受損,有害物質通過受損的腸屏障進入肝臟激活該通路,推動NASH的發生發展。
總結文獻過程中發現,表2所示的中藥復方均可通過調控TLR4/NF-κB通路改善不同飲食誘導的實驗動物肝臟脂肪變性和炎性病變,且都有健脾的功效。大柴胡湯的拆方柴胡、黃芩、白芍水煎劑還能改善腸道屏障功能,降低血漿內毒素水平。提示有健脾功效的中藥復方可能通過TLR4/NF-κB通路改善NASH。
4 小結與展望
綜上所述,TLR4/NF-κB通路是中藥治療NASH的途徑和靶點之一,部分黃酮類、萜類、醌類、生物堿類、多酚類、多糖類和其他類型的化合物以及部分有健脾功效的中藥復方可通過調控TLR4/NF-κB通路減輕肝臟炎癥反應,對NASH起到治療作用。中藥治療NASH有其特有的優勢,NASH的發生是“多重打擊”的結果,因此NASH患者常伴隨腸道菌群紊亂、腸通透性增加,上述部分中藥活性成分及復方能夠調節腸道菌群、改善腸屏障功能。中藥及中藥復方作用多途徑、多靶點,可在中醫整體觀、辨證論治觀的指導下對本病產生更有效、更全面的治療效果。對中藥單味藥、提取物、單體的研究,能夠進一步明確藥物作用的成分及機制。在今后的臨床治療中,可以從TLR4/NF-κB通路著手,發掘能有效抑制該通路的藥物,更有效地治療NASH,但目前對TLR4/NF-κB通路的研究還處于基礎階段,需要更加深入的研究。此外,中藥成分復雜,應當加強對中藥活性成分及其作用機制的研究,合理配伍用藥,豐富中藥臨床用藥的理論基礎。

表1 中藥活性成分調控TLR4/NF-κB通路改善NASH

表2 中藥復方調控TLR4/NF-κB通路改善NASH
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:田格格負責擬定思路,撰寫、修改論文;夏恩蕊、張素妍負責參與文獻收集及分析;張順貞負責指導撰寫、修改論文并最后定稿;徐福榮負責指導撰寫,修改論文。

