基于氧化應激探討中藥活性成分防治非酒精性脂肪性肝病的研究進展
周 靜, 張德新
湖北中醫藥大學 檢驗學院, 武漢 430065
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)受基因、代謝、環境和腸道菌群的影響,是一種多病因參與的代謝性疾病,包括非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)以及NASH相關肝硬化及其肝細胞癌[1]。研究[2]報道,到2030年NAFLD總人數預計將增長18.3%,達到1.009億,患病率為28.4%。氧化應激在NAFLD進展中扮演著重要角色,可激活多種轉錄因子,包括活化核因子κB(NF-κB)、激活蛋白1、p53、缺氧誘導因子1α、過氧化物酶體增殖物激活受體γ(PPARγ),β-catenin/Wnt和核因子E2相關因子2(Nrf2)等,導致多種基因表達[3]。這促進肝星狀細胞、巨噬細胞、Kupffer細胞活化,加重NAFLD的炎癥、纖維化和凋亡[4]。目前,尚無批準用于NAFLD的藥物治療方案[5]。研究[6]表明,中藥在抗氧化應激防治NAFLD方面取得了一定成果。本文就近年來從氧化應激途徑對中藥活性成分抗NAFLD的研究進展進行闡述,以了解氧化應激在NAFLD的作用機制以及中藥活性成分抗氧化應激機理,為預防和控制NAFLD提供科學依據。
1 基于氧化應激對NAFLD的機制探討
氧化應激由體內自由基、反應性代謝產物如活性氧(ROS)/活性氮(RNS)產生以及抗氧化保護機制之間失衡導致,偏向于氧化[3]。多項研究表明線粒體功能紊亂[7]、細胞色素P450酶2E1(CYP2E1)活性升高[8]、內質網應激[9]、氧化酶家族上調[10]、鐵超載[11]引起的氧化應激與NAFLD有關。
1.1 線粒體功能紊亂 Sim?es等[7]發現線粒體功能障礙、ROS過度生成、氧化應激損傷等相互作用會促進NAFLD的發生和發展。ROS主要來源于線粒體電子傳遞鏈,從而導致線粒體功能障礙,最終使得NAFLD發展的機制主要有:(1)飲食攝入或胰島素抵抗,線粒體脂肪酸β氧化增加,使電子傳遞鏈中電子通量增加,電子傳遞鏈產生的電子不通過細胞色素C而直接與氧反應,使ROS增加[12],導致線粒體DNA和蛋白亞基受損,進而增加氧化應激和對線粒體的氧化損傷,以此惡性循環[13];(2)ROS也易氧化線粒體膜磷脂成分,如多不飽和脂肪酸使丙二醛 (malondialdehyde,MDA)和4-羥基壬烯醛(4-hydroxynonenal, 4-HNE)水平升高[14],從而抑制細胞色素C氧化酶,誘導解偶聯蛋白2,最終導致線粒體功能異常[15];(3)轉錄共激活因子過氧化物酶體增殖物激活受體γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC1α)表達減少,可能導致抗氧化失活[16]。
1.2 CYP2E1活性升高 NAFLD中ROS的另一個主要來源是CYP2E1,它是微粒體氧化系統的一種主要酶,可由乙醇、酮體、游離脂肪酸等誘導[17]。CYP2E1在催化生物轉化過程中會產生ROS,誘導脂質過氧化,產生MDA、4-HNE等活性醛類物質,ROS還可以攻擊核酸和蛋白質,誘導線粒體膜通透性,損害線粒體呼吸鏈關鍵酶,進一步增加電子泄漏和ROS的形成,引起嚴重的氧化應激、線粒體功能障礙和細胞死亡[18]。Diesinger等[19]發現作為CYP2E1活性位點的競爭性抑制劑,ω-咪唑烷基衍生物 Ⅰ-ol和 Ⅰ-An部分呈劑量依賴性緩解NAFLD小鼠模型氧化應激,可能成為治療NAFLD的一種新途徑。
1.3 內質網應激 脂質過載也會引起內質網應激,主要通過激活未折疊蛋白反應途徑[20]。未折疊蛋白反應通過激活特定下游信號通路使得ROS生成增加,還可通過需要肌醇的信號蛋白1(inositol-requiring signaling protein 1,IRE1)途徑激活c-Jun氨基末端激酶(JNK),誘發炎癥反應使ROS升高,而IRE1可抑制胰島素受體底物活性,加重胰島素抵抗[21]。飽和脂肪酸也會誘導內質網鈣儲存的破壞,這可以通過形成細胞色素C的通透性轉換孔作用于線粒體,從而增加ROS和誘導細胞凋亡[22]。Xu等[23]發現miR-26a過表達可降低衣霉素或毒胡蘿卜素處理的NAFLD模型細胞磷酸化真核翻譯起始因子2亞基α(p-eIF2α)、IRE1α和C/EBP 同源蛋白(CHOP)表達,與高脂飲食喂養的野生型(WT)小鼠相比,肝臟特異性miR-26a轉基因小鼠中p-eIF2α、磷酸化PEK內質網激酶、結合免疫球蛋白、CHOP和蛋白質二硫鍵異構酶降低,表明miR-26a缺乏加重內質網應激和NAFLD進展。
1.4 氧化酶家族上調 尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH oxidase,NOX)在許多病理條件下都是ROS的主要來源,其中肝臟主要的活性氧產生氧化酶NOX1、NOX2(主要產超氧化物)和NOX4(主要產H2O2)[10]。且CYP2E1可以增強NOX活性,促進ROS形成[14]。也有研究[24]發現NASH患者NOX2顯著上調,攝入黑巧克力(含可可多酚)2周會降低NASH患者血清可溶性NOX2衍生肽、異前列腺素和細胞角蛋白18水平,表明NOX2可能是對抗NASH的一個靶點。
1.5 鐵超載 鐵是生物必須的微量營養素,一旦鐵過量,常蓄積在肝臟、心臟、內分泌器官等。通過Fenton反應產生ROS,引起臟器或組織的損傷,而肝臟鐵超載可能有助于大泡性脂肪變性的初始發展和進展為NASH[25]。在約1/3的NAFLD患者中發現了肝臟的鐵蓄積[11]。鐵沉積于網狀內皮系統(RES)對肝臟以及心血管致命和非致命事件的綜合原因特異性危險比(csHR)為2.4(95%CI:1.0~5.8,P=0.048)和3.2( 95%CI:1.2~8.2,P=0.015),肝細胞/網狀內皮系統(HC/RES)混合鐵沉積模式csHR更高,為3.6(95%CI:1.4~9.5,P=0.010)。表明RES與不良結局相關,會增加總體死亡率和肝臟相關或心血管事件的風險[26]。分析其原因,RES鐵沉積更可能是全身和肝臟炎癥機制的指標,從而推動NAFLD的發展。
2 中藥活性成分抗NAFLD氧化應激作用
近年來多種中藥活性成分被證明具有改善NAFLD的作用,主要包括黃酮類、多糖類、多酚類、生物堿類、三萜類、苷類等,多種中藥活性成分不僅有抗炎、抑菌、降脂、抗癌、免疫調節等作用,還具有抗氧化的作用。下文將各中藥活性成分對NAFLD抗氧化作用進行闡述,為后續中藥防治NAFLD提供參考。
2.1 黃酮類 Zhong等[27]發現黃芩苷給藥組能顯著降低高脂肪高膽固醇飲食(HFC)誘導的NAFLD小鼠體內的MDA、4-HNE、8-羥基脫氧鳥苷(8-OhdG)水平,明顯增加谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)水平,黃芩苷抗氧化應激作用可能與同時抑制CYP2E1和JNK的活化有關。Ou等[28]發現水飛薊賓治療可明顯減輕蛋氨酸及膽堿缺乏飲食(MCD)誘導的NASH小鼠模型的肝脂肪變性,降低模型組CYP2E1和4-HNE的組織水平,提高SOD水平,水飛薊賓在這項研究中顯示出抗氧化作用,與上調依賴于Nrf2的抗氧化劑基因谷氨酰半胱氨酸連接酶調節亞基(GCLM),谷氨酸半胱氨酸連接酶催化亞基(GCLC),醌氧化還原酶1(NQO1),血紅素加氧酶1(HMOX1)和谷胱苷肽S轉移酶M1(GSTM1)有關,表明水飛薊賓可能充當新型Nrf2誘導劑。劉皎皎等[29]利用高脂飲食喂養雄性SD大鼠建立NAFLD模型,發現虎杖苷以劑量依賴方式提高大鼠肝臟SOD和GST水平,降低MDA水平,提示虎杖苷具有明顯的抗氧化作用,能有效抑制NAFLD大鼠模型肝臟脂質過氧化。Porras等[30]發現槲皮素不僅能調節脂質代謝基因表達、降低CYP2E1的過度表達,還能逆轉腸道微生物失調、抑制內毒素血癥介導的TLR-4-NF-κB的炎癥反應、降低內質網應激標志物葡萄糖調節蛋白78(GRP78)、CHOP表達。
2.2 多糖類 黃芪多糖能改善高脂飲食誘導的NAFLD小鼠模型肝損傷,降低MDA,提高血清總SOD活性,護肝作用優于辛伐他汀組,具有抗氧化性[31]。舒濤等[32]發現玉米須多糖能夠明顯降低高脂飲食誘導的NAFLD大鼠體質量、TG、TC和ROS水平,能顯著升高miR-146a且下調NOX4的表達水平從而緩解肝臟脂肪累積以及氧化應激損傷,表明玉米須多糖對NAFLD大鼠的保護作用與調控miR-146a/NOX4/ROS通路有關。Li等[33]發現靈芝多糖可顯著降低T2DM合并NAFLD小鼠的體質量、MDA和TNFα水平,增加SOD、過氧化氫酶(catalase,CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)和Nrf2及下游靶基因HO-1的蛋白表達,表明靈芝多糖通過調節Nrf2/HO-1信號通路,以減輕模型小鼠肝臟脂肪變性、氧化應激和炎癥反應。郭怡瓊等[34]發現枸杞多糖能夠降低高脂飲食誘導的NAFLD大鼠的TG、TC、MDA水平,升高HDL、SOD水平,枸杞多糖改善NAFLD大鼠肝臟脂肪變性和降低氧化應激損傷與上調PGC1α有關。
2.3 酚類 Gheibi等[35]通過檢測NAFLD模型大鼠血清TG、HDL、LDL以及肝臟MDA、SOD、GSH-Px、總抗氧化劑能力(total antioxidant capacity,TAC)、NO水平,發現與未治療組相比,姜黃素和去氧膽酸均可顯著降低血清NO、TAC和GSH-Px、SOD的水平,共同給藥組降低更加明顯,表明姜黃素單用和聯合去氧膽酸均能降低NAFLD肝臟脂肪變性,提高抗氧化能力,聯合使用效果更佳。也有學者[36]比較洛伐他汀,姜黃素、小檗堿在治療NAFLD中的作用,發現姜黃素、小檗堿均能降低模型小鼠的TG、TC、LDL、MDA水平,提高HDL、GSH-Px水平,且姜黃素聯用小檗堿對改善NAFLD大鼠氧化應激效果優于洛伐他汀。白藜蘆醇(10和20 μmol/L)可以降低HepG2細胞的脂肪變性,通過線粒體膜電位和染色發現,白藜蘆醇顯著降低了游離脂肪酸混合物處理HepG2細胞的氧化應激[37]。Xia等[38]發現綠茶多酚(200 mg/kg)干預能顯著降低高脂飲食誘導NAFLD大鼠模型的空腹血糖、胰島素抵抗、肝臟脂肪以及TNFα、IL-6、MDA水平。相比之下,肝臟中的SOD升高。綜上,多酚類具有強大的抗氧化能力。
2.4 生物堿類 小檗堿干預降低了高脂飲食誘導的NAFLD小鼠血清TG、TC和LDL水平,增加了HDL水平,能逆轉模型小鼠SIRT3的下調并降低長鏈酰基輔酶A脫氫酶(LCAD)脫乙酰化,將SIRT3敲除后,小檗堿這種有益作用顯著減弱,進一步證明小檗堿通過激活 SIRT3 促進LCAD脫乙酰化來促進線粒體β氧化[39]。丁靜等[40]研究發現鹽酸小檗堿能夠降低ROS、MDA表達,通過促進NRf2核轉位和NRf2 mRNA表達而對NAFLD小鼠模型肝臟發揮保護作用。Chen等[41]發現川芎嗪可降低高脂飲食誘導的NAFLD小鼠模型MDA和ROS水平,提高GSHpX活性,辛伐他汀組提高了SOD和GSH-pX水平,MDA未增高,川芎嗪與辛伐他汀組都能通過抑制TNFα/(p-NF-κB)/ ROS信號通路而發揮對NAFLD小鼠肝臟的保護作用。費雯婕等[42]發現氧化苦參堿干預組與二甲雙胍組均能顯著降低NAFLD細胞模型MDA和ROS生成,提高了總SOD、GSH-Px活性,表明氧化苦參堿能提高HepG2細胞的抗氧化能力,減少氧化應激損傷。另有學者[43]發現,荷葉堿治療能使高脂飲食誘導的NAFLD大鼠模型肝臟中的SOD和GSH-Px的活性以及磷脂酰膽堿和1-酰基甘油磷酸膽堿的水平增加,而降低MDA水平和CYP2E1、CYP3A4和脂肪酸去飽和酶2的表達,表明荷葉堿抗氧化機制可能與抑制肝臟中CYP酶的表達有關,從而改善NAFLD大鼠的氧化應激反應,緩解肝臟脂肪變性。
2.5 三萜類 Cheng等[44]用人參皂苷Rg2處理油酸與棕櫚酸誘導的原代肝細胞NAFLD模型后,可有效抑制ROS過量生成,促進抗氧化基因包括GCLC、GCLM、Kelch 樣環氧氯丙烷相關蛋白-1(Keap1)、HOMX1、和 Nrf2表達,表明人參皂苷Rg2能糾正原代肝細胞的氧化還原失衡,可能與激活SIRT1有關。另一研究[45]表明人參皂苷Rg1預防氧化應激的作用可能是通過PPARα減少脂質過氧化,同時降低該NAFLD模型小鼠肝臟中GPR78、CHOP和Caspase- 12的表達來減輕肝臟內質網應激。人參皂苷Rg1亦可上調PPARα轉錄水平,進而靶向改善脂肪代謝[46]。Yang等[47]通過體內外實驗發現高脂誘導可明顯促進NAFLD小鼠模型鐵的積累,表現為轉鐵蛋白受體1的上調和鐵蛋白重鏈1的下調,銀杏內酯B能顯著降低NAFLD細胞和動物模型的TG、TC、MDA、游離脂肪酸、Fe2+、ROS水平,升高SOD、GSH-Px ,其減輕NAFLD模型的氧化應激水平和鐵超載的機制與激活Nrf2通路有關。黃強等[48]用不同劑量積雪草苷干預NAFLD模型大鼠,結果發現各劑量組以不同程度降低模型小鼠的TG、TC水平以及CYP2E1的表達,其中高劑量組(45 mg/kg)能顯著降低MDA水平,提高SOD活性,表明積雪草苷對NAFLD具有一定的抗氧化作用,其減輕肝臟脂質過氧化作用機制可能與抑制CYP2E1信號通路有關。
2.6 苷類 Shen等[49]通過體內體外實驗誘導NAFLD模型,用梔子苷干預后,能顯著降低大鼠模型TG、TC、LDL、VLDL水平,提高HDL、SOD水平,梔子苷改善NAFLD大鼠和HepG2細胞脂肪變性,抑制氧化應激損傷的機制與Nrf2通路有關。Ma等[50]發現芍藥苷治療降低了NAFLD大鼠模型肝臟脂肪變性,提高了小鼠模型肝臟和血清的SOD活性,降低了MDA、ROS產生并抑制肝臟中CYP2E1的表達,芍藥苷預防氧化應激的潛在作用可能與減少自由基產生或增加自由基清除活性有關。許瓊梅等[51]發現龍膽苦苷治療組能降低NAFLD模型大鼠的血清TG、TC、LDL水平,提高HDL,改善大鼠肝臟的脂肪變性,同時龍膽苦苷治療組SOD、GSH-Px升高,MDA降低,其抗氧化應激作用與增強p-AMPK、Nrf2蛋白水平有關。各中藥活性成分對NAFLD的抗氧化作用總結如表1。
3 小結與展望
NAFLD所涉及的病理機制復雜,而氧化應激是NAFLD發病過程中的重要部分,因此抗氧化應激損傷成為治療NAFLD的關鍵。中藥抗氧化應激作用以防治NAFLD的機制主要有改善肝臟脂肪變性,提高抗氧化相關基因表達水平,增強抗氧化酶活性,降低脂質過氧化。但目前研究多集中于細胞和動物階段,檢測指標以TG、TC、SOD、MDA為主,研究指標相對單一,且缺少臨床試驗研究,另外,不同中藥活性成分配伍研究較少。因此,探索特異性指標,從多角度、多條信號轉導途徑深入研究中藥活性成分抗氧化應激的作用機制,組合不同中藥活性成分復方,可為預防和治療NAFLD提供科學依據。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:周靜負責查找文獻,分析資料,撰寫論文初稿;張德新負責擬定寫作思路,指導撰寫文章并最后定稿。
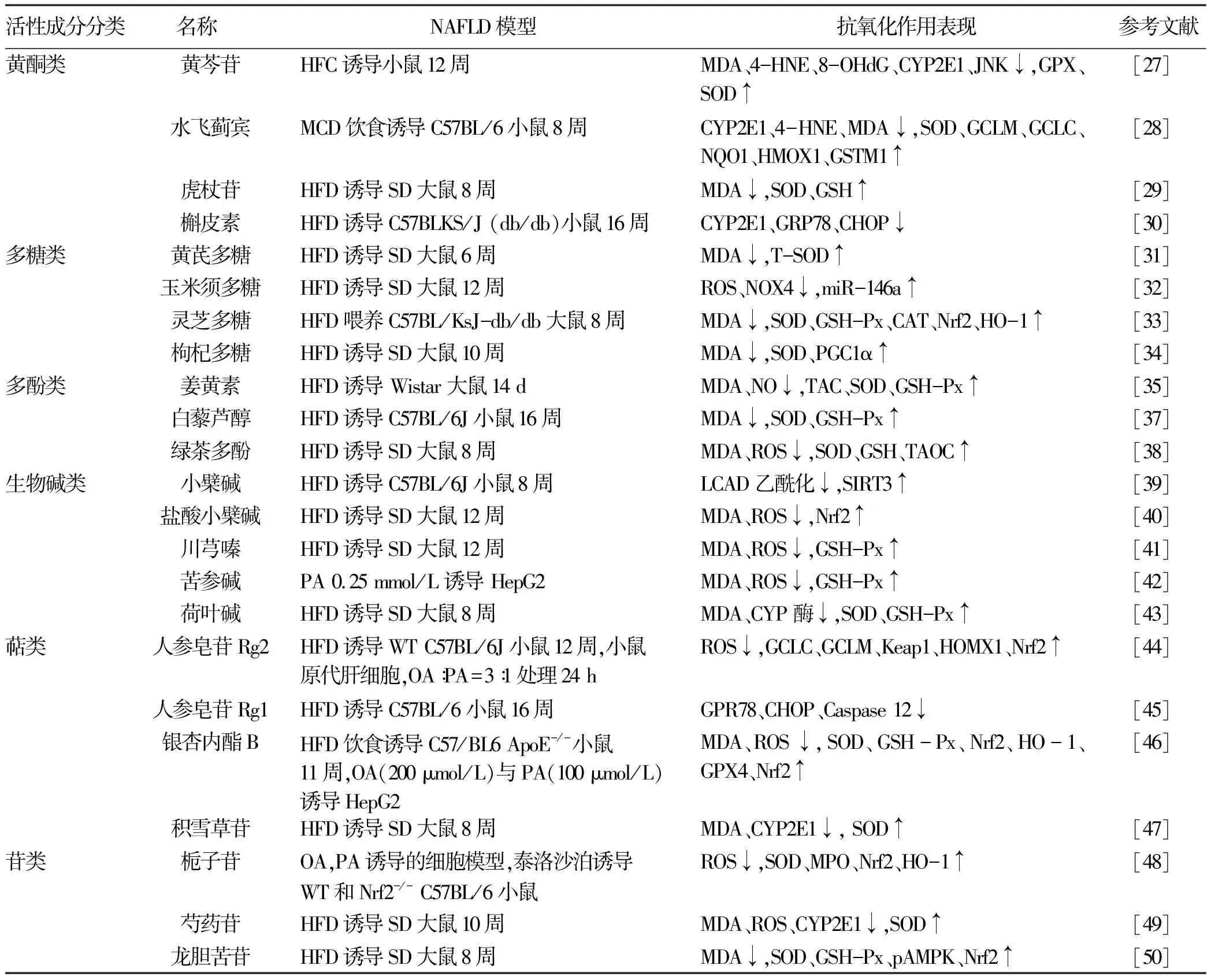
表1 中藥活性成分對NAFLD的抗氧化作用

