氫氘交換用于古代皮革膠原蛋白微觀結構的研究
龔德才,李 政,王紫璇,魏莎妮,陳柳杏,張 楊,
(1.中國科學技術大學,安徽合肥 230026;2.荊州文物保護中心,湖北荊州 434020)
0 引 言
皮革是一種天然高分子材料,受溫度、濕度、光等環境因素影響,其主要成分膠原蛋白容易發生氧化和水解,分子的空間結構被破壞,從而導致皮革物理化學性質改變。古代皮革在墓葬復雜埋藏環境的長期影響下,微觀結構發生了巨大變化,物理機械性能降低。因此,研究膠原蛋白的微觀結構對于了解古代皮革的劣化具有非常重要的意義。
膠原蛋白具有完整的四級空間結構[1]:一級結構是指多肽鏈中氨基酸的排序,其基本順序是Gly-X-Y,通常X為脯氨酸(Pro),Y為羥脯氨酸(Hyp),其結構式如圖1所示;二級結構是指肽鏈主鏈的局部空間結構,主要表現形式有α螺旋、β折疊和無規卷曲。三級結構是指多肽鏈中各種二級結構進一步折疊盤曲形成的一定規律三維空間結構。四級結構是指亞基之間通過非共價鍵結合形成的聚合體結構。三股螺旋結構是膠原蛋白特有的結構形式[2],氫鍵是維持膠原分子螺旋結構穩定性的主要作用力[3]。古代皮革發生劣化,維系膠原蛋白結構穩定的氫鍵斷裂,螺旋結構解螺旋,可以通過施加外界擾動的方式來獲取膠原蛋白結構信息。
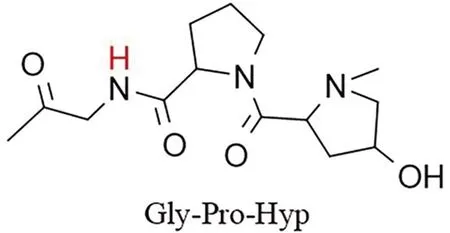
圖1 膠原蛋白多肽鏈主要序列Gly-Pro-Hyp結構式
氫氘交換即氘代,是一種很好的擾動方式。因氫氘交換速率與蛋白質結構密切相關,其常被用于蛋白質的結構研究。氫氘交換往往與其他分析技術相結合來發揮作用,如質譜、核磁共振等。早在20世紀50年代Linderstr?m-Lang等就認識到了蛋白質中氫原子和重水中氘原子的交換現象[4],并通過氫氘交換反應來研究蛋白質結構。此后,氫氘交換逐漸被應用于蛋白質的結構研究。鑒于氫氘原子質量數之間存在的差異,氫氘交換質譜法在蛋白質研究中得到了廣泛的應用,包括對蛋白質構象[5]、蛋白質的結構和動力學[6]、蛋白質折疊[7]等方面的研究。隨著核磁共振技術的不斷發展,其也與氫氘交換反應相結合,用于蛋白質結構研究中[8]。氫氘交換反應已用于一些膜蛋白[9]、無序蛋白[10]等蛋白質的結構研究中,但其用于古代皮革膠原蛋白的結構研究卻未見報道。
將蛋白質浸入重水溶液中,不穩定的氫原子會與氘原子發生交換[11]。不穩定的氫原子包括蛋白分子主鏈酰胺鍵中氨基的氫原子和與側鏈上氧原子、氮原子、硫原子相連的氫,而那些與碳原子結合的氫不會發生交換。在組成膠原蛋白的18種氨基酸中,蘇氨酸、酪氨酸等氨基酸側鏈雖然含有與氧原子相連且可被置換的氫原子,但其數量在膠原肽鏈中所占比例太小,故只考慮主鏈氨基的氫氘交換。甘氨酸、脯氨酸和羥脯氨酸殘基含量很高,但脯氨酸與羥脯氨酸為環狀亞氨基酸,其相應殘基中沒有可被氘原子置換的主鏈酰胺氫。甘氨酸所占比例最高且可以提供酰胺氫,因此在膠原蛋白中,甘氨酸的主鏈酰胺氫(圖1中紅色的氫原子)成為了氫氘交換反應的主要對象。
氫氘交換速率受多種因素影響,包括溫度[12]、pH[13]、氫鍵和溶劑可及性[14]。在相同的溫度、溶液pH條件下,主鏈氨基氫原子氫氘交換的速率主要取決于氫鍵和溶劑可及性。暴露在外側、與溶液密切接觸且未形成氫鍵的主鏈氨基氫原子交換速率快,那些參與形成氫鍵或者處于蛋白內部的殘基區域的氫原子的氫氘交換速率就非常緩慢[15]。故在相同外界條件下,在一定時間內不同蛋白質發生氘代程度的不同取決于氫氘交換速率的不同,反映了蛋白質結構的差異。
本研究利用氫氘交換技術(HDX)結合傅里葉紅外光譜技術(FTIR),對現代皮革、人工老化皮革和古代皮革的微觀結構進行了研究,通過膠原蛋白特征吸收峰的位置以及氘代率來評估古代皮革的劣化程度,探究古代皮革在劣化過程中膠原蛋白微觀結構發生的變化。
1 材料與方法
1.1 實驗材料
現代皮革樣品(New leather)為市售植鞣牛皮革。人工老化皮革樣品(Aged leather)為自制。古代皮革樣品(編號Old1)為戰國時期(公元前475年—前221年)皮革制品,出土于荊門郭家崗M1號戰國墓,由荊門博物館提供。古代皮革樣品(編號Old2和Old3)為戰國時期皮革制品,出土于荊州夏家臺M258號戰國墓,由荊州博物館提供。
氫氧化鈉,分析純,國藥集團化學試劑有限公司。氫氧化鈣,分析純,天津市光復精細化工研究所。硫酸銨,分析純,生工生物工程(上海)股份有限公司。重水,分析純,青島騰龍微波科技有限公司。
1.2 樣品制備
人工老化皮革樣品是由現代皮革樣品經老化處理而成,具體老化方法參照Sebestyén等[16]所使用的人工皮革樣品老化方法。先將現代皮革裁剪成4 cm×4 cm大小樣品,浸泡在質量分數為4%的Ca(OH)2和0.5%的NaOH混合溶液中,溫度25 ℃,2 d后取出,用1%濃度硫酸銨溶液漂洗,然后浸泡在去離子水中直至pH值為中性,最后將樣品放入120 ℃烘箱4 d后取出,放置溫度20 ℃、濕度55%的恒溫恒濕箱中,1 d后取出備用。
1.3 氫氘交換反應
將少量現代皮革、人工老化皮革以及古代皮革樣品分別放入離心管中,加入2 mL氘水使樣品完全浸入。所有樣品在25 ℃恒溫水浴鍋中放置20 d。相同條件下用蒸餾水分別處理各個樣品作為水浴對照樣。所有樣品在恒溫恒濕條件保存直到測試。
值得注意的是,實驗條件的選擇對實驗結果很重要。隨著溫度的降低,分子動能和擴散速度變小,氫氘交換速率會減緩。研究[17]表明,當溫度從25 ℃降低至0 ℃,氫氘交換速率會降低約14倍;故選取25 ℃作為氘代反應溫度。在一些可溶的氘代有機物的制備過程中,為使體系中氘代盡量完全,其氘代反應時間設為一周[18]。膠原蛋白與其他蛋白質不同,其特征氨基酸脯氨酸與羥脯氨酸為環狀亞氨基酸,且占有較高的比例。這兩種氨基酸在肽鏈中無法提供可被氘原子置換的酰胺氫,一定程度上降低了膠原蛋白對氘代反應的敏感性。綜合以上分析,為盡可能使樣品氘代完全,將氘代反應時間設置為20 d。
1.4 傅里葉變換紅外光譜分析(FTIR)
取少量樣品在紅外燈下烘烤干燥后用研缽磨碎,采用溴化鉀壓片法對皮革樣品進行分析測試。利用美國Nicolet公司生產的Nicolet 8700傅里葉變換紅外光譜儀,數據采集參數分辨率為4 cm-1,掃描次數為32次,掃描范圍為4 000~1 000 cm-1。自動進行水氣校正、平滑。使用Origin軟件對紅外譜圖進行處理,對膠原蛋白酰胺A帶進行高斯函數擬合分峰。
2 結果與討論
2.1 紅外光譜譜圖分析
圖2為現代皮革樣品與其水浴對照樣品的紅外光譜圖,可以看出,兩者膠原蛋白的特征吸收峰酰胺A帶、酰胺B帶、酰胺Ⅰ帶、酰胺Ⅱ帶、酰胺Ⅲ帶峰位基本一致。人工老化皮革和古代皮革的水浴對照樣的特征吸收峰峰位也未發生變化,說明在此實驗條件下蒸餾水處理沒有對膠原蛋白結構產生影響,相應特征吸收峰的位置不會改變。在本實驗中氫氘交換是膠原蛋白酰胺A帶特征吸收峰波數發生位移的唯一原因。
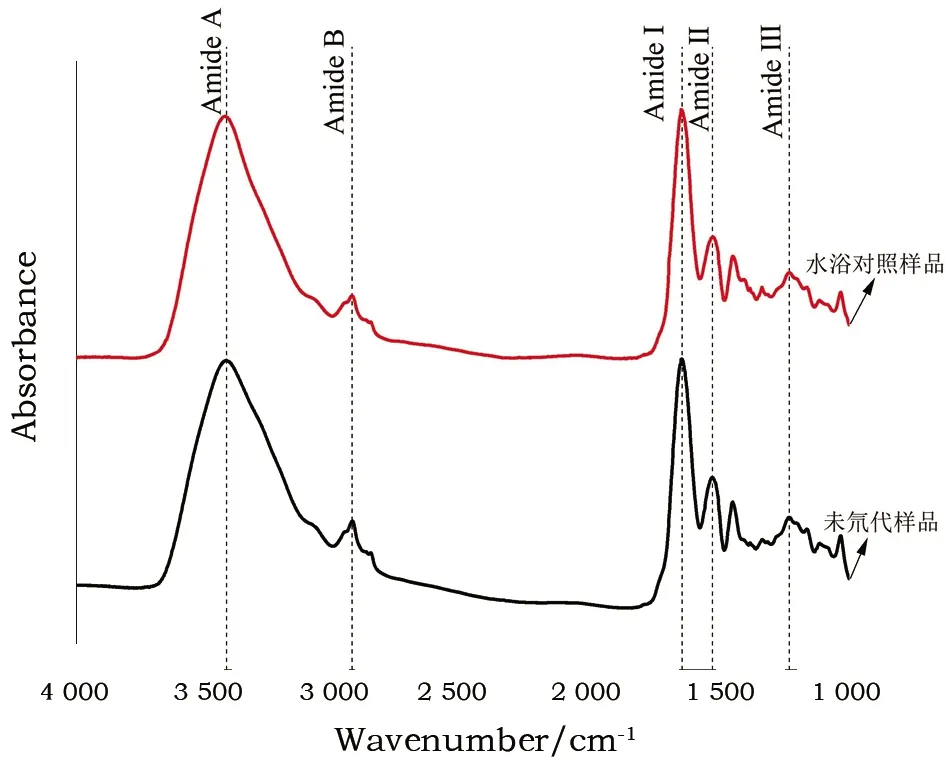
圖2 現代皮革樣品與其水浴對照樣品傅里葉變換紅外光譜
膠原蛋白酰胺A帶吸收峰位于3 424~3 320 cm-1,主要與N-H伸縮振動有關[19]。圖3為現代皮革與人工老化皮革氘代前后膠原蛋白酰胺A帶紅外光譜圖。N-H伸縮振動可視為質量為μ的質點做簡諧振動,振動吸收波數用雙原子分子振動方程計算[20]見式(1)。
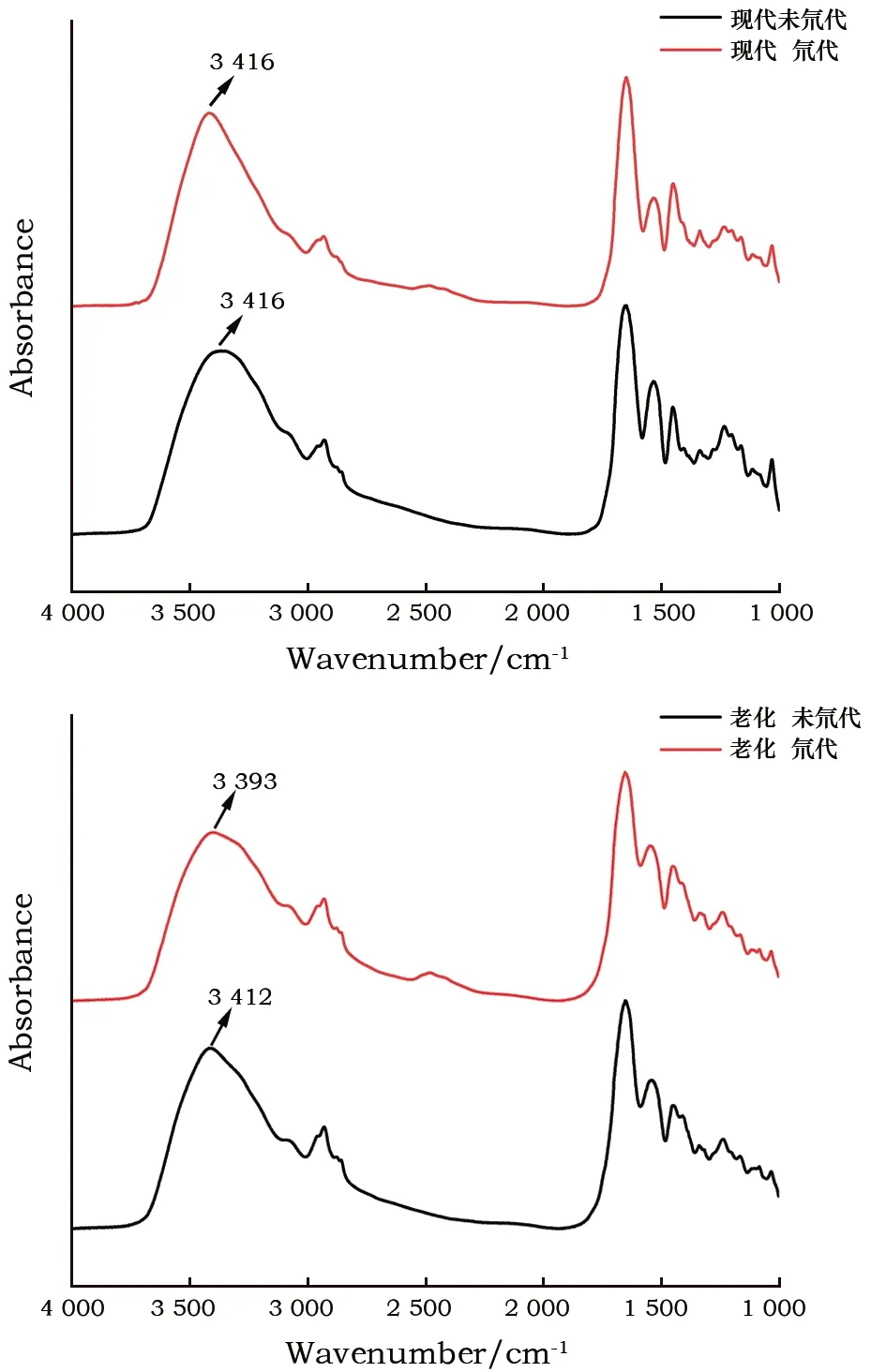
圖3 現代皮革與人工老化皮革氘代前后紅外光譜圖對比
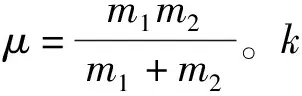
N-D的折合質量μ2大于N-H的折合質量μ1,所以發生氘代反應后,其伸縮振動產生的酰胺A帶吸收峰應向低波數方向移動。
根據式(2)計算氘代后官能團的吸收峰位有時會與實際測試所得結果有較大差異,這個偏差有時達幾百個波數,帶來這種偏差的直接原因是由于計算時忽略了該官能團在分子中所處的化學環境[21]。N-D的伸縮振動吸收峰波數理論計算值為2 500 cm-1左右,而實際所得的紅外譜圖中,N-D的伸縮振動吸收峰出現在3 400 cm-1附近。氘代后樣品的紅外譜圖在2 500 cm-1處有微弱的吸收峰,這是氘代處理后殘留于樣品中微量重水的O-D的伸縮振動形成的[22]。
從氘代結果來看,現代皮革氘代前后由N-H伸縮振動引起的酰胺A帶波數沒有發生位移,說明現代皮革未發生明顯氘代反應。人工老化皮革樣品氘代后酰胺A帶波數發生了明顯位移,吸收峰從3 412 cm-1向低波數方向移至3 393 cm-1,說明-NH基團有部分被置換為-ND基團,折合質量μ變大導致波數發生位移。從紅外譜圖分析可知,人工老化皮革比現代皮革更容易發生氘代反應,這與人工老化皮革中膠原蛋白結構被破壞有關。
膠原蛋白中有多種類型的氫鍵,包括主鏈酰胺氫與羰基氧形成的N-H…O=C型氫鍵、水分子介導形成的氫鍵[23]等,這些氫鍵對維持膠原蛋白結構穩定有著重要作用。現代皮革不易發生氘代反應,說明其保持有致密的三螺旋結構,氫鍵締合程度大,氘水難以進入其中置換相應的氫。Gly(甘氨酸)在組成膠原蛋白的氨基酸中體積最小,位于螺旋結構的中心軸位置[24],其酰胺氫是參與氫氘交換反應的主要對象。在相同外界條件下,與現代皮革相比,人工老化皮革對氘代反應更敏感,根據影響氫氘交換速率的因素可知,人工老化皮革膠原蛋白中主鏈酰胺氫的溶劑可及性以及其參與形成的氫鍵發生了變化。維系三螺旋結構穩定的氫鍵斷裂,三股螺旋結構發生一定程度解體,位于螺旋結構中心的甘氨酸暴露出來,增大了骨架酰胺氫的溶劑可及性,加快了氫氘交換速率。
圖4為古代皮革樣品Old1、Old2、Old3氘代前后的紅外光譜圖。古代皮革氘代后其酰胺A帶均發生不同程度位移,說明古代皮革比現代皮革更容易發生氘代反應。古代皮革在劣化過程中,維持膠原蛋白三螺旋結構穩定的N-H…O=C型氫鍵以及水分子介導形成的氫鍵發生斷裂,三螺旋結構發生一定程度解體,其空間構象變得紊亂、松散,導致酰胺氫相對暴露于氘水中,氘原子容易進入其中置換氫原子,如圖5所示。氘代后樣品Old1酰胺A帶吸收峰由3 416 cm-1向低波數移動至3 404 cm-1,樣品Old2由3 412 cm-1移至3 405 cm-1,樣品Old3由3 409 cm-1移至3 404 cm-1,3個古代皮革樣品中Old3吸收峰移動幅度小于Old1和Old2,說明其氘代程度小,三股螺旋構象相對保存完好,氘原子較難置換其中的氫原子。
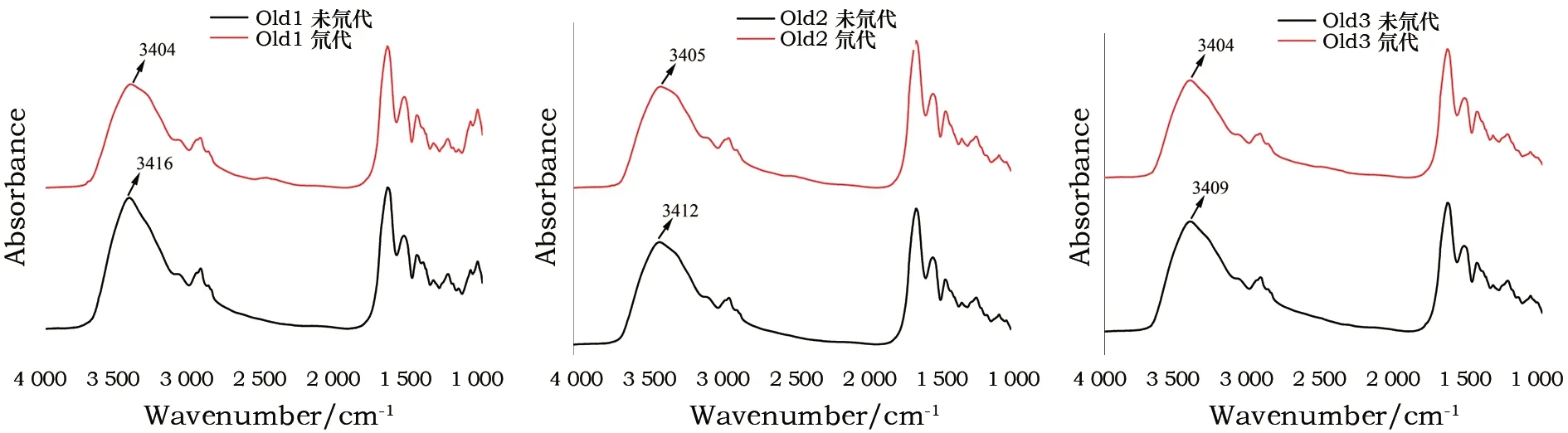
圖4 古代皮革氘代前后紅外光譜圖對比
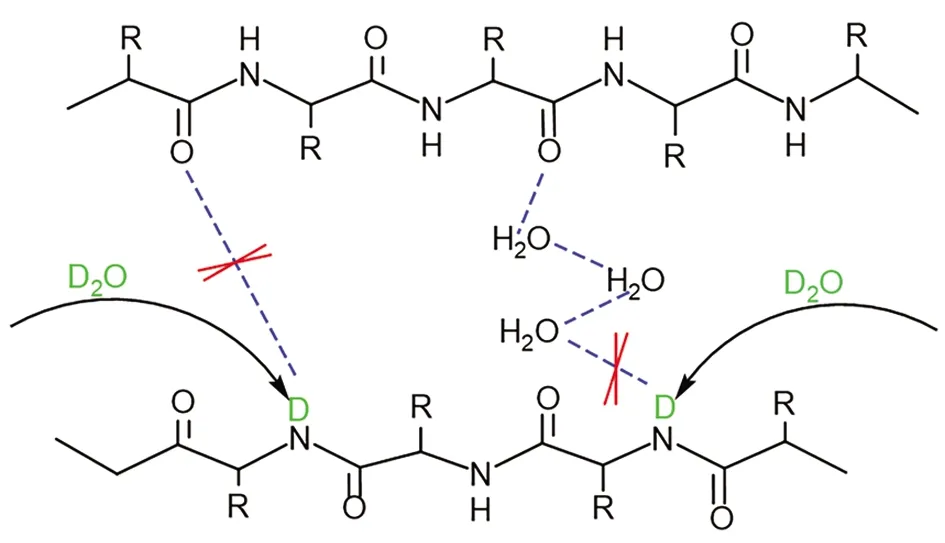
圖5 膠原蛋白氫鍵斷裂及氫氘交換示意圖
2.2 氘代率分析
在樣品氘代后的紅外譜圖中,其酰胺A帶為不對稱的寬峰,由N-H與N-D的伸縮振動共同引起,通過將其分峰擬合,比較兩者的相對質量分數來分析氘代反應,見式(3)。
(3)
圖6為皮革樣品膠原蛋白酰胺A帶分峰擬合圖。其中紅色實線為未分峰圖譜,黑色虛線為分峰擬合圖譜。因N-D相對折合質量μ大于N-H,故其中高波數擬合峰(左邊虛線)歸屬為N-H伸縮振動吸收峰,低波數擬合峰(右邊虛線)歸屬為N-D伸縮振動吸收峰。
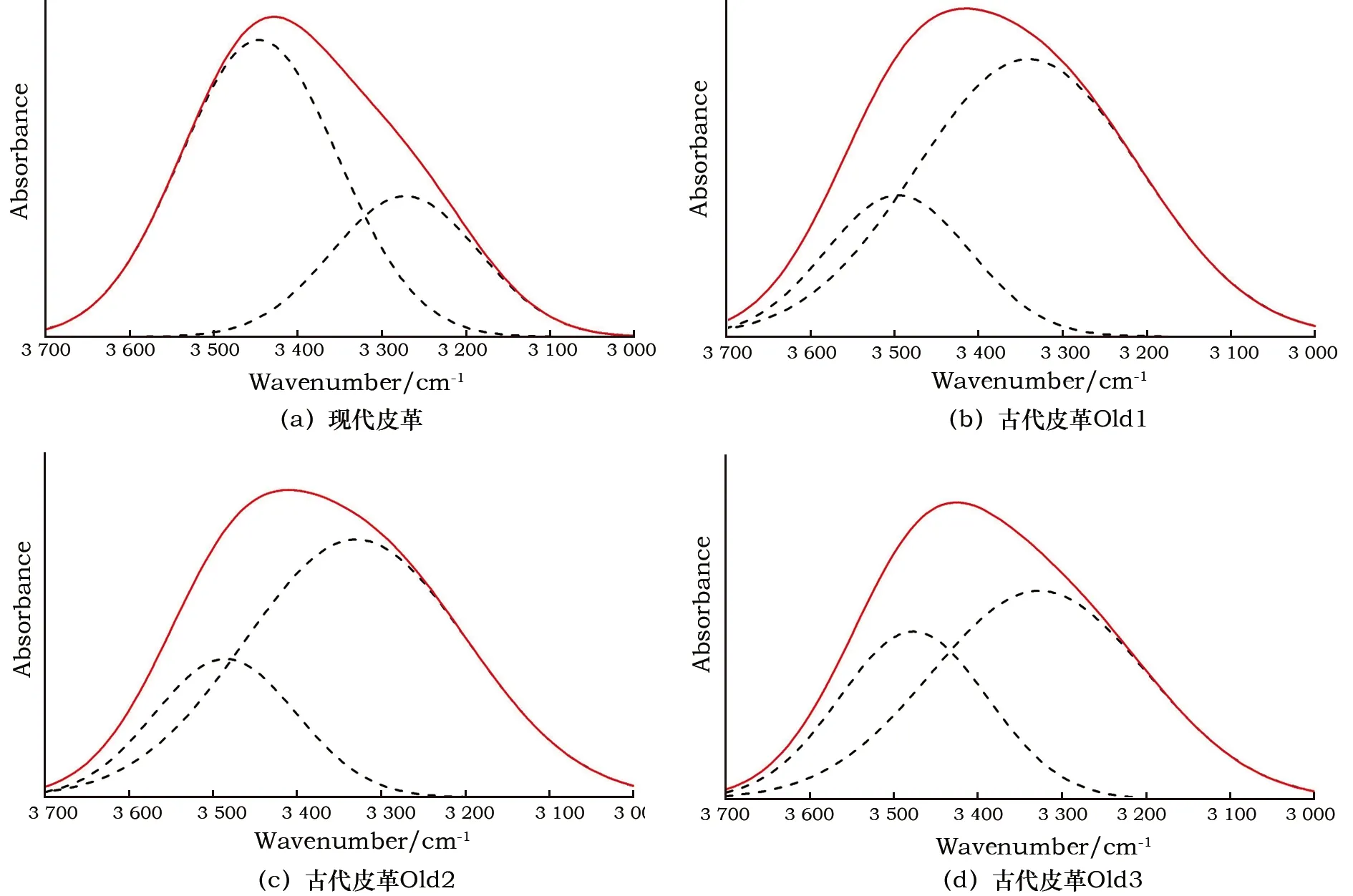
圖6 皮革樣品氘代后酰胺A帶分峰擬合圖
酰胺A帶不同化學鍵質量分數見表1。除少數氨基酸側鏈上含有可被氘原子置換的氫外,發生氘代反應的氫原子大都為主鏈酰胺氫,故酰胺A帶分峰擬合得到N-D質量分數可代表膠原蛋白中被氘原子置換的氫原子的比例,即氘代率。從表中可知,現代皮革氘代率最低,僅為32.09%,古代樣品Old1、Old2、Old3氘代率較高,分別為76.48%、75.71%和65.87%。在相同外界條件下,氘代率與氫氘交換速率成正比,氫氘交換速率取決于膠原蛋白三螺旋結構的緊密程度以及酰胺氫參與形成氫鍵的完好程度。現代皮革氘代率較低,說明其三螺旋結構最為穩定,氫鍵未發生大量斷裂,Gly深埋在三股螺旋的中心區,氘代反應難以置換出其中的氫,因此保存最為完好。研究表明,蛋白質骨架酰胺氫在二級結構中參與形成的氫鍵會阻礙氫氘交換過程[25]。膠原蛋白中氫鍵的斷裂在很大程度上加大了酰胺氫原子的溶劑可及性,使得劣化皮革更容易發生氘代反應。人工老化皮革與古代皮革的氘代率較高,說明兩者三螺旋結構均遭到了不同程度的破壞,維系螺旋結構穩定的氫鍵斷裂,氫原子暴露在溶劑中,這些變化都有利于氘代反應的進行。
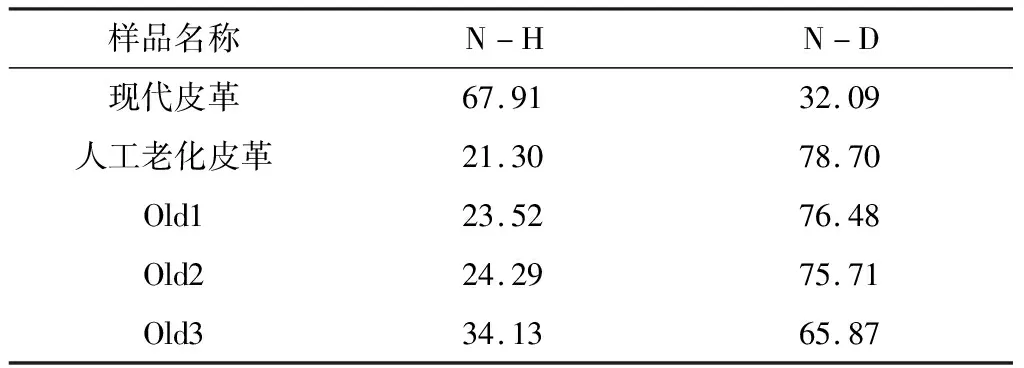
表1 酰胺A帶不同化學鍵質量分數
氘代率越高說明膠原蛋白螺旋結構被破壞程度越大,皮革劣化越嚴重。在3個古代皮革樣品中,Old3的氘代率最低,可以認為其劣化程度最低。人工老化皮革的氘代率與古代皮革相近,說明采用的模擬老化試驗達到了預期目的。膠原蛋白的三股螺旋結構主要由肽鏈之間的氫鍵維持,氫鍵鍵能不高,在堿、熱的作用下會發生斷裂,導致其三螺旋結構逐漸解螺旋,變為疏松雜亂的無規卷曲構象。
需要說明的是本實驗中兩個方面的原因也可能對結果造成誤差:1)氘代條件對氘代程度的影響;2)水汽對紅外譜圖的干擾。氘代條件包括反應時間、溫度等。在一定范圍內,氘代時間越長,氘代程度越高。溫度不同,氘代速率也會有很大的不同。保證氘代條件相同是結果具有可比性的前提。故所有樣品氘代過程均在恒溫水浴鍋中進行,保持每個樣品的氘代條件相同。采用溴化鉀壓片法,常常會因為溴化鉀在研磨中吸附空氣中的水汽對紅外譜圖產生干擾,故所有樣品在測試之前都在紅外燈下烘烤0.5 h以上,盡可能降低水汽對紅外譜圖的影響。
3 結 論
采用氫氘交換技術結合傅里葉紅外光譜技術,通過特征吸收峰的位置和氘代率對現代皮革、人工老化皮革和古代皮革膠原蛋白的微觀結構進行了研究。研究結果表明,現代皮革不易發生氘代反應,主要原因是現代皮革膠原蛋白中酰胺氫參與的氫鍵沒有被破壞,保持有穩定的螺旋結構,氘水難以進入其中置換相應的氫。人工老化皮革和古代皮革樣品對氘代反應更敏感,這是因為人工老化皮革和古代皮革在劣化過程中膠原蛋白結構發生變化,緊密的三螺旋結構解體,主鏈酰胺氫相對暴露,其中維持螺旋穩定性的氫鍵強度減弱并發生斷裂。隨著螺旋解體,活性基團之間的距離加大,更難以成鍵。
相同氘代條件下,古代皮革氘代率最大為76.48%,而現代皮革氘代率僅為32.09%,其膠原蛋白結構最完好。三個古代皮革樣品中Old3的氘代率最低,說明其三股螺旋結構被破壞程度最低,劣化程度也最低。氫氘交換結合傅里葉變換紅外光譜技術適宜于研究劣化皮革膠原蛋白三螺旋結構,可用于評估古代皮革劣化程度。

