血漿置換與雙重血漿分子吸附系統單用或聯合使用治療HBV相關慢加急性肝衰竭患者預后預測模型的建立與評估
黃貝貝, 寧 玲, 李文淵, 鄭曉瑋, 張 玥, 江守偉, 張振華, 李 磊
1 安徽醫科大學附屬省立醫院 感染病科, 合肥 230001; 2 安徽醫科大學第二附屬醫院 感染和肝病科, 合肥 230601
據報道我國約有1.3億HBV感染者,其中約3千萬為慢性感染[1]。HBV感染相關慢加急性肝衰竭(hepatitis B virus infection related acute-on-chronic liver failure,HBV-ACLF)在慢性HBV感染基礎上發生,主要表現為惡心、嘔吐、疲勞、黃疸進行性上升、凝血功能障礙等急性肝功能失代償。同時可合并肝性腦病、腹水、肝腎綜合征等并發癥[2]。ACLF的內科治療效果不佳,病死率高,嚴重威脅患者生命安全。肝移植可以有效地提高這些患者的生存率,然而因供體肝的嚴重缺乏和經濟負擔問題使我國肝移植的開展受到了較大限制[3]。目前臨床上各種人工肝支持系統(artificial liver support system,ALSS)已被廣泛的用于治療ACLF,多項研究[4-5]證實,ALSS可以延長患者的生存期。我國目前較為常用的ALSS模式有:血漿置換(plasma exchange,PE) 、血漿灌流、血漿濾過、血漿透析、血漿濾過透析、雙重血漿分子吸附系統(dual plasma molecular adsorption system,DPMAS) 和聯合模式(PE+DPMAS)等。本中心主要使用的人工肝模式為PE、DPMAS及PE+DPMAS,本研究就經過此類模式治療的HBV-ACLF患者24周生存預后進行研究。
目前對于肝衰竭患者的預后評價主要采用終末期肝病模型(MELD)[6]和MELD-Na評分[7],但這些模型是否適用于評估接受ALSS治療的HBV-ACLF患者的預后尚不明確。本研究分析了行PE、DPMAS及兩者聯合模式治療的HBV-ACLF患者的24周生存預后的獨立影響因素,建立了一種新的生存預測模型,并對新建立的預測模型進行了驗證。
1 資料與方法
1.1 研究對象 收集2015年1月—2019年12月在安徽醫科大學附屬省立醫院接受PE+DPMAS治療的HBV-ACLF患者為建模組,另收集2018年1月—2020年1月在安徽醫科大學第二附屬醫院接受PE+DPMAS治療的HBV-ACLF患者為驗證組。HBV-ACLF的診斷標準參照《肝衰竭診治指南(2018年版)》[2],并排除合并惡性腫瘤、妊娠、合并其他嚴重疾病等情況。所有的患者除接受PE+DPMAS外,均接受針對HBV-ACLF的內科綜合治療,包括口服抗病毒藥物、保肝降酶、輸白蛋白等對癥治療。
1.2 研究方法 對行PE+DPMAS治療的HBV-ACLF患者進行回顧性研究,隨訪其24周的生存情況。收集患者診斷HBV-ACLF時的臨床資料、實驗室檢測結果及并發癥情況,實驗室指標包括:TBil、INR、Alb、肌酐(Cr)、血清鈉(Na)等。臨床并發癥包括肝腎綜合征、腹水、肝性腦病、消化道出血。同時計算MELD評分及MELD-Na評分。MELD=3.78×In[TBil(mg/dL)]+11.2×In[INR]+9.57×In[Cr(mg/dL)]+6.43×(病因:膽汁性或酒精性0,其他1);MELD-Na=MELD+1.59×[135-Na (mmol/L)]。
1.3 倫理學審查 本研究通過安徽醫科大學附屬省立醫院醫學倫理委員會審批,批號:2021-RE-006,患者及家屬均簽署知情同意書。
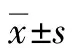
2 結果
2.1 一般資料 本研究共納入建模組患者133例和驗證組患者55例。建模組患者的INR(P=0.001)、Cr(P<0.001)均高于驗證組患者,同時驗證組患者的MELD(P<0.001)和MELD-Na(P=0.002)評分均低于建模組患者。2組患者其他指標比較,差異均無統計學意義(P值均>0.05)(表1)。
2.2 患者24周生存的影響因素分析 根據24周的生存情況,將建模組患者分為生存組(n=71)和死亡組(n=62)(表2)。生存組患者較死亡組患者更為年輕(P<0.001)。死亡組合并有肝腎綜合征(P=0.005)、肝性腦病(P=0.002)、消化道出血(P=0.008)的患者較生存組多。死亡組患者的TBil(P=0.001)、INR(P<0.001)和Cr(P=0.015)較生存組高。死亡組患者的Alb(P=0.035)和PLT(P=0.002)水平較生存組低。進一步進行Cox多因素分析后,年齡(HR=1.030,P=0.013)、TBil(HR=1.018,P<0.001)、INR(HR=1.517,P<0.001)和PLT(HR=0.993,P=0.04)是HBV-ACLF患者24周生存的獨立影響因素。

表1 建模組和驗證組患者一般資料比較

表2 建模組患者24周生存預后的單因素和多因素Cox回歸分析
2.3 患者24周生存預測模型的建立 根據Cox多因素分析結果,建立一個新的行PE+DPMAS治療的HBV-ACLF患者預后預測模型,即ATIP=0.029×年齡(歲)+0.018×TBil(mg/dL)+0.417×INR-0.007×PLT(109/L)。ATIP模型的AUC(0.863)顯著高于MELD評分(AUC=0.777,P=0.012)和MELD-Na評分(AUC=0.768,P=0.012)。建立的預測模型在驗證組中進行進一步驗證。與建模組一致,ATIP模型在所有預后模型中AUC最高,與MELD評分(AUC=0.712,P=0.011)、MELD-Na評分(AUC=0.691,P=0.010)比較,差異均有統計學意義(表3,圖1)。

注:a,模型組;b,驗證組。圖1 不同預后模型預測HBV-ACLF患者24周生存的 ROC曲線
3 討論
盡管有效的抗HBV藥物已經得到了廣泛的應用,但各種誘因導致的HBV-ACLF仍較為常見,且患者的生存預后差[8]。HBV-ACLF患者目前已經成為我國肝移植限期手術的主要來源之一,然而由于肝臟供體的嚴重緊缺,對于HBV-ACLF的主要治療手段和移植前處理仍依賴ALSS。有報道[9]稱,若能在肝移植前設法降低MELD評分,可有效改善HBV-ACLF患者的預后。同時有報道[10-11]指出PE治療可顯著降低HBV-ACLF患者的TBil、轉氨酶和INR水平,改善MELD評分,延長患者的生存時間。Xu等[12]也證實了ALSS在為HBV-ACLF患者等待肝移植爭取時間支持方面具有重要現實意義。
盡管在東西方國家已經推導并驗證了數個ACLF患者生存的預測模型,但由于中西方關于肝衰竭病因學和治療理念上的差異,對我國的現實指導意義有限。而關于HBV-ACLF患者接受ALSS治療生存的預后模型尚未見報道。MELD模型是2000年由Malinchoc建立的用來預測行經頸靜脈肝內門體分流術的肝硬化患者的短期預后模型,后被逐漸應用于多種肝病的預后預測[13]。之后在此基礎上優化衍生出MELD-Na等評分系統。MELD和MELD-Na評分可操作性強,臨床應用較為廣泛。這兩個預后模型均提示TBil和INR與肝衰竭患者的預后密切相關[14-15]。血清TBil是反映肝功能損害嚴重程度的可靠指標,INR是肝衰竭早期預警和病情進展的敏感指標,與患者預后顯著相關[16-18]。本研究也證實了TBil、INR對接受PE+DPMAS模式治療的HBV-ACLF患者24周生存具有重要影響。在Xia等[19]的研究中曾用MELD評分預測ALSS的治療效果,但在本研究中患者MELD評分的AUC明顯小于所建立的ATIP模型。同時結果顯示MELD-Na的AUC在三個預后評估模型中是最低的,提示其更適用于頑固性低鈉血癥患者的生存預后預測。當ATIP模型評分>0.31時,PE+DPMAS治療的HBV-ACLF患者生存率明顯下降。
在本研究中,根據Cox回歸分析發現PLT是行PE+DPMAS治療的HBV-ACLF患者的保護因素,提示PLT越低患者的預后越差。PLT主要來源于骨髓成熟的巨核細胞,通過黏附、聚集、釋放凝血因子等在機體止血中起重要作用[20]。在肝衰竭的患者中,促血小板生成素水平降低[21-22]、骨髓抑制[23]、脾功能亢進[24]、彌漫性血管內凝血[25]的發生均可以導致PLT水平的降低。既往有報道[25]指出在肝硬化和肝衰竭患者中,肝臟凝血機制異常可引起肝內的彌散性血管內凝血形成,導致PLT凝血消耗。許姍姍等[26]對HBV-ACLF患者進行多因素logistic分析后發現,PLT是其獨立影響因素,PLT減少可能與其參與肝臟微循環消耗有關。石新星等[27]的研究也證實了PLT減少是影響HBV-ACLF患者預后的獨立影響因素。有研究[28]通過對ACLF患者PLT計數的動態觀察發現,ACLF死亡患者PLT數量下降幅度明顯增大,HBV-ACLF患者恢復時,PLT計數明顯回升。另外有研究[29]報道PLT含有豐富的細胞因子,如5-羥色胺,可以促進肝臟細胞的再生。明確PLT變化在ACLF發生發展中的意義有助于為探索新的治療方法提供線索。本研究結果與以往相關研究的結果相符,提示血小板是行PE+DPMAS治療的ACLF患者預后的獨立影響因素。

表3 行PE+DPMAS治療的HBV-ACLF患者預后評分系統預測價值比較
另外,與未納入研究的其他肝衰竭評分系統,如CTP評分、SOFA評分、APACHE評分等相比,ATIP模型具有指標客觀,臨床易獲取和計算相對簡便等優點,因此更適用于我國的臨床實際。本研究也比較了PE、DPMAS和聯合模式ALSS對預后的影響,結果發現ALSS模式對HBV-ACLF患者24周生存無影響。
本研究尚具有一定的局限性。本研究中沒有與只接受常規藥物治療的HBV-ACLF患者進行比較,且納入研究的病例數相對較少。盡管結果證實建立的新模型相對MELD和MELD-Na模型具有更好的預測效能,但僅基于行PE+DPMAS治療的HBV-ACLF患者,該模型是否可以應用于其他病因導致的ACLF,還需要進一步研究驗證。
綜上所述,本研究通過回顧性分析PE+DPMAS治療的HBV-ACLF患者的24周生存情況,發現TBil、INR、年齡和PLT是其獨立影響因素。根據這些因素建立的ATIP預測模型優于經典的MELD評分和MELD-Na評分模型,對于行PE+DPMAS治療的HBV-ACLF患者24周生存具有更佳的預測效能。對于經ATIP模型預測預后較差的患者,應優先考慮進行肝移植手術。這對于臨床針對HBV-ACLF患者及時調整治療策略、科學利用稀缺的供肝資源、改善患者預后具有現實指導意義。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:李磊、張振華對研究的思路或設計有關鍵貢獻;黃貝貝、寧玲、李文淵、鄭曉瑋、張玥參與了研究數據的獲取分析解釋過程;黃貝貝、寧玲、江守偉參與起草或修改文章關鍵內容。

