金黃色葡萄球菌cydA 基因對能量代謝的影響研究
陳嬙,羅東,彭林鳳,陳開森
(南昌大學第一附屬醫院1.檢驗科;2.呼吸科,江西 南昌 330006)
金黃色葡萄球菌(Staphylococcus aureus, S.aureus, 簡稱金葡菌) 是一種廣泛存在于環境中的重要病原菌[1,2],其能量的利用主要是有氧呼吸。 有氧呼吸的本質是通過一系列的氧化還原反應,最后將電子傳遞給氧生成水,同時偶聯氧化磷酸化作用生成能量物質ATP、ADP 等[3]。NADH、NAD+等在呼吸鏈傳遞能量中具有重要作用。
金葡菌編碼兩個末端氧化酶,分別為cydAB 和qoxABCD 編碼的細胞色素bd 氧化酶和細胞色素aa3 氧化酶[4]。 在金葡菌中,cydAB 與qoxABCD 一起失活會阻止呼吸作用并誘導小菌落變體(Smallcolony variants, SCVs)形成[5],表現為生長代謝緩慢、菌落細小(正常菌株的1/10 左右)、色素合成能力低下、溶血性下降、凝固酶反應遲緩、毒力基因表達下調,與生物膜形成和黏附相關的主要基因常常表達增加[6]。 我們前期的研究證實了金葡菌cydA基因缺失后,該變異菌不能形成血漿凝固酶,同時毒力因子表達,甚至粘附能力都受到影響[7]。 有研究結果證實在結核分枝桿菌中,cydAB 是與抑制細菌終末端呼吸氧化酶相關藥物的潛在靶標[8]。
為了更進一步了解cydA 如何影響到金葡菌血漿凝固酶形成,我們通過構建cydA 突變株,觀察不同外界環境下cydA 對能量代謝的影響,現報告如下。
1 材料與方法
1.1 實驗材料
1.1.1 菌種和質粒 金黃色葡萄球菌Newman 菌株及溫度敏感型穿梭質粒pKOR1,為本實驗室所保存。
1.1.2 試劑和儀器 試劑:營養肉湯,比色法NAD+檢測試劑盒、ATP 檢測試劑盒、氯霉素、TSB、脫水四環素(中國索萊寶生物科技有限公司);細菌基因組DNA 提取試劑盒(DP302,中國天根生化科技北京有限公司),2×PFU PCR Master MIX (中國天根生化科技北京有限公司);BP ClonaseTM2 Enzyme Mix(美國Invitrogen 公司);質粒提取試劑盒(中國Axygen 公司)。
儀器:聚合酶鏈反應(PCR) 儀(BioRead 公司);電轉化儀(BioRead 公司);紫外凝集成像儀(北京六一公司);酶標儀(山東恒美電子科技有限公司)。
1.2 CydA 敲除株的構建 通過融合PCR 將cydA基因上、下游同源片段連接起來;通過基于位點特異性重組的gateway 克隆技術將融合PCR 產物連接入溫度敏感型穿梭質粒pKOR1,轉化修飾缺陷型大腸桿菌DC10B,獲得同源重組質粒pKOR1-cydA;電轉化金黃色葡萄球菌Newman 株;在40℃高溫和10 μg/ml 氯霉素雙重選擇壓力下,質粒通過第1 次同源重組整合到金黃色葡萄球菌染色體上;轉移到無抗生素的培養基中繼續培養,發生第2 次同源重組; 將菌液涂布于含1μg/ml 脫水四環素的培養基上進行反向篩選,最后,挑取菌落通過PCR 鑒定。 本研究所使用的PCR 引物及內切酶見表1。

表1 本研究所使用的引物
1.3 不同條件下的細菌培養 將劃線純化的Newman 野生菌、△cydA 接種至3ml 新鮮肉湯培養基中,37℃,200r/min 過夜培養,第2d,1: 100 比例稀釋后轉接到3ml 新鮮LB 培養基中,分別置于常規氣體及25℃、35℃、40℃條件下恒溫搖床,200r/min過夜培養;此外,將Newman 野生菌、△cydA 放在6%CO2氣體及35℃培養,具體條件參照常規氣體培養。
1.4 細菌ATP 的提取及測定 本實驗參照索萊寶ATP 檢測試劑盒的說明書,并做適量修改,具體操作步驟如下:取600nm 下OD 值為1.0 麥氏單位的過夜培養菌液1ml,10000g,4℃離心2min 收集到離心管內,棄上清;用無菌PBS 緩沖液重懸洗滌3次,去上清液,加入1.0ml 提取液,超聲波破碎6 min(超聲條件:冰浴,強度20%,超聲2s,停1s,10,000g,4℃離心10min;取上清液至另一EP 管中,加入500μl 的氯仿充分震蕩混勻,10,000g 4℃離心3min,取上清液于1.5m LEP 管中,置冰上待測;酶標儀預熱30 min 以上,調節波長到340nm,蒸餾水調零; 臨用前按ATP 試劑盒內說明書,配制工作液,冰上避光操作;按順序在96 孔板中依次加入樣本液20μl,檢測工作液100μl,迅速吹打混勻后,立即速置于酶標儀中測定340nm 下10s 的吸光值A1;然后將96 孔板放入37℃培養箱中孵育3min,速置于酶標儀中測定吸光度值A2。 分別計算ΔA測定=A2 測定管-A1 測定管,并記錄結果。 根據標準曲線計算出樣品中ATP 的濃度。
1.5 NAD+ 的提取及測定 本實驗參照索萊寶NAD+檢測試劑盒的說明書,并做適量修改,具體操作步驟如下:取600nm 下OD 值為1.0 麥氏單位的過夜培養菌液1ml,10,000g,4℃離心2min 收集到1.5ml EP 離心管內,棄上清;用無菌PBS 緩沖液重懸洗滌3 次,去上清液,加入1ml 酸性提取液,超聲波破碎6min(超聲條件:冰浴,強度20%,超聲2s,停1s),10000g,4℃離心10min;煮沸5min,冰浴中冷卻后,10000g 4℃離心10min; 取上清液200 μL 轉移至另一新的1.5ml EP 管中,加入等量堿性提取液使之中和,10000g 4℃離心10min,取上清液,冰上保存待測;酶標儀調節波長至570nm,蒸餾水調零;取1.5ml 棕色EP 管分別設定對照管,測定管,空白管,加入上清液,及蒸餾水;向對照管加入加入NAD 試劑盒內標注的NAD+反應液,充分混勻,室溫避光靜置20min;向測定管,空白管中加入NAD+反應液100μl,充分混勻,靜置5min 后,15,000rpm,25℃離心15min,棄上清,沉淀中加入NADH 檢測液200μl。 立即吹打混勻,取200μl 至96 孔板中,迅速將96 孔板置入酶標儀,設置37℃孵育2h,570nm 下比色; 讀取吸光值△A=A 測定管-A 對照管,空白管做一到兩次,記錄吸收值。 根據標準曲線計算出樣品中NAD+的濃度。
1.6 生長曲線實驗 將Newman 野生菌、cydA 敲除株接種至3 mL 新鮮肉湯培養基中,37℃過夜培養,隨后將細菌以1:50 稀釋至新鮮TSB 培養基中,于37℃100 rpm 搖床震蕩培養,大約每隔1h 取100 μl 細菌測OD600,測定完畢后用Graphpad prism5繪制細菌生長曲線,獨立重復至少三次。
2 結果
2.1 CydA 敲除株構建成功的驗證 采用cydA 基因上下游引物篩選cydA 敲除菌落,結果如圖1,圖中的第1、2、4、9 泳道為野生Newman 菌株,含有cydA 基因片 段,擴增 出3039bp 的條帶,其中3,5,6,7,8 泳道為初篩基因敲除成功株,無cydA基因片段,擴增出1250bp 條帶,并對圖中的陽性克隆PCR 產物進行測序,與Newman 標準序列進行比對,證實cydA 基因均被成功敲除。
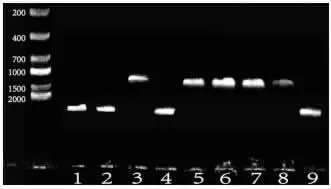
圖1 CydA 基因上下游引物PCR 擴增篩選結果
2.2 CydA 基因缺陷對ATP 檢測結果的影響 為了研究cydA 基因缺陷是否會影響金黃色葡萄球菌的能量代謝,根據標準曲線計算出樣品中ATP 濃度。 結果發現在不同培養條件時,cydA 基因缺陷型株中的ATP 的水平相比Newman 菌株均無顯著降低(P>0.05),表明cydA 基因失活后不會使金葡菌胞內能量物質ATP 減少進而影響細菌生長繁殖,見圖2。
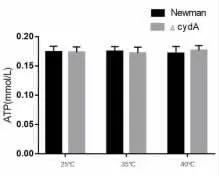
圖2 常規氣體條件下Newman 菌內ATP 水平
2.3 CydA 基因缺陷對NAD+ 檢測結果的影響NAD+是細胞中含量最豐富的輔酶,NADH 為它的還原形式。 在呼吸作用中,在糖酵解、三羧酸循環過程中由NAD+產生NADH,而在氧化磷酸化過程中,NADH 釋放出質子和電子,提供能量合成ATP,因此,如果細菌細胞內NAD+減少,會直接抑制呼吸作用,進而抑制氧化磷酸化產生ATP。 為了驗證CydA 基因缺陷會導致金黃色葡萄球菌胞內NAD+水平降低,從而影響ATP 的合成,根據NAD+標準曲線計算出樣品中NAD+的濃度。 檢測了不同菌株中NAD+的水平。 結果發現,在不同溫度條件和不同CO2濃度水平下,cydA 基因缺陷型菌株中的NAD+的水平相比Newman 野生株均有顯著降低,見圖3、圖4 和圖5。
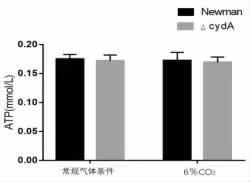
圖3 6%CO2 氣體條件下Newman 菌內NAD+ 水平
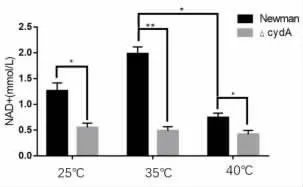
圖4 . 常規氣體條件下Newman 菌內NAD+ 水平(*, P<0.05; **, P<0.01)
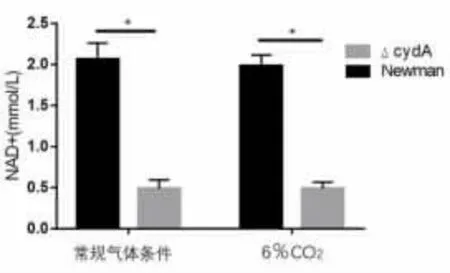
圖5 6% CO2 氣體條件下Newman 菌內NAD+ 水平(*, P<0.05; **,P<0.01)
3.4 CydA 基因對細菌生長的影響 在12h 的生長時間內,cydA 基因敲除株的生長并未出現顯著影響(P>0.05);表明cydA 基因的缺失并不會影響細菌的生長,見圖6。
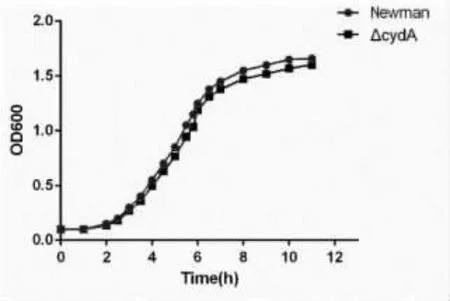
圖6 細菌生長曲線
3 討論
CydA 是bd 型細菌泛醌細胞色素氧化酶的一個亞基,目前對于bd 型細菌泛醌細胞色素氧化酶的認識主要來自大腸埃希菌,bd 型的泛醌細胞色素氧化酶是膜上的呼吸鏈末端氧化酶,參與NADH分解代謝并為ATP 的合成提供質子跨膜運動的動力[9]。 本研究以cydA 基因缺陷型菌株為切入點,通過檢測金葡菌胞內NAD+和細菌胞內ATP 水平,發現金葡菌cydA 缺陷株內ATP 水平無明顯變化,但NAD+水平明顯下降,由于△cydA 中只有aa3型末端氧化酶存在,這一結果產生可能是由于細胞內aa3 型末端氧化酶電子傳遞鏈分支產能效率稍低[8],產生了較少的NADH,從而使NAD+含量下降,此外,cydA 失活后,可能存在其他產能途徑補償了金黃色葡萄球菌內ATP 合成,這從cydA 基因缺失后,生長能力未改變一致。
本研究發現金葡菌cydA 基因突變可以影響NAD+的生成,從而導致血漿凝固酶等毒力因子的形成能力降低,這一發現具有一定應用價值,表現為抗金葡菌毒素雖然不能直接殺死金葡菌,但可以降低其防御能力,有利于免疫細胞殺傷及抗生素的有效殺滅[10]。 同時我們通過基因序列比對發現該基因序列較為保守,是否存在其它菌該基因缺失也導致毒力降低值得探討。 由于抗生素的副作用越來越明顯地影響到細菌的防治,故通過影響病原體毒力因子的表達也許是一種新的思路,故該基因作為新的抗菌靶點值得期待。

