直接飼喂微生物和發酵制品生產菌株鑒定及其安全性評價指南
1 適用范圍
1.1 本指南規定了直接飼喂微生物和發酵制品生產菌株鑒定及其安全性評價的基本原則、基本要求、評價方法以及結果判定。
1.2 本指南適用于新飼料添加劑評審和已經批準使用的飼料添加劑再評價時,對直接飼喂微生物和發酵制品生產菌株開展的鑒定及其安全性評價,包括發酵制品中與生產菌株直接相關的安全性評價。
1.3 本指南僅涵蓋直接飼喂微生物和發酵制品與生產菌株相關的鑒定及其安全性評價,產品的其他安全性評價按照相關規定和指南開展。
1.4 本指南所稱微生物包括細菌、酵母和絲狀真菌。其他如古菌、微藻等微生物的相關評價可參照本指南要求,采取個案分析評價。
1.5 本指南適用于通過農業轉基因生物安全評價、獲得農業轉基因生物安全證書的轉基因微生物生產菌株及其發酵制品的相關內容評價。
1.6 飼料或飼料原料發酵生產所用微生物菌株的鑒定及其安全性相關內容評價參照本指南進行。
2 術語和定義
以下術語和定義適用于本指南。
2.1 直接飼喂微生物(Direct-Fed microorganisms)
在飼料中添加或直接飼喂給動物的活的微生物飼料添加劑。
2.2 發酵制品(Fermentation products)
微生物在受控制條件下,通過生命活動生產的特定代謝產物經分離、提取、純化、精制和干燥等工藝制成的飼料添加劑,如氨基酸、維生素、酶制劑等。
2.3 抗微生物藥物(Antimicrobial)
合成或天然存在的能殺死微生物或抑制其在動物或人體內生長或繁殖的活性物質,在本指南中特指抗菌藥物。
注:本指南中抗菌藥物包括用于人體或動物的世界衛生組織(WHO)定義的極為重要抗菌藥物(CIAs)或高度重要抗菌藥物(HIAs)。
2.4 獲得性耐藥(Acquired antimicrobial resistance)
在對特定抗菌藥物典型敏感的菌種中,由于獲取外源基因或基因突變引起某一菌株對該抗菌藥物產生的耐藥。
2.5 關注基因(Gene of concern)
已知毒力因子的編碼基因、耐藥基因,以及與已知毒性化合物產生等有關的基因。
2.6 臨界值(Cut-off value)
根據抗菌藥物對特定微生物類群(種或屬)的最低抑菌濃度(MIC)分布而設定的,用于耐藥判定的值。
2.7 轉基因微生物(Genetically modified microorganisms)
利用基因工程技術改變基因組構成的重組微生物。
2.8 危害(Hazard)
飼料中對人和動物健康有潛在不良影響的生物、化學或物理性因素或條件。
2.9 風險(Risk)
飼料中危害產生某種不良健康影響的可能性或嚴重性。
習近平總書記強調“打好扶貧攻堅戰,要采取穩定脫貧措施,建立長效扶貧機制,把扶貧工作鍥而不舍抓下去”[9]。在精準推進脫貧攻堅戰中,社區教育應根據實際,因地制宜地采取更加靈活的教學或培訓形式,開展扶貧培訓與扶貧教育。這更加符合貧困群眾脫貧的實際需求,能夠讓貧困群眾感受到培訓內容并非只停留于理論,也可以運用培訓所學投入到生產實際中,早日擺脫貧困。這樣,社區教育在精準扶貧中才能做到“扶真貧”“真扶貧”。
2.10 產毒能力(Toxigenicity)
微生物產生對人和動物有毒作用的活性代謝產物的能力。
2.11 致病性(Pathogenicity)
微生物感染宿主造成健康損害引起疾病的能力。
2.12 毒性(Toxicity)
微生物有毒代謝產物引起的宿主健康損傷。
3 基本原則
3.1 直接飼喂微生物和發酵制品生產菌株鑒定及其安全性評價應基于當前的科學認知開展,具體的評價試驗應遵循本指南規定的一般原則,并結合直接飼喂微生物和發酵制品特征屬性進行方案設計和試驗實施。
3.2 直接飼喂微生物和發酵制品生產菌株鑒定及其安全性評價試驗應按照國家、行業標準或參照國際組織標準檢測方法、技術規范等進行,若無相關標準檢測方法、技術規范則按照行業公認的檢測方法進行。
3.3 直接飼喂微生物和發酵制品生產菌株鑒定及其安全性評價試驗(包括檢測)應由具備微生物相關專業知識和試驗技能的專業人員在具備相應設施設備的試驗場所,按照規范的操作程序進行。試驗應在有效的質量控制下開展,并且由試驗機構指定的負責人負責。用于新飼料添加劑申報的,微生物鑒定及其安全性評價試驗應由農業農村部指定的評價試驗機構開展。農業農村部尚未指定評價試驗機構的,應由具有相應條件和能力的檢測評價機構開展。
3.4 直接飼喂微生物或發酵制品生產中使用復合菌株時,應分別針對每個菌株開展相關評價。
3.5 本指南中涉及的用于菌株安全性分析、比對、評價的相關數據庫、藥物名單等,應采用最新版本。
3.6 鑒于菌株在使用過程中可能產生變異或衰退,開展安全性評價時應充分考慮菌株鑒定報告及安全性評價相關檢測報告的時效性。
4 基本要求
通過形態觀察、生理生化檢測和分子生物學分析等技術方法對直接飼喂微生物和發酵制品生產菌株進行鑒定。通過表型試驗、分子生物學試驗、全基因組序列(WGS)分析、相關文獻資料綜述等,對微生物產毒能力和致病性、抗菌藥物敏感性、抗菌藥物產生等特性進行評價,對直接飼喂微生物和發酵制品生產菌株安全性進行綜合評估。不同微生物及生產菌株評價基本要求見表1。
5 評價方法
5.1 微生物鑒定
5.1.1 基本信息
明確直接飼喂微生物和發酵制品生產菌株的來源、屬名、種名(包括中文學名、拉丁學名等)和菌株名稱或編號。細菌的命名應遵循原核生物系統學國際委員會(ICSP)的規定,并符合原核生物國際命名法規(ICNP)要求。酵母和絲狀真菌的命名應符合國際藻類、真菌和植物命名法規(ICN)的要求。明確菌株的改良史,包括實施的誘變步驟和遺傳修飾。轉基因生產菌株的遺傳修飾按照5.6的要求進行描述。
5.1.2 鑒定
直接飼喂微生物和發酵制品生產菌株應明確鑒定至少到種或亞種水平。若根據最新方法和當前知識菌株無法明確鑒定至已有物種,應進行菌株及其近緣種的系統發育分析。
5.1.2.1 細菌鑒定
綜合形態觀察、生理生化檢測、分子生物學分析對細菌進行鑒定。
——形態觀察:包括菌落顏色、形狀、邊緣、透明度等宏觀形態觀察,以及菌體大小、形狀、革蘭氏染色反應、是否有芽胞、芽胞的著生位置等微觀形態觀察。
——生理生化檢測:包括碳源利用、氮源利用、氧化酶反應、過氧化氫酶反應等關鍵生理生化特征檢測。
——分子生物學分析:如16S rDNA序列、持家基因序列或WGS等分析。用于新飼料添加劑申報的,應利用WGS數據進行分析鑒定。
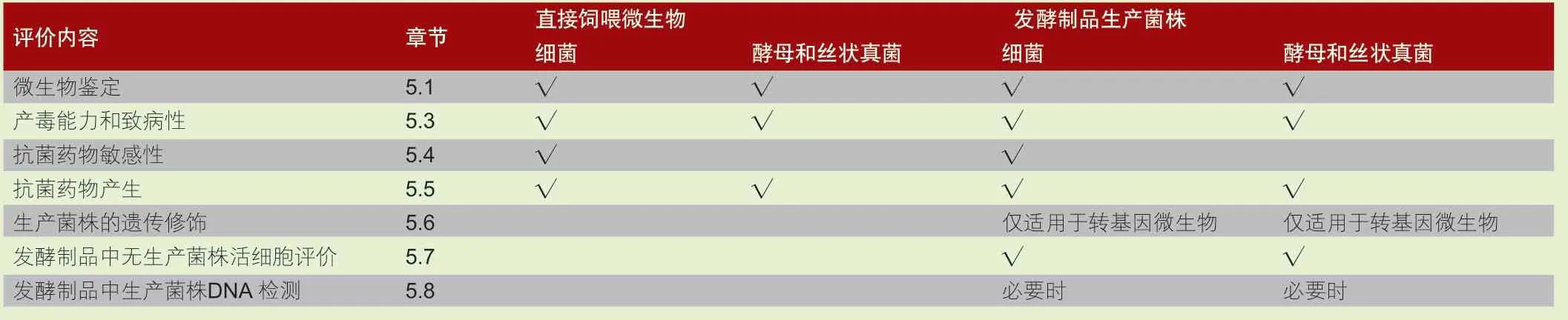
表1 菌株鑒定及其安全性評價基本要求
5.1.2.2 酵母菌鑒定
綜合形態觀察、生理生化檢測、分子生物學分析對酵母菌進行鑒定。
——形態觀察:包括菌落質地、顏色、邊緣等宏觀形態觀察,以及菌體大小、形狀、是否有真假菌絲、生殖方式等微觀形態觀察。
——生理生化檢測:包括碳源利用、糖類發酵、氮源利用等關鍵生理生化特征檢測。
——分子生物學分析:如26S rDNA、ITS rDNA等特征序列或WGS分析。
5.1.2.3 絲狀真菌鑒定
綜合形態觀察、分子生物學分析對絲狀真菌進行鑒定。
——形態觀察:包括菌落的質地、顏色、生長速度、色素的產生等宏觀形態觀察,以及菌絲的顏色、產孢結構的大小及發生方式、孢子顏色、形狀、是否具有有性生殖結構等微觀形態觀察。
——分子生物學分析:如18S rDNA序列、ITS rDNA序列及其他特征基因(如微管蛋白基因、鈣調蛋白基因、翻譯延伸因子等)序列或WGS分析。
5.2 WGS測序
采用二代和三代測序技術對直接飼喂微生物和發酵制品生產菌株進行全基因組測序,獲得其基因組完成圖,測序報告至少應包括以下信息:
DNA提取方法;測序方案和儀器;序列組裝方法,如生物信息學方法、從頭測序或重測序等;序列質量評價,如平均Phred得分、reads數目、覆蓋度、N50和K-mer等;WGS的FASTA電子文件;相對于預期基因組大小的contigs總長度;基因注釋方法;對于酵母和絲狀真菌,還需提供從相關數據庫(如BUSCO數據庫)獲得的注釋質量信息。
5.3 產毒能力和致病性
應通過國內外安全性評價資料綜述、動物致病性試驗和WGS分析對直接飼喂微生物和發酵制品生產菌株的產毒能力和致病性進行綜合評價,其中絲狀真菌還應開展產毒試驗。
鑒于屎腸球菌(Enterococcus faecium)和芽胞桿菌(Bacillusspp.)已有成熟的致病性評價方法,可分別按附錄A和附錄B開展評價。
5.3.1 國內外文獻資料綜述
通過國內外文獻數據檢索(具體要求見附錄C),收集整理菌株的國內外使用歷史、安全性評價資料,包括對人和靶動物的產毒能力和致病性的相關信息;若無該評價菌株的上述資料,應收集整理同種內其他菌株或與其相近種屬的相關信息。若對菌株進行了任何降低毒性和致病性的選育(包括誘變和/或遺傳修飾),應予以說明。
5.3.2 動物致病性試驗
制備直接飼喂微生物或發酵制品生產菌株的菌懸液,將其作為受試物,通過腹腔注射和經口灌胃等途徑給予實驗動物,評價不同暴露途徑下受試物對實驗動物的致病性。動物致病性試驗按照國家、行業標準方法開展。
5.3.3 WGS分析
5.3.3.1 細菌
將菌株WGS與最新數據庫(包括但不限于VFDB、PAI DB、CGE等)中存儲的序列進行比對,分析菌株遺傳物質中是否存在已知毒力因子的編碼基因。分析結果重點關注該種或近緣種中已知毒力因子(如毒素、入侵與粘附因子)的完整編碼基因。結果至少應包括如下信息:基因名稱、定位(染色體或質粒)、編碼蛋白的功能、覆蓋度(序列長度覆蓋度≥70%)、相似性百分比(輸入序列與數據庫中序列的匹配度≥80%)和e值(<10-5)等。
5.3.3.2 酵母和絲狀真菌
若菌株有WGS數據,則通過定向搜索確定菌株是否存在與產毒相關的已知代謝途徑。
5.3.4 產毒試驗
對于絲狀真菌,應在多種基質和條件下(單品種固體、多品種固體復合、不同成分液體組合等)進行產毒試驗,并按照國家標準檢測方法或國際組織規定的標準檢測方法進行已知毒性化合物含量檢測。
對于發酵制品生產菌株,若產毒試驗檢測到已知毒性化合物,還應通過檢測分析證明發酵制品中不含該化合物或該含量下風險無需關注。
5.3.5 結果分析
5.3.5.1 動物致病性試驗顯示受試物組動物在試驗期間出現中毒癥狀或死亡,或試驗期間體重等指標與對照組相比有顯著性差異時,則判定菌株具有致病性。
5.3.5.2 產毒試驗檢測到已知毒性化合物時,則判定絲狀真菌菌株具有產毒能力。
5.3.5.3 動物致病性試驗顯示無致病性的微生物,但WGS分析存在以下情況的,需結合國內外文獻資料綜述、毒力因子編碼基因或產毒代謝相關基因發揮作用的機制、相關基因變為活性基因的可能性等情況進行綜合判斷。對于發酵制品生產菌株,還應結合生產工藝、終產品中生產菌株和已知毒性化合物的存在情況等進行綜合判斷。
——WGS分析顯示存在已知毒力因子的編碼基因(或產毒代謝相關基因)的細菌或酵母;
——產毒試驗未檢測到已知毒性化合物,但WGS分析顯示存在產毒代謝相關基因的絲狀真菌。
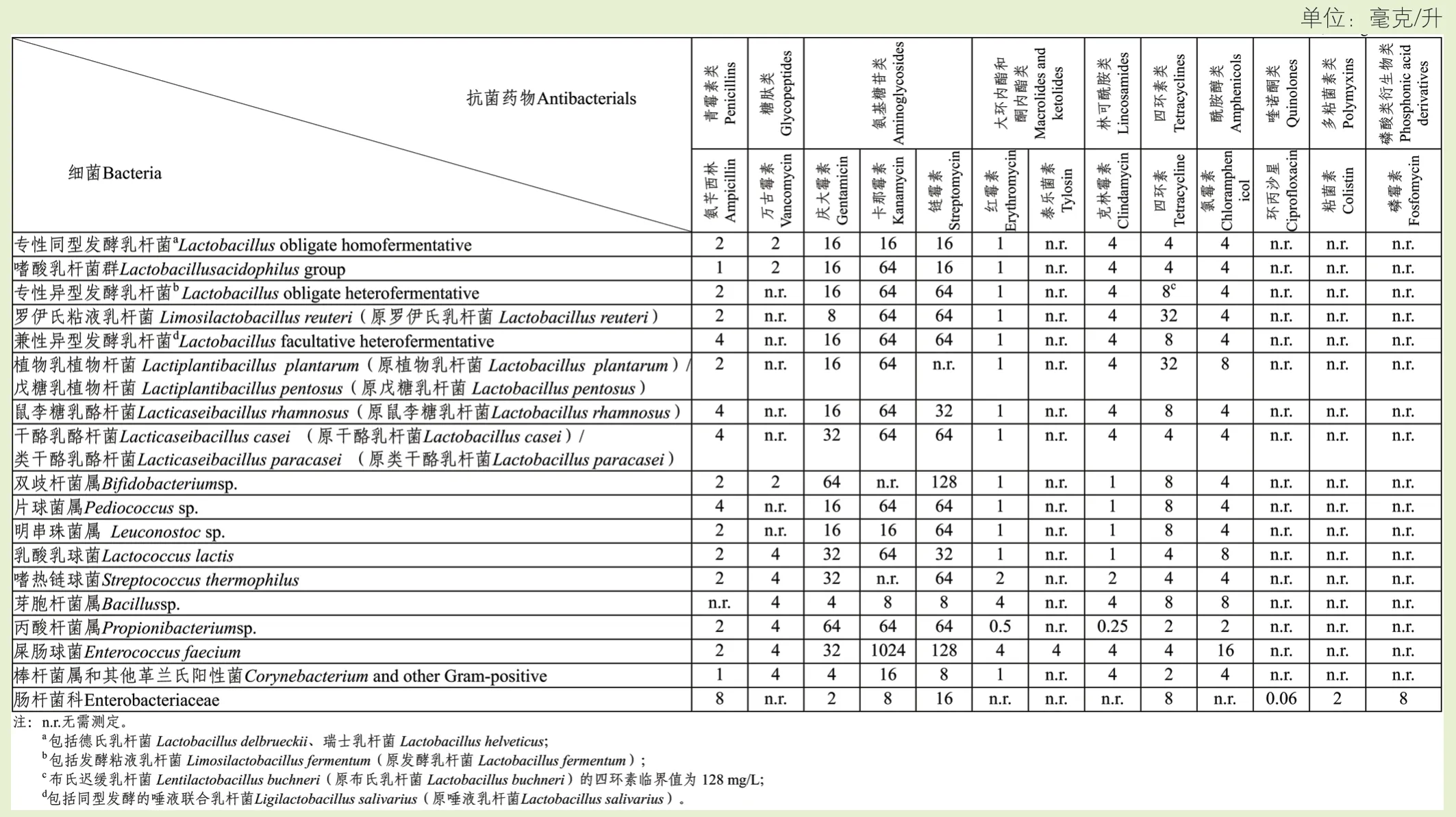
5.4 抗菌藥物敏感性
直接飼喂微生物和發酵制品生產菌株為細菌的,應開展抗菌藥物敏感性評價。通過開展測定抗菌藥物MIC值的表型試驗和WGS分析,評價菌株是否具有獲得性耐藥。
5.4.1 表型試驗
至少對菌株進行附錄D所列抗菌藥物MIC值的測定。對于附錄D中未列出的細菌,革蘭氏陽性菌應選擇附錄D中“棒狀桿菌和其他革蘭氏陽性菌”規定的抗菌藥物,革蘭氏陰性菌應選擇附錄D中“腸桿菌科”規定的抗菌藥物。
MIC值測定應采用瓊脂或肉湯二倍梯度稀釋法進行定量測定,采用國際或國內標準方法,如EUCAST、CLSI、ISO、WS等標準方法。除非抗菌藥物不適用定量方法進行測定,否則不得采用定性或半定量方法(如擴散法)間接測定MIC值。
MIC測定通常應選擇藥物敏感性試驗專用培養基,如Muelle-Hinton或IsoSensitest培養基。對于某些特定菌種或菌株,可以根據微生物特性選擇其他針對性培養基,如某些乳酸菌和雙歧桿菌的乳酸菌藥物敏感性試驗培養基(LSM)。試驗過程中應同時關注培養基組分(如對氨基苯甲酸、胸苷、甘氨酸、二價陽離子等)、試驗類型(肉湯微量稀釋或瓊脂稀釋)和培養條件(如pH、溫度、培養時間)等因素對某些抗菌藥物敏感水平的潛在影響。
通過將測定的MIC值與附錄D中給出的各抗菌藥物的臨界值進行比較,以區分耐藥菌株和敏感菌株。
——MIC值≤臨界值時,認為菌株對該抗菌藥物敏感;
——MIC值>臨界值時,認為菌株對該抗菌藥物耐藥。
對于附錄D中未列出的細菌,測定的MIC值應與該種或相關種的已發表文獻值進行比較。
5.4.2 WGS耐藥基因分析
對菌株WGS進行分析,檢測對用于人或動物的抗菌藥物(WHO發布的CIAs或HIAs)耐藥的編碼基因或起促進作用的基因。對菌株WGS進行分析時,應將其與最新耐藥基因分析數據庫進行比對,如CARD和ResFinder等。分析結果重點關注抗菌藥物耐藥性完整編碼基因,至少應包括如下信息:基因名稱、定位(染色體或質粒)、編碼蛋白的功能、覆蓋度(序列長度覆蓋度≥70%)、相似性百分比(輸入序列與數據庫中序列的匹配度≥80%)和e值(<10-5)等。
5.4.3 結果分析
5.4.3.1 當測定的MIC值≤臨界值(附錄D),若通過WGS分析未發現選定抗菌藥物的耐藥基因,則認為菌株不具有獲得性耐藥;若通過WGS分析檢測到選定抗菌藥物的耐藥基因時,應評估耐藥基因變為活性基因的可能性(如與活性基因序列進行比較等),并進行綜合判斷菌株是否具有獲得性耐藥。
5.4.3.2 當測定的MIC值>臨界值(附錄D),若通過WGS分析未發現與選定抗菌藥物表型相關的已知耐藥基因,則認為菌株不具有獲得性耐藥;若通過WGS分析檢測到與抗菌藥物表型直接相關的已知耐藥基因,則認為菌株具有獲得性耐藥。
5.4.3.3 對所有菌株,若通過WGS分析,發現存在除附錄D中選定抗菌藥物以外的其他CIAs或HIAs的耐藥基因,則應分別測定對應抗菌藥物的MIC值,并與文獻值進行比較:
——當MIC值≤文獻值,應評估耐藥基因變為活性基因的可能性(如與活性基因序列進行比較等),并進行綜合判斷菌株是否具有獲得性耐藥;
——當MIC值>文獻值,則認為菌株具有獲得性耐藥。
5.5 抗菌藥物產生
應對直接飼喂微生物和發酵制品生產菌株是否產生人或動物用抗菌藥物(WHO發布的CIAs或HIAs)進行評價,已知不產生人或動物用抗菌藥物的微生物菌種除外。產品生產過程中若使用任何抗菌藥物,應予以說明。
應評價培養物上清液對抗菌藥物敏感的參考菌株的抑菌活性。推薦EUCAST、CLSI等相關方法中的參考菌株,也可使用國家級菌種保藏中心的等效菌株,也可根據實際生產情況增加參考菌株。若檢測結果顯示擬評價菌株培養物上清液對一種或一種以上參考菌株出現抑菌活性,應對抑菌物質進行鑒定,確定其是否為人或動物用抗菌藥物。
若用于發酵制品的生產菌株能產生人或動物用抗菌藥物,應證明發酵制品中無抗菌藥物殘留。應明確說明用于抗菌藥物殘留檢測樣品的具體采樣階段。樣品應來自工業化生產線,若尚無工業化產品,可采用中試產品。
5.6 生產菌株的遺傳修飾
若發酵制品生產菌株為轉基因微生物,應對菌株遺傳修飾信息進行如下描述。
5.6.1 遺傳修飾目的
說明遺傳修飾的目的,以及遺傳修飾后微生物表型和代謝相關的特性及其變化。
5.6.2 遺傳修飾的序列特征
詳細描述插入、缺失、堿基對置換或移碼突變等遺傳修飾的序列特征。
5.6.2.1 插入序列
轉基因微生物的插入序列可來自于特定生物體,也可以通過設計獲得。當插入的DNA是由不同來源的序列組合而成時,應分別提供每條序列的相關信息。
(1)來源于特定供體的DNA
提供供體生物屬和種水平的分類學信息。若序列來自環境樣品,應提供與其最近的直系同源基因。對插入序列的描述應包括以下內容:
——所有插入元件的核苷酸序列,包括功能注釋以及所有功能元件的物理圖譜;
——插入元件的結構和功能,包括編碼和非編碼區;
——編碼蛋白質的名稱,推導的氨基酸序列和功能,提供編碼酶的EC編號(如有)。
(2)設計序列
設計序列是非自然存在的基因序列,如密碼子優化基因、合理設計嵌合/合成基因或包含嵌合序列的基因等。描述應包括以下內容:
——設計原理和策略;
——DNA序列和功能元件的物理圖譜;
——推導氨基酸序列和編碼蛋白質的功能;
——應通過與最新數據庫(如ENA、NCBI、UniProt等)比對,確定重組蛋白的功能結構域,并描述數據庫中與插入序列相似性最高的蛋白信息。
5.6.2.2 缺失序列
對有意缺失的序列進行描述,并說明預期效果。
5.6.2.3 堿基對替換和移碼突變
應對引入的堿基對替換和/或移碼突變進行說明,并說明其預期效果。
5.6.3 遺傳修飾結構分析
推薦采用WGS進行生產菌株遺傳修飾結構的特征分析。
5.6.3.1 細菌遺傳修飾結構分析
用于新飼料添加劑申報的,應利用WGS分析菌株遺傳修飾的結構特征。應提供包括遺傳修飾的所有基因組區域(染色體、重疊群或質粒)圖譜或圖示的詳細說明,包括:
——插入、修飾或缺失的開放閱讀框(ORF)。應詳細描述每個ORF的基因產物信息,至少包括氨基酸序列、功能和代謝作用。重點描述引入的關注基因,包括毒力/產毒、產臨床相關抗菌藥物、耐藥性等相關基因。
——插入、缺失、修飾的非編碼序列。對序列(如啟動子、終止子等)的作用和功能進行描述。
可通過比較轉基因微生物與未經修飾的受體菌株的WGS完成上述分析。應對用于分析和比較的序列/數據庫及方法進行詳細說明。
5.6.3.2 酵母或絲狀真菌遺傳修飾結構分析
對于可獲得WGS的酵母或絲狀真菌,按照5.6.3.1進行遺傳修飾結構分析。
對于無法獲得WGS的酵母或絲狀真菌,應對遺傳修飾的所有步驟進行描述。所提供的信息應能識別所有可能引入受體微生物中的遺傳物質。主要包括載體特征、遺傳修飾過程、殘留的載體或供體DNA結構及關注基因。
(1)載體特征
描述載體的來源和類型(質粒、噬菌體、病毒、轉座子),若使用了輔助質粒,也應予以描述;提供所有功能元件和其他載體元件位置圖譜,并對該圖譜進行詳細闡述,用以標識每個元件,包括編碼和非編碼序列、復制和轉移的位點、調控元件、耐藥基因及其大小、來源和作用等信息。
(2)遺傳修飾過程信息
應對遺傳修飾過程進行詳細描述,包括DNA插入、缺失、替換或改造至受體的方法,以及篩選轉基因微生物的方法;說明引入的DNA在微生物中的存在位置,明確插入基因是否在載體上,或是插入到染色體和/或真核微生物的細胞器(如線粒體)中。
(3)轉基因微生物中殘留的載體和/或供體核酸結構
詳細說明實際插入、替換或修飾序列的位置圖譜;對于序列缺失的情況,必須提供缺失區域的大小和功能。
(4)關注基因
對插入到轉基因微生物中的任何關注基因進行明確說明。
若在遺傳修飾過程中可能引入關注基因(包括遺傳修飾過程中使用的載體、輔助質粒以及用于轉化的質粒/復制子序列中的關注基因),應通過檢測證明轉基因微生物中不存在該關注基因。
檢測應采用適宜的方法,如Southern雜交或PCR。
——Southern雜交應設置適宜的陽性和陰性對照。應說明所使用探針的長度、位置,瓊脂糖凝膠中DNA的上樣量及印跡前的凝膠圖像。陽性對照的濃度應為生產菌株每個基因組中靶片段的1~10個拷貝。若使用多個探針,則應采用獨立的試驗分別進行測定。
——PCR擴增應設置陽性對照和陰性對照。陽性對照應包括兩種:含有遺傳修飾過程中引入的關注基因的對照;用于排除PCR抑制的對照。
5.7 發酵制品中無生產菌株活細胞評價
發酵制品中應不含有生產菌株活細胞。應詳細描述生產過程中去除或滅活微生物的處理工藝步驟,并通過檢測證明發酵制品中無生產菌株活細胞。
采用可培養方法檢測產品中是否存在生產菌株活細胞。具體的樣品采集、樣品前處理、培養條件、質控試驗和鑒定確認要求見附錄E。
對于由相同上游發酵工藝(包括發酵、提取等)生產的中間產品,經不同后處理工藝(如與載體或稀釋劑混合、包被等)獲得的不同配方添加劑產品,應至少對發酵中間產品進行評價。若為不同發酵生產體系生產的產品,應對每個產品分別評價。
5.8 發酵制品中生產菌株DNA檢測
以下兩類發酵制品應開展生產菌株DNA殘留檢測:
(1)生產菌株為非轉基因微生物,但攜帶獲得性耐藥基因的;
(2)生產菌株為轉基因微生物。
采用特異PCR方法對生產菌株特定DNA片段(如獲得性耐藥基因、遺傳修飾目的基因)進行檢測。特異PCR方法涉及的樣品采集、DNA提取、PCR擴增和質控要求見附錄F。
6 結果判定
本部分僅涉及微生物(直接飼喂微生物和發酵制品生產菌株)相關安全性評價結果。
6.1 直接飼喂微生物
6.1.1 細菌
——不具有獲得性耐藥、不產生臨床相關抗菌藥物、無致病性/產毒能力的菌株判定為無危害。
——具有獲得性耐藥的菌株判定為具有危害,對靶動物和添加劑暴露物種具有風險,不建議用于直接飼喂微生物的生產。
——具有致病性/產毒能力,或產生人或動物用抗菌藥物的菌株判定為具有危害,對敏感靶動物和添加劑暴露物種具有風險,不建議用于直接飼喂微生物的生產。
6.1.2 酵母和絲狀真菌
——無致病性/產毒能力且不產生臨床相關抗菌藥物的菌株判定為無危害。
——具有致病性/產毒能力,或產生人或動物用抗菌藥物的菌株判定為具有危害,對敏感靶動物和添加劑暴露物種具有風險,不建議用于直接飼喂微生物的生產。
6.2 非轉基因發酵制品生產菌株
6.2.1 細菌
——不具有獲得性耐藥、不產生臨床相關抗菌藥物、無致病性/產毒能力的生產菌株判定為無危害,發酵制品無生產菌株引起的風險。
——具有獲得性耐藥的生產菌株判定為具有危害。若生產菌株攜帶獲得性耐藥基因,并且在發酵制品中檢測到長度足以覆蓋耐藥基因的完整DNA片段,則發酵制品對靶動物和暴露物種具有風險,不建議該菌株用于發酵制品的生產;若發酵制品中未檢出生產菌株相關耐藥基因DNA片段,則認為不具有風險。
——具有產毒能力,或產生臨床相關抗菌藥物的生產菌株判定為具有危害,發酵制品對敏感靶動物和暴露物種具有風險,不建議該菌株用于發酵制品的生產,除非證明發酵制品中不存在相關毒素或抗菌藥物。
6.2.2 酵母和絲狀真菌
——不產生臨床相關抗菌藥物且無致病性/產毒能力的生產菌株判定為無危害,發酵制品無生產菌株引起的風險。

——具有產毒能力,或產生臨床相關抗菌藥物的生產菌株判定為具有危害,發酵制品對敏感靶動物和暴露物種具有風險,不建議該菌株用于發酵制品的生產,除非證明發酵制品中不存在相關毒素或抗菌藥物。
6.3 轉基因發酵制品生產菌株
6.3.1 細菌
——不具有獲得性耐藥、不產生臨床相關抗菌藥物、無致病性/產毒能力、遺傳修飾未引入/改變關注基因,且按照5.8所述方法,在發酵制品中未檢出生產菌株重組DNA的生產菌株判定為無危害,發酵制品無生產菌株引起的風險。
——具有獲得性耐藥的生產菌株判定為具有危害。若發酵制品生產菌株攜帶獲得性耐藥基因,并在發酵制品中檢測到耐藥基因的完整DNA片段,則發酵制品對靶動物和暴露物種具有風險,不建議該菌株用于發酵制品的生產;若發酵制品中未檢出生產菌株相關耐藥基因DNA片段,則認為不具有風險。
——若生產菌株具有產毒能力,或產生臨床相關抗菌藥物,則菌株判定為具有危害,發酵制品對敏感靶動物和暴露物種具有風險,不建議該菌株用于發酵制品的生產,除非證明發酵制品中不存在相關毒素或抗菌藥物。
6.3.2 酵母和絲狀真菌
——無致病性/無產毒能力、不產生臨床相關抗菌藥物、遺傳修飾未引入/改變關注基因,且按照5.8所述方法,在發酵制品中未檢出生產菌株重組DNA的菌株判定為無危害,發酵制品無生產菌株引起的風險。
——具有產毒能力,或產生臨床相關抗菌藥物的生產菌株判定為具有危害,發酵制品對敏感靶動物和暴露物種具有風險,不建議該菌株用于發酵制品的生產,除非證明發酵制品中不存在相關毒素或抗菌藥物。
附錄A屎腸球菌致病性評價方法
屎腸球菌(E.faecium)包括兩個類群。其中一個類群主要為分離自健康個體糞便的菌株,其特征是對氨芐西林敏感。另一個類群主要為臨床分離株,其特征是對氨芐西林耐藥。屎腸球菌致病性評價中,除對氨芐西林耐藥性進行評價外,致病島標記基因esp、類糖基水解酶基因hylEfm和標記物IS16也是屎腸球菌評價的關注點。
按照5.4.1的方法測定氨芐西林對屎腸球菌的MIC值。
——若MIC值>2毫克/升,則認為該菌株對氨芐西林耐藥,判定菌株具有致病性。
——若MIC值≤2毫克/升,則認為該菌株對氨芐西林敏感,還應利用WGS分析是否含有遺傳元件esp、hylEfm和IS16。若未檢測到上述三種遺傳元件,則判定該菌株不具有致病性危害。若檢測到上述三種遺傳元件中的一種或多種,則判定該菌株具有致病性。
附錄B芽胞桿菌致病性評價方法
蠟樣芽胞桿菌群(Bacillus cereusgroup)菌種普遍存在產毒能力,不建議將其用于直接飼喂微生物和發酵制品生產。如確需使用,應對菌株進行動物致病性試驗和WGS分析。若動物致病性試驗顯示受試物組動物在試驗期間出現中毒癥狀或死亡,或試驗期間體重等指標與對照組相比有顯著性差異時,則判定菌株具有致病性。若無動物致病性,但WGS分析發現菌株具有腸毒素的編碼基因(如非溶血性腸毒素基因nhe、溶血素BL基因hbl和細胞毒素K基因cytK)及嘔吐素合成酶基因ces或相似基因,則判定菌株具有致病性,除非能證明該基因不具有功能性。
對于蠟樣芽胞桿菌群(B.cereusgroup)以外的其他芽胞桿菌(Bacillusspp.),應通過開展動物致病性試驗或細胞毒性試驗評價菌株致病性。細胞毒性試驗方法如下:
B.1 供試品制備
將菌株接種于腦心浸液肉湯(BHI)培養基中,30℃培養6小時至細胞濃度達到108CFU/毫升以上,15000轉/分鐘室溫離心5分鐘,吸取上清液作為供試品備用。
B.2 Vero細胞檢測
將Vero細胞接種至添加5%胎牛血清的最小必需培養液(MEM),于24孔板中培養2~3天,確認Vero細胞融合后去除培養液,用1毫升預熱(37℃)的MEM培養液洗滌細胞1次。按如下步驟開始檢測:
——每孔中依次加入1毫升預熱(37℃)的低亮氨酸培養液和100微升供試品,37℃孵育2小時。
低亮氨酸培養液配制:在400毫升MEM培養液中分別添加200毫摩爾/升的L-谷氨酰胺10毫升和500毫摩爾/升的N-(2-羥乙基)哌嗪-N’-2-乙烷磺酸(HEPES)緩沖液(pH 7.7)40毫升,加水定容至1升,過濾除菌并分裝備用。
——去除含有供試品的低亮氨酸培養液,每孔加入1毫升預熱(37℃)的低亮氨酸培養液,洗滌1次。
——將8毫升預熱(37℃)的低亮氨酸與16微升14C-亮氨酸(比活度>300毫居里/毫摩爾/升)混合,每孔中加入300微升上述混合物(每孔含25~100 nCi14C-亮氨酸),37℃孵育1小時。
——去除放射性培養液,每孔中加入5%三氯乙酸1毫升,室溫放置10分鐘。去除三氯乙酸,每孔加入1毫升5%三氯乙酸,洗滌2次。
——去除三氯乙酸,每孔加入100毫摩爾/升氫氧化鉀300微升,室溫放置10分鐘。將每孔中的混合物轉移至含有2毫升閃爍液的閃爍管中,渦旋混勻,使用閃爍計數器計數1分鐘放射性。
——未添加供試品的Vero細胞作為陰性對照。可使用具有已知細胞毒性的蠟樣芽胞桿菌菌株的表面活性素(或培養物上清液)作為陽性對照。
按以下公式進行蛋白質合成抑制率計算:

若蛋白質合成抑制率高于20%,則判定菌株具有細胞毒性。
也可使用熒光分光光度計測量Vero細胞懸浮液的碘化丙啶染色法進行細胞毒性試驗。該方法使用培養2天的單層融合Vero細胞。用含碘化丙啶(5微克/毫升)的2毫升 EC緩沖液(含135毫摩爾/升氯化鈉、15毫摩爾/升 HEPES、1毫摩爾/升氯化鎂、1毫摩爾/升氯化鈣和10毫摩爾/升葡萄糖,用Tris調節至pH 7.0~7.1)將細胞調節至終濃度106個/毫升的懸液,置于1厘米石英比色皿中,37℃恒溫保存。向上述細胞懸液中加入100微升供試品,使用磁力攪拌器和攪拌子連續混合細胞,在575/615納米的激發/發射波長和5納米狹縫條件下,每隔30秒進行熒光連續檢測。若檢測結果超過陽性對照(通常為使用清洗劑處理的細胞)熒光/吸光度20%以上,則認為菌株具有細胞毒性。通常情況下,結果無需去除背景熒光。
附錄C數據檢索要求
文獻數據應以結構化方式進行檢索。申請人應盡可能檢索所有相關信息源,并說明采用該信息源的理由。應對文獻數據庫(至少包括農業、醫學數據庫)中以期刊、報告、會議記錄和書籍等形式記錄的文獻進行全面檢索。此外,還應考慮文獻數據庫以外的信息源,如全文期刊的參考文獻列表、會議或組織機構網站等。
文獻檢索至少應涵蓋最近20年的相關信息源。相關文獻列表應通過參考文獻管理軟件進行編輯并提交。對重要文獻應提供復印件。用于新飼料添加劑申報的,申請者必須確保提交的出版物或信息滿足其版權所有者規定的條款。
應詳細記錄并提交檢索方法,相關內容如下:
(1)對于數據庫檢索,至少應包括:
——數據庫名稱和服務提供者;
——檢索日期和檢索時間范圍;
——檢索中使用的任何限制條件,如語言或出版狀態;
——完整的檢索策略(所有項目和設置條件組合)和檢索得到的記錄數量。
(2)文獻數據庫以外的檢索,至少應包括:
a)網站和期刊目錄檢索
——信息源名稱(即網站名稱。若檢索特定目錄,提供期刊名稱);
——網址;
——檢索日期和檢索時間范圍。若檢索目錄,提供檢索日期、卷號和期號;
——檢索方法,如瀏覽、使用搜索引擎或掃描表;
——檢索中使用的任何限制條件(如出版物類型);
——檢索項目和檢索到的相關摘要或全文數量。
b)參考文獻列表檢索
——已掃描參考文獻列表文件的書目詳情;
——檢索到的參考文獻數量。
附錄D細菌不同抗菌藥物的臨界值(Cut-off value)
附錄E發酵制品中無生產菌株活細胞評價方法
E.1 樣品采集
每個發酵制品產品至少取3個批次,每個批次至少取3個樣品進行檢測。樣品應從工業化生產線采集,記錄采樣點所處的具體生產階段。若尚無工業化產品,可采用中試產品,但應明確中試生產工藝(發酵及后處理工藝)具有工業化生產工藝的代表性。
E.2 樣品前處理
每個樣品至少取10克(毫升)進行前處理后制備檢液。如固體樣品:稱取10克,加入90毫升滅菌生理鹽水,充分振蕩混 勻,使其分散混懸,靜置后,取上清液作為1∶10稀釋的檢液。水溶性液體樣品:用滅菌吸管吸取10毫升樣品,加入90毫升滅菌生理鹽水,混勻后制成1∶10稀釋的檢液。至少取10毫升上述檢液進行生產菌株活細胞培養檢測。用于培養檢測的檢液中至少含有1克(毫升)樣品。
E.3 培養條件
采用可培養的方法分析發酵制品中生產菌株活細胞存在情況。選擇適宜的培養條件(包括培養基、培養溫度和時間等),確保生產菌株活細胞生長。應使用最小選擇壓力的培養基(如常用于培養革蘭氏陰性細菌和芽胞桿菌的胰蛋白胨大豆瓊脂培養基、常用于培養酵母的麥芽浸粉瓊脂培養基、常用于培養絲狀真菌的馬鈴薯葡萄糖瓊脂培養基等),延長培養時間(至少長于兩倍常規培養時間)使受損細胞恢復。若菌株能形成芽胞,應采用適宜的萌發程序(如細菌熱處理),使其萌發后進行后續培養。
E.4 質控試驗
培養檢測時,每批次樣品應設置陽性對照,即在每批次其中1個樣品中接種較低數量的生產菌株活細胞(如每個平板10~1000個菌落),以證明所用培養基和培養條件適合于產品中生產菌株活細胞的生長。
應考慮檢測方法的特異性,以避免樣品中污染菌的干擾。
E.5 鑒定確認
樣品經培養后,若平板上長出與陽性對照形態相似的菌落,應通過鑒定確認其是否為生產菌株。
附錄F發酵制品中生產菌株DNA檢測方法
F.1 樣品采集
每個發酵制品產品至少取3個批次,每個批次至少取3個樣品進行檢測。樣品應從工業化生產線采集,記錄采樣點所處的具體生產階段。若尚無工業化產品,可采用中試產品,但應明確中試生產工藝(發酵及后處理工藝)具有工業化生產工藝的代表性。
F.2 DNA提取
至少從1克(毫升)樣品中提取DNA。若上游發酵中間產品濃度高于終產品濃度,可使用上游發酵中間產品提取DNA。對于相同上游發酵工藝生產的中間產品,經不同后處理工藝獲得的不同配方添加劑產品,應對濃度最高的產品進行檢測。若為不同發酵生產體系生產的產品,應對每個添加劑產品分別進行檢測。
應采用適合于生產菌株各類細胞形式(如營養細胞、芽胞)的DNA提取方法,確保能從產品中提取到可能殘留的DNA。
F.3 特異PCR擴增
針對生產菌株的特定DNA片段設計特異性引物,通過PCR檢測生產菌株DNA是否存在。應詳細描述生產菌株的特定DNA片段、特異性引物、聚合酶以及擴增條件等信息。
若生產菌株含有耐藥基因(無論其是否為轉基因微生物),所設計引物的擴增產物應覆蓋耐藥基因的完整DNA片段。
若生產菌株為不含耐藥基因的轉基因微生物,所設計引物應針對遺傳修飾目的基因,其擴增產物不超過1Kb。
F.4 質控
PCR檢測時應當包括以下對照和靈敏度測試:
——將直接從生產菌株中提取的總DNA作為PCR擴增的陽性對照;
——將直接從生產菌株提取的總DNA梯度稀釋后,分別添加至樣品中,提取DNA并進行PCR擴增,計算檢測限;
——將直接從生產菌株提取的總DNA作為排除PCR抑制的陽性對照,即將直接從生產菌株提取的總DNA添加至從樣品中提取的DNA中進行PCR擴增,以檢查樣品DNA中是否存在導致PCR失敗的因素,如存在PCR抑制劑、核酸酶等;
——不含樣品DNA的陰性對照;
——檢測閾值應不高于10納克 DNA/克(毫升)樣品。
附錄G縮略詞
BHI Brain Heart Infusion Broth,腦心浸液肉湯
cescereulidesynthetase gene,嘔吐素合成酶基因
CFU Colony Forming Unit,菌落形成單位
CIA Critically Important Antimicrobial,極為重要抗菌藥物
CLSI Clinical and Laboratory Standard Institute,美國臨床和實驗室標準協會
cytKcytotoxin K gene,細胞毒素K基因
espenterococcal surface protein gene,腸球菌表面蛋白基因
EUCAST European Committee on Antimicrobial Susceptibility Testing,歐洲抗微生物藥敏感試驗委員會
DNA Deoxyribonucleic Acid,脫氧核糖核酸
hblhemolysin BL gene,溶血素BL基因
HEPES 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid,N-(2-羥乙基)哌嗪-N’-2-乙烷磺酸
HIA Highly Important Antimicrobial,高度重要抗菌藥物
hylEfm Putative glycosyl hydrolases gene of Enterococcus faecium,屎腸球菌類糖基水解酶基因
ICSP International Committee on Systematics of Prokaryotes,原核生物系統學國際委員會
ICNP International Code of Nomenclature of Prokaryotes,原核生物國際命名法規
ICN International Code of Nomenclature for algae,fungi,and plants,國際藻類、真菌和植物命名法規
IS16Insertion sequence 16,插入序列16
ISO International Organization for Standardization,國際標準化組織
ITS Internal Transcribed Spacer,核糖體rDNA翻譯間隔序列
LSM LAB susceptibility test medium,乳酸菌藥物敏感性試驗培養基
MEM Minimum Essential Medium,最低必需培養基
MIC Minimum Inhibitory Concentration,最低抑菌濃度
nhenon-hemolytic enterotoxin gene,非溶血性腸毒素基因
ORF Open Reading Frames,開放閱讀框
PCR Polymerase Chain Reaction,聚合酶鏈式反應
WGS Whole Genome Sequence,全基因組序列
WHO World Health Organization,世界衛生組織
附錄H相關網址
BUSCO http://busco.ezlab.org
CARD https://card.mcmaster.ca
CGE http://www.genomicepidemiology.org
ENA http://www.ebi.ac.uk/ena
NCBI https://www.ncbi.nlm.nih.gov
CLSI http://www.clsi.org
PAI DB http://www.paidb.re.kr/about_paidb.php
ResFinder https://cge.cbs.dtu.dk/services/ResFinder
UniProt http://www.uniprot.org
VFDB http://www.mgc.ac.cn/VFs/main.htm