大豆GmWRKY50的抗體制備及其蛋白水平表達分析
范會芬,孫天杰,蘇偉華,肖付明,張 潔,王冬梅
(1.省部共建華北作物改良與調控國家重點實驗室,河北農業大學 生命科學學院,河北省植物生理與分子病理學重點實驗室,河北 保定 071001;2.河北省邯鄲市農業科學院,河北 邯鄲 056001)
大豆(Glycinemax)是重要的經濟作物,在世界食用油生產中占有重要地位[1]。提高產量并保障供應,是大豆生產面臨的重要問題。大豆的產量不僅受到氣候條件和土壤條件(鹽分、干旱和金屬污染)等環境因素的影響,還深受大豆花葉病毒(Soybeanmosaicvirus,SMV)等病原物的危害[2]。大豆花葉病毒侵染引起的大豆花葉病毒病頻繁流行,可導致大豆的株高和莢果數分別下降57%,68%,給大豆生產造成巨大損失[3]。因此,發掘抗病基因,提高大豆產量是保障大豆生產安全的關鍵。
過氧化氫(H2O2)作為活性氧(Reactive oxygen species,ROS)的主要成員之一,在植物免疫應答過程中發揮重要作用[4]。研究發現,細胞可利用其質膜上的NADPH(Nicotinamide adenine dinucleotide phosphate)氧化酶(又稱呼吸爆發氧化酶同系物RBOH)等在胞外產生H2O2。胞外H2O2可進入胞質,進而氧化修飾胞內蛋白質,從而誘導下游信號轉導,以調控生物的生長、發育及其對脅迫的響應[4]。H2O2在植物防御病毒的侵染早期可引起寄主細胞局部壞死,也作為信號分子誘導抗病防御反應[5]。有研究表明,煙草葉片受煙草花葉病毒侵染后,質膜NADPH氧化酶蛋白表達量增加,H2O2水平升高,并且在壞死斑邊緣的細胞壁有胼胝質的積累[6]。利用水楊酸處理煙草葉片,可激活ROS信號通路和誘導胼胝質在胞間連絲上的沉積,抑制番茄花葉病毒(TMV)的擴散[7]。Sun等[8]前期研究結果表明,在大豆與SMV互作體系的不親和組合中,H2O2主要分布在寄主的細胞壁及質膜部位;預注射NADPH氧化酶抑制劑咪唑后,H2O2的產生和胼胝質的沉積均明顯減少,說明H2O2的產生可能主要依賴于NADPH氧化酶,通過參與調控胼胝質在胞間連絲的沉積,完成對病毒胞間轉運的阻斷。
WRKY轉錄因子家族廣泛存在植物細胞中,可調控ROS的產生和清除[9],在植物應對各種生物脅迫的免疫反應中發揮著重要作用[10-11]。研究表明,過表達GhWRKY15基因的煙草植株通過調控ROS信號通路增強了對TMV和黃瓜花葉病毒(CMV)的抗性[9]。在大豆與赤霉菌互作過程中,GmWRKY40能夠與茉莉酸信號途徑抑制因子JAZ蛋白互作,通過激活H2O2合成途徑和抑制H2O2的清除,參與大豆抵抗大豆赤霉病的過程[10]。過表達CsWRKY50能夠提高H2O2的清除能力,增強黃瓜對霜霉病的抗性[12]。
Sun等[8]前期通過高通量測序構建了清除H2O2前后大豆與SMV互作的轉錄組數據庫。本研究在前期工作基礎上,從中篩選得到一個差異表達的WRKY轉錄因子家族成員GmWRKY50,通過原核表達技術獲得了其帶有6×His標簽的純化蛋白并制備了多克隆抗體,利用制備的抗體檢測了GmWRKY50在大豆與SMV互作過程中的蛋白水平表達變化,旨在為進一步闡明GmWRKY50在H2O2調控下參與大豆抵御SMV侵染的功能和分子機制奠定基礎。
1 材料和方法
1.1 試驗材料
1.1.1 大豆的種植 大豆(冀豆7號)由光照強度為10 000 lx的高壓鈉燈進行照射,溫度恒定在25 ℃,光周期為16 h/8 h(L/D)。挑選顆粒飽滿的冀豆7號種子,種植于裝有蛭石的塑料培養盆(直徑為15 cm)中,每盆種植16株。
1.1.2 病毒的繁殖和保存 病毒SMV株系N3的繁殖通過葉片進行,將帶有N3的大豆花葉癥狀明顯的南農1138-2葉片放入標記好取樣日期的1.5 mL的Ep管中,液氮速凍,分批凍存于-80 ℃。葉片保存的時間越長,病毒的活力越弱;通過保存葉片的方法保存病毒,并不能使病毒長存,要及時更新并儲存新繁殖的病毒葉片;病毒的繼代繁殖可以通過接種大豆活體植株進行。將具有明顯花葉癥狀的帶病毒葉片放入研缽中,輔以金剛砂的阻力,加入適量0.01 mol/L磷酸鹽緩沖液(pH值7.0)進行充分研磨,然后作為接種劑進行摩擦接種,用無菌毛刷蘸取研磨液均勻刷在兩周齡的南農1138-2植株的展開葉片及主莖中(增加繁殖效率),每5 d進行一次接種,接種3次,最后一次接種病毒1個月后,觀察新生葉片是否發生了花葉卷曲,并取卷曲葉片進行PCR擴增,驗證葉片是否含有SMV-CP,驗證無誤后進行后續試驗。
1.2 試驗方法
1.2.1 總RNA的提取及cDNA第一條鏈的合成 種植冀豆7號15 d,在3輪復葉接種SMV后48 h取樣,液氮速凍,研磨,并提取RNA(具體步驟參考說明書);經反轉錄試劑反轉為cDNA待用。
1.2.2GmWRKY50基因生物信息學分析 根據轉錄組數據庫中的基因ID為Glyma.17G224800.1在http://soykb.org/網站進行檢索,下載該基因編碼區序列;在NCBI在線搜索并分析該基因片段長度,獲得該基因的核酸序列和蛋白質序列具體信息;同時在NCBI BlastP中搜索大豆、水稻(Oryzasativa)、擬南芥(Arabidopsisthaliana)、煙草(Nicotianatabacum)、蒺藜苜蓿(Medicagotruncatula)等物種中具有相似序列的基因,并進行序列篩選,下載并以FASTA形式保存篩選的序列,運用ClustalW軟件進行序列比對,保存比對結果;使用MEGA 7.0軟件以鄰接法構建發育樹,選擇泊松模型,校驗參數為Bootstrap=500。
1.2.3GmWRKY50原核表達載體構建 根據GmWRKY50的基因序列設計帶有BamH Ⅰ酶切位點的F-ggatccATGACAGACAAAATACCAAAACCACCAC和帶有Hand Ⅲ酶切位點的R-aagcttGGAAGAACTTGGATGAGTGTGGTTG擴增目的基因(小寫字母為酶切位點序列),用T4DNA連接酶連接至pCold Ⅱ并轉化到大腸桿菌菌株Top10中,通過Amp抗性培養基篩選陽性克隆,進行培養并提質粒,雙酶切驗證后,送至北京華大基因科技有限公司進行測序。將構建成功的pCold Ⅱ-GmWRKY50質粒轉化到BL21菌株中,Amp抗性培養基篩選出陽性單克隆。
1.2.4 GmWRKY50重組蛋白的誘導及溶解性分析 將正確的單克隆菌株培養至OD600為0.3~0.4,置于4 ℃ 1 h,然后通過終濃度不同的IPTG,培養不同的時間,以確定最適合的誘導條件。吸取2 mL菌液以7 000 r/min離心后,加入蛋白裂解液(0.5 mmol/L NaCl,20 mmol/L Tris,pH值8.0)60 μL重懸后加入6×Loading Buffer,煮沸10 min,經SDS-PAGE檢測表達量;并通過Western Blotting技術驗證誘導后的目的蛋白是否為帶有His標簽的重組蛋白。檢測具體步驟參考麻楠等[13]的方法,以BSA為陰性對照,取純化后的蛋白進行SDS-PAGE:①將電泳后的凝膠以90 V的電壓轉移至硝酸纖維素膜(PVDF)上,持續50 min;②清洗PVDF膜15 min,其間更換2次TBST緩沖液(2.42 g/L Tris,8.80 g/L NaCl,2 mL/L Tween 20);③用含有5%脫脂奶粉的TBST緩沖液封閉1 h;④用Anti-GmWRKY50進行孵育3 h,抗體稀釋比例為1∶6 000;⑤Anti-His孵育完畢后,用TBST緩沖液清洗PVDF膜15 min,其間更換2次緩沖液;⑥再使用HPR標記的羊抗鼠IgG(為1∶6 000)孵育1 h后,用TBST緩沖液將PVDF膜清洗15 min,其間更換2次緩沖液,直至清洗干凈;并借助Immobilon Western HRP 底物于暗室進行顯影。
根據上述探索的IPTG濃度以及誘導時間進行誘導,收集2 mL誘導后菌體,用400 μL裂解液(PMSF工作濃度為0.05 mmol/L)重懸,超聲波處理10 min(功率90 W,超聲30 s,間隔10 s)后4 ℃離心(12 377 r/min,15 min),分離上清液和沉淀并通過SDS-PAGE檢測。
1.2.5 GmWRKY50蛋白的純化 ①純化過程借助12 mL的親和層析柱,向柱中加入2 mL Ni-NTA SefinoseTMResin,用緩沖液(0.5 mmol/L NaCl和20 mmol/L Tirs,pH值8.0)清洗后,使用配套的篩板對純化介質進行排氣,此過程緩沖液的高度高于篩板,將純化介質壓平整,待用;②將樣品加入盛有純化介質的柱子里,控制流速(約1 mL/min);③分別使用不同咪唑濃度的洗脫緩沖液(表1)洗脫目的蛋白,每種濃度加2 mL,每1 mL收集為1管,分別標記為1和2;④SDS-PAGE檢測純化效果。

表1 緩沖液的制備Tab.1 Buffer preparation mmol/L
1.2.6 收集純化的蛋白 將250 mmol/L咪唑洗脫下來的蛋白進行收集,加入6×Loading Buffer,煮沸10 min,以牛血清白蛋白(BSA)為標準,檢測蛋白洗脫效果。用考馬斯亮藍G-250進行考染觀察,純化的總蛋白量大于2 mg后,送北京華大蛋白質研發中心有限公司進行抗體的制備。
1.2.7 抗體特異性檢測 抗體特異性檢測具體步驟參考1.2.4,提取大豆葉片的總蛋白:將蛋白酶抑制劑(PMSF)終濃度為0.05 mmol/L的蛋白提取液(50 mmol/L Tris、0.15 mol/L NaCl、0.5%NP-40,pH值8.0)加入研磨至粉末狀的樣品中,在渦旋振蕩器上進行充分渦旋,每10 min渦旋1次,渦旋1次1 min,全程在冰上進行,其間補加PMSF。蛋白檢測步驟如1.2.6,該步驟選用的Anti-GmWRKY50稀釋比例為1∶3 000,使用HPR標記的羊抗兔IgG的稀釋比例為1∶4 000。
1.2.8 GmWRKY50在大豆抵抗SMV侵染過程中的表達量變化 GmWRKY50在大豆抵抗SMV侵染過程中的表達量變化,即對大豆葉片蛋白的提取及表達量檢測:具體參考1.2.4和1.2.7。
2 結果與分析
2.1 GmWRKY50基因的克隆及其生物信息學分析和原核表達載體構建
以大豆品種冀豆7號的cDNA為模板,PCR擴增獲得GmWRKY50編碼序列(圖1-A),并對該基因進行了生物信息學分析,結果顯示(圖1-B-E),該基因CDS全長為495 bp,編碼氨基酸165個,含有1個WRKY結構域;從氨基酸序列可以看出,WRKY結構特征為WRKYGKK,鋅指結構特征為C2H2(CX4-CX23-HXH)。
通過NCBI在線檢索GmWRKY50蛋白同源基因,選擇大豆、水稻、擬南芥、煙草、小麥等物種中的相似序列,利用MEGA 7.0軟件進行系統進化樹分析,結果表明(圖1-E),GmWRKY50與模式生物擬南芥AtWRKY50同源關系最近。
A.GmWRKY50基因的克隆;B.GmWRKY50的CDS序列;C.GmWRKY50的氨基酸序列;D.GmWRKY50結構域;E.GmWRKY50系統發育樹分析;F.pCold Ⅱ-GmWRKY50重組質粒的酶切前后對比。A.Cloning of GmWRKY50 gene; B.GmWRKY50 CDS sequence; C.GmWRKY50 amino acid sequence; D.GmWRKY50 domain;E.GmWRKY50 phylogenetic analysis; F.Comparison before and after restriction digestion of pCold Ⅱ-GmWRKY50 recombinant plasmid.
以大豆品種冀豆7號的cDNA為模板,PCR擴增獲得GmWRKY50編碼序列,與pCold Ⅱ質粒重組構建原核表達載體后,進行雙酶切驗證,均在495 bp(圖1-A、F)處有相應大小的條帶,同時測序后序列比對完全正確,說明pCold Ⅱ-GmWRKY50原核表達載體構建成功。
2.2 GmWRKY50融合蛋白的誘導及可溶性分析
為分析GmWRKY50-6×His重組蛋白表達的優化條件,使用不同終濃度的IPTG和不同培養時間進行處理。SDS-PAGE分析發現,IPTG終濃度為0.5 mmol/L、誘導4 h的重組蛋白表達效果良好,高效的表達出了分子量約為18.86 ku的GmWRKY50重組蛋白。以上述條件誘導蛋白表達后,收集菌體進行超聲破碎并離心,分別取上清液及沉淀進行電泳檢測。結果表明,重組蛋白在上清液和沉淀中均表達,取上清液中的重組蛋白進行純化(圖2)。

A.IPTG誘導GmWRKY50的表達;B.檢測誘導的重組蛋白;C.GmWRKY50溶解性分析。A.IPTG induces the expression of GmWRKY50; B.Detection of induced recombinant protein; C.GmWRKY50 solubility analysis.
2.3 GmWRKY50融合蛋白的純化與富集
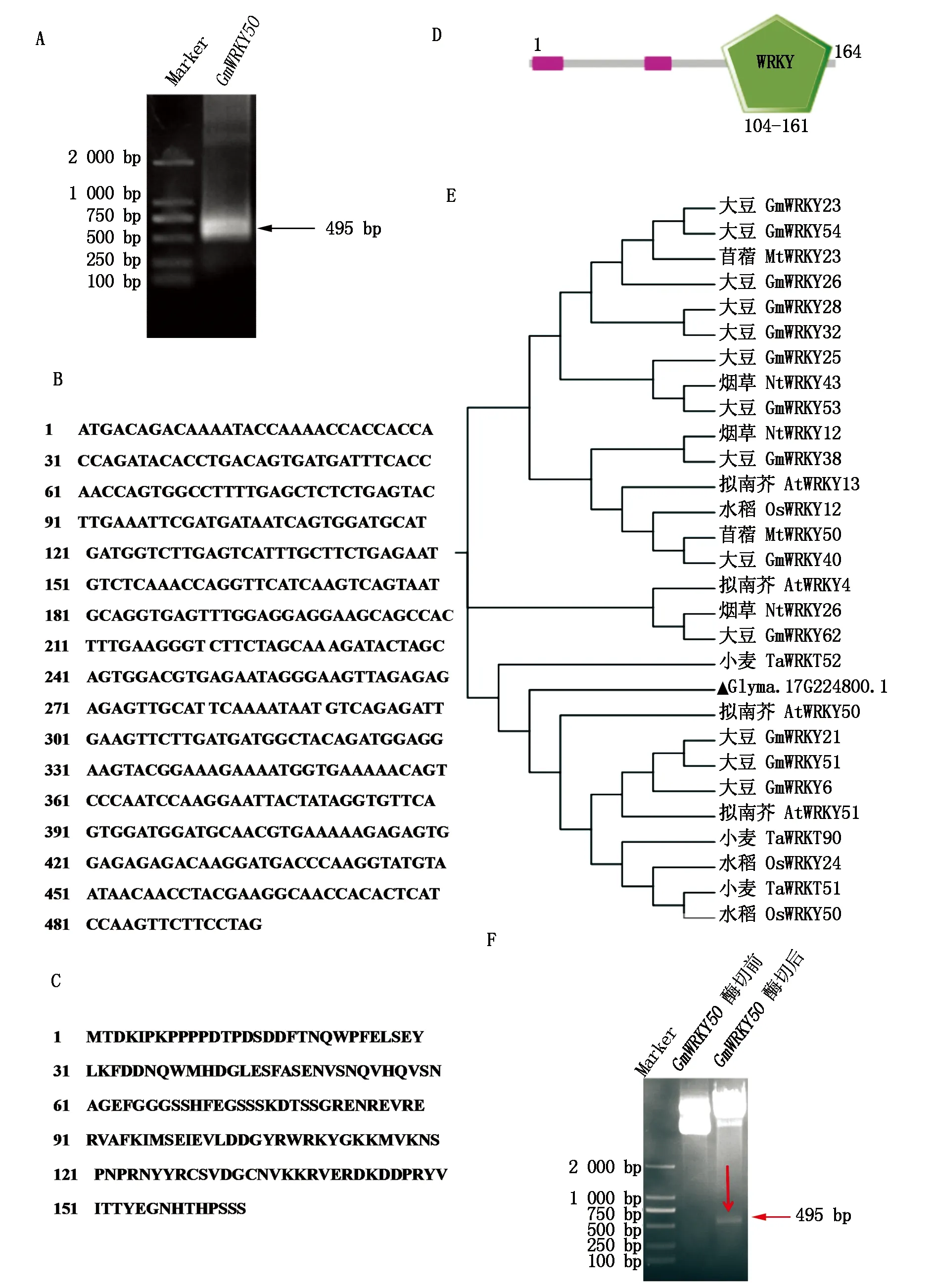
超聲破碎離心后,取上清液,使用Ni-NTA親和純化介質進行GmWRKY50重組蛋白的純化,以表1中純化緩沖液進行洗脫,結果表明(圖3),使用250 mmol/L咪唑洗脫的目的蛋白純度相對較高,且洗脫較為完全。將250 mmol/L咪唑洗脫下來的蛋白進行富集,向洗脫樣品中加入6×Loading Buffer,煮沸5 min,使用12%分離膠、5%濃縮膠的SDS-PAGE檢測蛋白洗脫效果,GmWRKY50的純度較高,且濃度達5 mg/mL以上,將考染后的條帶切下,送北京華大蛋白質研發中心有限公司進行抗體的制備。
1-2.不同濃度咪唑的洗脫液1和洗脫液2。1-2.Eluent 1 and eluent 2 of different concentrations of imidazole.
2.4 GmWRKY50抗體的特異性檢測
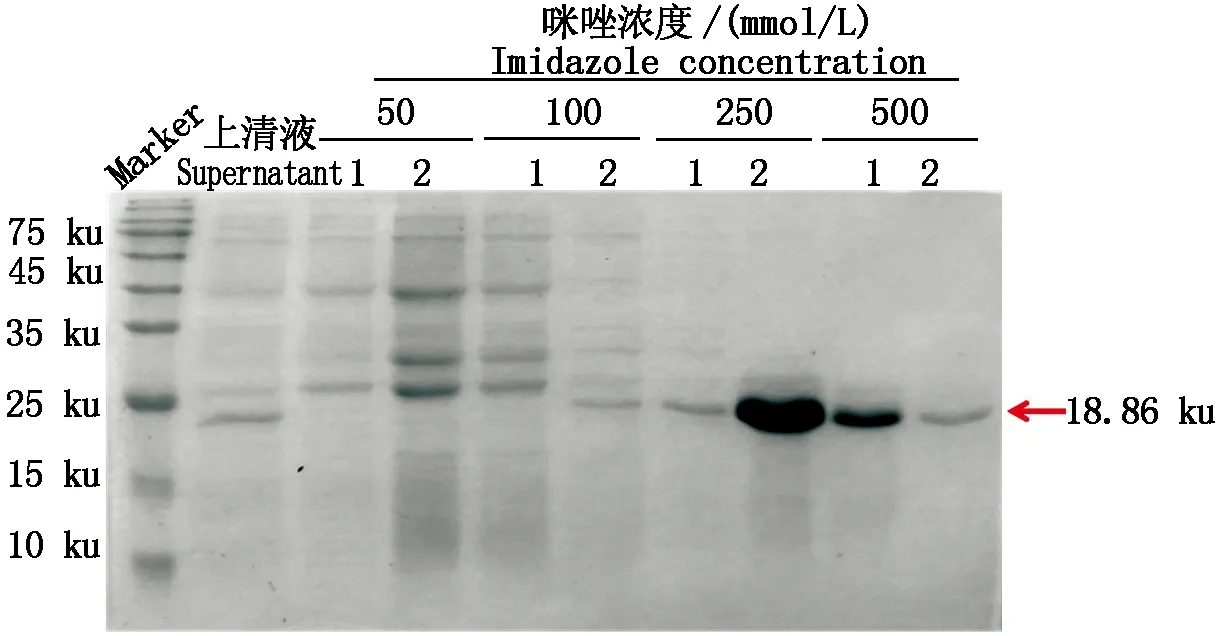
提取大豆葉片總蛋白并進行電泳,借助Western Blotting進一步驗證Anti-GmWRKY50抗體的特異性,結果顯示(圖4),當抗體稀釋比例為1∶3 000時,出現的條帶位置與GmWRKY50預期分子量大小以及誘導后使用Anti-His抗體(1∶6 000)雜交后的位置基本一致,表明該抗體能夠特異性識別GmWRKY50。
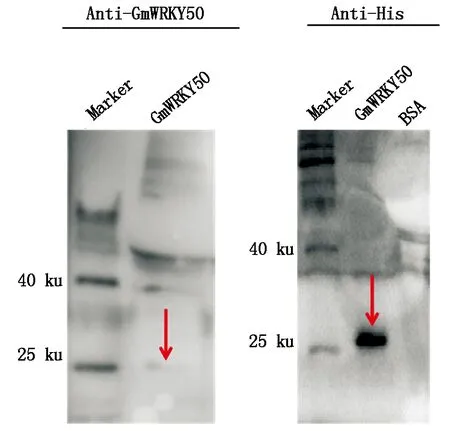
圖4 Anti-GmWRKY50抗體的特異性檢測Fig.4 Specific detection of Anti-GmWRKY50 antibody
2.5 GmWRKY50在大豆與SMV互作過程中的表達量檢測
為了進一步分析大豆中GmWRKY50在抵抗SMV過程中的作用,對大豆葉片接種大豆花葉病毒N3后在0,12,24,48 h進行取樣,并提取葉片總蛋白,檢測GmWRKY50在蛋白水平的表達量變化。結果表明(圖5),SMV侵染12,24,48 h的樣品中GmWRKY50的蛋白水平表達量均高于0 h。說明GmWRKY50受到了SMV侵染的誘導,進一步說明GmWRKY50在蛋白水平響應SMV侵染過程。
GmWRKY50.Western Blotting檢測GmWRKY50;Rubsico.麗春紅染色檢測Rubsico。GmWRKY50.Western Blotting to detect GmWRKY50;Rubsico.Ponceau stain to detect Rubsico.
3 討論
WRKY類轉錄因子是植物特有的,具有1個或2個保守的WRKY結構域(約60個氨基酸)[14]。其分子結構特征為具有保守的肽序列Trp-Arg-Lys-Tyr(WRKY)和鋅指結構域C2HXH[15],WRKY蛋白的核心序列是WRKYGQK。WRKY轉錄因子分為3個家族,將有2個WRKY結構域的分為Ⅰ族[14];有一個WRKY結構域且鋅指結構為HXH的分別為Ⅱ族,為HXC的分為Ⅲ族[14]。Ⅱa-b、Ⅱc、Ⅱd-e是對Ⅱ族的進一步分化;Ⅲ族分為Ⅲa和Ⅲb 2個亞家族。Ⅰ族的鋅指特征CX4-CX22-23HXH,Ⅱa/Ⅱb/Ⅱd/Ⅱe的保守序列為CX5-CX23-24HXH,Ⅱc與Ⅰ族的保守序列相同[15],Ⅲa的保守序列為CX7-CX23-30HXC,而Ⅲb為CX6-9-CX23-30HXC[16]。
目前,擬南芥中已確定的WRKY家族成員有74個[17],煙草中有164個[18],水稻中有111個[19],小麥中有171個[20],大豆中有178個[21]。在不同作物中WRKY結構域經常發生變異。在大豆中,WRKYGQK中的Q優先突變,而W、K和Y相對保守,WRKYGKK突變體較多,該突變影響蛋白質與DNA的相互作用[21];WRKYGKK大多數來自第Ⅱ組WRKY基因家族,這也說明第Ⅱ組WRKY基因的生物學功能更加多樣化[21]。在小麥中發現了3個突變體,分別是WRKYGKK(10)、WRKYGEK(11)和WSKYGQK(1),10個突變為WRKYGKK結構域的轉錄因子分布在Ⅱc亞家族,11個突變為WRKYGEK結構域的轉錄因子分布在Ⅲ族,突變為WSKYGQK結構域的轉錄因子為TaWRKY157[20]。本研究中發現GmWRKY50蛋白中結構域的序列為WRKYGKK-CX4-CX23-HXH,而且在擬南芥中AtWRKY50結構域為同為WRKYGKK-CX4-CX23-HXH[22],在進化發生關系的分析中發現GmWRKY50與AtWRKY50同源關系最近,同為Ⅱc家族的轉錄因子。
為了進一步研究GmWRKY50基因的功能,將GmWRKY50蛋白進行了原核表達,GmWRKY50蛋白的相對分子質量約為18.86 ku,帶6個His標簽,其分子量約為0.84 ku,GmWRKY50-6×His相對質量約為19.70 ku,與電泳檢測結果的大小基本一致,但還是有偏差,尤其是Western Blotting的結果,首先造成這種偏差的原因可能是因為蛋白質翻譯水平后修飾造成了不同的折疊構象,小麥的TCTP蛋白表達亦有類似情況發生[13];出現該現象的另一種原因,可能是用來衡量蛋白質分子量大小的蛋白質Marker可能存在不同程度的偏差。本研究通過該技術獲得了純化蛋白并制備了多克隆抗體,進一步通過蛋白質印跡法證明GmWRKY50在蛋白表達水平響應SMV的侵染。本研究制備的特異性抗體為進一步研究GmWRKY50在響應SMV侵染過程中的功能和作用機制奠定了基礎。

