MsWRKY33蛋白的抗體制備及對非生物逆境的響應
張錦錦,王云平,王 筱,張書興,王學敏
(1.中國農業科學院 北京畜牧獸醫研究所,北京 100193;2.北京匯誠綠洲園林工程有限公司,北京 100125)
WRKY轉錄因子家族在植物中廣泛存在,在擬南芥(Arabidopsisthaliana)[1]、水稻(OryzasativaL.)[2]、大豆(GlycinemaxL.)[3]、玉米(ZeamaysL.)[4]、小麥(TriticumaestivumL.)[5]、棉花(GossypiumhirsutumL.)[6]等植物中均已發現多個WRKY轉錄因子。WRKY轉錄因子家族參與了多種生物學過程,例如種子萌發[7-8]、植物生長和發育[9]、植物衰老[10]等。同時還發現WRKY轉錄因子家族參與了植物體內多種轉錄調控和信號轉導過程[7,11-14],例如生物脅迫和非生物脅迫反應,植物免疫應答和病原體防御[15-16]。WRKY基因的結構域是由60個氨基酸殘基所組成的,由于所有的WRKY轉錄因子都有一段高度保守的WRKYGQK結構域,所以被統稱為WRKY轉錄因子[17]。研究表明,高度保守的WRKY結構域是WRKY轉錄因子最主要的特征,使其能特異識別靶基因啟動子區的W-box(C/TTGACC/T)作用元件,直接或間接結合參與植物信號轉導過程基因的順式作用元件,從而誘導靶基因表達,調控植物各種發育與生理過程。研究證明,WRKY轉錄因子在調控干旱、低溫、鹽堿等脅迫響應途徑中發揮重要作用[18-19]。例如,在擬南芥中過表達AtWRKY25、AtWRKY33基因可提高植株的耐鹽性[20];擬南芥中過表達大豆GsWRKY20基因可以增強轉基因植物的耐旱性[21];在擬南芥中過表達小麥TaWRKY79,當植株受到NaCl和ABA的誘導時,轉基因植株表現出更強的耐受性[22];將大豆GmWRKY21在擬南芥中異源表達,與野生型植株相比,GmWRKY21轉基因植株的耐冷性增強[23]。綜上所述,WRKY蛋白是植物抗非生物脅迫的關鍵因子,但WRKY家族成員眾多,參與的調控網絡也十分復雜,人們對該家族基因的蛋白表達方面了解甚少。
紫花苜蓿(MedicagosativaL.)是一種重要的豆科牧草,在世界各地廣泛種植,因其良好的飼用價值,成為畜牧業的首選青飼料之一[24]。但紫花苜蓿產量嚴重受鹽堿、干旱、溫度等環境條件的制約[25]。紫花苜蓿對非生物逆境的響應是一個非常復雜的過程,目前多從生理生化及分子生物學等角度對其進行解析[26-27]。蛋白質是植物各種生理變化的執行者,隨著蛋白質組學的不斷發展,越來越多的學者更注重蛋白質在植物體中的作用研究。相對于擬南芥、大豆等作物中的WRKY基因的研究,對紫花苜蓿WRKY轉錄因子在蛋白水平的研究鮮有報道。在前期的轉錄組高表達差異基因研究中發現,MsWRKY33基因在多種非生物逆境中均出現高豐度差異表達,推測其可能參與到非生物逆境的響應途徑中,但是具體功能還有待進一步研究。為在蛋白水平上探索紫花苜蓿MsWRKY33基因的生物學功能,本研究以中苜1號紫花苜蓿為材料,對MsWRKY33蛋白結構特性進行了生物信息學分析,并基于抗原-抗體的特異性免疫識別,通過免疫印跡技術分析了多種逆境和ABA處理條件下MsWRKY33蛋白的表達特征。該研究豐富了對MsWRKY33基因功能的認識,并初步分析了MsWRKY33蛋白在紫花苜蓿響應多種非生物逆境中的作用。
1 材料和方法
1.1 試驗材料
中苜1號紫花苜蓿為中國農業科學院北京畜牧獸醫研究所育成品種。
1.2 試驗方法
1.2.1 生物信息學分析 使用ExPASy(https://web.expasy.org/)對MsWRKY33蛋白理化性質進行預測;SMART(http://smart.embl-heidelberg.de/)用于預測MsWRKY33保守功能結構域;使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)預測蛋白跨膜序列;PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)預測信號肽等二級結構;用BEPITOPE軟件對MsWRKY33蛋白進行免疫原性預測。確定該蛋白的免疫原性、可溶性、信號肽及跨膜區域等影響蛋白表達的區域。
1.2.2 MsWRKY33抗原序列的克隆 使用普洛麥格公司的RNA提取試劑盒提取中苜1號紫花苜蓿總RNA;利用Trans Script Green One-Step qRT-PCR反轉錄體系合成cDNA。以cDNA為模板,引物MsWRKY33-F:5′-TCAGGGATCCGGTAGTCATAATCATCCT-3′;MsWRKY33-R:5′-CGTAGTCGACTTAAACATTGTTGTTGTTG-3′,高保真酶TaqPolymerase(TaKaRa)擴增MsWRKY33抗原序列。PCR反應程序為94 ℃ 4 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 45 s,28個循環;72 ℃延伸10 min,1%瓊脂糖凝膠電泳分離擴增的目的條帶,用瓊脂糖凝膠回收試劑盒回收目的片段。用SaIⅠ/BamHⅠ雙酶切該目的片段和連接載體pET-SUMO,T4連接酶連接后轉化大腸桿菌Trans5α,挑取單克隆進行PCR檢測,陽性克隆送上海生工生物工程有限公司測序。
1.2.3 蛋白制備與純化 將測序鑒定正確的重組質粒pET-MsWRKY33轉化大腸桿菌BL21(DE3),挑取含重組質粒的單菌落至1 mL LB(Kan,50 μg/mL)中,37 ℃過夜培養,取10 μL菌液加入相同的250 mL LB培養基中,37 ℃振蕩培養至OD600=0.6,取50 μL液體作為未誘導的對照組,余下的加入IPTG誘導劑至終濃度0.5 mmol/L作為試驗組,兩組繼續在37 ℃振蕩培養3 h。取菌體1 mL,10 360 r/min離心30 s收獲沉淀,用100 μL 1%SDS重懸,混勻,100 ℃ 10 min。10 360 r/min離心10 min,取上清進行SDS-PAGE檢測分析。
大量表達蛋白則取2 mL過夜培養菌液加入2 L LB(Kan,50 μg/mL)培養基中,37 ℃振蕩培養至OD600約0.6,降低溫度到30 ℃。加入IPTG誘導劑至終濃度0.5 mmol/L作為試驗組,30 ℃繼續振蕩培養3 h。收集發酵液,10 360 r/min離心10 min收集菌體,由于重組蛋白端C具有His標簽,可以進行鎳柱親和純化。因此誘導表達后的菌體可懸浮于50 mL預冷的親和層析NTA-0緩沖液中,冰浴超聲波破碎細菌,控制功率為300 W,超聲4 s,暫停4 s,超聲90次。10 360 r/min 4 ℃離心30 min,收集上清以及沉淀。取少量樣品進行聚丙烯酰胺凝膠電泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)檢測,剩余上清及沉淀置于4 ℃備用。
將Ni-NTA樹脂裝入合適的層析柱,用10倍柱床體積的NTA-0 Buffer沖洗。將剩余樣品加到層析柱中,流速控制在0.5 mL/min左右,收集穿透部分。層析用10倍柱床體積的NTA-0 Buffer沖洗,流速控制在1 mL/min左右。分別用10倍柱床體積的NTA-20,NTA-60,NTA-200,NTA-500 Buffer洗脫,流速控制在1 mL/min左右,收集各洗脫峰。SDS-PAGE檢測各組分。純度達到要求的組分,置于透析帶中,4 ℃以1×PBS透析(換液2次)。4 ℃超濾濃縮透析產物。
1.2.4 多克隆抗體的制備與純化 將重組pET-MsWRKY33蛋白作為抗原(2 μg/mL),乳化后進行兔子免疫,總共經過6次免疫,每次免疫中間隔14 d,最后一次免疫3~5 d后心臟取血,4 ℃析出血清,獲得含抗體的血清后用PBS洗滌純化,使用Millipore蛋白濃縮管濃縮到所需體積,經過SDS-PAGE檢測純度,-20 ℃保存,避免反復凍融。同時,重組蛋白作為抗原(2 μg/mL),100 μL/孔加入聚苯乙烯96孔反應板中,4 ℃放置過夜。次日傾去孔內的液體,PBS洗滌3次。加100 μL/孔TBST,室溫放置30 min,PBS洗滌3次。加入含待測抗體的抗血清(取血4 ℃過夜后5 980 r/min離心10 min得上清),將血清按1∶2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000……進行倍比稀釋(以空白血清做陰性對照),每孔100 μL,再加入HRP標記羊抗兔IgG(1∶10 000),100 μL/孔,37 ℃孵育30 min。酶標儀測定450 nm處各孔的吸光度值,陽性反應的最大稀釋度為待測樣品的效價。
1.2.5 樣品處理 選取健康飽滿的中苜1號紫花苜蓿種子,用砂紙輕輕擦出劃痕以除硬實,置于預先鋪好濕潤濾紙的培養皿中萌發,待種子露白后,轉移至1/2 MS液體培養基中,在人工智能溫室中培養。培養條件為:光照16 h,溫度25 ℃,光強400 μmol/(m2·s);黑暗8 h,溫度23 ℃。
①干旱處理:將紫花苜蓿苗置于含15% PEG 6000的1/2 MS營養液中,于處理的0,6,12,24,48 h 5個時間點取樣,液氮速凍后,-80 ℃保存備用。
②鹽處理:將紫花苜蓿苗置于含150 mmol/L NaCl的1/2 MS營養液中,于處理的0,6,12,24,48 h 5個時間點取樣,液氮速凍后,-80 ℃保存備用。
③低溫處理:將紫花苜蓿苗置于4 ℃環境中,于處理的0,6,12,24,48 h 5個時間點取樣,液氮速凍后,-80 ℃保存備用。
④脫落酸(Abscisic acid,ABA)處理:將紫花苜蓿苗置于含0.1 mmol/L ABA的1/2 MS營養液中,于處理的0,6,12,24,48 h 5個時間點取樣,液氮速凍后,-80 ℃保存備用。
1.2.6 蛋白提取 將上述凍存的苜蓿樣品在液氮中充分研磨,每100 mg樣品加入1 mL蛋白質提取液(62.5 mmol/L Tris-HCl,pH=7.4)、10%甘油、0.1% SDS、2 mmol/L EDTA、1 mmol/L PMSF和5%β-巰基乙醇),立即混勻置于冰上30 min,每隔10 min渦旋振蕩1次,10 360 r/min 4 ℃離心20 min,取上清即為總蛋白質,-20 ℃保存備用。
1.2.7 免疫印跡分析(Western Blotting,WB) 將各個處理的蛋白樣品從-20 ℃冰箱中取出,沸煮5 min,10 360 r/min離心30 s。用DYCZ-24K型電泳儀(北京六一生物科技有限公司,北京)進行SDS-PAGE電泳,分離蛋白質,電泳完成后,將膠取下來,依據膠的大小剪取聚氧亞乙烯膜(PVDF)。PVDF膜用100%甲醇處理5 min。用DYCZ-24K型電轉儀(北京六一生物科技有限公司,北京)進行膜轉移:膜心黑色面(負極)在下,按照海綿、3層濾紙、膠、膜、3層濾紙、海綿的結構放置,過程中用玻璃棒趕凈氣泡,放入下槽,在下槽側面放置冰盒,加含SDS的轉移Buffer至刻度線位置,電壓100 V,1 h冰上轉膜。將轉好的PVDF膜取出,置于TBST緩沖液,室溫封閉12 h。在封閉好的膜中加入一抗(MsWRKY33多抗)(1∶1 000)20 μL,室溫孵育5 h,然后用TBST溶液洗3次,每次10 min,再加入二抗(羊抗兔IgG(H+L)-HRP)(1∶10 000),室溫振蕩孵育2 h,用TBS溶液洗膜3次,每次10 min,再用TBS洗10 min,用吸水紙吸干膜上的TBS緩沖溶液,用ECL化學發光劑孵育膜2 min,使用Tanon 5200全自動化學發光圖像分析系統發光成像,檢測蛋白表達結果,并利用圖像處理軟件Image J讀取WB條帶灰度值。
2 結果與分析
2.1 MsWRKY33蛋白生物信息學分析
利用生物信息學預測網站ExPASy對MsWRKY33蛋白理化性質進行預測,該蛋白全長511 aa,蛋白分子式為C1129H1788N320O371S10,理論分子量為57.16 ku,理論等電點為7.02,不穩定指數為50.6,預測是一個不穩定蛋白。此外,該蛋白含有21個酸性氨基酸殘基和21個堿性氨基酸殘基,平均疏水性為-0.314,由此說明MsWRKY33蛋白可能是一個親水性蛋白。使用SMART預測MsWRKY33蛋白在200~450 aa的位置有2個WRKY結構域(圖1-A)。二級結構預測顯示MsWRKY33蛋白主要由無規則卷曲和延伸鏈結構組成,不具有信號肽(圖1-B)和跨膜結構域(圖1-C),不屬于分泌型蛋白。
免疫原性預測顯示,該蛋白免疫原性較強(圖1-D)。該蛋白全長序列較長,一般情況下,蛋白的分子量越大,蛋白的表達難度越大。結合序列的特異性以及B細胞表位覆蓋度,將序列截斷,選用247~457 aa區域重組蛋白制備多抗,確定的表達序列如圖1-E所示。
2.2 MsWRKY33抗原序列的克隆
以中苜1號紫花苜蓿總RNA反轉錄成的cDNA為模板,MsWRKY33-F/R為引物,用PCR的方法擴增出長度為654 bp(247~457 aa)的抗原序列(圖2-A)。將該片段克隆到pET-SUMO表達載體中,轉化后挑取單克隆,利用引物MsWRKY33-F/R進行PCR驗證(圖2-B)。將陽性克隆送北京華大基因生物公司進行測序,克隆的MsWRKY33抗原序列與圖1-E中的蛋白序列相符,沒有突變發生,表明載體已經構建成功。
2.3 蛋白制備與純化
將重組質粒pET-MsWRKY33轉化到大腸桿菌BL21后,未誘導的作為對照組,經IPTG誘導的作為試驗組,收獲沉淀后取上清進行SDS-PAGE,結果如圖3-A,得到小量表達的MsWRKY33蛋白。原核表達的蛋白分為可溶性蛋白和包涵體2種,可溶性蛋白存在于菌體破碎后的上清部分,包涵體為沉淀中的不可溶性蛋白。為獲得較多的可溶性MsWRKY33蛋白,進行了大量表達。使用超聲破碎離心,分離得到上清和沉淀,分別將其純化后再進行SDS-PAGE,結果如圖3-B所示,未經誘導的對照樣品中沒有信號,而在上清、沉淀和純化蛋白質樣品中均出現分子量符合預期的特異信號,表明插入的外源基因片段已經成功在大腸桿菌中表達。再經Ni-NTA樹脂層析柱純化后獲得純化重組蛋白,如圖3-C所示,只檢測出單一的且分子量符合的目標信號,表明已成功獲得了純化重組蛋白。
2.4 多克隆抗體的制備與純化及抗體WB檢測
以純化的MsWRKY33蛋白為免疫原,免疫兔子,得到抗血清,經純化后獲得多克隆抗體。以MsWRKY33純化蛋白包被96孔板,以未免疫的正常兔血清為對照,酶標儀測定抗體效價,結果如圖4所示,當OD450值為2.5時,抗體的稀釋倍數約為16 000左右,即利用這一濃度可以有效地檢測到抗原,表明制備的抗體具有很高的檢測靈敏度。純化后的多克隆抗體經過SDS-PAGE檢測其純度,結果如圖5-A所示。為驗證多克隆抗體的特異性,采用WB進行檢測,結果如圖5-B所示:樣品中沒有可見的背景信號,以天然蛋白(天然蛋白質的分子量為56 ku)作為對照,重組蛋白有分子量為48 ku(23 ku MsWRKY33目的蛋白+25 ku標簽)的特異條帶。上述結果說明,所獲得的MsWRKY33抗體具有較強的特異性。

A.小量表達重組蛋白的SDS-PAGE檢測:1.Marker;2.轉化pET-MsWRKY33未經IPTG誘導的蛋白;3.轉化pET-MsWRKY33經IPTG誘導的蛋白。B.大量表達重組蛋白SDS-PAGE檢測:4.Marker;5.轉化pET-SUMO空載體的總蛋白;6.轉化pET-MsWRKY33未經IPTG誘導的蛋白;7.轉化pET-MsWRKY33經IPTG誘導的蛋白沉淀;8.轉化pET-MsWRKY33經IPTG誘導的蛋白上清。C.純化重組蛋白:9.純化后pET-MsWRKY33蛋白;10.Marker;黑色箭頭表示重組蛋白所在位置。
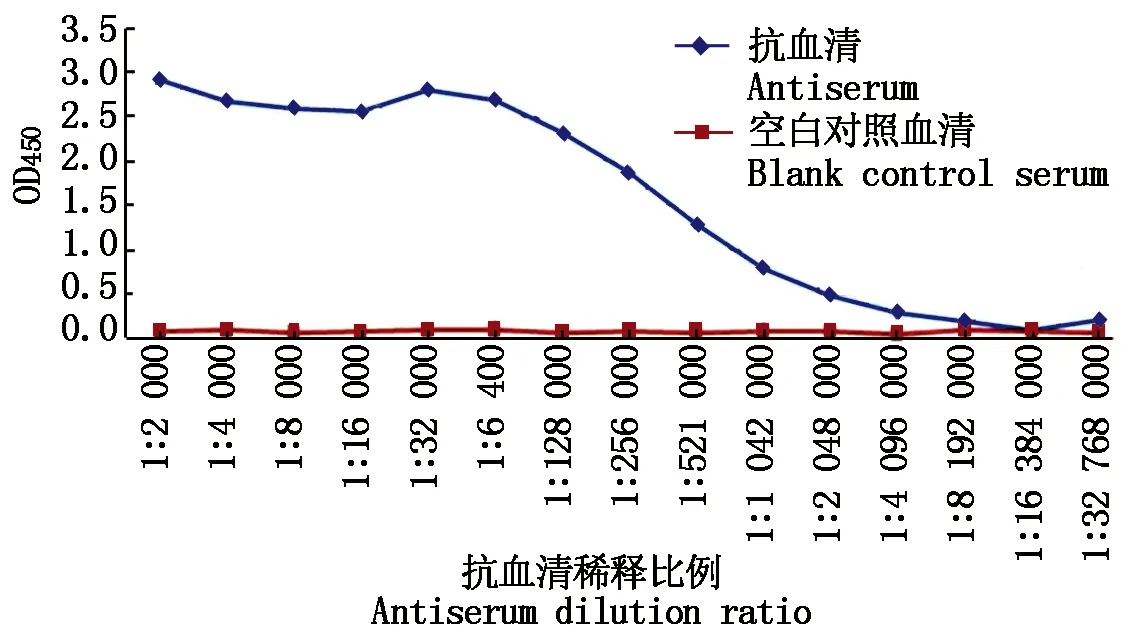
圖4 抗體效價檢測Fig.4 Antibody titer determination
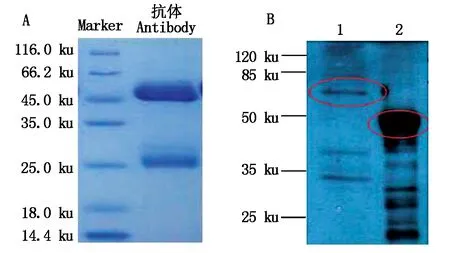
A.MsWRKY33多克隆抗體;B.WB檢測結果:1.天然蛋白;2.重組蛋白;紅色圓圈表示目標蛋白所在位置。
2.5 MsWRKY33蛋白在逆境脅迫下的表達特征
為了解MsWRKY33在鹽、低溫、干旱3種逆境條件和ABA處理下蛋白水平的表達情況,本試驗對中苜1號紫花苜蓿進行了這4種處理,在處理后的0,6,12,24,48 h分別采集了樣品。提取蛋白后用制備的MsWRKY33多克隆抗體進行WB試驗。如圖6所示,用NaCl脅迫處理后,在6,12 h樣品泳道中對應48 ku位置幾乎沒有可見條帶,在24 h樣品泳道目標區域有明顯的條帶,說明處理24 h后蛋白表達量顯著增加,處理48 h蛋白表達豐度又大幅降低(圖6-A),說明鹽脅迫可以誘導MsWRKY33蛋白在紫花苜蓿中的表達。4 ℃、PEG和ABA處理后,MsWRKY33蛋白的表達也均在24 h顯著增加,說明這3種處理也可以誘導MsWRKY33蛋白在紫花苜蓿中的表達。同時利用Image J軟件分析了4個處理下WB條帶的灰度值,從圖6-E可以發現,NaCl處理下MsWRKY33蛋白在24 h的表達豐度明顯強于其他3個處理,高出其他3個處理2~5倍,表明NaCl處理下的蛋白表達高于其他3個處理。在48 h時,只有NaCl處理下MsWRKY33蛋白還有較高的表達,其余3個處理MsWRKY33蛋白的表達均已同0 h一致,說明MsWRKY33蛋白對鹽處理更加敏感且持續。
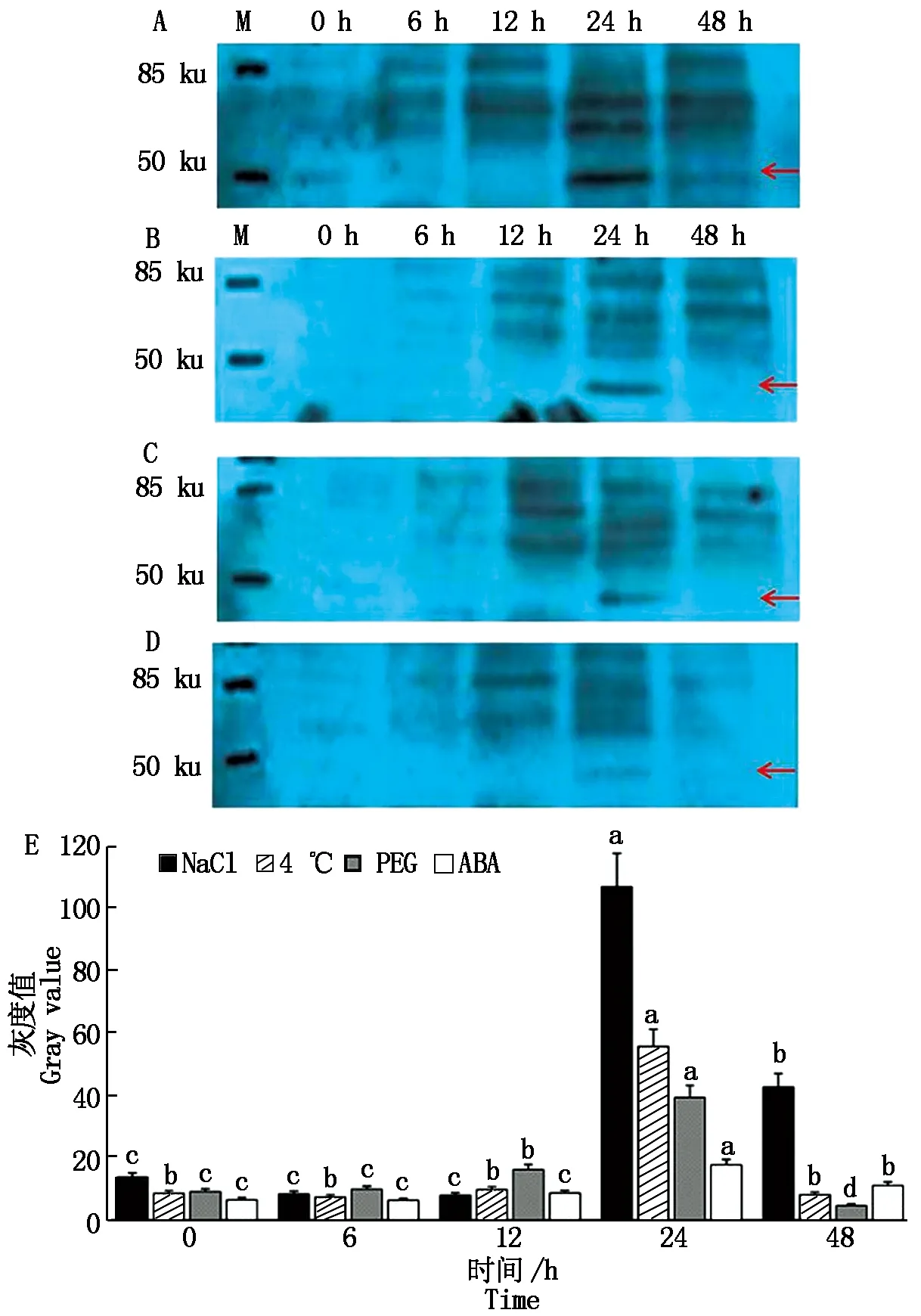
A.NaCl處理;B.4 ℃處理;C.PEG處理;D.ABA處理;E.WB的灰度值分析;紅色箭頭表示MsWRKY33蛋白被脅迫誘導表達時出現的位置;不同小寫字母表示在P<0.05 水平差異顯著。
3 討論與結論
在過去幾十年中,研究者運用原核表達的重組蛋白免疫鼠、兔等動物來制備抗體已經表達了數百種重組蛋白[28]。通過原核表達獲得大量的抗原蛋白,既可用于蛋白質性質與功能研究,也可用于蛋白質的相互作用等生化功能研究[29]。本研究中,將MsWRKY33抗原序列克隆到原核表達載體上,經IPTG誘導實現了MsWRKY33融合蛋白的高效表達。融合蛋白經Ni-NTA親和柱親和層析洗脫后,得到了滿足抗體制備需要的高純度抗原,經免疫小鼠,純化抗血清后得到了效價較高且特異性好的多克隆抗體,該抗體不僅可以識別在大腸桿菌原核表達的MsWRKY33融合蛋白,而且還可以特異識別紫花苜蓿總蛋白中的MsWRKY33蛋白。多克隆抗體的成功制備為進一步研究紫花苜蓿MsWRKY33蛋白功能奠定了基礎。
WB技術由Burnette[30-31]在1981年提出,其原理主要是提出組織總蛋白經SDS-PAGE電泳,分離出大小不同的蛋白質,通過抗原抗體特異結合轉移至PVDF膜上,最后用ECL發光信號檢測蛋白質表達情況。本研究利用制備的MsWRKY33多克隆抗體進行WB試驗,成功檢測到分子量接近于50 ku的重組蛋白。并且研究了鹽、低溫、干旱和ABA這4種脅迫下紫花苜蓿組織中MsWRKY33蛋白的表達情況,初步研究發現MsWRKY33蛋白表達受4種逆境誘導,但在高鹽條件下紫花苜蓿中的MsWRKY33蛋白表達豐度明顯高于其他處理,表明MsWRKY33蛋白在植物響應鹽脅迫過程中可能具有較為重要的作用。馮光燕等[32]在轉錄水平上檢測了鹽脅迫下中苜1號紫花苜蓿中MsWRKY33的表達情況,發現MsWRKY33的表達量在處理前8 h均較低,在處理12 h達到最高水平,后又緩慢降低,在本試驗中,MsWRKY33蛋白水平表達在24 h達到最高水平,可以看出,蛋白表達峰值的到來要晚于轉錄水平。這主要是因為真核基因表達的轉錄和翻譯發生的時間和位點存在時空間隔,其次在轉錄后,又會有轉錄后加工,轉錄產物的降解、翻譯,甚至翻譯后加工及修飾等。所以導致轉錄水平和翻譯水平不完全一致,可能在MsWRKY33蛋白達到峰值的時候mRNA已經開始降解,或者在mRNA達到峰值的時候MsWRKY33蛋白量還在增加中。
通常植物的耐逆途徑是由多個基因控制,一個轉錄因子不僅可以參與多個抗逆途徑,某個耐逆途徑也可以由多個轉錄因子調控[33]。近幾年,越來越多的研究表明,WRKY轉錄因子在傳導逆境信號、調控逆境相關基因中扮演關鍵角色[15]。本研究發現紫花苜蓿MsWRKY33轉錄因子蛋白參與多種非生物逆境脅迫,對鹽脅迫尤其敏感,而鹽脅迫調控網絡主要通過至少2種途徑:ABA依賴和非ABA依賴信號傳導途徑[34]。馮光燕等[32]在轉錄水平上檢測了ABA處理后中苜1號紫花苜蓿中MsWRKY33的表達情況,發現MsWRKY33的表達量在處理12 h達到峰值,且表達豐度較低,在本研究中,經ABA處理后MsWRKY33蛋白的表達豐度也較低,僅在24 h有微弱表達。說明MsWRKY33參與的鹽脅迫調控網絡可能不依賴于ABA信號途徑或ABA信號途徑不是主要途徑。
本研究發現MsWRKY33蛋白不具有信號肽,有較強的蛋白免疫原性,并根據其蛋白特性克隆了MsWRKY33抗原序列,制備了MsWRKY33多克隆抗體。通過WB實驗發現MsWRKY33蛋白對鹽脅迫響應較為敏感,且可能通過非ABA依賴信號傳導途徑參與鹽脅迫調控。

