立足實驗情境 發展核心素養
——以“難溶電解質的溶解平衡”為例
廣東省中山市第二中學(528429) 林增輝
1 教學情境的概述
合理的情境化教學,能有效地調動學生的學習興趣和積極性,因此,教學情境的創設倍受關注,成為了教學的重要組成部分,但教學情境的引入,在豐富課堂教學的同時,也引發了大家的思考。有學者通過剖析多節化學優質課,從“構成”“功能”和“過程特征”3個維度對教學情境進行分析,指出應圍繞教學與評價目標、聚焦學科核心素養等創設教學情境。學者們在課例分析的基礎上,指出了教學情境應用中存在的問題,提出了創設教學情境應該遵循的基本原則,使教學情境的創設越來越有針對性和技術性。
《普通高中化學課程標準(2017年版)》明確提出:倡導真實問題情境的創設,開展以化學實驗為主的多種探究活動。課標明確倡導創設教學情境,這既是對教學情境研究的重視,也是對教學情境功能的期許。但值得一提的是,因為課程標準中出現“真實”字樣,在日常教學中,很多教師把“真實問題情境”理解為“生活情境”,認為只有生活中的問題,才是“真實情境”,才能培養學生的探究能力,忽視了“開展以化學實驗為主的多種探究活動”。筆者認為,生活情境有它的優點,能快速調動學生的生活經驗,增強課堂的趣味性。能讓學生快速進入課堂的角色;但很多生活情境,看似簡單,實則包含了很復雜的內容,學生很難在課堂上用有限的化學知識進行分析,自然也難以達到教學的目的。而實驗情境,則能讓學生利用觀察實驗現象、收集實驗數據,結合化學理論知識進行推理學習,達到深刻理解化學過程的目的。因此,富有探究價值的化學實驗情境,無論是用于學科知識的關聯、學科問題的揭示,還是培養學生的高階思維能力,都能發揮積極的作用。筆者以“難溶電解質的溶解平衡”為例,立足于實驗情境展開教學,成效卓著。
2 基于實驗情境的教學案例
2.1 基于教學情境視角的文獻分析
“難溶電解質的溶解平衡”是一個應用性很強的化學現象,在日常生活和工業生產中很容易找到與之有聯系的內容,很多教師的教學設計都呈現了這一特點。教師選擇了生活中出現的一些化學現象,篩選出學生比較熟悉的內容,輔以合適的教學問題,設計成富含學科意義的情境,給予了學生們開闊的視野和積極的啟發。由于生活情境能讓學生快速進入課堂角色,在本節課中,筆者以“純凈水對人體骨質的影響”為情境教學內容。為了讓學生能更真切地感受難溶物的溶解平衡現象,筆者創設了一系列的實驗情境,在實驗情境中探索難溶物的溶解平衡原理。
2.2 教學內容與學情分析
“難溶電解質的溶解平衡”是人教版化學選修4第3章第4節的內容,這一節主要講授的內容是溶解平衡的概念、平衡移動的影響因素和溶解平衡的應用。在此之前,學生已經學習了離子反應、難溶電解質的概念,也學習了化學平衡、電離平衡和水解平衡等基本理論,因此,本節課的關鍵在于怎樣把“難溶電解質”和“溶解平衡”進行有機融合,落實溶解平衡的基本概念,突破沉淀的生成、溶解和轉化等實際的應用問題,建立基于溶度積的定量分析模型。此外,筆者還注意到了一些學生認知的薄弱點,例如對于難溶的物質,學生往往會認為是絕對不溶的,缺乏“相對性”的意識。又如在判斷平衡移動的方向時,學生還不善于利用平衡常數進行定量的分析,習慣于簡單的定性判斷,思維方法不夠豐富。這些也將是課堂教學需要解決的基本問題。
2.3 教學目標
(1)通過觀察實驗現象,應用化學平衡理論理解、描述難溶電解質的溶解平衡現象。
(2)掌握溶度積常數,并能利用濃度商、溶度積常數進行簡單地計算。
(3)運用定量計算,理解淀沉生成、溶解和轉移的本質,認識沉淀溶解平衡在生活、生產中的作用。
2.4 教學環節設計
2.4.1 環節一:情境引入、宏觀辨識
問題討論:長期喝純凈水,對人的骨骼有什么影響嗎?
設計說明:利用生活常識引發疑問,為什么骨骼中難溶性的鈣鹽會被溶解?
2.4.2 環節二:宏觀辨識與微觀探析
實驗1:向盛有3 mL 0.1 mol/L NaCl溶液的試管(試管①)中滴加5~6滴0.1 mol/L AgNO3溶液。
提問:請問AgCl濁液中是否含有Ag+?
設計說明:氯化鈉過量,可以保證Ag+充分反應,在學生的經驗認識中,AgCl是不溶的,濁液中沒有Ag+。
實驗2:從試管①中取1 mL上層澄清溶液于試管②中,分別往兩支試管中逐滴加入飽和Na2S溶液(注:如能離心分離效果更好)。
設計說明:試管①②均生成黑色沉淀,說明清液中含有Ag+;試管①中原來的白色淀沉也轉變成黑色沉淀。這些現象,有力地沖擊學生的經驗認知,讓學生明白,難溶鹽也是能溶解的。
微觀探析:AgCl濁液中存在Ag+,符合化學平衡“沒有完全反應”的特點,當加入S2-,Ag+與S2-生成Ag2S(s),而繼續加入S2-,白色沉淀逐漸轉化為黑色Ag2S(s),可推斷AgCl(s)發生溶解,生成了Ag2S(s),難溶電解質既存在溶解平衡的現象,也可以發生轉化。
2.4.3 環節三:定量推理與模型認知
問題討論:為什么加入S2-,AgCl(s)會溶解,而Ag2S(s)會生成呢?如何解釋呢?
設計說明:創設疑問,為引入溶度積常數作鋪墊。
模型建立:①濃度商Qc>Ksp,溶液過飽和,生成沉淀;②濃度商Qc=Ksp,溶液飽和,沉淀與溶解處于平衡狀態;③濃度商Qc 2.4.4 環節四:應用模型、深化理解 沉淀反應應用一:沉淀的生成 經過近似計算,在常溫下,當c(OH-)約為10-11mol/L時,也就是pH約為3時,Fe3+幾乎完全沉淀。而當Cu2+完全沉淀時,c(S2-)僅為10-15mol/L的數量級。通過Ksp與Qc的計算,讓學生從定量的角度,了解在生活生產中,如何控制條件,達到沉淀離子的目的。 沉淀反應應用二:沉淀的溶解 微觀探析碳酸鈣溶于鹽酸的原理: 設計說明:在學生的認知中,CaCO3與鹽酸的反應,只是一個靜態的反應方程式,學生并不理解其微觀的反應過程。分析反應過程,讓學生認識到這是一個包含溶解平衡、弱電解質電離平衡的多平衡體系。 問題遷移:水解呈酸性的NH4Cl能否溶解堿性難溶物Mg(OH)2和Fe(OH)3? 實驗3:用小試管取2 mL 0.1 mol/L的MgCl2溶液,滴加5~6滴0.1 mol/L的NaOH溶液,溶液變渾濁。 問題討論:往上述試管中滴加0.1 mol/L的NH4Cl溶液,沉淀能否溶解? 實驗4:往Mg(OH)2懸濁液中滴加0.1 mol/L的NH4Cl溶液,白色渾濁消失。 問題討論:NH4Cl溶液能否溶解Fe(OH)3沉淀? 實驗5:往Fe(OH)3懸濁液中滴加0.1 mol/L的NH4Cl溶液,紅褐色沉淀沒有溶解。 定量分析:用pH試紙測定0.1 mol/L的NH4Cl溶液的pH約5~6,而在前面已經近似計算過,當pH約等于3時,Fe3+已經幾乎沉淀完全,因此,在pH約5~6的區間內,Fe(OH)3沉淀不會溶解。而利用Mg(OH)2的Ksp(1.8×10-11)進行近似計算,當溶液中的c(Mg2+)=0.1 mol/L時,c(OH-)要達到10-5mol/L的數量級才會產生沉淀,即pH要達到9以上,低于9則可促進沉淀的溶解。 設計說明:對于Mg(OH)2和Fe(OH)3這兩種弱堿,如果沒有利用Ksp進行計算,學生無法體會兩者之間的差異,容易產生錯誤的認識,通過實驗探究和定量分析,讓學生進一步理解物質性質的一般性和特殊性。 沉淀反應應用三:沉淀的轉化 (1)由環節二的實驗可知,溶度積小的沉淀可轉化為溶度積更小的沉淀。 (2)工業應用。用Na2CO3將鍋爐上難溶于酸的CaSO4轉化成易溶于酸的CaCO3[Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6]。 設計說明:將實驗室的結論推廣應用于工業生產,是化學學科的一大特色,學以致用,能極大程度地激發學生學習化學的興趣。同時,也可讓學生在實踐中,不斷地檢驗、推理論證理論模型,使化學理論和實踐相互促進。 創設實驗情境,基于實驗現象分析問題,是進行知識論證的有力手段。例如“取AgCl濁液的上層清液與S2-反應”這一實驗,有力地沖擊了學生的經驗認識,也成為了本節課的突破口。因此,通過創設實驗情境,并基于實驗情境,分析實驗的宏觀現象,引導學生從微觀角度進行推理論證,理解反應的本質,能有效地促進學生化學學科思維的發展。 化學是一門以實驗為基礎的科學,實驗的重要性眾所周知,但在開展實驗教學時,應明確實驗是為教學服務的,而不是教學為實驗服務的。實驗是探究、推理論證的途徑,在必要的時候,可適當增加實驗,以提高教學的有效性。在本案例的環節四中,關于沉淀的溶解,筆者設計了氯化銨溶液分別與Mg(OH)2沉淀、Fe(OH)3沉淀反應的實驗,在表面上看,兩者似乎都可以反應,但實驗事實證明,只有Mg(OH)2沉淀能與氯化銨溶液反應。這樣的設計不僅能讓學生深刻體會物質性質的一般性和特殊性,也能讓學生認識到化學實驗的重要性。因此,通過實驗與分析,能有效地突破本節課的重點和難點。 課堂是發展學生學科核心素養的主陣地,但歸根結底是要依靠學科知識進行落實。因此,教師首先必須明確每節課所能承載的素養功能,并有計劃地融入教學設計,最大程度地促進教學目標的達成。在本案例中,筆者從宏觀、微觀、定量和模型四個層次,分別融入了宏觀辨識與微觀探析、科學探究、證據推理與模型認知等核心素養目標,并以實驗情境為載體,促進學生核心素養的發展。

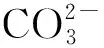
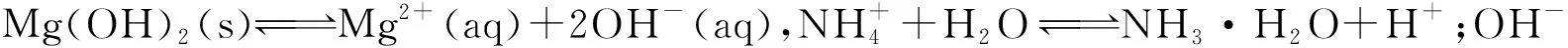
3 結語
3.1 立足實驗教學,發展學科思維
3.2 整合教學素材,突破重點難點
3.3 發展學科素養,達成教學目標

