抗核抗體及抗中性粒細胞胞漿抗體與膽道閉鎖嚴重程度和預后的相關性研究
李軻鑫 劉立偉 李敏 王昱 馬子坤 郭甜甜 孫麗瑩 朱志軍 賈繼東 趙新顏
膽道閉鎖(Biliary atresia,BA)是一種致命性的新生兒纖維炎性膽管破壞性疾病[1, 2],它是新生兒膽汁淤積性肝病的最主要原因,是兒童肝硬化及肝源性死亡的首要原因[3],同時也是兒童肝移植的最主要適應證[4- 5]。其病因尚未明確,發病率為1/3 000~20 000,且在亞洲地區更為常見[3, 6-7]。及時行葛西手術(Kasai procedure,KP)可顯著改善BA預后延長患兒生存期[8- 9],但仍有50%~80%的患兒最終需要行肝移植手術以挽救生命[1, 9, 10]。
近年來的研究表明,體液免疫尤其是自身免疫失調在BA中發揮了重要作用[11-17],但關于BA患兒血漿中自身抗體的報道較少或結果不一致。抗核抗體(Antinuclear antibodies,ANA)及抗中性粒細胞胞漿抗體(Antineutrophil cytoplasmic antibody,ANCA)作為臨床實踐中常見的自身抗體譜可見于多種自身免疫性肝病,但國內尚未系統研究ANA和ANCA在BA中的表達情況及其臨床意義。本研究檢測BA患兒血漿中ANA和ANCA 的表達情況,并分析二者與肝移植術前實驗室檢查、嚴重程度、肝臟病理組織學表現及術后并發癥的相關性,旨在為自身抗體在BA中的預后價值提供實驗依據。
資料與方法
一、研究人群
選取2017年4月至2020年10月于首都醫科大學附屬北京友誼醫院行肝移植手術的BA患兒。納入標準:(1)術中膽道造影確診BA;術后病肝病理學檢查符合BA;(2)外周血和肝組織樣本保存于樣本庫中可以獲取。排除標準:(1)病理診斷不符合BA的其他膽汁淤積性肝病(如進行性家族膽汁淤積性肝病、Alagille綜合征等);(2)患兒或其母親患自身免疫性疾病者(如自身免疫性肝炎、潰瘍性結腸炎、系統性紅斑狼瘡、干燥綜合征、血管炎等);(3)二次肝移植者。本研究方案已通過首都醫科大學附屬北京友誼醫院倫理委員會批準(批件號:2020-P2-226-01)。
二、研究方法
(一)收集患兒術前基礎資料 收集入組患兒的人口學及臨床資料,肝移植術前血常規、肝功能生化及凝血功能指標,計算Child-Pugh評分及兒童終末期肝病模型評分(Pediatric End-stage Liver Disease score,PELD)[18]。
(二)ANCA和ANA檢測 通過酶聯免疫吸附法檢測術前血漿中的抗核抗體譜IgG(歐蒙,中國,EA 1590-9601-8G),包含以下抗原:dsDNA、組蛋白、核糖體P蛋白、nRNP、Sm、SS-A、SS-B、Scl-70、Jo-1和著絲點。血漿樣本進行1∶201稀釋,ANA比值=樣本吸光度值/校準品吸光度值,比值≥1.0為陽性,<1.0為陰性。
通過間接免疫熒光法定性檢測抗中性粒細胞胞漿抗體IgG(歐蒙,中國,FA 1201-1010-13)。血漿樣本進行1∶10稀釋,ANCA陽性定義為抗體滴度≥1∶10,并根據熒光特征分為胞漿型(cANCA)和核周型(pANCA)。
(三)病理組織染色及評分 將肝移植術中切除部分病肝組織固定、包埋,制備石蠟切片,行HE、Masson、網織、銅、鐵染色。根據標準化評分系統對BA患兒的匯管區炎癥、肝纖維化、細膽管膽栓及肝細胞淤膽進行病理組織學評分[19-20]。
(四)肝移植術后隨訪 通過醫院管理系統(HIS系統)進行肝移植的術后隨訪:(1)術后第1周、第2周及第4周的ALT和總膽紅素(Total bilirubin,TBil)的動態變化;(2)術后巨細胞病毒(Cytomegalovirus,CMV)、EB病毒(Epstein Barr virus,EBV)感染,膽道和血管并發癥,排斥反應,肝相關死亡等事件的發生情況。隨訪時間定義為肝移植手術至隨訪1年或死亡的時間。
三、統計學分析
所有數據均采用IBM SPSS Statistics Version 24.0軟件進行分析。正態分布的計量資料用均數±標準差表示,非正態分布則用中位數及四分位數表示,組間比較采用Mann-WhitneyU檢驗或Kruskal-Wallis檢驗;計數資料以頻數和百分比表示,組間比較采用χ2檢驗。相關性分析中,雙變量正態分布計算Pearson積矩相關系數,否則計算Spearman秩相關系數。P<0.05為差異有統計學意義。
結 果
一、BA患兒的人口學特征及臨床資料
根據入排標準,本研究共納入2017年4月至2020年10月于首都醫科大學附屬北京友誼醫院行肝移植手術的BA患兒98例,包括未行葛西手術者30例,葛西術后行肝移植術者68例。入組患兒中,男性52例(53.0%),女性46例(46.9%),中位月齡為9.0月。ALT中位水平198.5(91.3, 434.5)U/L, AST中位水平332.4(139.7, 582.4)U/L,TBil中位水平137.9(38.9, 341.4)μmol/L,總膽汁酸(TBA)中位水平134.2(73.2, 244.2)μmol/L。肝移植術前Child-Pugh評分和PELD評分中位值分別為6.3(8.0, 10.0)和13.0(1.0, 23.8)。肝硬化(S4期)患兒所占比例較高,達71.4%(70/98)。見表1。
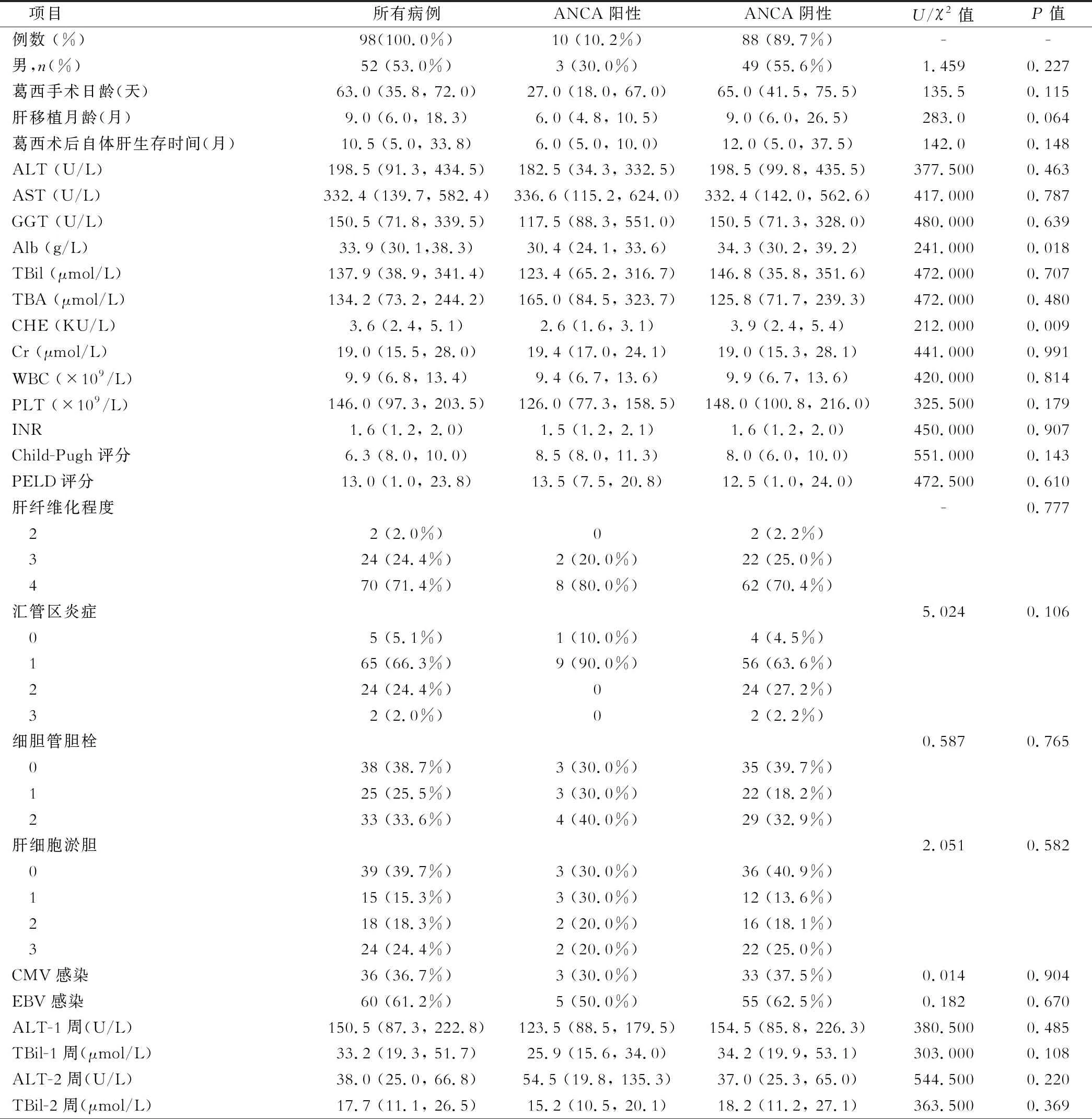
表1 三組BA患兒的人口學特征及臨床資料比較
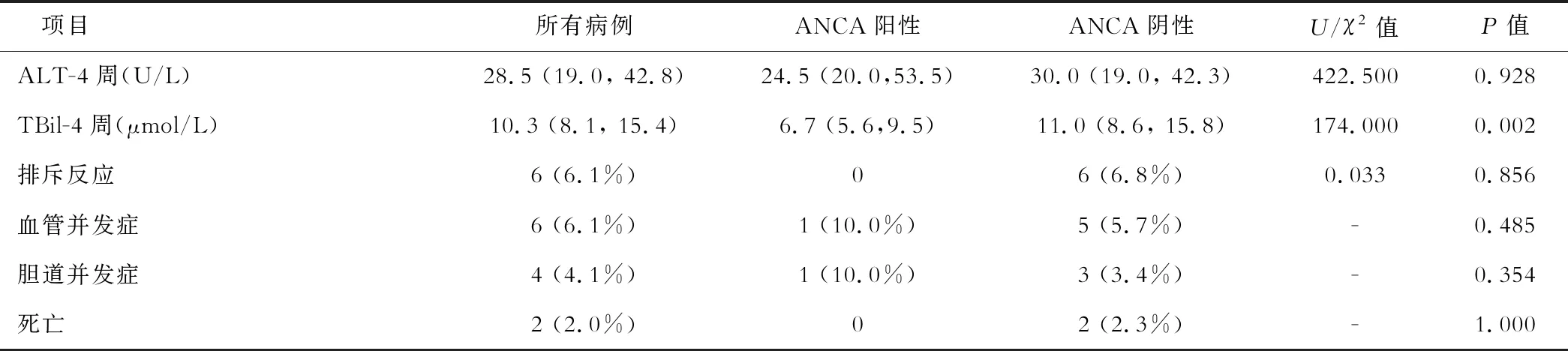
續表1
二、肝移植術后隨訪結果
與術前相比,肝移植術后第1周、第2周、第4周ALT和TBil水平顯著下降(ALT:198.5 vs 150.5 vs 38.0 vs 28.5 U/L,P<0.001;TBil:137.9 vs 33.2 vs 17.7 vs 10.3 μmol/L,P<0.001)。術后非嗜肝性病毒感染率較高,其中CMV感染率為36.7%(36/98),EBV感染率為61.2%(60/98)。出現膽道、血管并發癥,排斥反應,肝相關死亡事件分別為4例(4.1%)、6例(6.1%)、6例(6.1%)、2例(2.0%)。
三、ANA半定量比值與術前嚴重程度、病理組織學評分及術后CMV感染的相關性
90例患兒檢測了血漿抗核抗體,3例(3.3%)ANA陽性,未行葛西手術者2例,葛西術后者1例。ANA半定量比值與術前嚴重程度的相關性分析顯示,ANA半定量比值與Child-Pugh評分和PELD評分均呈正相關,相關系數分別為0.257(P=0.016,圖1A)和0.230(P=0.031,圖1B),但相關程度較弱。而且在葛西術后的BA患兒中,ANA半定量比值隨葛西術后自體肝生存時間的延長而降低(P=0.011,R=-0.326,圖1C)。病理組織學評價中,ANA比值在BA肝硬化(S4期)患兒中顯著升高(P=0.016,表2);存在膽汁淤積的患兒ANA比值更高,且隨著細膽管膽栓程度的加重而升高(P=0.040,表2),肝細胞淤膽≥2分的患兒ANA半定量比值有升高趨勢,但差異無統計學意義;匯管區炎癥程度與ANA半定量比值無顯著差異。肝移植術后發生CMV感染的患兒ANA半定量比值較未發生者顯著升高(P=0.034,表2)。EBV感染者ANA比值有升高趨勢,但差異無統計學意義。ANA半定量比值與術后排異反應、ALT和TBil的動態變化及生存情況未見顯著相關性。
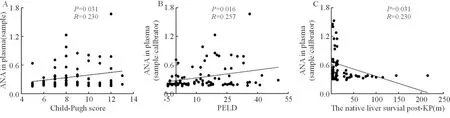
注:肝功能儲備分級(Child-Pugh評分,圖A)、兒童終末期肝病模型(PELD)評分(圖B)均與ANA比值呈正相關;在葛西術后的BA患兒中,ANA半定量比值隨葛西術后自體肝生存時間的延長而降低(圖C)。ANA:抗核抗體;KP:葛西手術;葛西術后自體肝生存時間:葛西手術距肝移植的時間(月)。
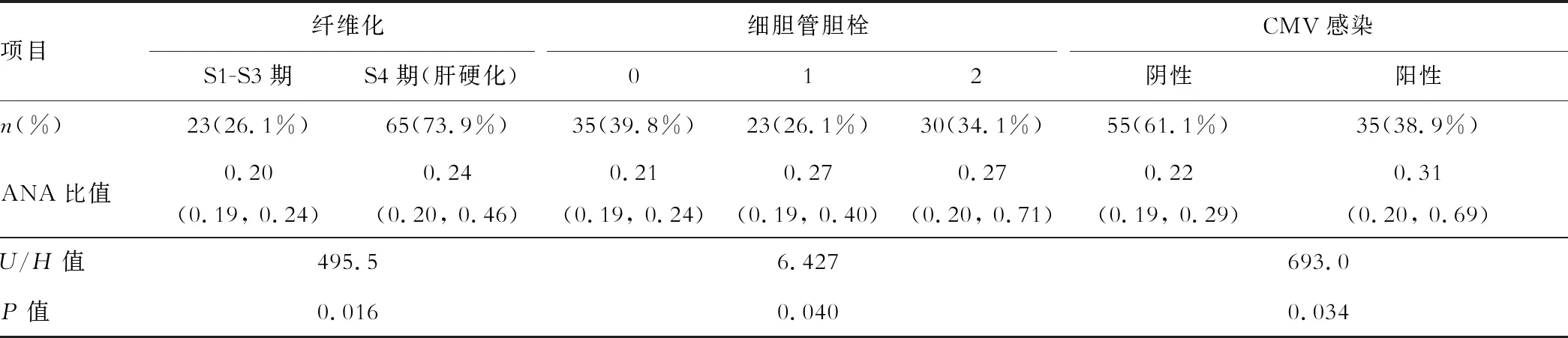
表2 ANA半定量比值與不同病理組織學評分及術后有無CMV感染的比較
四、ANCA陽性患兒Alb、CHE水平顯著降低
BA患兒中有10.2%(10/98)為ANCA陽性,其中1例為cANCA 1∶10陽性,9例為pANCA陽性,1∶10、1∶32、1∶100陽性各3例。
比較ANCA陽性與陰性患兒的術前實驗室檢查發現,ANCA陽性患兒術前的白蛋白(Alb)、膽堿酯酶(CHE)水平顯著低于ANCA陰性者(Alb: 30.4 vs 34.3 g/L,P=0.018; CHE: 2.6 vs 3.9 KU/L,P=0.009,表1),提示ANCA陽性患兒的肝臟合成功能受損更為嚴重;術后第1、2、4周TBil逐漸下降,且同一時間段內ANCA陽性者的TBil更低(34.2 vs 25.9,18.2 vs 15.2,11.0 vs 6.7 μmol/L,表1),復常率更高。ANCA陽性患兒術前病理組織學評分、嚴重程度評分及術后非嗜肝性病毒感染、血管并發癥、膽管并發癥等均與ANCA陰性患兒間差異無統計學意義。
討 論
本研究中BA患者肝移植術前ANA陽性率為3.3%,低于既往研究報道的葛西術前ANA陽性率11.3%[17]。其半定量比值與反映疾病嚴重程度的Child-Pugh評分和PELD評分呈正相關(盡管相關程度弱)。在我們的前期研究中發現,葛西手術可改善BA患兒的肝臟病理[21],而本研究中葛西術后患兒的ANA比值低于未行葛西患兒(0.22 vs 0.26,P=0.087),且ANA比值在有肝硬化的患兒中顯著升高,并隨著膽汁淤積程度的加重而升高,提示ANA比值與BA的病理特征具有一定相關性。
肝移植術前ANCA陽性率(10.2%)同樣低于先前報道的葛西術前ANCA陽性率(29.0%)[17]。肝功能生化指標中,已報道有3種IgM自身抗體水平與TBil和AST正相關[12],而我們發現,ANCA陽性患兒肝移植術前的Alb、CHE水平更低,肝臟的合成功能更差;但術后第1、2、4周ANCA陽性者的TBil水平更低,復常率更高,其機制尚待進一步研究。
在術后并發癥方面,有學者發現ANCA陽性與葛西術后膽管炎發生率呈正相關[17],與CMV感染無關。而本研究中,肝移植后發生CMV感染的患兒ANA比值顯著升高,但與術后膽道、血管并發癥,排異反應,肝相關死亡事件無顯著相關性。
既往研究表明,體液免疫在BA的發病過程中有至關重要的作用,且BA患兒中存在不同程度自身抗體陽性。輪狀病毒感染的BA小鼠模型若缺乏用于抗體產生和抗原呈遞的Ig-α(B細胞受體的組成部分)則不能引起BA,提示B細胞在介導BA的發病過程中起重要作用[14-15]。而且在BA患兒出生后的前幾個月內,其肝臟中的B細胞淋巴細胞增殖持續存在,致病性IgG抗體明顯增加,而B細胞修飾療法可以改善BA小鼠的肝臟病理[11]。這提示B細胞是BA發病過程中必不可少的。以下發現更是提供了BA中存在自身抗體的直接證據:BA患兒中發現了沿肝外膽管上皮基底膜沉積的IgM或IgG[16]、血清中可檢測到自身免疫性肝病相關的自身抗體[17]以及動物模型中發現的抗α-烯醇酶(膽管上皮抗原)自身抗體[13]。
本研究發現,BA患兒血漿中的ANA及ANCA與疾病的嚴重程度和預后具有相關性,并首次發現ANA半定量比值與BA病理特征中肝硬化(S4期)和膽汁淤積程度相關。目前BA的確診依賴于術中膽管造影和肝活檢等侵入性診斷方法[11, 22],自身抗體能否作為新的特異性標志物用于BA的無創診斷,尚有待展開進一步的研究。本研究為單中心回顧性研究,入組患兒處于疾病終末期,病情較重,不能完全代表疾病早期及BA的普遍情況。

