Ni/N-rGO催化苯酚選擇性加氫制備環己酮性能
黃國強,徐海升,李善建,郜鵬程
(西安石油大學 化學化工學院,陜西 西安 710065)
隨著化石能源儲量的逐漸減少以及生態環境問題的日益凸顯,尋找和開發新型環保能源已成為亟待解決的問題[1-2]。生物質經熱解或液化得到的生物質油被認為是潛在的化石燃料替代品,但生物質油的氧含量較高,導致生物質油黏度高、熱值低、化學穩定性差,這嚴重影響了其廣泛應用[3-5]。加氫脫氧(HDO)或選擇性加氫被認為是提高生物質油性能及獲取高附加值產品的有效方法[6-7]。苯酚常作為生物質油模型化合物用于加氫反應探究[8]。
苯酚選擇性加氫制備環己酮并及時分離,可實現間接脫氧的同時獲取高附加值產品,具有較高的研究價值。苯酚選擇性加氫制備環己酮的反應歷程為苯酚首先加氫生成環己烯醇,環己烯醇經過烯醇式異構化得到環己酮,但環己酮不穩定會繼續加氫生成環己醇[9]。因此,提高苯酚轉化效率的同時提高環己酮選擇性是該研究的主要目的。研究發現,苯酚在催化劑表面的吸附方式對催化產物選擇性有顯著影響[9-10]。在酸性位點,苯環和載體之間以共平面方式吸附,二者吸附作用較強,不利于環己酮脫附,所以更容易過度加氫生成環己醇;在堿性位點,苯環和載體之間以非共平面方式吸附,有利于環己酮脫附[11]。因此,筆者通過水熱法合成了氮摻雜還原氧化石墨烯(N-rGO)載體,然后采用浸漬法制備了不同鎳負載量的Ni/N-rGO催化劑,將其用于苯酚選擇性加氫制備環己酮反應。考察了催化劑制備及加氫反應條件對催化劑活性和環己酮選擇性的影響,并通過正交實驗確定了最佳反應條件。
1 實驗部分
1.1 原料和試劑
鱗片石墨,安徽安特生物化學有限公司產品;硝酸鈉、過氧化氫(質量分數30%)、氫氧化鈉、苯酚、環己酮,天津市科密歐化學試劑有限公司產品;2,4-二硝基苯肼,上海科豐實業有限公司產品;濃硫酸,四川西隴科學有限公司產品;濃鹽酸,西安雁塔化學試劑廠產品;高錳酸鉀,天津市北聯精細化學品開發有限公司產品;Ni(NO3)2·6H2O,天津市華東試劑廠產品;尿素,天津永晟精細化工有限公司產品;無水乙醇,天津市大茂化學試劑廠產品。以上試劑均為分析純。
1.2 實驗儀器
DZF-6050AB型真空干燥箱,上海坤天實驗儀器有限公司生產;SHZ-D(Ⅲ)型循環水真空泵,上海邦西儀器科技有限公司生產;L-500型離心機,上海利鑫堅離心機有限公司生產;KQ 5200B型超聲波清洗器,昆山市超聲儀器有限公司生產;FA 1004型分析電子天平,上海精科天平儀器廠生產;DF-101S型集熱式恒溫加熱磁力攪拌器,上海棱標儀器有限公司生產;GW 300型變頻高溫滾子加熱爐,青島同春石油儀器有限公司生產;UV-2600型紫外可見分光光度計,日本島津公司生產;100 mL間歇式高溫高壓反應釜,西安太康科技有限公司生產;ASAP 2020型N2吸附-脫附測定儀,美國麥克公司生產;D8 ADVANCE型X射線衍射儀,德國Bruker公司生產;Quanta 600 FEG型掃描電鏡,美國FEI公司生產。
1.3 催化劑制備
通過一步水熱法制備得到N-rGO載體。稱取一定量采用改進Hummers法合成的氧化石墨烯(GO)加入去離子水[12-13],超聲處理2 h,得到高度分散的1 mg/mL氧化石墨烯分散液,以尿素為氮源和還原劑,按照GO與尿素質量比為1∶30緩慢將尿素加入GO分散液中,室溫繼續超聲攪拌0.5 h后倒入500 mL水熱反應釜,在變頻高溫滾子加熱爐中于180 ℃水熱反應12 h,反應結束后,將反應釜中的懸浮液離心,抽濾離心管下層固體,并用去離子水和無水乙醇反復洗滌至中性,然后在真空干燥箱中充分干燥,得到N-rGO[14]。
采用浸漬法制備Ni/N-rGO催化劑。稱取一定量的N-rGO作為載體,按比例加入0.1 mol/L的Ni(NO3)2水溶液,常溫下磁力攪拌2 h,浸漬12 h后于70 ℃水浴中恒溫攪拌蒸干浸漬液中的水分,將樣品放置在烘箱中充分干燥;然后在氮氣保護下于管式爐中400 ℃焙燒4 h,最后在氫氣氣氛中以5 ℃/min 的升溫速率升至450 ℃還原2 h,得到鎳基Ni/N-rGO催化劑。將鎳負載量(質量分數,下同)為10%、20%、30%的催化劑分別記為10%Ni/N-rGO、20%Ni/N-rGO、30%Ni/N-rGO。
1.4 催化劑表征
采用美國Micromeritics公司生產的ASAP 2020型N2吸附-脫附儀測定Ni/N-rGO催化劑的比表面積(BET法)、平均孔徑和孔體積(BJH法);采用德國Bruker公司生產的D8 ADVANCE型X射線衍射儀測定催化劑晶相結構,Cu靶輻射,管電壓為40 kV,管電流為30 mA,掃描速率為5 °/min,掃描范圍為10°~80°;采用美國FEI公司生產的Quanta 600 FEG型掃描電鏡表征催化劑表面形貌和粒度分布情況。
1.5 催化劑性能評價
將制備的Ni/N-rGO催化劑和苯酚溶液裝填到100 mL間歇式高溫高壓反應釜中,在給定實驗條件下通入氫氣進行苯酚催化加氫實驗。實驗結束后,準確稱量反應結束后收集液的質量和體積,通過UV-2600型紫外可見分光光度計測定收集液中苯酚和環己酮的吸光度,然后根據苯酚和環己酮的標準曲線計算得到產物中苯酚和環己酮的質量[8],進一步由式(1)、式(2)計算苯酚轉化率(x,%)和環己酮選擇性(s,%)。
(1)
(2)
式(1)和式(2)中:mp表示反應的苯酚質量,g;mp0表示苯酚初始的質量,g;mc表示生成環己酮的質量,g。
2 結果與討論
2.1 催化劑表征
2.1.1 N2吸附-脫附表征
表1列出了N-rGO載體及不同鎳負載量催化劑樣品的比表面積及孔結構性質。
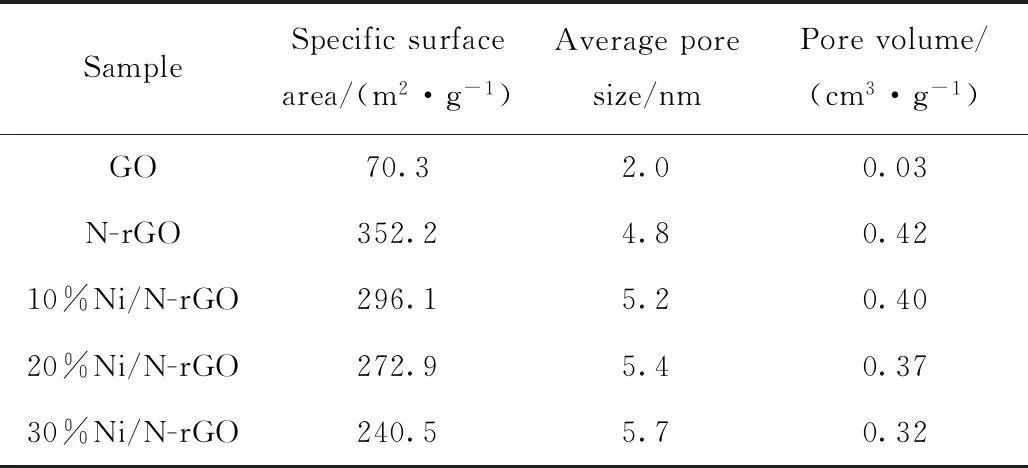
表1 載體及各催化劑樣品的物理結構性質Table 1 Physical structural properties of each catalyst
由表1可知:N-rGO載體的比表面積、平均孔徑、孔體積較GO明顯增加,這可能是摻氮后GO片層間的大量含氧基團被去除,石墨片層間產生了空隙,因此N-rGO物性參數急劇增大;負載金屬鎳后,催化劑的比表面積和孔體積都有所下降但平均孔徑有所提高,隨著鎳負載量增加這一現象更加明顯。這可能是負載金屬后,金屬顆粒占據了載體的表面,導致催化劑比表面積下降;催化劑平均孔徑增大可能是由于其表面的小孔優先被金屬顆粒堵塞造成的。
2.1.2 XRD表征
圖1為不同鎳負載量催化劑樣品的XRD譜圖。

N-rGO—N-doped reduced graphene oxide圖1 不同鎳負載量催化劑樣品的XRD譜圖Fig.1 XRD patterns of catalysts with different nickel loadings
由圖1可知:2θ在25.6°對應N-rGO的(002)晶面衍射峰,N-rGO的(002)晶面衍射峰寬而彌散,是非晶態碳材料的特征;2θ在44.5°、51.7°和76.3°對應Ni的(111)、(200)、(220)晶面衍射峰。隨著鎳負載量的增加,鎳的晶面衍射峰越來越尖銳且強度越強,但N-rGO的(002)晶面衍射峰不斷變小,可能是負載量較少時,金屬鎳分散均勻且金屬尺寸較小;當鎳負載量為30%時,可能是金屬鎳發生團聚金屬顆粒變大覆蓋了載體表面,導致N-rGO的(002)晶面衍射峰變小。
2.1.3 SEM表征
圖2為載體N-rGO和20%Ni/N-rGO催化劑樣品的SEM照片。由圖2可知:N-rGO載體呈大片層狀結構,表面有較多透明、無序薄紗狀褶皺,說明氮摻雜引入了較多的缺陷位;負載金屬鎳后N-rGO載體表面變的粗糙,有較多顆粒狀物質,說明金屬鎳負載成功且金屬鎳顆粒較小,分散相對均勻,局部有明顯的大顆粒出現,為鎳的團聚現象。

圖2 載體N-rGO和20%Ni/N-rGO催化劑樣品的SEM照片Fig.2 SEM images of carrier N-doped reduced graphene oxide (N-rGO)and 20%Ni/N-rGO catalysts(a)N-rGO;(b)Ni/N-rGO
2.2 Ni/N-rGO催化劑催化苯酚選擇性加氫反應性能
2.2.1 鎳負載量對催化劑反應性能的影響
在反應溫度為150 ℃、反應壓力為0.4 MPa、反應時間為2.0 h、Ni/N-rGO催化劑/苯酚質量比(簡稱劑/酚質量比)為0.35的條件下,考察鎳負載量對苯酚選擇性加氫制環己酮的影響,結果如圖3所示。

x—The conversion rate of phenol;s—The selectivity of cyclohexanone圖3 鎳負載量對Ni/N-rGO催化劑催化苯酚加氫制環己酮的影響Fig.3 Effect of nickel loading on hydrogenation of phenol to cyclohexanone catalyzed by Ni/N-rGO catalystReaction conditions:T=150 ℃;p=0.4 MPa;t=2.0 h;m(Ni/N-rGO)/m(Phenol)=0.35
由圖3可見,隨著鎳負載量的增加,苯酚轉化率、環己酮選擇性均先增大后減小。當鎳負載量為20%時,苯酚轉化率達到92.23%,環己酮選擇性最高為60.70%。這是因為當鎳負載量較低時,催化劑表面活性中心較少,加氫反應不完全,致使苯酚轉化率及環己酮選擇性都較低;當鎳負載量較高時,金屬鎳容易在催化劑表面團聚,堵塞催化劑孔道結構,致使催化活性和產物選擇性降低。
2.2.2 尿素/GO質量比對催化劑反應性能的影響
在反應溫度為150 ℃、反應壓力為0.4 MPa、反應時間為2.0 h、劑/酚質量比為0.35的條件下,考察尿素/GO質量比對苯酚選擇性加氫制環己酮的影響,結果如圖4所示。

x—The conversion rate of phenol;s—The selectivity of cyclohexanone;GO—Graphite oxide圖4 尿素/GO質量比對20%Ni/N-rGO催化劑催化苯酚加氫制環己酮的影響Fig.4 Effect of urea to GO mass ratio on hydrogenation of phenol to cyclohexanone catalyzed by 20%Ni/N-rGO catalystReaction conditions:T=150 ℃;p=0.4 MPa;t=2.0 h;m(Ni/N-rGO)/m(Phenol)=0.35
由圖4可見,隨著尿素添加量的增加,苯酚轉化率逐漸提高,環己酮選擇性呈先增大后減小的趨勢。當尿素/GO質量比為30時,苯酚轉化率為90.54%,環己酮選擇性最高為62.19%。分析其原因可能是隨著尿素含量增加,較多的氮原子摻雜到石墨烯中使得催化劑活性位增多;氮原子富電子特性能給活性金屬Ni提供電子進而活化更多的氫,使得催化劑活性提高[15];且研究表明[16],適當的氮摻雜可形成OH—N或OH—π相互作用,致使苯酚以非共平面方式吸附在載體上,有利于環己酮從石墨烯表面快速脫附進而提高環己酮選擇性。隨著尿素添加量過高,金屬Ni和載體之間相互作用進一步加強,部分未脫附的環己酮會繼續加氫生成副產物,導致環己酮選擇性下降。
2.2.3 H2還原溫度對催化劑反應性能的影響
在反應溫度為150 ℃、反應壓力為0.4 MPa、反應時間為2.0 h、劑/酚質量比為0.35的條件下,考察H2還原溫度對苯酚選擇性加氫制環己酮的影響,結果如圖5所示。
由圖5可見,隨著氫氣還原溫度的上升,苯酚轉化率先快速升高后趨于下降,環己酮選擇性呈先增大后減小的趨勢。當還原溫度為450 ℃時,苯酚轉化率達到91.37%,環己酮選擇性最高為61.03%。這是因為當還原溫度較低時,只有少部分的NiO被還原,催化劑活性較低;隨著還原溫度升高,較多的NiO開始被還原,因此催化劑活性和環己酮選擇性都快速提升[17];當溫度達到500 ℃時,可能是還原溫度過高導致部分還原態金屬Ni發生了團聚,進而導致苯酚轉化率和環己酮選擇性都有所下降。
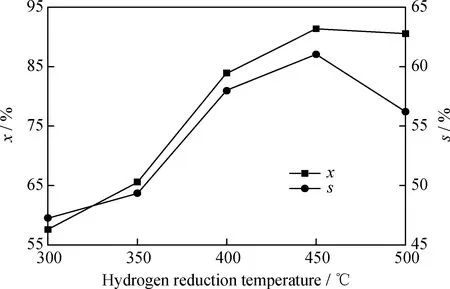
x—The conversion rate of phenol;s—The selectivity of cyclohexanone圖5 氫氣還原溫度對20%Ni/N-rGO催化劑催化苯酚加氫制環己酮的影響Fig.5 Effect of hydrogen reduction temperature on hydrogenation of phenol to cyclohexanone catalyzed by 20%Ni/N-rGO catalystReaction conditions:T=150 ℃;p=0.4 MPa;t=2.0 h;m(Ni/N-rGO)/m(Phenol)=0.35
2.2.4 反應溫度對催化劑反應性能的影響
在反應壓力為0.4 MPa、反應時間為2.0 h、劑/酚質量比為0.35的條件下,考察反應溫度對苯酚選擇性加氫制環己酮的影響,結果如圖6所示。
由圖6可見,隨著反應溫度的升高,苯酚轉化率持續提升,而環己酮選擇性先升高后下降。當反應溫度為150 ℃時,苯酚轉化率為91.93%,環己酮選擇性最高為61.75%。這是因為在實驗條件范圍內,升高溫度會提高苯酚加氫反應速率,有利于苯酚轉化。在150 ℃之后環己酮選擇性開始減小,是由于苯酚加氫制備環己酮(ΔG=-145 kJ/mol)受熱力學影響較大[18],較高溫度并不利于環己酮生成。
2.2.5 反應壓力對催化劑反應性能的影響
在反應溫度為150 ℃、反應時間為2.0 h、劑/酚質量比為0.35的條件下,考察反應壓力對苯酚選擇性加氫制環己酮的影響,結果如圖7所示。

x—The conversion rate of phenol;s—The selectivity of cyclohexanone圖6 反應溫度對20%Ni/N-rGO催化劑催化苯酚加氫制環己酮的影響Fig.6 Effect of reaction temperature on hydrogenation of phenol to cyclohexanone catalyzed by 20%Ni/N-rGO catalystReaction conditions:p=0.4 MPa;t=2.0 h;m(Ni/N-rGO)/m(Phenol)=0.35

x—The conversion rate of phenol;s—The selectivity of cyclohexanone圖7 反應壓力對20%Ni/N-rGO催化劑催化苯酚加氫制環己酮的影響Fig.7 Effect of reaction pressure on hydrogenation of phenol to cyclohexanone catalyzed by 20%Ni/N-rGO catalystReaction conditions:T=150 ℃;t=2.0 h;m(Ni/N-rGO)/m(Phenol)=0.35
由圖7可見,隨著反應壓力的增大,苯酚轉化率先增大后趨于平緩,而環己酮選擇性先增大后減小。當反應壓力為0.4 MPa時,苯酚轉化率為90.99%,環己酮選擇性最高為61.92%。這是因為在實驗條件范圍內,適當增大反應壓力可有效提高催化活性及環己酮選擇性;環己酮是中間產物穩定性較差,隨著反應壓力繼續增大,環己酮可能會繼續加氫生成其他副產物,因而壓力過高環己酮選擇性會下降。
2.2.6 反應時間對催化劑反應性能的影響
在反應溫度為150 ℃、反應壓力為0.4 MPa、劑/酚質量比為0.35的條件下,考察反應時間對苯酚選擇性加氫制環己酮的影響,結果如圖8所示。
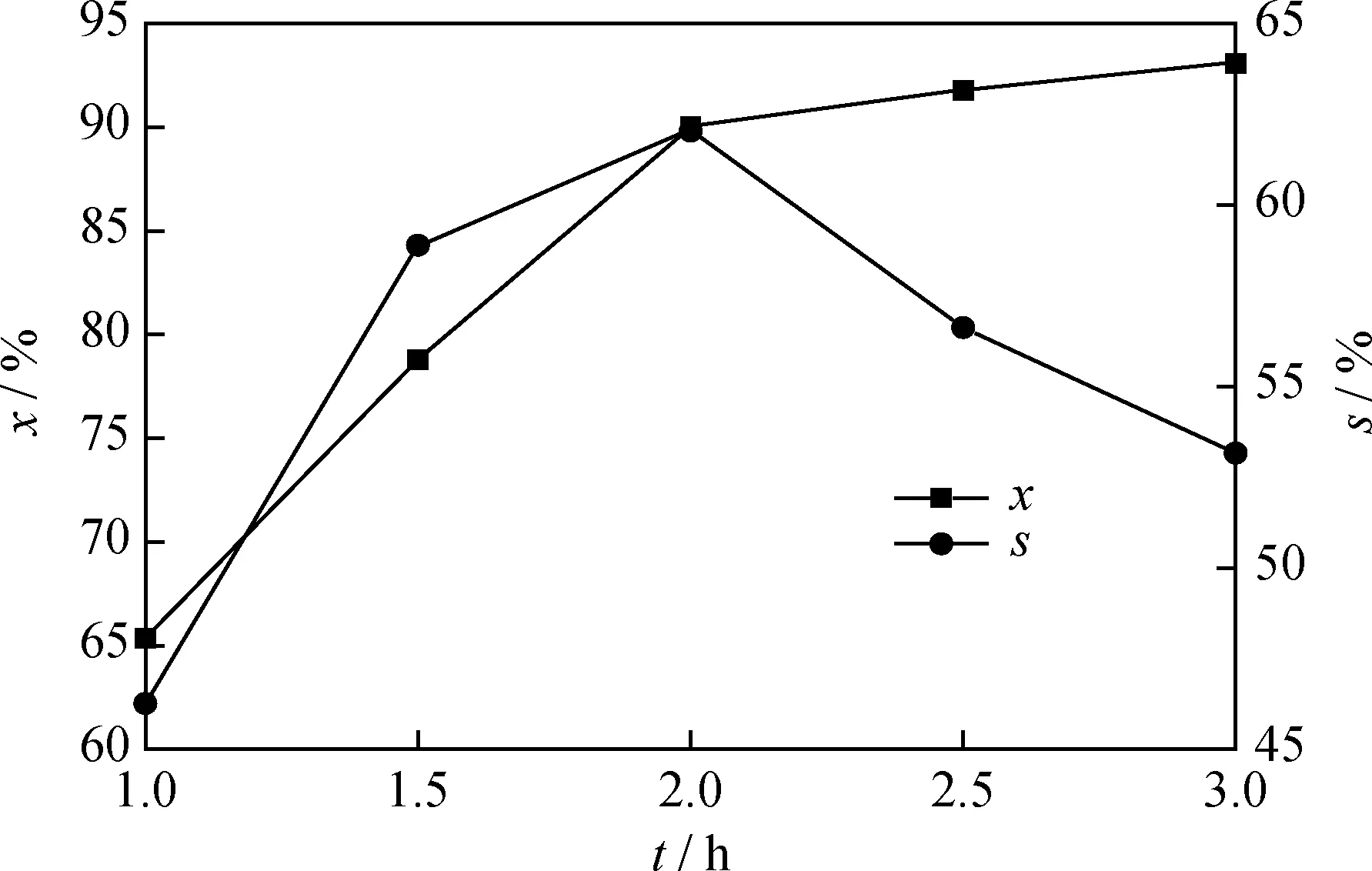
x—The conversion rate of phenol;s—The selectivity of cyclohexanone圖8 反應時間對20%Ni/N-rGO催化劑催化苯酚加氫制環己酮的影響Fig.8 Effect of reaction time on hydrogenation of phenol to cyclohexanone catalyzed by 20%Ni/N-rGO catalystReaction conditions:T=150 ℃;p=0.4 MPa;m(Ni/N-rGO)/m(Phenol)=0.35
由圖8可見,隨著反應時間的延長,苯酚轉化率呈上升趨勢,而環己酮選擇性先升高后下降。當反應時間為2.0 h時,苯酚轉化率為90.01%,環己酮選擇性最高為62.03%。這是因為隨反應時間延長,較多活化的氫原子與苯酚充分接觸,促進苯酚加氫生成環己酮;但隨著反應時間過長,未及時脫附的環己酮會繼續和氫氣反應生成其他副產物,導致環己酮選擇性下降。
2.2.7 20%Ni/N-rGO催化劑的穩定性
催化劑穩定性是評價催化劑性能指標的重要因素之一。將20%Ni/N-rGO催化劑重復利用,考察催化劑重復利用次數對苯酚選擇性加氫制環己酮的影響,結果如圖9所示。
由圖9可見:20%Ni/N-rGO催化劑重復使用3次后,苯酚轉化率和環己酮選擇性略有下降;當20%Ni/N-rGO催化劑重復使用5次后,苯酚轉化率和環己酮選擇性下降比較明顯,苯酚轉化率下降約9百分點,環己酮選擇性降至50.93%。這可能是隨著循環使用次數的增加,催化劑活性不斷流失及催化劑嚴重團聚造成的。
3 結 論
(1)通過N2吸附-脫附、XRD、SEM等表征手段對制備的載體N-rGO和不同鎳負載量Ni/N-rGO催化劑進行表征,結果表明:載體N-rGO具有較大的比表面積和均勻的孔道結構;Ni/N-rGO催化劑中活性組分鎳在N-rGO載體表面分散相對均勻,局部有團聚現象;適當氮原子的摻雜有利于提高催化劑的反應活性和選擇性。
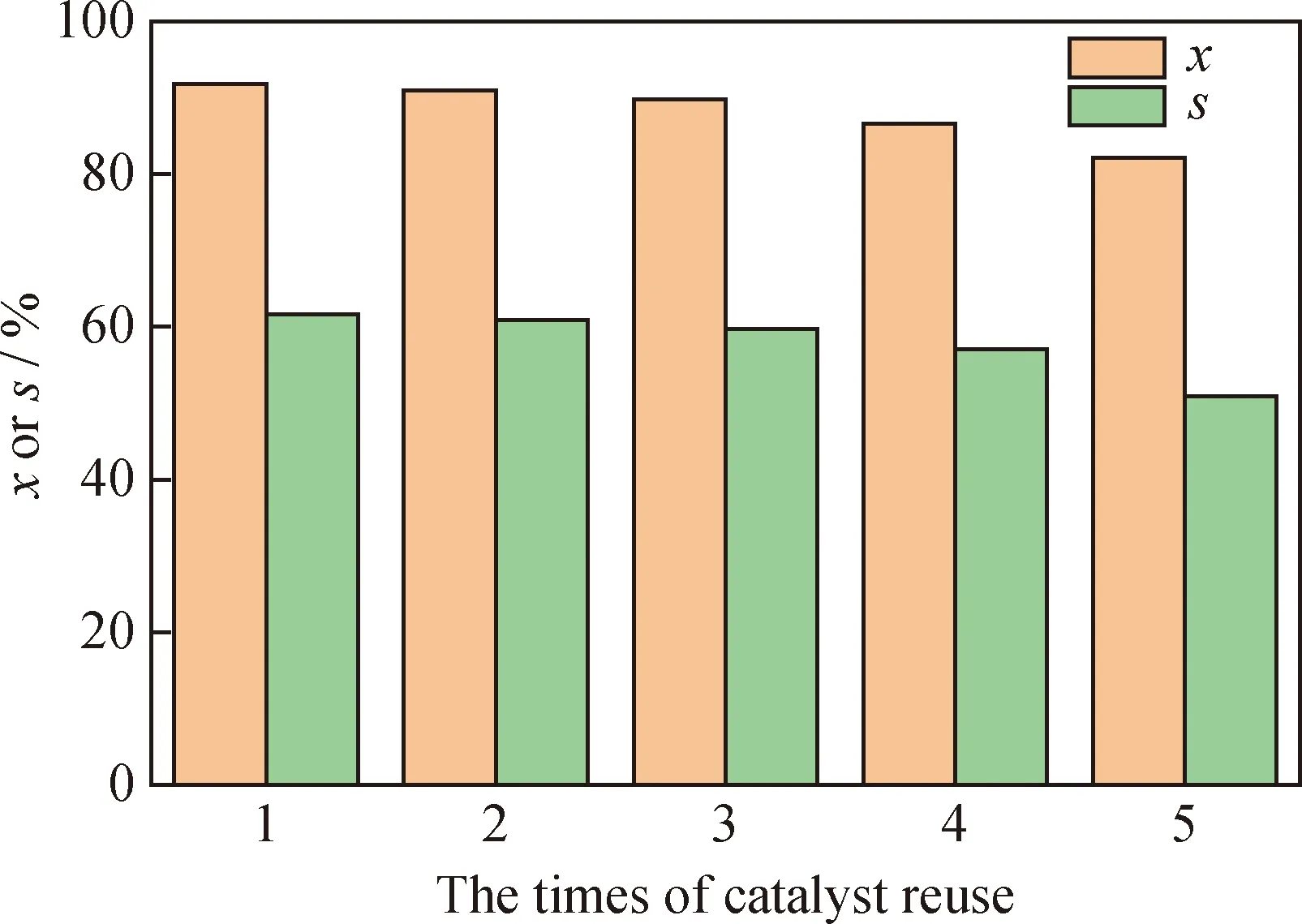
x—The conversion rate of phenol;s—The selectivity of cyclohexanone圖9 20%Ni/N-rGO催化劑重復使用次數對催化苯酚加氫制環己酮的影響Fig.9 Effect of 20%Ni/N-rGO catalyst reuse times on hydrogenation of phenol to cyclohexanoneReaction conditions:T=150 ℃;p=0.4 MPa;t=2.0 h;m(Ni/N-rGO)/m(Phenol)=0.35
(2)通過考察催化劑的制備條件(活性金屬負載量、尿素添加量及H2還原溫度)和反應條件(溫度、壓力、時間)對Ni/N-rGO催化劑催化苯酚加氫制備環己酮的影響,得到Ni/N-rGO催化劑的最佳制備條件為:鎳負載質量分數20%、尿素/GO質量比30、H2還原溫度450 ℃;Ni/N-rGO催化劑催化苯酚加氫制備環己酮的最佳反應條件為:反應溫度150 ℃、反應壓力0.4 MPa、反應時間2.0 h;20%Ni/N-rGO催化劑在最佳反應條件下催化苯酚加氫制備環己酮,苯酚轉化率可達91.93%,環己酮選擇性可達61.75%。
(3)Ni/N-rGO催化劑制備工藝簡單、成本低且具有較好的加氫性能,但其穩定性較差、高溫易團聚,因此后續可以通過添加其他助劑或改進催化劑制備方法對Ni/N-rGO催化劑進一步改性優化。

