枯草芽孢桿菌tdh基因對醬香風味的影響
李雯,謝和
(貴州大學 生命科學學院/農業生物工程研究院,山地植物資源保護與保護種質創新教育部重點實驗室,山地生態與農業生物工程協同創新中心,貴州 貴陽,550025)
醬香風味是經微生物發酵產生,由酸類、醇類、醛類、酮類、酚類、吡嗪類等多種風味物質共同發揮作用形成的一種復合香味[1]。研究人員對比各種香型白酒的風味物質發現,吡嗪類化合物在醬香型白酒中種類多且含量豐富[2],其中以四甲基吡嗪(tetramethylpyrazine,TTMP)和2,5-二甲基吡嗪(2,5-dimethylpyrazine,2,5-DMP)較突出。TTMP呈泡豆子水氣味[3],其46%酒精水溶液具有甜香、水果香、花香[4],在微生物發酵體系中,由乙偶姻和氨基酸脫下的氨作用生成[5];2,5-DMP呈炒花生的烘焙香味和巧克力、奶油的氣味[6],在46%酒精水溶液中呈青草、炒豆香[2],在微生物發酵過程中,由L-蘇氨酸脫氫酶(L-threonine dehydrogenase,L-TDH)以L-蘇氨酸為底物生成[7-9]。據報道,吡嗪類物質減少,醬香風味會消失[10],表明該物質在白酒風味中對其他香味物質有重要的襯托、疊加作用,可使白酒香氣更加豐厚、飽滿[11-13]。
枯草芽孢桿菌(Bacillussubtilis)是重要的工業發酵生產菌種[14-15],針對B.subtilis現主要通過CRISPR/Cas9系統[16]、Cre-LoxP定點重組系統和重疊延伸PCR技術相結合[17]實現對B.subtilis的基因敲除,但國內外大多數研究人員仍采用傳統的同源重組敲除技術。
本實驗室在前期對醬香風味的研究工作中發現,在醬香風味更加濃郁、突出的發酵物中2,5-DMP相對含量較高,TTMP相對含量較低,而在醬香味不突出的發酵物中則相反。由此推測,2,5-DMP可能是對醬香風味起主要烘托作用的吡嗪類物質。因此,本研究以可使發酵物產生濃郁、純正醬香風味的B.subtilisE20為原始菌株,使用同源重組技術敲除tdh基因,然后進行產醬香模擬發酵,對發酵物進行聞香評價、風味物質檢測及特征香氣成分評價,以期了解2,5-DMP在醬香風味呈味中的重要性,有助于了解固態發酵中醬香風味的形成。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與質粒
枯草芽孢桿菌B.subtilisE20、枯草芽孢桿菌B.subtilis1S101由貴州大學微生物學實驗室分離并保存;埃希氏大腸桿菌E.coliDH5α、質粒pUC18購自TakaRa公司;質粒pUC18-CAT、pUC18-HR-CAT、pUC18-HL-CAT-HR,本研究構建。
1.1.2 引物
實驗所用引物如表1所示。

表1 實驗所用引物Table 1 Primers used in the experiment
1.1.3 試劑與儀器
氯霉素,北京索萊寶科技有限公司;GreenTaqMix、基因組提取試劑盒、質粒提取試劑盒、膠回收試劑盒,南京諾唯贊生物科技有限公司;DNA Marker、限制性內切酶、T4 DNA Ligase,TakaRa公司;其他試劑,國產或進口分析純。
T100TMPCR儀、GDXR+凝膠成像儀,美國Bio-Rad公司;DYY-4C核酸電泳儀,北京六一儀器廠;ZWYR-D2403真彩觸摸屏三單元疊加振蕩器,上海智城分析儀器制造有限公司;HP-5MS色譜柱、HP6890/5975C GC-MS,美國安捷倫公司;2 cm-50/30 μm DVB/CAR/PDMS StableFlex萃取纖維,美國Supelco公司。
1.1.4 培養基
牛肉膏蛋白胨固體培養基(g/L):牛肉膏3,蛋白胨10,NaCl 5,瓊脂20,pH 7.0~7.2,121 ℃滅菌20 min。
牛肉膏蛋白胨液體培養基(g/L):牛肉膏3,蛋白胨10,NaCl 5,pH 7.0~7.2,121 ℃滅菌20 min。
LB液體培養基(g/L):蛋白胨10,酵母浸粉5,NaCl 10,pH 7.0,121 ℃滅菌20 min。
LB固體培養基(g/L):蛋白胨10,酵母浸粉5,NaCl 10,瓊脂粉20,pH 7.0,121 ℃滅菌20 min。
黃豆發酵培養基:選用市售優質黃豆,用自來水浸泡24 h,按每瓶50 g分裝于250 mL三角瓶中,棉塞密封,121 ℃滅菌30 min,冷卻至室溫待用。
1.2 實驗方法
1.2.1 敲除載體的構建
以含氯霉素乙酰轉移酶(chloramphenicol acetyltransferase,CAT)基因(cat)的B.subtilis1S101基因組DNA為模板,用引物CAT-F/R進行PCR擴增獲得cat基因序列;以野生菌株B.subtilisE20基因組DNA為模板,使用tdh基因同源左臂引物HL-F/R、同源右臂引物HR-F/R擴增基因序列,將上述片段連入pUC18,并轉化到E.coliDH5α感受態細胞中,構建敲除載體pUC18-HL-CAT-HR。
1.2.2 基因敲除菌株的構建
將構建成功的敲除載體pUC18-HL-CAT-HR轉化至E20感受態細胞中,E20感受態細胞的制備及轉化按照文獻描述的方法[18]。將轉化產物涂布于含有5 μg/mL氯霉素的LB固體平板上,37 ℃培養過夜。使用驗證引物TEST-F/R對挑取的陽性轉化子進行菌落PCR、基因組DNA PCR和測序鑒定,將鑒定為重組型的菌株命名為E20-Δtdh。
1.2.3 產醬香模擬發酵方法
從牛肉膏蛋白胨固體平板上挑取野生菌株E20、突變菌株單菌落接種于牛肉膏蛋白胨液體培養基中,150 r/min、37 ℃振蕩培養24 h。用移液槍吸取1 mL種子菌液接種于黃豆發酵培養基中,振蕩均勻后置于恒溫培養箱中,模擬產醬香升溫發酵,溫度控制方法依次為30、35、40、45、50、55 ℃各24 h。
1.2.4 揮發性風味物質的檢測
運用頂空固相微萃取裝置聯合GC-MS對野生菌株、突變菌株的黃豆發酵物進行檢測分析。取搗碎后混勻樣品3 g,置于25 mL固相微萃取儀采樣瓶中,插入裝有2 cm-50/30 μm DVB/CAR/PDMS StableFlex纖維頭的手動進樣器,在65 ℃的平板加熱條件下頂空萃取60 min,移出萃取頭并立即插入GC進樣口(250 ℃)中,熱解析進樣。GC條件:色譜柱為HP-5MS(60 m×0.25 mm,0.25 μm)彈性石英毛細管柱,初始溫度 40 ℃(保留2 min),以3.5 ℃/min升溫至180 ℃;以10 ℃/min升溫至260 ℃,運行時間:50 min;汽化室溫度250 ℃;載氣為高純He(99.999%);柱前壓15.85 psi,載氣流量1.0 mL/min,分流10∶1,溶劑延遲時間:3 min。MS條件:EI離子源;離子源溫度230 ℃;四極桿溫度150 ℃;電子能量70 eV;發射電流34.6 μA;倍增器電壓1 847 V;接口溫度280 ℃;質量范圍29~500 amu。對總離子流圖中的各峰經質譜計算機數據系統檢索及核對Nist 17和Wiley 275標準質譜圖,用峰面積歸一化法測定各化學成分的相對質量分數。
1.2.5 特征香氣成分評價方法
目前許多學者主要參考劉登勇等[19]的氣味活度值(odor activity value,OAV)法評價各揮發性成分對樣品總體香氣的貢獻。為篩選出所檢出風味物質中OAV最高的若干種揮發性風味化合物,可用這些化合物的相對百分含量(C)進行分析[20]。因此,參考解春芝[20]的方法采用相對風味活度值(relative OAV,ROAV)定義對樣品風味貢獻最大的組分:ROAVmax=100。其他風味成分ROAV計算如公式(1)所示:
(1)
式中:Ci、Ti分別為各揮發性物質的相對百分含量和相對應的感覺閾值,Cmax、Tmax分別為對樣品總體風味貢獻最大組分的相對百分含量和相對應的感覺閾值。
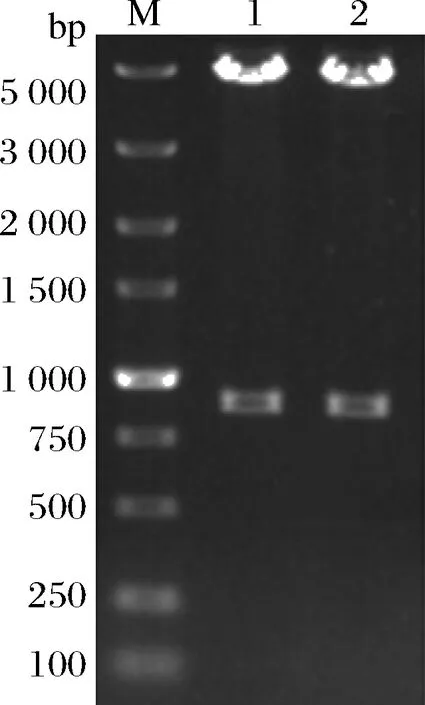
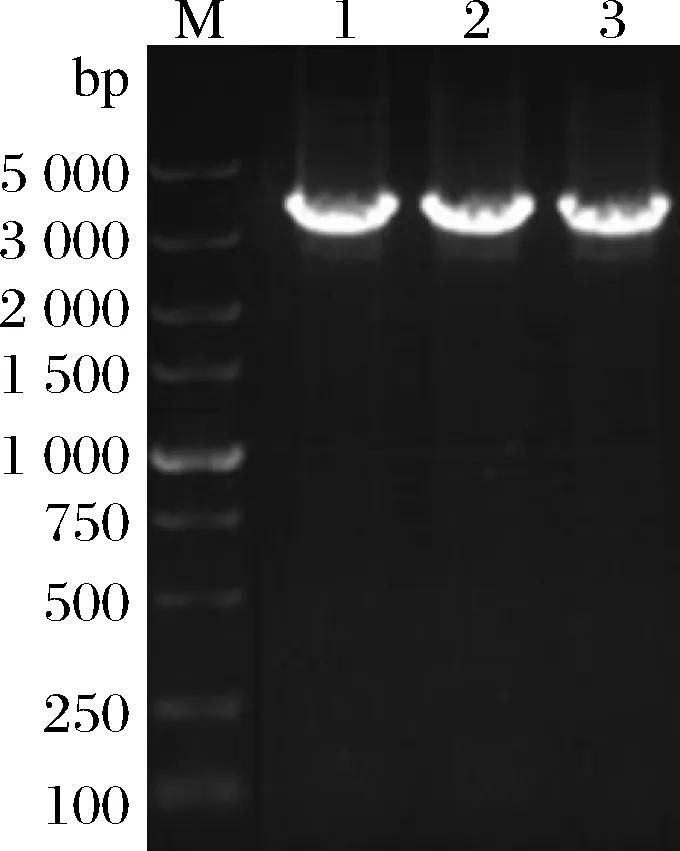
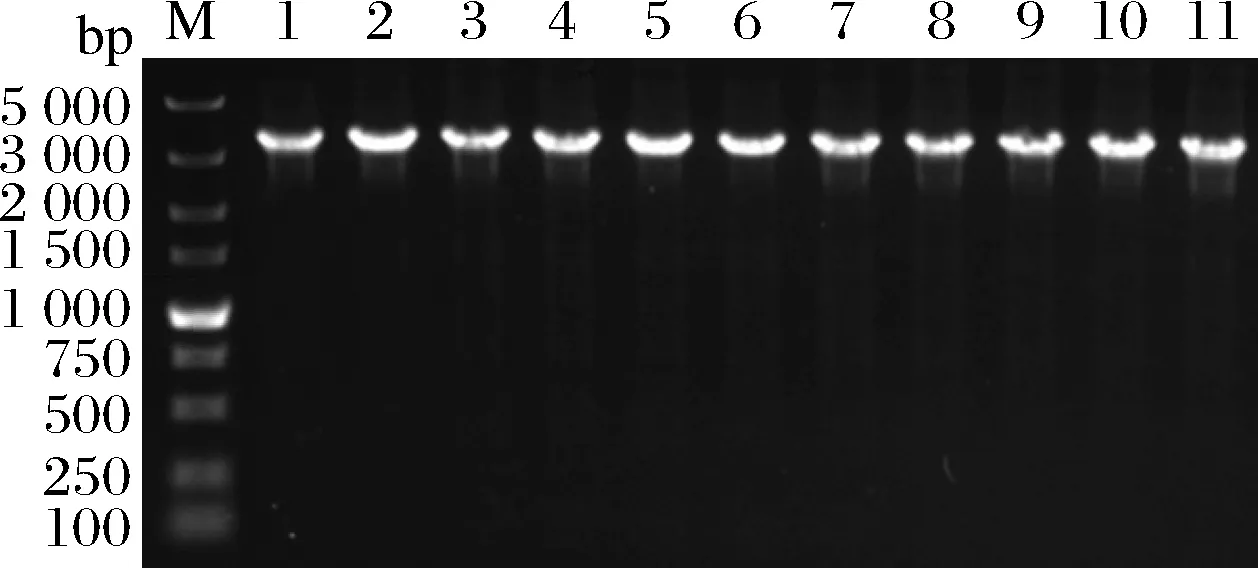
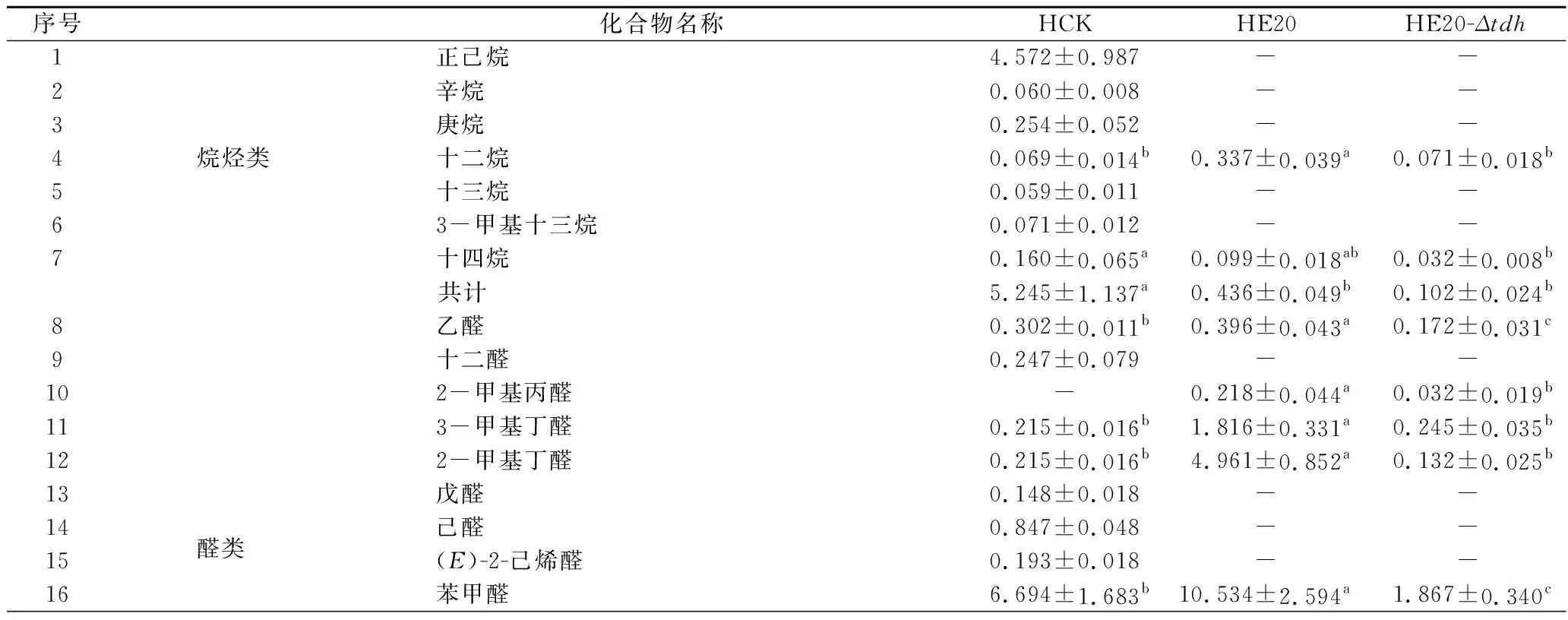
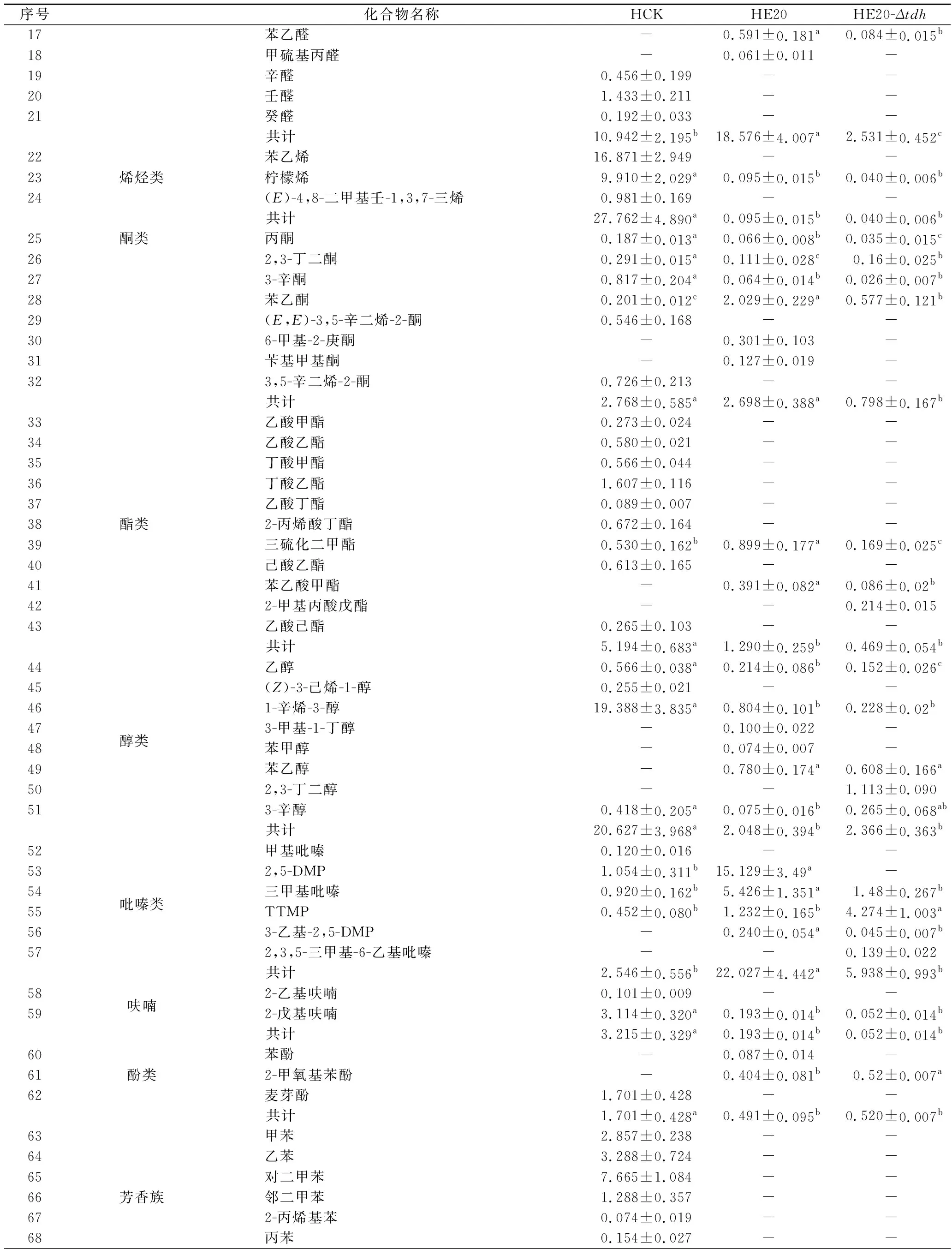
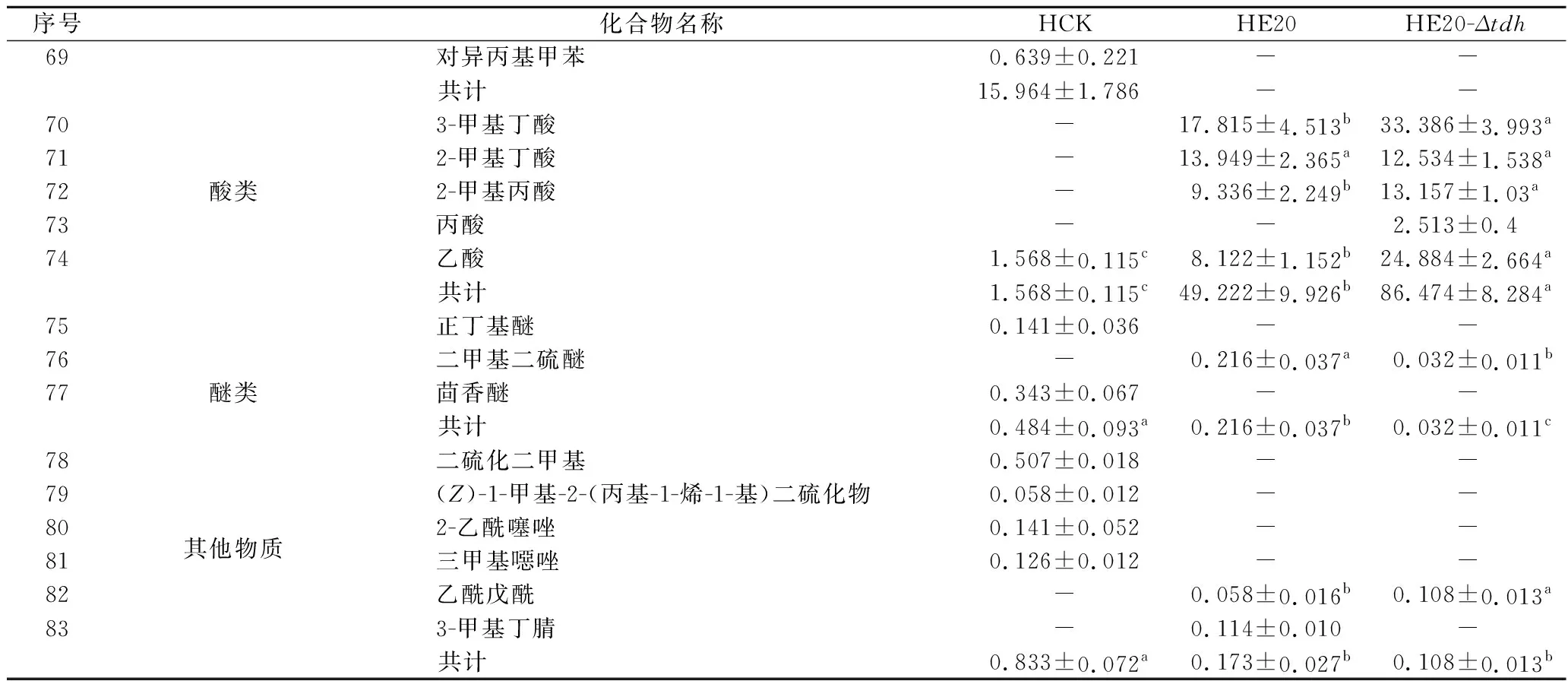
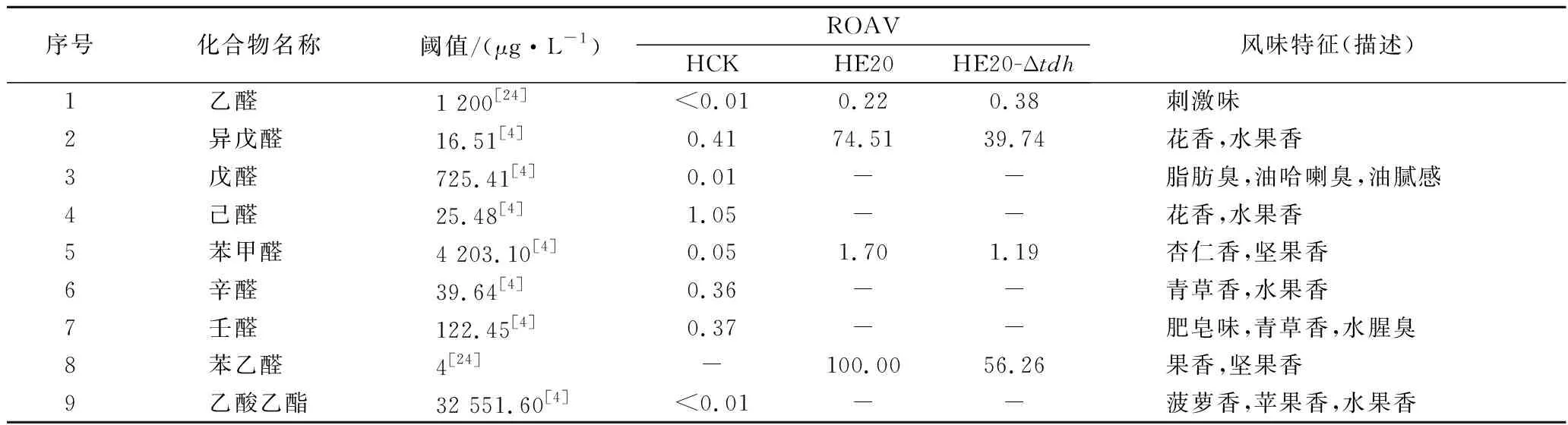
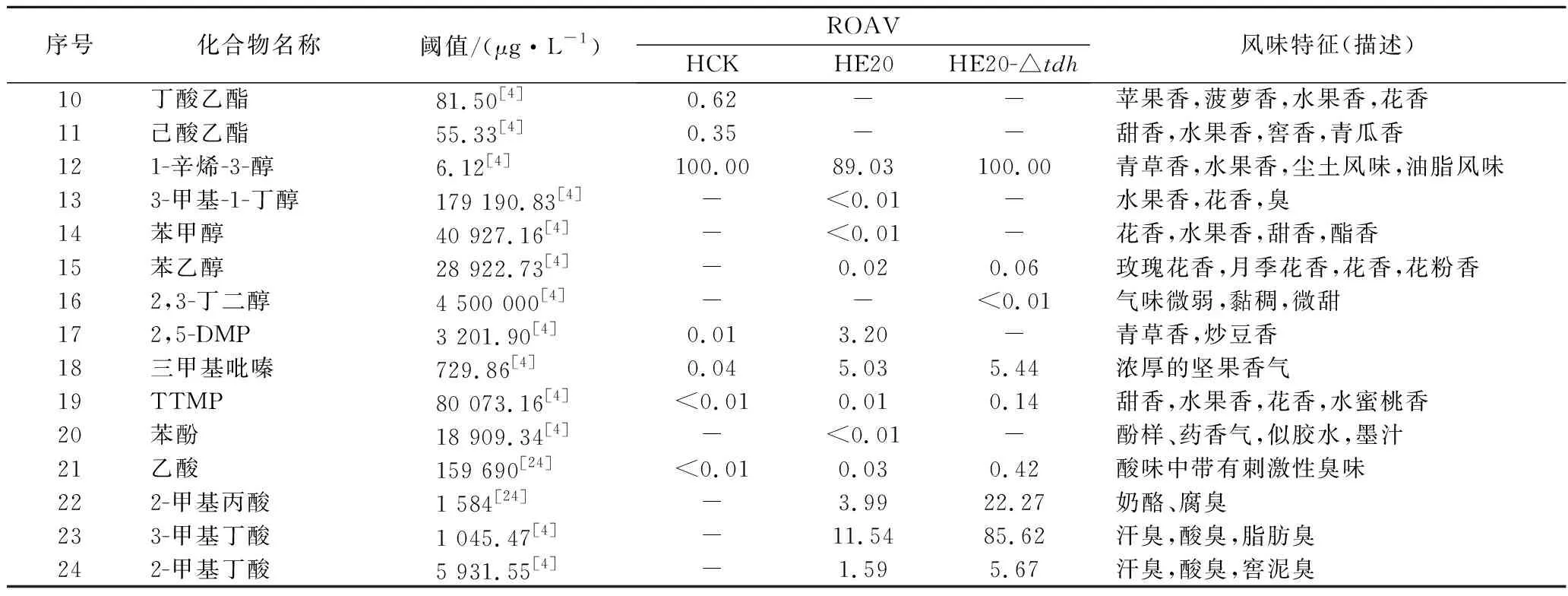
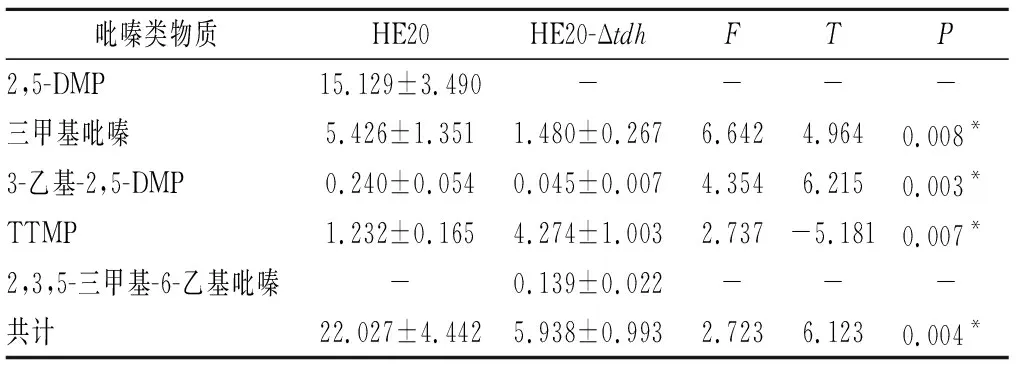
所有組分均滿足0 分別以1S101和E20的基因組DNA為模板,PCR擴增獲得CAT、tdh基因同源左臂(HL)和同源右臂(HR)片段,3個片段的大小分別為1 539、892、511 bp。將CAT、HL、HR目的片段采用雙酶切、酶連接的方法分步接入pUC18,轉化至E.coliDH5α中;從氯霉素(25 μg/mL)LB固體平板上挑選單菌落進行PCR及質粒雙酶切(EcoR I、KpnI)鑒定,結果顯示2條明顯的與預期相符的條帶(4 736、892 bp)(圖1);同時測序結果顯示,構建的敲除質粒序列同預期一致,表明pUC18-HL-CAT-HR載體構建成功,構建流程如圖2所示。 M-DL 5 000 marker;1~2-pUC18-HL-CAT-HR質粒平行樣圖1 pUC18-HL-CAT-HR質粒雙酶切Fig.1 pUC18-HL-CAT-HR plasmid double enzyme digestion 檢測引物TEST-F/R(表1)位于tdh基因同源左臂上游、同源右臂下游。使用引物TEST進行PCR驗證原始菌株和敲除菌株,片段大小為2 760、3 407 bp。挑取經菌落PCR驗證為陽性交換的突變菌株進行基因組DNA PCR,獲得條帶單一、明亮且片段大小為3 407 bp左右的目的條帶(圖3),且測序結果表明,突變菌株中的tdh基因已成功被敲除載體上的cat基因替換,表明突變菌株E20-Δtdh構建成功。 M-DL 5 000 marker;1~3-E20-Δtdh基因組DNA平行樣圖3 E20-Δtdh基因組DNA PCRFig.3 E20-Δtdh genomic DNA PCR 為確保突變菌株E20-Δtdh具有遺傳穩定性,使用抗性平板進行劃線傳代培養(傳至12代),提取基因組進行PCR驗證,均獲得了大小為3 407 bp左右的片段(圖4),表明突變菌株E20-Δtdh遺傳性穩定。 M-DL 5 000 marker;1~11-2~12代E20-Δtdh菌株基因組圖4 E20-Δtdh基因組PCRFig.4 E20-Δtdh genomic PCR 使用野生菌株E20、突變菌株E20-Δtdh分別對黃豆發酵培養基進行產醬香模擬發酵,以加入等量無菌水的黃豆發酵培養基為空白對照,發酵結束后對發酵物進行感官評價(表2、圖5)。添加無菌水的空白對照樣品(HCK)主要呈黃豆的甜香味;經野生菌株E20發酵的黃豆發酵培養基(HE20)褐變極為明顯,最終呈棕褐色或黑褐色,有濃郁、純正的醬香風味,有大量的黏液產生;由突變菌株E20-Δtdh發酵的黃豆發酵培養基(HE20-Δtdh)褐變程度與HE20一致,同樣有大量黏液產生,但醬香味比HE20略淡,有焦糊味產生。 圖5 醬香模擬發酵后的黃豆發酵培養基Fig.5 Soybean fermentation medium after Maotai flavor simulated fermentation 表2 醬香模擬物發酵感官評價Table 2 Sensory evaluation on fermentation of Maotai flavor simulants 黃豆發酵物HCK、HE20、HE20-Δtdh的總離子流色譜圖如圖6所示。 a-HCK;b-HE20;c-HE20-Δtdh圖6 黃豆發酵物風味物質的GC-MS總離子流色譜圖Fig.6 GC-MS total ion flow chromatography of flavor compounds in soybean fermentation products 由表3可知,使用微生物和不使用微生物進行發酵,主體風味成分有較大的差異。在HCK、HE20和HE20-Δtdh中分別檢測出了61、38、34種揮發性風味成分。HCK的吡嗪類物質相對含量與HE20相差19.481%,差異顯著,與HE20-Δtdh相差3.392%,差異不顯著。與HCK相比,HE20和HE20-Δtdh中的烷烴類、烯類、醇類、呋喃類、苯類、酚類、醚類、其他類物質的總量都較低,但酸類物質總量有所增加,在HE20-Δtdh中,酸類物質含量高達86.474%。 表3 HCK、HE20、HE20-Δtdh中的揮發性成分Table 3 Relative content of volatile components in HCK, HE20 and HE20-Δtdh 續表3 續表3 風味物質對總體風味的貢獻不僅取決于其含量,還取決于其氣味閾值。通過查詢,共找到24種揮發性風味化合物氣味閾值;進行ROAV分析,結果如表4所示,HCK中ROAV>1的物質有1-辛烯-3-醇和己醛,是HCK中的關鍵風味化合物,1-辛烯-3-醇呈青草香、水果香、蘑菇香,己醛具有花香、水果香;對總體風味有修飾作用的物質有異戊醛、辛醛、壬醛、丁酸乙酯和己酸乙酯(0.1≤ROAV<1),它們均具有花香、水果香、甜香味,與嗅聞到的黃豆甜香味相符。 表4 HCK、HE20、HE20-Δtdh中揮發性物質的閾值及ROAVTable 4 Threshold and ROAV of volatile substances in HCK, HE20, HE20-Δtdh 續表4 在醬香味純正、濃郁的HE20中,關鍵風味化合物(ROAV>1)有苯乙醛、1-辛烯-3-醇、異戊醛、3-甲基丁酸、三甲基吡嗪、2-甲基丙酸、2,5-DMP、苯甲醛、2-甲基丁酸;ROAV在0.1~1的僅有乙醛,有一定的刺激味。醬香味較淡的HE20-Δtdh除缺少了2,5-DMP呈香外,其余關鍵風味化合物同HE20一致,但ROAV有差異;HE20的異戊醛、苯乙醛、苯甲醛的ROAV分別是HE20-Δtdh的1.9、1.8、1.4倍;HE20-Δtdh的1-辛烯-3-醇、乙酸、2-甲基丙酸、3-甲基丁酸、2-甲基丁酸分別是HE20的1.1、14、5.6、7.4、3.6倍,雖然兩者的乙酸ROAV相差倍數最大,但乙酸對總體風味無直接影響。 在HE20、HE20-Δtdh的關鍵風味化合物中,苯乙醛、異戊醛、苯甲醛主要呈果香、堅果香、花香,關鍵的酸類風味化合物3-甲基丁酸、2-甲基丙酸、2-甲基丁酸主要呈現酸、汗味等,與在醬香型白酒中檢測到的主要酸類化合物相吻合[23-24],三甲基吡嗪、2,5-DMP主要呈濃厚的堅果香氣、青草香、炒豆香;結合感官評價(表2),HE20-Δtdh缺少了2,5-DMP,醬香風味不突出,表明該物質在發酵物形成醬香風味中具有十分重要的作用。 吡嗪類化合物對醬香風味的形成具有重要作用。對HE20、HE20-Δtdh中的吡嗪類物質進行T檢驗(表5),HE20-Δtdh中的三甲基吡嗪和3-乙基-2,5-DMP呈減少趨勢,且差異顯著;在HE20-Δtdh中檢測到少量的2,3,5-三甲基-6-乙基吡嗪(0.139%),在HE20中未檢測出。在HE20中檢測出大量的2,5-DMP(15.129%)而在HE20-Δtdh中未檢測到,表明tdh基因的缺失影響了2,5-DMP的生成;在HE20中檢測到的TTMP相對含量并不高,HE20-Δtdh中TTMP相對含量比HE20多出了3.042%,兩者差異顯著。另一方面,據ROAV分析(表4),2,5-DMP、三甲基吡嗪對發酵物的總體風味有直接影響,TTMP在HE20中對總體風味無顯著影響(ROAV<0.1),在HE20-Δtdh對總體風味起修飾作用(0.1≤ROAV<1)。因此推測,在對醬香風味起烘托作用的吡嗪類物質中,2,5-DMP的貢獻可能比TTMP的貢獻大。 表5 HE20、HE20-Δtdh發酵物中吡嗪類物質相對含量獨立樣本T檢驗Table 5 Independent sample T test for the relative content of pyrazines in HE20 and HE20-Δtdh fermentation 本研究通過同源重組對1株可使發酵物產生濃郁醬香味的B.subtilisE20菌株的tdh基因進行了基因敲除。將突變菌株與野生菌株接種至黃豆發酵培養基中進行模擬產醬香升溫發酵。通過感官評價和頂空固相微萃取聯合GC-MS技術分析了發酵物風味的變化,結合ROAV分析發現,野生菌株E20可使黃豆發酵產生濃郁的醬香風味,苯乙醛、1-辛烯-3-醇、異戊醛、3-甲基丁酸、2-甲基丙酸、三甲基吡嗪、2,5-DMP、苯甲醛、2-甲基丁酸為關鍵揮發性風味化合物。tdh基因敲除后黃豆發酵物醬香味不突出,該基因對黃豆發酵物中的酸類、醛類、吡嗪類揮發性風味物質的相對含量影響較大,未檢測到2,5-DMP。通過ROAV分析發現,tdh基因敲除后黃豆發酵物的關鍵揮發性風味化合物除無2,5-DMP外,其余與野生菌株E20黃豆發酵物的一致。在醬香風味的特征成分——吡嗪類物質中,2,5-DMP、三甲基吡嗪對總體風味有直接影響,TTMP在HE20中對總體風味無顯著影響,在HE20-Δtdh對總體風味有修飾作用,表明在對醬香風味起烘托作用的吡嗪類物質中,起主要貢獻作用的是2,5-DMP,TTMP對總體風味的修飾作用不大。tdh基因與2,5-DMP的生成密切相關且與醬香風味的形成呈正相關關系,這對進一步研究醬香風味的形成機制有重要意義。2 結果與分析
2.1 敲除載體的構建
2.2 基因敲除菌株的獲得及驗證
2.3 醬香模擬發酵物感官評價


2.4 揮發性風味物質的檢測與分析

3 結論

