Keggin型磁性多酸負載型催化劑的制備及其燃油氧化脫硫性能
李斯文,張海艷,韓天昊,吳文琪,王 偉,趙建社
(1.長安大學 水利與環境學院,陜西 西安 710061;2.西北大學 化學與材料科學學院,陜西 西安 710127)
眾所周知,石油產品中的含硫物質對環境造成了非常嚴重的影響,尤其是使空氣污染越來越嚴重[1]。硫化物的排放導致PM2.5逐漸升高,其大量來源于燃煤和燃油的燃燒,該污染成為了霧霾的元兇,并直接影響人們的生產和生活。另外,霧霾的出現也誘發了各種疾病:如哮喘、氣管炎、腦溢血、高血壓、結膜炎、咽炎等,其中呼吸道疾病最為嚴重。由此可以看出,硫氧化物的危害已經涉及到我們生活中的許多方面[2]。近年來,隨著世界經濟的飛速發展,汽車的保有量呈現直線上升的趨勢。鑒于油品中含硫化合物的危害,為了確保人類社會的可持續發展,世界各國家、地區相繼頒布了嚴格的燃油硫含量標準,自1993年歐盟實施歐Ⅰ標準開始,短短7年時間限制硫質量分數降至150 μg/g,繼而不到10年間已于2009年1月1日強制實行硫質量分數低于10 μg/g的歐Ⅴ標準。雖然中國汽柴油質量升級的總體進程落后于歐盟,但為了改善生存環境,中國正加速提高汽柴油質量。因此,降低燃料油中的硫含量,已成為當前一項重要任務[3]。
傳統的加氫脫硫(HDS)雖然是目前工業上主要的脫硫工藝,但是其高溫、高壓等苛刻的反應條件以及對于噻吩類硫化物較低的脫除效果限制了其進一步的廣泛應用[4-5]。而作為加氫脫硫的補充,氧化脫硫可在常溫、常壓下利用氧化劑將汽油中的硫化物氧化為砜和亞砜,從而達到深度脫硫的效果,催化劑經過再生后可重復利用,被認為是較有前景的脫硫工藝[6]。該技術的核心問題是如何設計并找到合適的氧化脫硫催化劑,并與合適的氧化劑配合,達到最高的脫硫率,并采用合適的萃取劑,將氧化后的砜類物質從油品中萃取出來[7]。
雜多酸(POM)具有獨特的酸性、多功能性和“假液相”行為,且不同的元素可表現出酸性和氧化還原的差別,使其催化性能可控,有利于催化劑設計,且對環境無污染,在催化反應過程中表現出極高的活性以及選擇性,屬于綠色催化劑[8-9]。雖然雜多酸催化劑具備優良的氧化脫硫性能,但是其低表面積以及難回收性限制了其在催化領域的應用價值。因此,尋求優良的載體以達到較好的負載是當前需要解決的問題[10]。目前,應用較多的載體主要包括MCM系列[11-12]、ZSM系列[13-14]、MOF系列[15]以及碳材料[16]等,其中MOFs由于孔徑可調的特點,被認為是良好的均相催化劑的載體,負載后的催化劑穩定性提升,壽命增長[17-18]。
筆者所在課題組之前將雜多酸負載到MOF-199@MCM-41的孔洞中[19],合成的負載型催化劑成功將反應物脫硫率提高到98.5%,同時催化劑回收5次情況下其催化效果仍然能夠保持在90%以上。但是較少的重復使用次數會限制該類催化劑的工業使用價值,磁性材料的引入可以有效解決目前面臨的問題。具有磁性的催化劑材料可以在反應結束時,通過引入外加磁場以達到對于催化劑的簡單吸附并回收的操作目的,該方法成本較低,回收效果優良,目前也被廣泛應用于工業領域[20-21]。
筆者制備了一類磁性MOF基多酸催化劑,即Fe@MOF-POM,通過多種表征手段證實了該類催化劑結構特性,以其為催化劑,空氣中O2為氧化劑,催化氧化模擬燃油,通過單因素法探究了反應時間、催化劑用量、溫度等對模擬燃油脫硫率的影響,考察了Fe@MOF-POM復合材料的穩定性及再生性能,推測相關反應機制。
1 實驗部分
1.1 原料和試劑
十二水合磷酸氫二鈉(Na2HPO4·12H2O)、二水合鉬酸鈉(Na2MoO4·2H2O)、二水合鎢酸鈉(Na2WO4·2H2O)、三水合硝酸銅(Cu(NO3)2·3H2O))、1,3,5-均苯三酸(H3BTC)、2-氨基-對苯二甲酸(H2BDC-NH2)、六水三氯化鐵(FeCl3·3H2O))、乙酸鈉(CH3COONa)、二苯并噻吩(C12H8S),均為阿拉丁試劑有限公司產品;濃硫酸(H2SO4),西安化學試劑廠產品;乙醇(C2H6O)、乙二醇(C2H6O2)、正辛烷(C8H18)、正十二烷(C12H26),天津市福晨化學試劑廠產品;N,N-二甲基甲酰胺(DMF)、乙醚(C4H10O),利安隆博華醫藥有限公司產品。以上試劑均為分析純。去離子水為實驗室自制。MOF-199(Cu)(MOF-199)是通過硝酸銅和均苯三酸合成制得的。
1.2 測試與表征
采用EQUINOX-55 FT-IR光譜儀(德國布魯克公司產品)測定催化劑樣品紅外光譜;采用D8-Advance X射線衍射儀(德國布魯克公司產品)測定催化劑樣品的晶相結構;采用IRIS Advantage電感耦合高頻等離子光譜儀(美國熱電公司產品)測定催化劑樣品存在元素情況;采用TM-3000掃描電鏡(日本日立公司產品)對催化劑表面形貌結構進行分析;采用LDJ9500磁性測試儀(美國LDJ公司產品)測定催化劑樣品磁性情況;采用HP6890氣相色譜儀(美國安捷倫公司產品)測定在保留時間內的系統內硫物質的峰面積,進而計算在催化劑作用下的脫硫效率。
1.3 催化劑的制備
Fe3O4@NH2-MOF-199(簡稱FeCu)的合成:將0.1 g的H2BDC-NH2和H3BTC混合物 (質量比為1∶1)與0.86 mmol Cu(NO3)2·3H2O混合后加入0.15 g Fe3O4中(Fe3O4參考文獻[22]合成方法制得),加入1 mL去離子水,研磨30 min。然后,將混合均勻的粉末轉移至含10 mL DMF溶液的聚乙烯內襯不銹鋼高壓釜,100 ℃下恒溫12 h。最后,產物用DMF沖洗3次,60 ℃真空干燥24 h。
Fe3O4@NH2-MOF-199-PMoW(簡稱FeCuP)的合成:將0.1 g的H2BDC-NH2和H3BTC混合物(質量比為1∶1)與0.86 mmol Cu(NO3)2·3H2O混合后加入至0.15 g Fe3O4中,加入1 mL去離子水,研磨30 min。加入0.1 g PMoW(PMoW參考文獻[19]合成),攪拌30 min。然后,將混合均勻的粉末轉移至含10 mL DMF溶液的聚乙烯內襯不銹鋼高壓釜中,100 ℃下恒溫12 h。最后,產物用DMF沖洗3次,60 ℃真空干燥24 h。
1.4 氧化脫硫實驗
將DBT溶于正十二烷中,配制成含硫質量分數為2000 μg/g的模擬燃油。氧化脫硫反應裝置如圖1所示,過程如下:將一定量催化劑和100 mL模擬燃油置于三頸瓶內,其中三頸瓶口分別接入鼓空氣裝置、回流管以及溫度計,調節反應溫度、攪拌速率和通空氣速率使體系充分反應。反應開始后,每隔30 min取樣一次,離心后吸取上層液,即氧化后的燃油,反應前后硫含量的變化采用Agilent-6890型氣相色譜儀進行檢測(燃油進樣量為0.1 μL,進樣口溫度為300 ℃,檢測器溫度為270 ℃,柱溫為255 ℃),實際脫硫率計算公式見式(1):

圖1 脫硫測試裝置圖Fig.1 Desulfurization test device diagram
(1)
式中:w0為初始硫質量分數,μg/g;wt為反應時間t時刻的硫質量分數,μg/g;x(DBT)為脫硫率,%。
反應結束后,采用外加磁場對催化劑進行簡單分離,經水、乙醇分別清洗3~5次后催化劑可進行重復使用實驗。
1.5 催化劑的重復使用
氧化脫硫完成后,用磁鐵吸住催化劑樣品,倒出反應后的油品。隨后對催化劑進行再生處理:用正辛烷、乙醇多次洗滌后得到固體產物,然后用乙醇浸泡2 h,以除去催化劑表面吸附的氧化產物,最后用去離子水洗滌3次、60 ℃烘干12 h,即得到回收的催化劑。回收處理后的催化劑樣品及新制的模擬燃油參照1.4節進行重復性探究實驗。
2 結果與討論
2.1 催化劑的物理性質表征
2.1.1 IR分析
圖2為各催化劑的IR譜圖。由圖2可以看出,單純的Fe3O4磁性材料在603 cm-1處具有明顯的特征峰,其主要來自于Fe—O的伸縮振動[23]。MOF-199特征峰則出現在1650、1450和1370 cm-1附近,這些峰歸屬于MOF-199中的羰基對稱和不對稱伸縮振動[24]。對于FeCu來說,它具備了Fe3O4和MOF-199的特征峰,說明了兩者很好地結合在一起。此外,在引入多酸PMoW后,FeCuP材料在700~1100 cm-1出現了歸屬于P—O以及Mo/W—O的特征峰,進一步證實了多酸很好地連接在磁性MOF材料上,使之成為一個完整的復合材料。
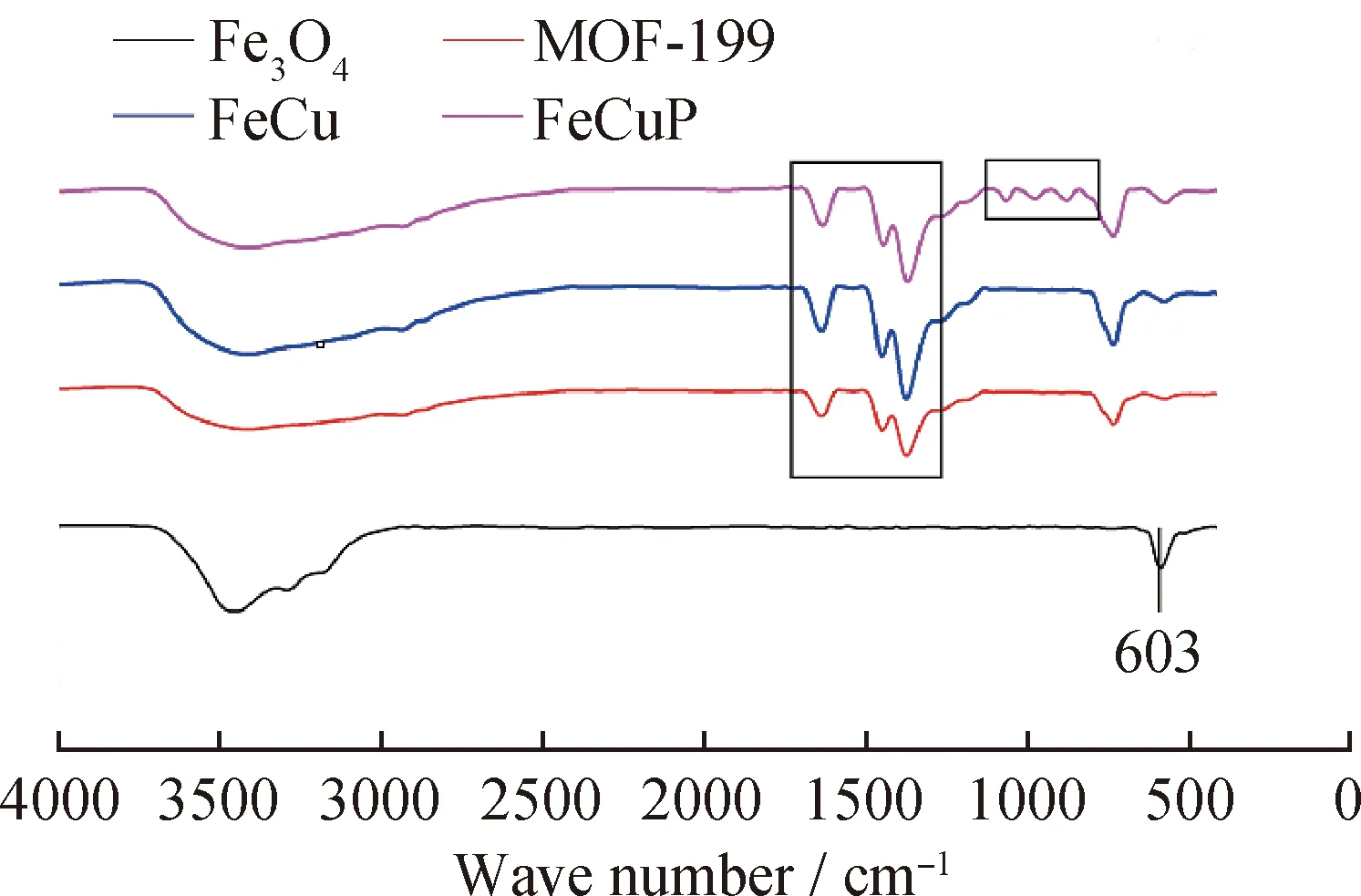
圖2 各催化劑的IR譜圖Fig.2 IR spectra of catalysts
2.1.2 XRD分析
圖3為各催化劑的XRD譜圖。據文獻[22]可知,單純的Fe3O4在2θ為30.39°、35.81°、43.54°、53.87°、57.35°和63.10°處均有較強的峰值,圖3中證實該磁性納米顆粒在整個合成反應過程中結晶相的穩定性。MOF-199材料在2θ為10°附近具有明顯的尖峰,在FeCu載體材料中沒有出現Fe3O4的特征峰,但出現了MOF-199的特征峰,說明Fe3O4已完全包裹在樣品內部,而MOF材料在FeCu載體表面存在;在引入多酸PMoW后,歸屬于多酸的雜峰出現進一步證實了多酸與磁性MOF材料很好的復合。

圖3 各催化劑的XRD譜圖Fig.3 XRD patterns of catalysts
2.1.3 SEM表征
圖4為各催化劑的SEM照片。由圖4看到:單純Fe3O4呈現出均勻光滑狀;隨著MOF以及PMoW的引入,顆粒表面逐漸變得粗糙,且顆粒直徑有些許變小的趨勢。從圖4(c)可以清晰地看出,顆粒表面呈現不規則的堆疊狀,間接證明了Fe3O4外圍附著MOF以及多酸的設計構想的成功。

圖4 各催化劑的SEM照片Fig.4 SEM images of catalysts(a)Fe3O4;(b),(c)FeCuP
2.1.4 TEM表征
圖5為FeCu和FeCuP樣品的TEM照片。由圖5可以看出:FeCu載體出現了明顯的核-殼結構,即磁性Fe3O4均勻分布于中心;當多酸PMoW引入后,出現了粗糙的顆粒表面,這與SEM照片結果一致,與最初設計結構相吻合。

圖5 FeCu和FeCuP的TEM照片Fig.5 TEM images of FeCu and FeCuP(a)FeCu;(b)FeCuP
2.1.5 XPS分析
圖6為FeCuP的XPS譜圖,其中出現的特征峰分別對應于其表面的C 1s、O 1s、Fe 2p、Cu 2p、P 2p、Mo 3d和W 4f 7種元素。根據不同元素的結合能分析,可充分證明了所合成催化劑的元素組成,其中Fe來自于Fe3O4材料,Cu來自于MOF-199材料,P、Mo和W來自于多酸PMoW。

圖6 FeCuP的XPS譜圖Fig.6 XPS spectra of FeCuP(a)Survey of FeCuP;(b)C 1s;(c)O 1s;(d)Fe 2p;(e)Cu 2p;(f)P 2p;(g)Mo 3d;(h)W 4f
2.1.6 磁性分析
用振動樣品磁力計(VSM)在室溫下磁場強度H從-20000 Oe到20000 Oe測試了不同樣品的磁特性——磁化強度M,見圖7。從圖7可以看出,Fe3O4、FeCu和FeCuP均呈超順磁性,飽和磁化值分別為41.3、18.9和7.6 emu/g,說明Fe3O4已成功地包覆到樣品中,減弱的磁化強度主要是由包覆在外的PMoW和MOF-199(Cu)引起的。綜上所述,明顯的磁化效果可以在回收實驗中發揮重要作用,僅采用外磁體進行催化劑的回收,這也是筆者工作的創新點,并將進行工業應用[25]。

圖7 Fe3O4、FeCu和FeCuP的VSM譜圖Fig.7 VSM profiles of Fe3O4,FeCu and FeCuP(a)Fe3O4;(b)FeCu and FeCuP
2.2 催化劑最佳脫硫反應條件的探究
2.2.1 不同類型催化劑的脫硫性能探究
以含有DBT的正十二烷溶液為模擬燃油進行催化劑的性能評價,如圖8所示。由圖8可見:未加PMoW的FeCu磁性載體材料,在反應時間達到30 min時,體系脫硫效率由最初的0增加到28.9%,且隨著時間的繼續增加,脫硫效率保持不變;而加入PMoW后,在反應前75 min內脫硫率呈現接近直線上升的趨勢,到75 min時達到峰值100%,且保持恒定不變。這是因為FeCu材料的脫硫效率主要來自于基于MOF材料的吸附作用,但效果不佳;加入PMoW后,催化性能較好的雜多酸承擔起催化脫硫反應中舉足輕重的作用,在較短的時間(75 min)即實現了燃油中DBT的100%脫除,充分證實了該類多酸型催化劑較優的脫硫性能,也為后期工業的廣泛應用奠定了充實的理論與實驗基礎。

圖8 FeCu和FeCuP對DBT脫硫活性對比Fig.8 Comparison of DBT desulfurization activities of FeCu and FeCuPReaction conditions:w(PMoW)=30%;c(Catalyst)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min
2.2.2 不同PMoW負載量的FeCuP催化劑脫硫性能探究
在反應時間為75 min、FeCuP催化劑質量濃度為0.5 g/L、反應溫度為60 ℃、通空氣速率為700 mL/min、攪拌速率為500 r/min條件下,探究催化劑中PMoW負載量對FeCuP催化氧化脫硫反應的DBT轉化率的影響,結果如圖9所示。由圖9可以看出:當PMoW負載質量分數從10%增加到30%時,脫硫率從59.6%顯著提高到100%;隨著PMoW負載量繼續增加,脫硫率出現明顯的下降趨勢,這可能是因為過高的負載量會引起PMoW的聚集,多余的PMoW會阻塞MOF孔道進而直接影響最終脫硫效果。因此,選擇30%的PMoW作為最佳負載量。

圖9 不同PMoW負載量對于DBT脫硫率的影響Fig.9 Influence of PMoW load on DBT desulfurization rateReaction conditions:c(FeCuP)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min;t=75 min
2.2.3 不同FeCuP催化劑用量的脫硫性能探究
在反應時間為75 min、PMoW負載質量分數為30%、反應溫度為60 ℃、通空氣速率為700 mL/min、攪拌速率為500 r/min條件下,考察催化劑用量對FeCuP催化氧化脫硫反應DBT脫硫率的影響,結果如圖10所示。由圖10看到:隨著催化劑用量從0.2 g/L增加到0.5 g/L,脫硫率從30.5%增加到100%;隨著催化劑用量繼續增多至0.7 g/L,脫硫率呈現略微下降的趨勢。這主要是因為催化劑用量的增加可以在底物含硫組分含量固定條件下增大催化活性組分的量,大大增加與底物DBT接觸的機會,充分實現對于DBT的脫除;但是過多的催化劑用量則產生了競爭催化效果。從經濟方面考慮,選擇0.5 g/L作為實驗最佳催化劑用量。
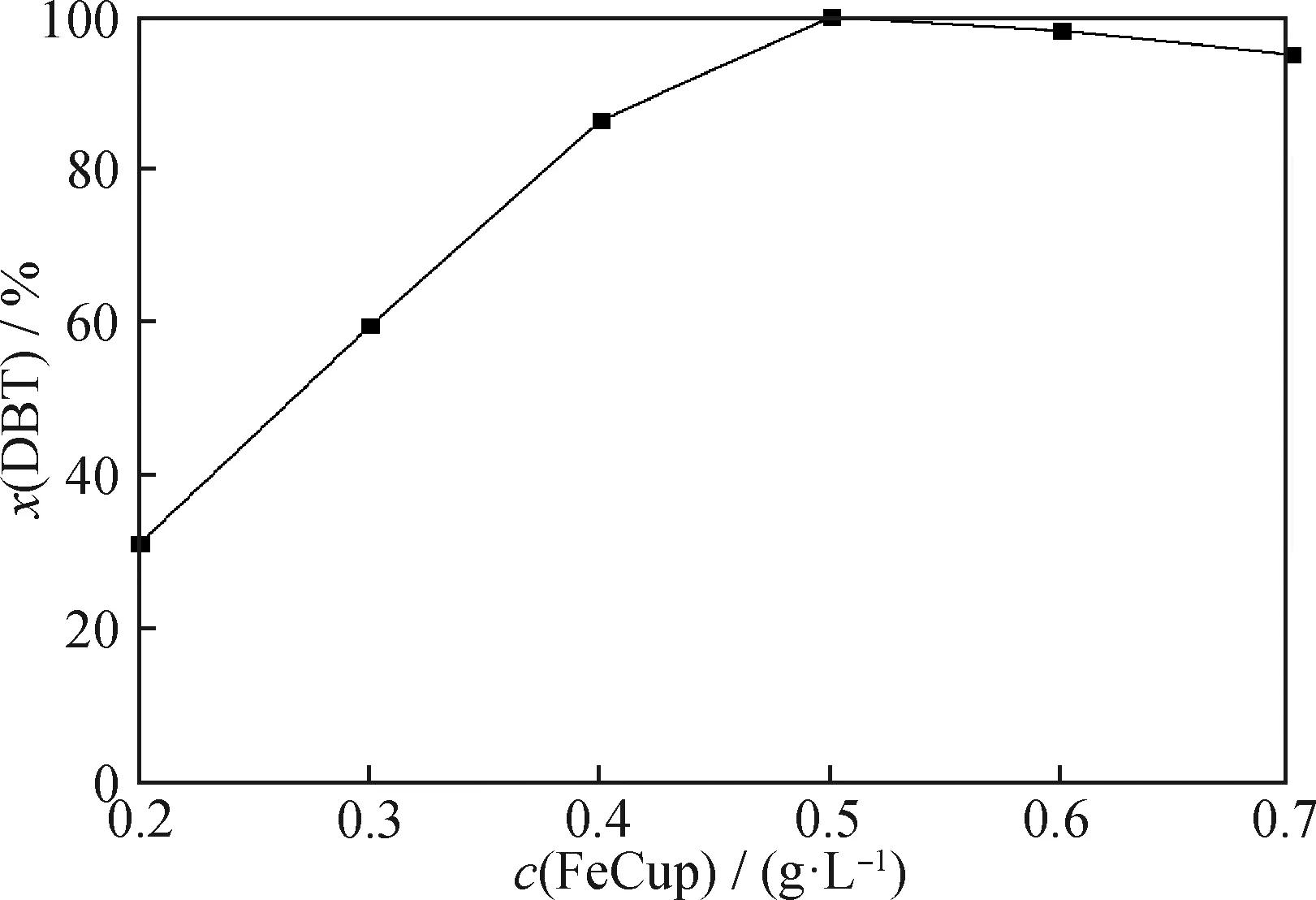
圖10 FeCuP催化劑用量對于DBT脫硫率的影響Fig.10 Influence of FeCuP catalyst amount on DBT desulfurization rateReaction conditions:w(PMoW)=30%;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min;t=75 min
2.2.4 不同溫度下的脫硫性能探究
在PMoW負載質量分數為30%、FeCuP催化劑用量為0.5 g/L、通空氣速率為700 mL/min、攪拌速率為500 r/min條件下,考察反應溫度對FeCuP催化氧化脫硫反應的DBT轉化率的影響,結果如圖11所示。由圖11看到:當反應時間相同時,隨著反應溫度的增加,模擬燃油脫硫率呈現逐漸增加的趨勢,60 ℃時可達到最大100%;繼續增加溫度至80 ℃,DBT脫硫率降低至90%。由此可見,較高的溫度不利于脫硫反應的進行,因此,選擇60 ℃為最佳反應溫度。
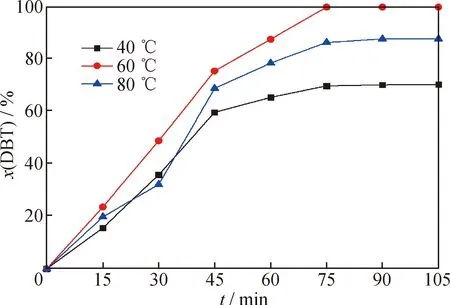
圖11 反應溫度對于DBT脫硫率的影響Fig.11 Influence of reaction temperature on DBT desulfurization rateReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;Agitation rate 500 r/min;Air flowing rate 700 mL/min
2.2.5 不同攪拌速率下的脫硫性能探究
在反應時間為75 min、PMoW負載質量分數為30%、FeCuP催化劑用量為0.5 g/L、反應溫度為60 ℃、通空氣速率為700 mL/min條件下,考察攪拌速率對FeCuP催化氧化脫硫反應的DBT轉化率的影響,結果如圖12所示。在該反應體系中,存在著固-液-氣三相組分,即固體催化劑、氣體氧化劑以及液體模擬燃油,適當地增大攪拌速率可增加三相的有效接觸,降低傳質阻力的影響[24];但是過大的攪拌速率會加速溶液的揮發。由圖12可以看出,當攪拌速率為500 r/min時,脫硫率最大,為100%。故選擇500 r/min為最佳攪拌速率。
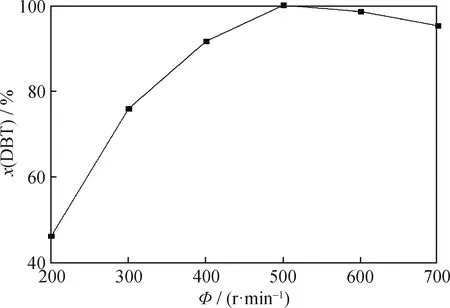
圖12 攪拌速率對于DBT脫硫率的影響Fig.12 Influence of agitation rate on DBT desulfurization rateReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;T=60 ℃;Air flowing rate 700 mL/min;t=75 min
2.2.6 不同通空氣速率下的脫硫性能探究
在反應時間為75 min、PMoW負載質量分數為30%、催化劑用量為0.5 g/L、反應溫度為60 ℃、攪拌速率為500 r/min條件下,考察通空氣速率對FeCuP催化氧化脫硫反應的DBT轉化率的影響,結果如圖13所示。由圖13可見,隨著空氣通入速率的增大,在700 mL/min和900 mL/min時均達到100%的脫硫效果,即充分的氧化劑的引入可以大大增加燃油脫硫率;但是過量的氧化劑則會造成體系溶液揮發,降低催化氧化效率。所以,根據經濟及成本兩方面考慮,選擇700 mL/min為最佳通空氣速率。
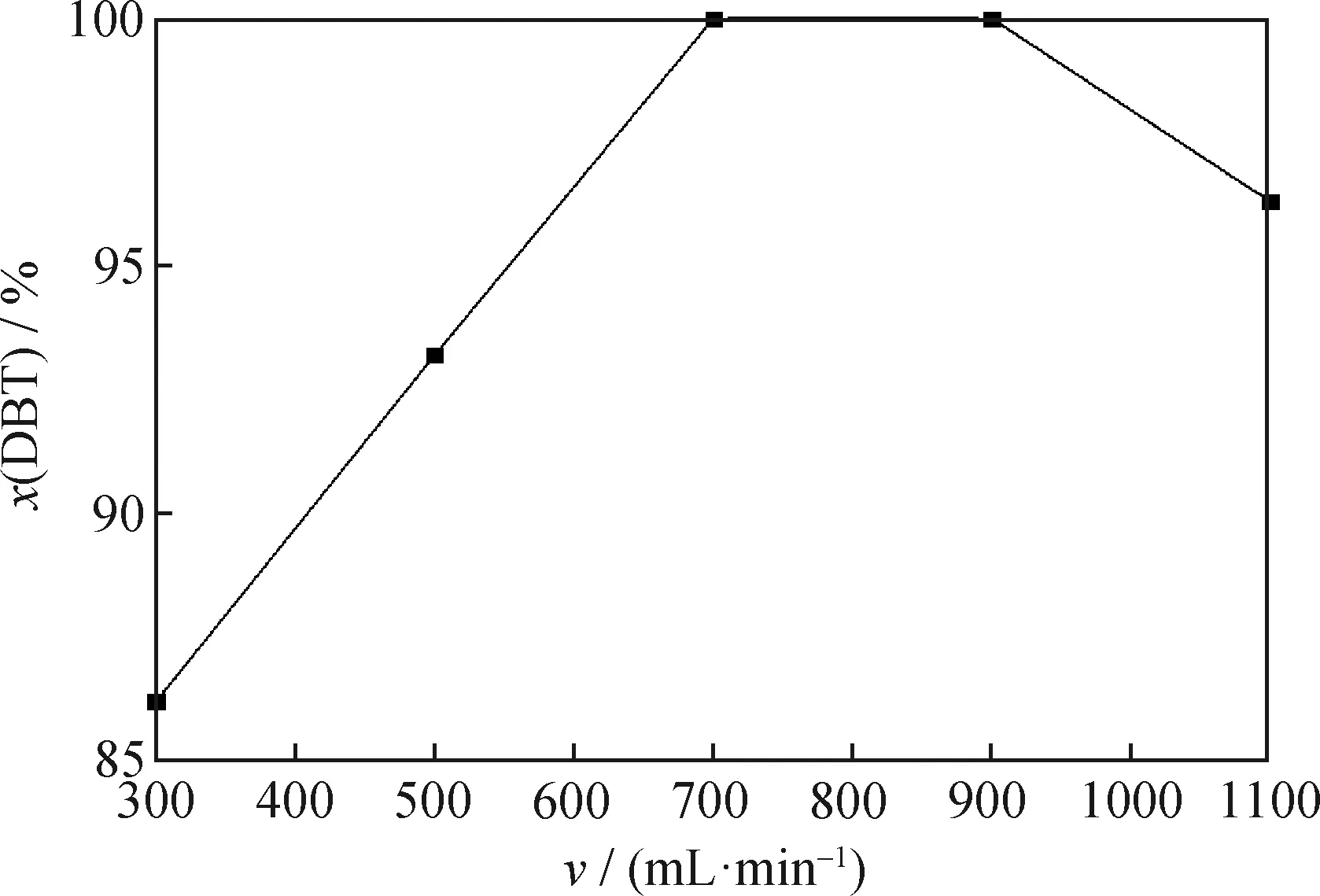
圖13 通空氣速率對于DBT脫硫率的影響Fig.13 Influence of air flowing rate on DBT desulfurization rateReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;t=75 min
2.3 FeCuP催化劑的循環性能評價及機理推測
為了研究FeCuP催化劑的重復利用性,在最優條件下對催化劑進行了連續測試,結果見圖14。由圖14可見,在連續循環10次后,FeCuP催化氧化燃油脫硫率從100%降低至96.56%,僅僅下降了3.44百分點,表明催化劑具有相對穩定的結構,催化性能被很好的保持,重復使用性能良好。
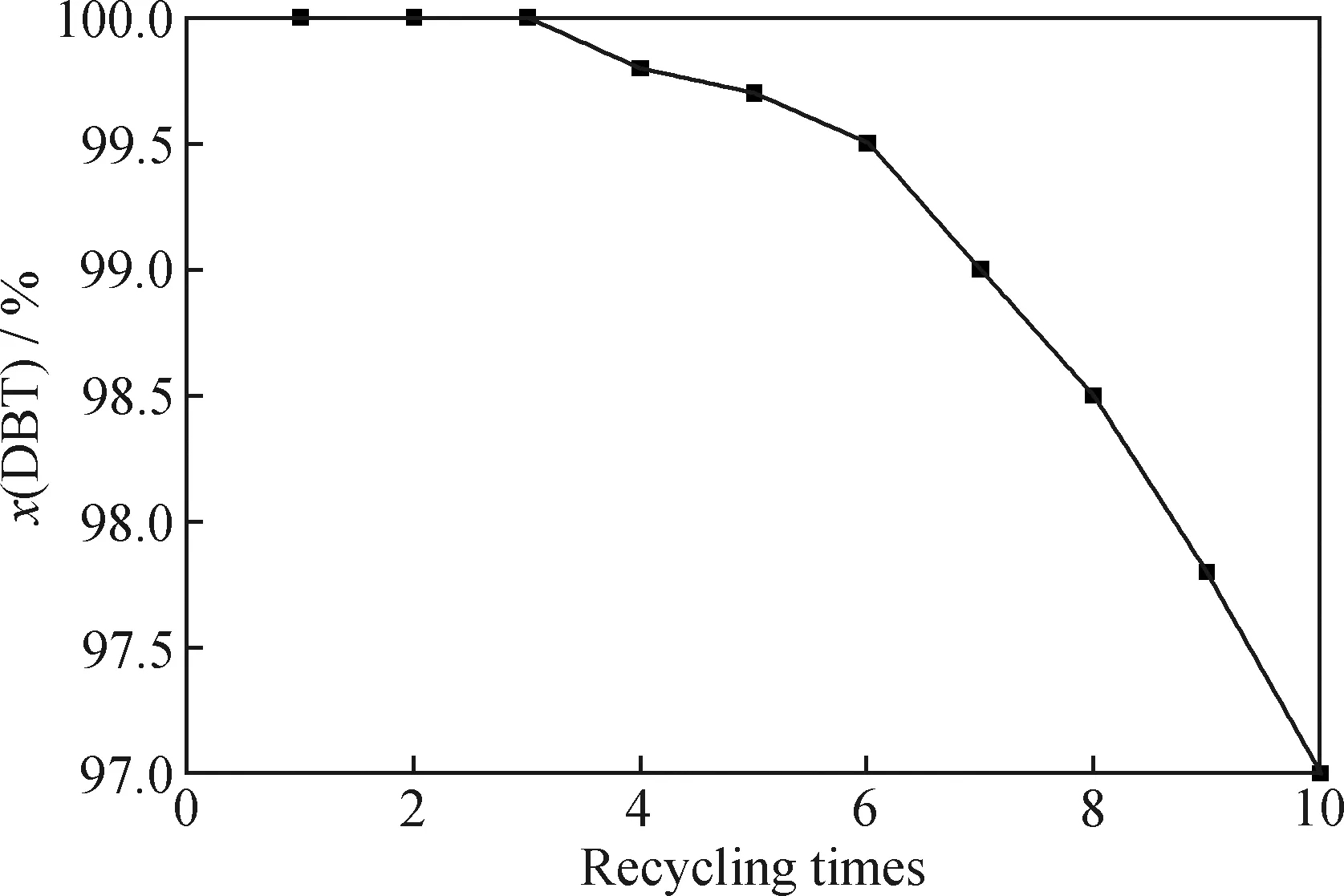
圖14 催化劑FeCuP的重復性能Fig.14 Repeatability performance of FeCuP catalystReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min;t=75 min
圖15為催化劑FeCuP在DBT脫硫反應中可能的脫硫反應機理和反應后萃取相的GC-MS圖。由圖15(a)可以看出,首先,分子氧和DBT被吸附到FeCuP催化劑的通道中,氧與PMoW的末端M=Od(M為Mo或W)基團(M(O)n-)反應,生成中間過氧配合物M(O2)n-,該過氧化物被認為是催化DBT的重要物質。隨后,DBT上的硫原子攻擊M(O2)n-并形成了對應的亞砜,接下來M(O2)n-以很快的速率被還原為M(O)n-,而亞砜(DBTO)進而變成砜(DBTO2)[26]。由圖15(b)觀察到DBTO2
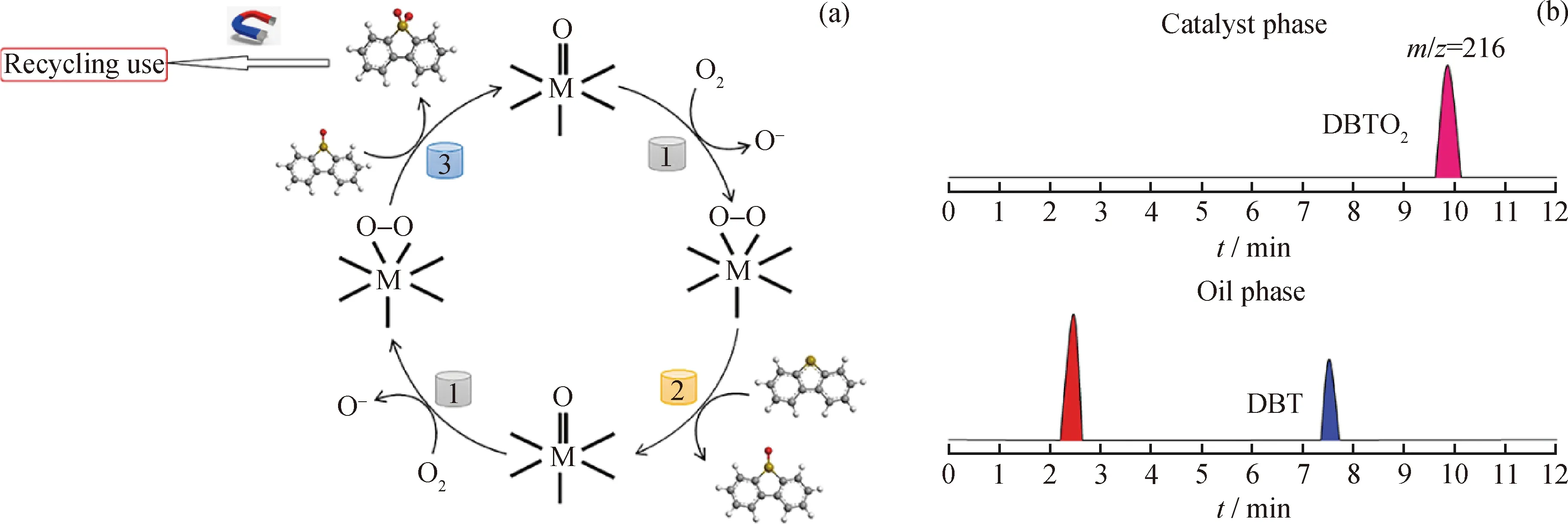
DBTO2—Dibenzothiophene sulfonea圖15 催化劑FeCuP在DBT脫硫反應中可能的脫硫反應機理和反應后的萃取相GC-MS色譜圖Fig.15 Diagram of possible desulfurization reaction mechanism and GC-MS chromatogram(a)Reaction mechanism;(b)GC-MS
對應的清晰峰(m/z=216),表明DBT最終被完全氧化為二苯丙砜,達到了燃油脫硫的效果。
3 結 論
(1)多酸具有較好的脫硫效果,隨著多酸活性組分的引入,FeCuP催化氧化脫硫反應的最優反應條件為:PMoW負載質量分數為30%,催化劑用量為0.5 g/L,反應溫度為60 ℃,攪拌速率為500 r/min,通空氣速率為700 mL/min。最優反應條件下模擬燃油中DBT的脫硫率可在75 min內達到100%。
(2)磁性材料中Fe3O4的引入,即簡單的外加磁場使用即可實現催化劑的回收與再利用,且催化劑重復使用10次仍保持95%以上的脫硫率。FeCuP催化劑在脫硫率以及重復使用次數上的明顯優化滿足了當今脫硫工業化的使用要求,具有較大的利用及推廣價值。

