利用核酸適配體的競爭置換作用檢測溶藻弧菌(Vibrio alginolyticus)*
林筱鈞 彭英林 鄢慶枇 江興龍, 周建傳 湯學(xué)敏 范云庭 鄭 江, , 3①
利用核酸適配體的競爭置換作用檢測溶藻弧菌()*
林筱鈞1, 2, 3, 4彭英林1鄢慶枇1江興龍1, 2周建傳1湯學(xué)敏2范云庭1鄭 江1, 2, 3①
(1. 集美大學(xué)水產(chǎn)學(xué)院 福建廈門 361021; 2. 鰻鱺現(xiàn)代產(chǎn)業(yè)技術(shù)教育部工程研究中心 福建廈門 361021; 3. 福建省水產(chǎn)生物育種與健康養(yǎng)殖工程研究中心 福建廈門 361021; 4. 福建省特種水產(chǎn)配合飼料重點(diǎn)實(shí)驗(yàn)室 福建福清 350308)
溶藻弧菌()是水產(chǎn)養(yǎng)殖中致病性較強(qiáng)的一種條件致病菌, 為更靈敏、高效地對其進(jìn)行檢測, 研發(fā)出一種基于核酸適配體競爭置換作用的檢測方法。首先設(shè)計(jì)并制備出磁珠-核酸適配體-熒光報告探針的檢測復(fù)合物(MAP檢測復(fù)合物), 然后利用溶藻弧菌與其核酸適配體有較好的親和特異性, 在對樣品進(jìn)行檢測時, 樣品中的溶藻弧菌就會競爭MAP檢測復(fù)合物中的核酸適配體, 從而置換出與該核酸適配體結(jié)合的熒光報告探針, 再通過檢測置換出的報告探針的熒光強(qiáng)度來表征溶藻弧菌的濃度, 從而實(shí)現(xiàn)對溶藻弧菌的定量檢測。結(jié)果表明, 該方法對溶藻弧菌的檢測限可達(dá)到1 CFU/mL, 與嗜水氣單胞菌()、遲鈍愛德華氏菌()、哈維氏弧菌()、大腸桿菌()等水產(chǎn)養(yǎng)殖中的常見致病微生物沒有交叉反應(yīng), 并在1~20、20~100和100~1 000 CFU/mL范圍內(nèi)都表現(xiàn)出較好的線性關(guān)系。另外還對MAP檢測復(fù)合物的制備條件進(jìn)行了優(yōu)化, 較為理想的制備條件為: 100 nmol/L核酸適配體與100 nmol/L熒光報告探針按體積比1︰1混合結(jié)合30 min, 制備出50 nmol/L的核酸適配體-熒光報告探針復(fù)合物, 然后該復(fù)合物再與25 μg/mL的磁珠按體積比1︰1混合結(jié)合60 min, 制備出相應(yīng)的MAP檢測復(fù)合物。利用核酸適配體的競爭置換作用檢測溶藻弧菌有較好的靈敏度和特異性, 展現(xiàn)了較好的應(yīng)用前景。
核酸適配體; 溶藻弧菌; 競爭置換作用; 熒光報告探針; 磁珠
溶藻弧菌()隸屬于弧菌科、弧菌屬, 是嗜鹽嗜溫性的革蘭氏陰性桿菌 (Luo, 2016)。它廣泛分布于海洋、河口、海水養(yǎng)殖池等水體環(huán)境中, 對魚、蝦、貝等水生生物都具有較強(qiáng)的致病性(張曉華等, 2018), 是水產(chǎn)養(yǎng)殖業(yè)中的重要條件致病菌(Liu, 2004; 余慶等, 2018)。對溶藻弧菌進(jìn)行快速的檢測是其病害防治的前提和基礎(chǔ)。目前, 溶藻弧菌的檢測方法主要有傳統(tǒng)的基于生理生化反應(yīng)的微生物培養(yǎng)法, 以及基于細(xì)菌16S rDNA等的分子生物學(xué)方法(張穎雪等, 2019)。傳統(tǒng)的微生物培養(yǎng)法較為耗時, 當(dāng)遇到表型較難分辨的類似菌時, 很容易出現(xiàn)判斷錯誤, 降低了檢測的準(zhǔn)確性(Da-Silva, 2018)。16S rDNA等分子生物學(xué)方法則在區(qū)分同屬細(xì)菌時的效果并不理想, 因?yàn)橥瑢偌?xì)菌的種間基因同源性很高, 不容易區(qū)分; 另外采用PCR進(jìn)行檢測擴(kuò)增時, 還可能會由于錯配而產(chǎn)生假陰性或假陽性現(xiàn)象(Li, 2018)。因此, 有必要尋找和開發(fā)更為理想、便捷的針對溶藻弧菌的檢測方法。
核酸適配體是利用SELEX (systematic evolution of ligands by exponential enrichment)技術(shù), 即指數(shù)富集配體的系統(tǒng)進(jìn)化技術(shù), 篩選出的能夠以較高親和力與靶目標(biāo)結(jié)合的單鏈寡核苷酸分子及其衍生物(V?limaa, 2015; 李亞楠等, 2017)。核酸適配體具有親和特異性高、分子量小、容易合成和修飾、可在體外篩選、免疫原性低、靶標(biāo)范圍廣等多種優(yōu)勢(Blind, 2015; Futami, 2019; Yan, 2019; Muhammad, 2021), 已用于金屬離子、小分子、蛋白質(zhì)、細(xì)胞和細(xì)菌等靶目標(biāo)的檢測分析(Qi, 2020; Raducanu, 2020; Uemachi, 2020; Yu, 2021)。
本文在溶藻弧菌核酸適配體的基礎(chǔ)上, 設(shè)計(jì)了一種熒光報告探針, 該探針能與溶藻弧菌核酸適配體的部分序列通過堿基互補(bǔ)配對結(jié)合, 形成核酸適配體-熒光報告探針復(fù)合物(AP復(fù)合物), 并且使該探針與核酸適配體間的堿基互補(bǔ)配對作用力要弱于溶藻弧菌與其核酸適配體間的親和力。當(dāng)該復(fù)合物遇到核酸適配體的靶目標(biāo)菌溶藻弧菌時, 靶目標(biāo)菌就會和熒光報告探針共同競爭核酸適配體, 由于靶目標(biāo)菌對核酸適配體的親和力更高, 競爭力更強(qiáng), 核酸適配體就會轉(zhuǎn)而與其靶目標(biāo)菌結(jié)合, 在這個競爭結(jié)合過程中, 原來與核酸適配體結(jié)合的熒光報告探針會被置換出來, 釋放到溶液中, 而且靶目標(biāo)菌越多, 置換出來的熒光報告探針也越多, 因此通過檢測溶液中的熒光強(qiáng)度就可間接測定靶目標(biāo)菌的濃度。本文利用這種競爭置換作用, 通過構(gòu)建的磁珠-核酸適配體-熒光報告探針的檢測復(fù)合物(MAP檢測復(fù)合物), 建立了一種檢測溶藻弧菌的方法。相關(guān)研究對于溶藻弧菌等水產(chǎn)病害的防治及其核酸適配體的應(yīng)用開發(fā)都具有重要價值。
1 材料與方法
1.1 材料
1.1.1 核酸適配體和磁珠 核酸適配體為先前獲得并驗(yàn)證的溶藻弧菌核酸適配體#37 (李玉寶, 2013), 其序列為5′-TCAGTCGCTTCGCCGTCTCCTTCAGC GGGATGAGGGAGTACAGTGGACT GCACAAGAGGGAGACCCCAGAGGG-3′, 5′端標(biāo)記有生物素, 熒光報告探針序列為5′-AAAAAAAAA3′, 5′端標(biāo)記有FAM熒光基團(tuán), 熒光報告探針和核酸適配體可通過下劃線處的堿基互補(bǔ)配對結(jié)合成核酸適配體-熒光報告探針復(fù)合物, 即AP復(fù)合物。核酸適配體和熒光報告探針的合成及標(biāo)記均由上海生工生物工程有限公司完成。磁珠為鏈霉親和素修飾的磁珠, 粒徑為200 nm, 濃度5 mg/mL, 購自北京雷鳴生物公司。
1.1.2 實(shí)驗(yàn)用菌和培養(yǎng)基 溶藻弧菌()、嗜水氣單胞菌()、遲鈍愛德華氏菌()、大腸桿菌()和哈維氏弧菌()均由集美大學(xué)病原微生物實(shí)驗(yàn)室鑒定并提供。大腸桿菌用LB培養(yǎng)基培養(yǎng), 其他菌用TSB培養(yǎng)基培養(yǎng)。
1.1.3 緩沖液 20×結(jié)合緩沖液(pH 7.4, 100 mL)的配制: NaCl 5.844 g, KCl 3.725 g, Tris-HCl 6.06 g, MgCl2·6H2O 2.033 g, 以上物質(zhì)全部溶于超純水中, 并定容至100 mL, 調(diào)節(jié)pH至7.4, 使用時用超純水稀釋為2×和1×結(jié)合緩沖液。TE緩沖液的配制(pH 8.0, 100 mL): 取1 mol/L Tris-HCl 1 mL, 0.5 mol/L EDTA 0.2 mL, 用超純水稀釋并定容至100 mL。
1.2 MAP檢測復(fù)合物的制備
分別取2 μmol/L核酸適配體400 μL和2 μmol/L熒光報告探針400 μL, 95 °C金屬浴加熱5 min, 再冰浴10 min。隨后將二者混合, 在200 r/min搖床孵育結(jié)合30 min, 形成800 μL、1 μmol/L核酸適配體-熒光報告探針復(fù)合物(AP復(fù)合物); 然后取5 mg/mL已被鏈霉親和素修飾過的磁珠, 用適量TE緩沖液洗滌3次后, 加入TE緩沖液稀釋至0.5 mg/mL; 將0.5 mg/mL的磁珠溶液800 μL與1 μmol/L的AP復(fù)合物800 μL混合, 200 r/min搖床孵育1 h; 鏈霉親和素和生物素的偶聯(lián)作用將AP復(fù)合物固定在磁珠上, 從而形成了磁珠-核酸適配體-熒光報告探針的檢測復(fù)合物(MAP檢測復(fù)合物), 然后于磁力架上磁分離5 min, 去上清, 磁分離出的MAP檢測復(fù)合物沉淀用適量TE緩沖液洗滌3次, 最后加入2×結(jié)合緩沖液1 600 μL重懸, 從而構(gòu)建出基于磁珠和核酸適配體的MAP檢測復(fù)合物。
1.3 可行性實(shí)驗(yàn)
為了驗(yàn)證構(gòu)建的MAP檢測復(fù)合物是否能夠?qū)θ茉寤【M(jìn)行檢測, 我們做了可行性驗(yàn)證實(shí)驗(yàn)。具體如下: 目標(biāo)菌溶藻弧菌用2×結(jié)合緩沖液分別稀釋至50和500 CFU/mL; 隨后取40 μL的MAP檢測復(fù)合物分別與上述不同濃度的溶藻弧菌各200 μL混合, 再分別加入160 μL 2×結(jié)合緩沖液至終體積為400 μL, 作為實(shí)驗(yàn)組; 另取40 μL MAP檢測復(fù)合物與360 μL 2×結(jié)合緩沖液混合, 作為空白對照組。每組6個平行, 實(shí)驗(yàn)組和對照組一同在常溫25 °C下200 r/min搖床孵育1 h, 孵育結(jié)束后, 進(jìn)行磁分離, 隨后取上清用Qubit 3.0熒光定量儀分別測定實(shí)驗(yàn)組和對照組的熒光強(qiáng)度。最終菌的熒光值等于實(shí)驗(yàn)組熒光值減去對照組平均熒光值。
1.4 MAP檢測復(fù)合物制備條件的優(yōu)化
1.4.1 熒光報告探針與核酸適配體結(jié)合比例和結(jié)合時間的優(yōu)化 通過前期研究, 初步確定了MAP檢測復(fù)合物的制備條件為: 25 μg/mL 200 μL的磁珠、50 nmol/L 100 μL的核酸適配體、結(jié)合時間60 min。在此條件下, 按1.2中的方法, 采用不同濃度的熒光報告探針來制備AP復(fù)合物, 進(jìn)而再制備出MAP檢測復(fù)合物, 然后磁分離, 檢測上清液的熒光強(qiáng)度, 研究熒光報告探針的不同濃度對熒光強(qiáng)度的影響, 進(jìn)而確定熒光報告探針與核酸適配體的結(jié)合比例。類似的, 在初步確定的MAP檢測復(fù)合物的制備條件下(25 μg/mL 200 μL的磁珠、核酸適配體和熒光報告探針均為50 nmol/L 100 μL), 按1.2中的方法, 采用不同的結(jié)合時間來制備AP復(fù)合物, 進(jìn)而再制備出MAP檢測復(fù)合物, 然后磁分離, 檢測上清液的熒光強(qiáng)度, 研究熒光報告探針與核酸適配體的結(jié)合時間對熒光強(qiáng)度的影響, 進(jìn)而確定相應(yīng)的結(jié)合時間。實(shí)驗(yàn)每組6個平行。
1.4.2 磁珠和AP復(fù)合物的結(jié)合比例和結(jié)合時間的優(yōu)化 按1.4.1中確定的優(yōu)化方法制備50 nmol/L AP復(fù)合物, 然后取200 μL該AP復(fù)合物和200 μL濃度分別為1、5、10、15、20、25、30、35、40、45、50 μg/mL的磁珠結(jié)合, 按1.2的方法制備MAP檢測復(fù)合物, 之后磁分離, 檢測上清液的熒光強(qiáng)度, 研究不同磁珠濃度對熒光強(qiáng)度的影響, 進(jìn)而確定磁珠和AP復(fù)合物的結(jié)合比例。類似的, 在確定了磁珠和AP復(fù)合物的結(jié)合比例后, 選擇25 μg/mL 200 μL的磁珠和50 nmol/L 200 μL的AP復(fù)合物, 按1.2中的方法, 采用不同的結(jié)合時間來制備MAP檢測復(fù)合物, 磁分離后, 檢測上清液的熒光強(qiáng)度, 研究磁珠與AP復(fù)合物的結(jié)合時間對熒光強(qiáng)度的影響, 進(jìn)而確定磁珠與AP復(fù)合物的結(jié)合時間。實(shí)驗(yàn)每組6個平行。
1.5 工作曲線的制作
將目標(biāo)菌溶藻弧菌用2×結(jié)合緩沖液分別稀釋至下列15個濃度梯度: 1、2、5、10、15、20、40、60、80、100、200、400、600、800和1 000 CFU/mL, 然后分別取40 μL的MAP檢測復(fù)合物與上述濃度的溶藻弧菌各200 μL混合, 再加入160 μL 2×結(jié)合緩沖液至終體積為400 μL, 作為實(shí)驗(yàn)組; 另取40 μL MAP檢測復(fù)合物與360 μL 2×結(jié)合緩沖液混合, 作為空白對照組。每組6個平行, 實(shí)驗(yàn)組和對照組一同在常溫25 °C下200 r/min搖床孵育1 h, 孵育結(jié)束后, 進(jìn)行磁分離, 隨后取上清用Qubit 3.0熒光定量儀分別測定實(shí)驗(yàn)組和對照組的熒光強(qiáng)度。菌的熒光值等于實(shí)驗(yàn)組熒光值減去對照組平均熒光值, 通過Origin軟件進(jìn)行線性擬合, 可得到相應(yīng)的工作曲線及其線性擬合方程。
1.6 特異性、穩(wěn)定性和重現(xiàn)性研究
1.6.1 特異性研究 將溶藻弧菌、嗜水氣單胞菌、遲鈍愛德華氏菌和哈維氏弧菌接種到TSB培養(yǎng)基, 將大腸桿菌接種至LB培養(yǎng)基, 所有的菌都在100 r/min、30 °C的搖床培養(yǎng)8 h; 取培養(yǎng)好的各種菌, 根據(jù)菌的濃度曲線, 用2×結(jié)合緩沖液分別稀釋至10、20、50、100和500 CFU/mL; 然后取40 μL的MAP檢測復(fù)合物與各種菌液各200 μL結(jié)合, 再加入160 μL 2×結(jié)合緩沖液, 作為實(shí)驗(yàn)組; 另取40 μL MAP檢測復(fù)合物與360 μL 2×結(jié)合緩沖液結(jié)合, 作為空白對照組。每組6個平行, 實(shí)驗(yàn)組和對照組一同在常溫25 °C下200 r/min搖床孵育1h, 孵育結(jié)束后, 進(jìn)行磁分離, 隨后取上清用Qubit 3.0熒光定量儀分別測定實(shí)驗(yàn)組和對照組的熒光強(qiáng)度。菌的熒光值等于實(shí)驗(yàn)組熒光值減去對照組平均熒光值。
1.6.2 穩(wěn)定性研究 按1.6.1的方法應(yīng)用MAP檢測復(fù)合物檢測10和100 CFU/mL的溶藻弧菌, 然后將該復(fù)合物置于4 °C冰箱避光保存5 d后, 再次用于10和100 CFU/mL溶藻弧菌的檢測, 比較兩次檢測中菌的熒光值, 研究該復(fù)合物及其檢測方法的穩(wěn)定性。
1.6.3 重現(xiàn)性研究 按1.6.1的方法應(yīng)用MAP檢測復(fù)合物檢測10和100 CFU/mL的溶藻弧菌, 共進(jìn)行6次重復(fù)性實(shí)驗(yàn), 計(jì)算相對標(biāo)準(zhǔn)偏差(相對標(biāo)準(zhǔn)偏差=標(biāo)準(zhǔn)差/平均值×100%), 研究其重現(xiàn)性。
1.7 加標(biāo)回收實(shí)驗(yàn)
為了研究該方法在實(shí)際樣品中對溶藻弧菌的檢測適用性, 在廈門集美龍舟池養(yǎng)殖廠取海水樣, 進(jìn)行加標(biāo)回收實(shí)驗(yàn)。用2×結(jié)合緩沖液將溶藻弧菌分別稀釋為20、100和1 000 CFU/mL, 然后分別取菌液2 mL與2 mL上述海水樣混合配制成加標(biāo)水樣, 此時加標(biāo)水樣中溶藻弧菌的濃度分別為10、50和500 CFU/mL。隨后取200 μL加標(biāo)水樣與40 μL的MAP檢測復(fù)合物混合, 再加入160 μL 2×結(jié)合緩沖液, 作為實(shí)驗(yàn)組; 另取100 μL海水、40 μL的MAP檢測復(fù)合物和260 μL 2×結(jié)合緩沖液結(jié)合, 作為空白對照組。每組6個平行, 實(shí)驗(yàn)組和對照組一同在常溫25 °C下200 r/min搖床孵育1 h; 孵育結(jié)束后, 將實(shí)驗(yàn)組和對照組用磁力架進(jìn)行磁分離, 待磁珠全部被吸至管底后, 取上清, 用Qubit 3.0熒光定量儀分別測定實(shí)驗(yàn)組和對照組的熒光強(qiáng)度。
每個加標(biāo)水樣的熒光值等于實(shí)驗(yàn)組熒光值減去對照組平均熒光值, 每個樣品均進(jìn)行6次以上重復(fù)實(shí)驗(yàn), 然后計(jì)算每個加標(biāo)水樣的平均值和標(biāo)準(zhǔn)差, 以及相對標(biāo)準(zhǔn)偏差(相對標(biāo)準(zhǔn)偏差=標(biāo)準(zhǔn)差/平均值×100%); 分別將加標(biāo)水樣的熒光平均值帶入1.5中獲得的工作曲線回歸方程中, 可計(jì)算出回收量, 相應(yīng)的回收率=回收量/加入量×100%。
1.8 統(tǒng)計(jì)分析
利用EXCEL軟件中的-檢驗(yàn)函數(shù)對實(shí)驗(yàn)數(shù)據(jù)進(jìn)行組間差異分析,<0.05為顯著差異,<0.01為極顯著差異。
2 結(jié)果與分析
2.1 核酸適配體競爭置換作用的檢測原理
選用溶藻弧菌的核酸適配體, 構(gòu)建一種可用于檢測溶藻弧菌的磁珠-核酸適配體-熒光報告探針的檢測復(fù)合物(MAP檢測復(fù)合物), 然后將該檢測復(fù)合物與溶藻弧菌混合孵育, 利用溶藻弧菌對其核酸適配體的競爭作用置換出MAP檢測復(fù)合物中的熒光報告探針, 從而實(shí)現(xiàn)對溶藻弧菌的檢測。其基本原理如圖1所示, 首先將帶有熒光標(biāo)記的報告探針通過部分堿基的互補(bǔ)配對作用與生物素標(biāo)記的核酸適配體結(jié)合形成具有部分雙鏈DNA的AP復(fù)合物; 然后利用鏈霉親和素和生物素的偶聯(lián)作用將核酸適配體固定在鏈霉親和素修飾的磁珠上, 從而構(gòu)建出可用于溶藻弧菌檢測的MAP檢測復(fù)合物。當(dāng)體系中不存在溶藻弧菌時, 通過磁分離可以將MAP檢測復(fù)合物全部分離, 上清液的熒光強(qiáng)度極弱; 當(dāng)檢測體系中存在溶藻弧菌時, 溶藻弧菌與其核酸適配體也有很強(qiáng)的特異性親和力, 就會和熒光報告探針競爭核酸適配體。在初始設(shè)計(jì)中, 我們通過增減互補(bǔ)堿基的數(shù)量來調(diào)節(jié)核酸適配體與熒光報告探針間的堿基互補(bǔ)配對作用, 使堿基互補(bǔ)配對的作用力弱于溶藻弧菌與其核酸適配體的親和力, 這樣在爭奪核酸適配體的競爭中, 溶藻弧菌的競爭力就要強(qiáng)于熒光報告探針, 這就導(dǎo)致原本結(jié)合在MAP檢測復(fù)合物上的熒光報告探針被溶藻弧菌置換出來進(jìn)入上清液, 從而使得上清液熒光強(qiáng)度明顯增加; 并且上清液的熒光強(qiáng)度與體系中存在的溶藻弧菌濃度成一定的線性關(guān)系, 因此, 通過分析檢測體系中的熒光強(qiáng)度可以實(shí)現(xiàn)對溶藻弧菌的定量檢測。
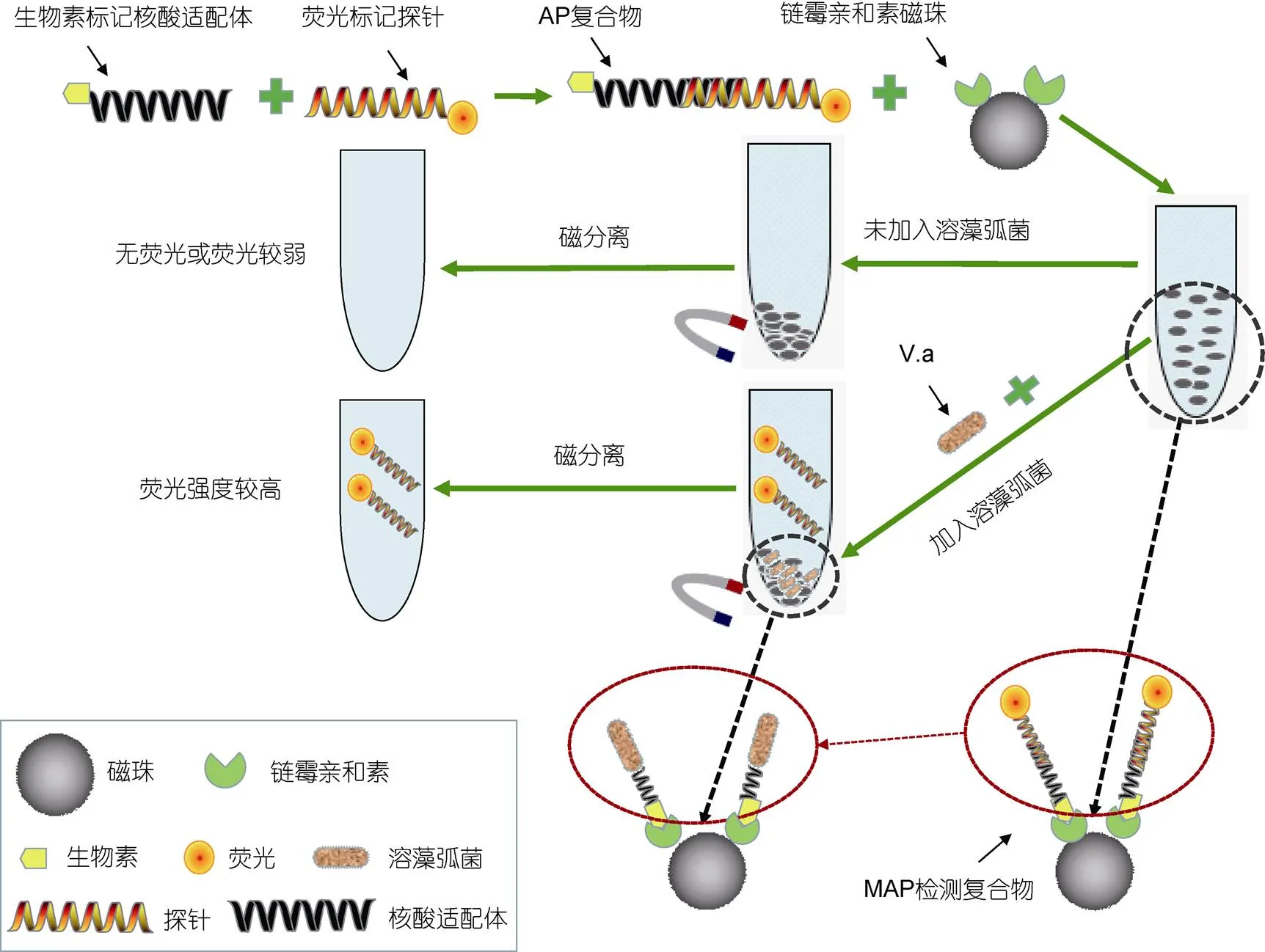
圖1 利用核酸適配體的競爭置換作用檢測溶藻弧菌的示意圖
2.2 可行性實(shí)驗(yàn)
如表1所示, 溶藻弧菌濃度為零的空白對照, 熒光強(qiáng)度極低, 只有1.38; 溶藻弧菌濃度分別為50和500 CFU/mL時, 熒光強(qiáng)度分別為1 240.84和2 456.18, 表明不同濃度的溶藻弧菌, 熒光強(qiáng)度有很大差別, 說明熒光強(qiáng)度與菌濃度有很大的相關(guān)性; 而相同濃度的溶藻弧菌, 其標(biāo)準(zhǔn)差較小, 熒光強(qiáng)度波動不大, 有較好穩(wěn)定性, 因此采用該方法來檢測溶藻弧菌是可行的。
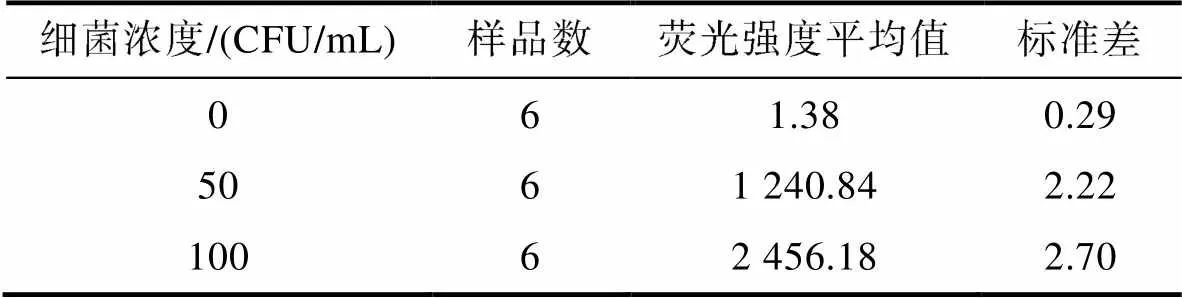
表1 可行性實(shí)驗(yàn)結(jié)果
2.3 MAP檢測復(fù)合物制備條件的優(yōu)化
2.3.1 熒光報告探針與核酸適配體結(jié)合比例和結(jié)合時間的優(yōu)化 熒光報告探針濃度的影響如圖2a所示, 在1~50 nmol/L范圍內(nèi), 熒光強(qiáng)度較低且穩(wěn)定, 說明在50 nmol/L以下, 熒光報告探針全部與核酸適配體結(jié)合。當(dāng)熒光報告探針的濃度超過50 nmol/L以后, 熒光強(qiáng)度隨著探針的濃度增加而快速增加, 說明50 nmol/L就是探針的飽和濃度, 而這個濃度也正是核酸適配體的初始濃度, 這也表明熒光報告探針與核酸適配體的結(jié)合是按摩爾比1︰1進(jìn)行結(jié)合的。熒光報告探針與核酸適配體結(jié)合時間對熒光強(qiáng)度的影響如圖2b所示, 熒光強(qiáng)度隨著結(jié)合時間增加而減少, 但結(jié)合30 min以后, 熒光強(qiáng)度已較低且不發(fā)生明顯變化, 說明30 min后熒光報告探針已幾乎全部與核酸適配體結(jié)合完全。因此, 核酸適配體-熒光報告探針復(fù)合物(AP復(fù)合物)較為理想的制備條件是: 相同摩爾濃度的核酸適配體與熒光報告探針按體積比1︰1混合后孵育結(jié)合30 min。
2.3.2 磁珠和AP復(fù)合物的結(jié)合比例和結(jié)合時間的優(yōu)化 不同濃度的磁珠和50 nmol/L AP復(fù)合物結(jié)合制備MAP檢測復(fù)合物, 磁珠濃度的影響如圖3a所示。隨著磁珠濃度的升高, 熒光強(qiáng)度逐漸下降, 說明溶液中越來越多游離的AP復(fù)合物被固定在磁珠上, 當(dāng)磁珠濃度超過25 μg/mL后, 熒光強(qiáng)度則變化不大, 趨近于零, 說明此時上清液中游離的AP復(fù)合物已幾乎全部與磁珠結(jié)合了, 再增加磁珠濃度已沒有效果。因此, 較為理想的結(jié)合比例應(yīng)是25 μg/mL磁珠與50 nmol/L AP復(fù)合物按體積比1︰1進(jìn)行混合結(jié)合。
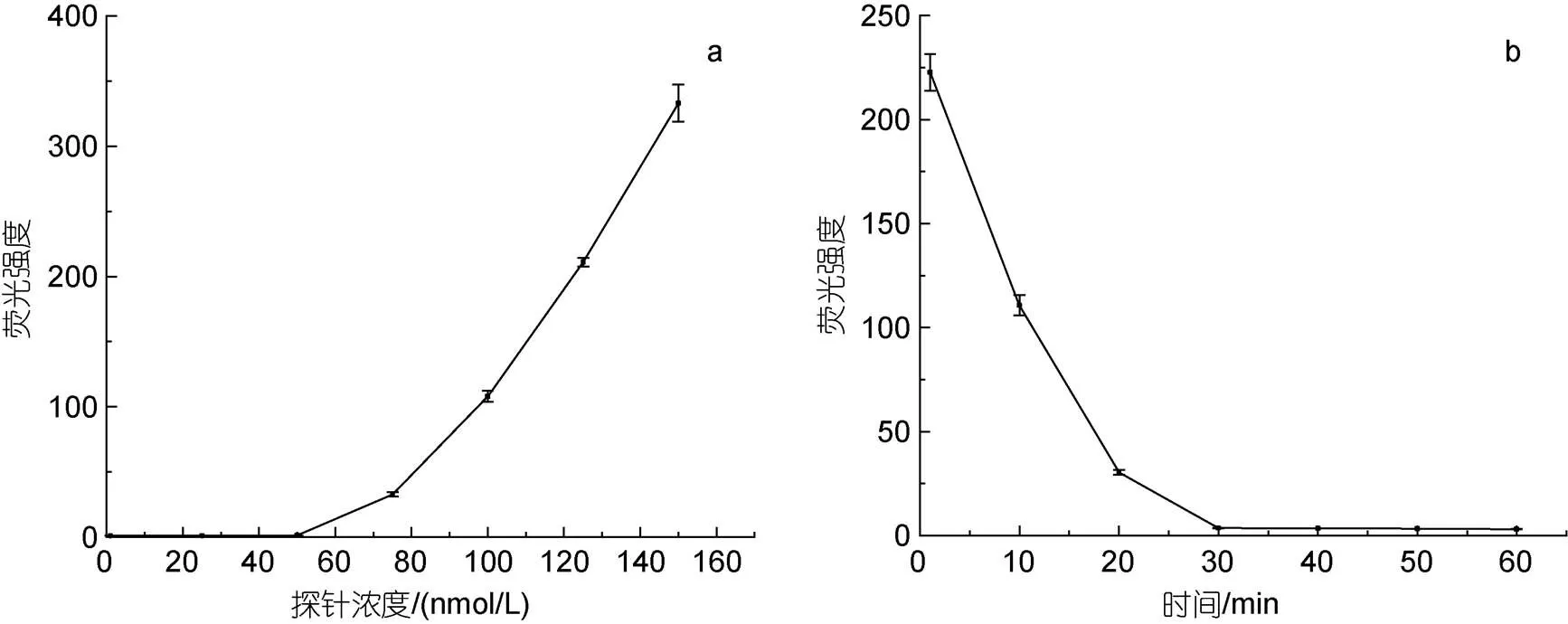
圖2 熒光報告探針濃度(a)及孵育時間(b)對熒光強(qiáng)度的影響
磁珠和AP復(fù)合物結(jié)合時間的影響如圖3b所示。熒光強(qiáng)度隨著結(jié)合時間的增加而逐漸減弱, 當(dāng)結(jié)合時間超過60 min以后, 熒光強(qiáng)度趨于一個穩(wěn)定值, 再增加結(jié)合時間熒光強(qiáng)度下降幅度不明顯。表明經(jīng)過60 min的孵育, 磁珠上的鏈霉親和素與AP復(fù)合物上生物素的偶聯(lián)結(jié)合反應(yīng)已經(jīng)基本完成。因此, 磁珠和AP復(fù)合物的優(yōu)化結(jié)合條件為: 25 μg/mL磁珠與50 nmol/L的AP復(fù)合物按體積比1︰1混合后孵育結(jié)合60 min。
綜合2.3.1和2.3.2的結(jié)果, 最終確定MAP檢測復(fù)合物的優(yōu)化制備條件為: 100 nmol/L核酸適配體與100 nmol/L熒光報告探針按體積比1︰1混合后結(jié)合30 min, 制備出50 nmol/L的AP復(fù)合物, 然后50 nmol/L的AP復(fù)合物再與25 μg/mL的磁珠按體積比1︰1混合后結(jié)合60 min, 制備出相應(yīng)的MAP檢測復(fù)合物。
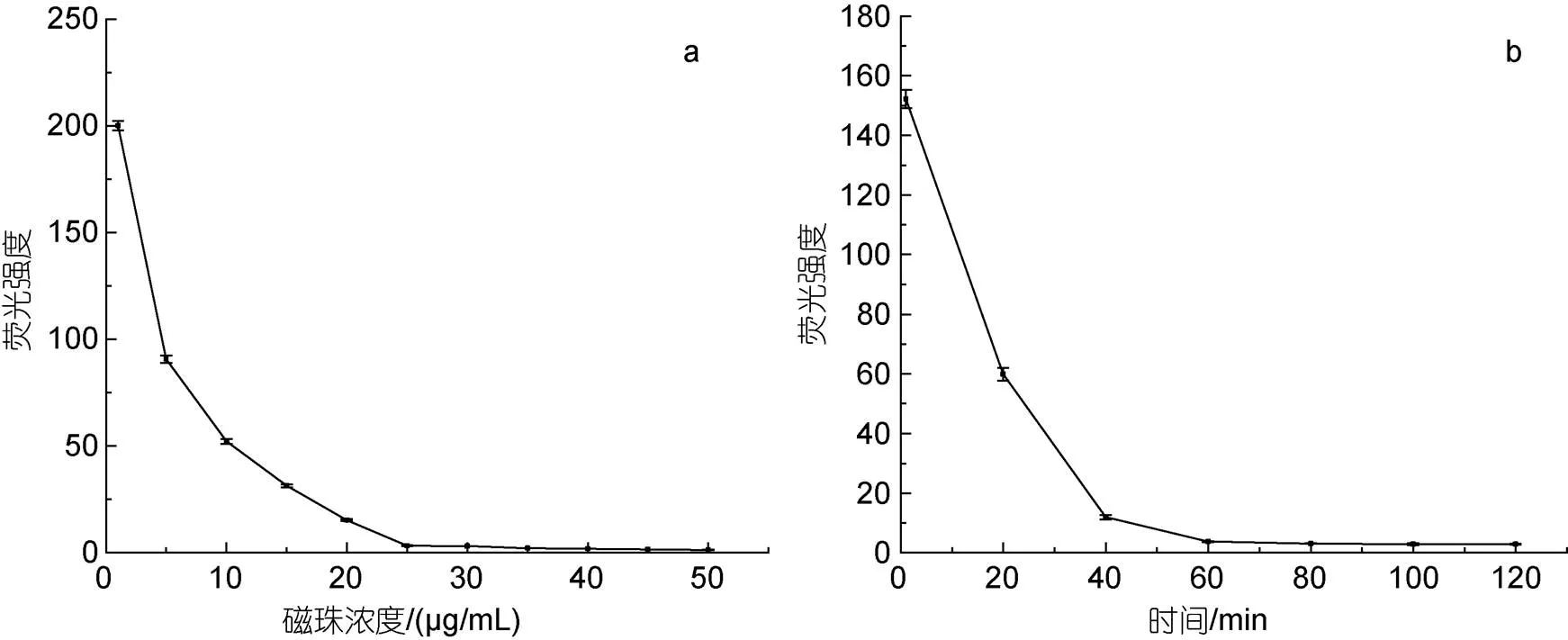
圖3 磁珠濃度(a)和結(jié)合時間(b)對熒光強(qiáng)度的影響
2.4 檢測方法的工作曲線及其定量效果分析
根據(jù)檢測原理, 利用構(gòu)建的MAP檢測復(fù)合物對溶藻弧菌進(jìn)行定量檢測, 以評價該檢測方法的定量效果。相應(yīng)的工作曲線和線性擬合曲線如圖4所示, 隨著溶藻弧菌濃度增加, 熒光強(qiáng)度也不斷增大, 而且熒光強(qiáng)度()與溶藻弧菌濃度()在不同范圍內(nèi), 表現(xiàn)出不同的線性關(guān)系。按照溶藻弧菌的濃度進(jìn)行分段線性擬合, 擬合出線性回歸方程如表2所示。從表中可看出, 溶藻弧菌濃度分別在1~20、20~100和100~1 000 CFU/mL范圍內(nèi), 熒光強(qiáng)度與菌濃度都呈現(xiàn)出較好的線性關(guān)系, 只是三個檢測范圍的線性方程不同而已。說明該檢測方法有較好的定量檢測效果, 其最低檢測限可達(dá)到1 CFU/mL。
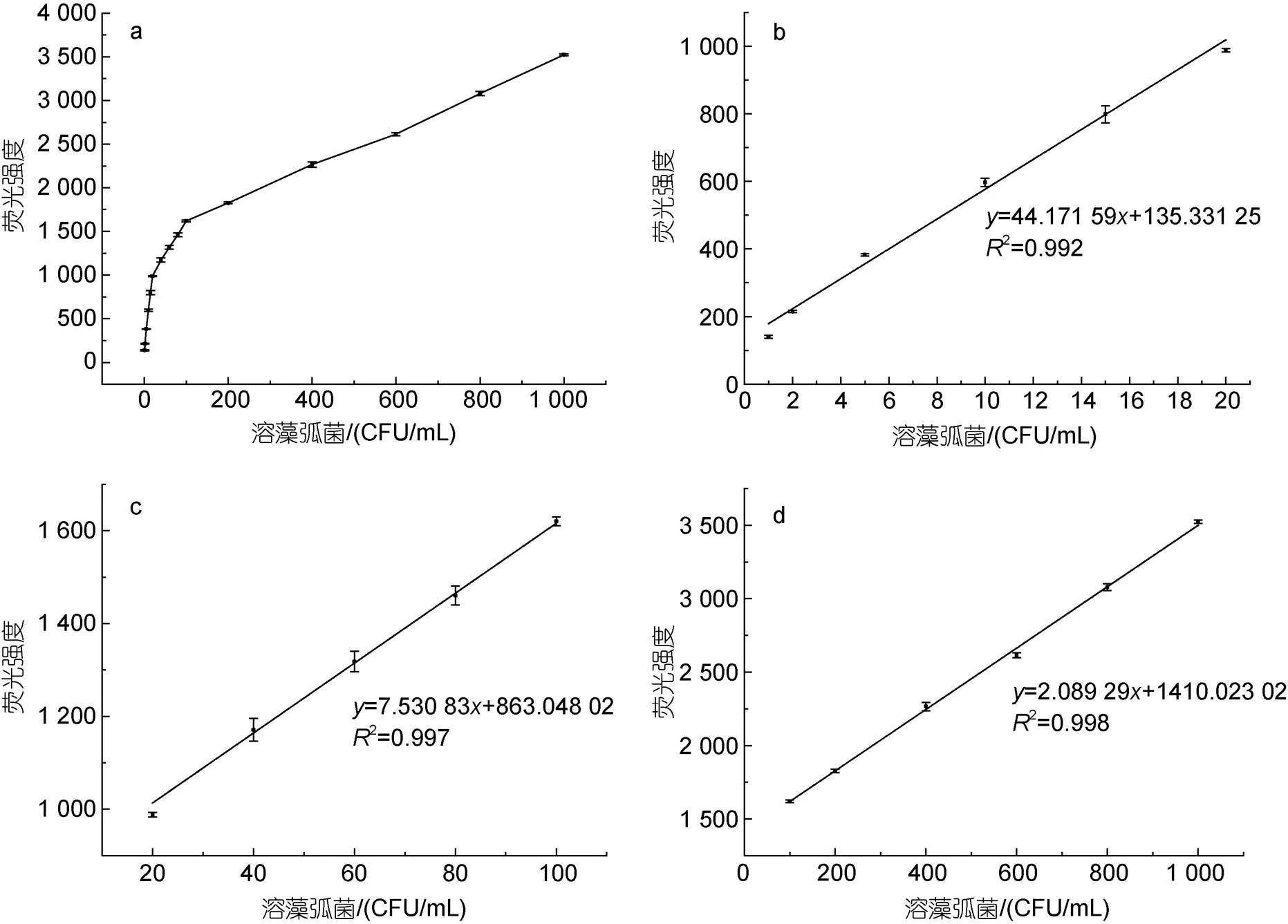
圖4 利用MAP檢測復(fù)合物對溶藻弧菌進(jìn)行檢測的工作曲線及線性擬合曲線
注: a. 全濃度范圍的工作曲線; b. 1~20 CFU/mL范圍的線性擬合曲線; c. 20~100 CFU/mL范圍的線性擬合曲線; d. 100~1 000 CFU/mL范圍的線性擬合曲線

表2 利用MAP檢測復(fù)合物檢測溶藻弧菌得到的線性擬合方程
2.5 特異性、穩(wěn)定性和重現(xiàn)性
為考察該檢測方法的特異性, 采用該方法, 利用MAP檢測復(fù)合物對濃度相同的溶藻弧菌、哈維氏弧菌、嗜水氣單胞菌、遲鈍愛德華氏菌和大腸桿菌進(jìn)行檢測。結(jié)果如圖5所示, 在菌濃度分別為10、20、50、100和500 CFU/mL時, 目標(biāo)菌溶藻弧菌檢測出的熒光強(qiáng)度都極顯著的高于其他細(xì)菌(<0.01), 約有8.6倍以上, 說明應(yīng)用MAP檢測復(fù)合物檢測溶藻弧菌的方法有較好的特異性。
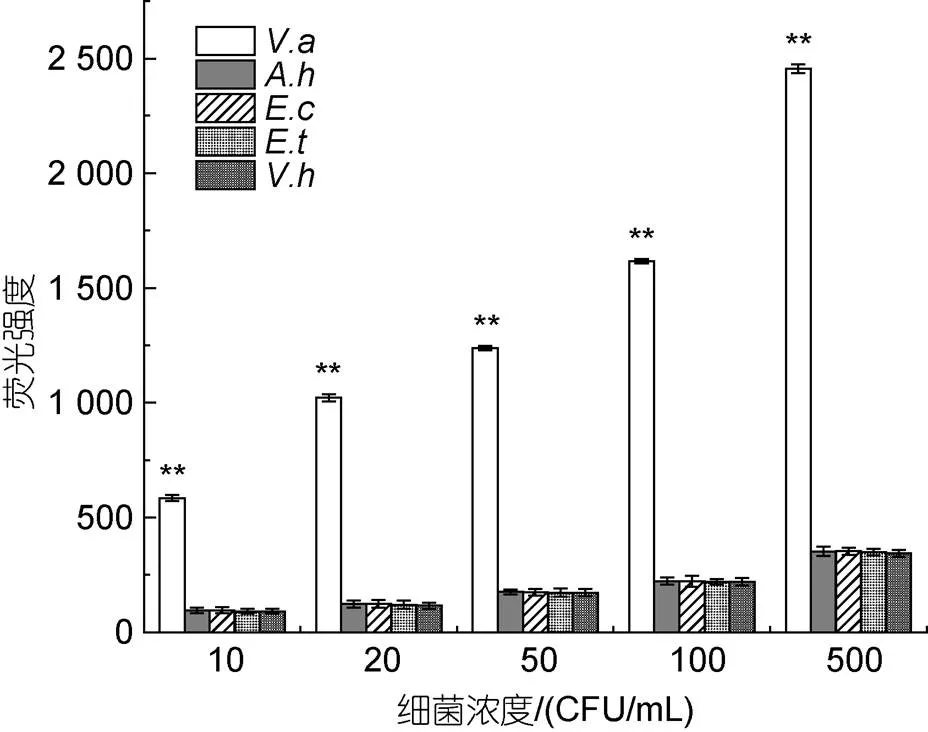
圖5 MAP檢測復(fù)合物對溶藻弧菌的檢測特異性
注:: 嗜水氣單胞菌;: 大腸桿菌;: 遲鈍愛德華氏菌;: 溶藻弧菌;: 哈維氏弧菌。圖中**表示達(dá)到極顯著水平(<0.01)
在穩(wěn)定性研究方面, 將MAP檢測復(fù)合物置于4 °C冰箱避光保存5 d后, 再分別用于10和100 CFU/mL溶藻弧菌的檢測, 結(jié)果顯示熒光強(qiáng)度分別可以保持在97.74%和99.75%。說明該方法或該檢測復(fù)合物具有較好的穩(wěn)定性。
在重現(xiàn)性研究方面, 對濃度分別為10和100 CFU/mL的溶藻弧菌進(jìn)行了6次檢測, 檢測結(jié)果的相對標(biāo)準(zhǔn)偏差(RSD)分別為1.89%和0.47%。說明應(yīng)用MAP檢測復(fù)合物檢測溶藻弧菌的方法具有較好的重現(xiàn)性。
2.6 加標(biāo)回收實(shí)驗(yàn)
加標(biāo)回收實(shí)驗(yàn)的結(jié)果如表3所示, 溶藻弧菌的加標(biāo)回收率為95.47%~102.89%, 測定結(jié)果的相對標(biāo)準(zhǔn)偏差(RSD)為1.29%~3.49%, 均在合理范圍, 說明本檢測方法及構(gòu)建的MAP檢測復(fù)合物可以用于溶藻弧菌的檢測。
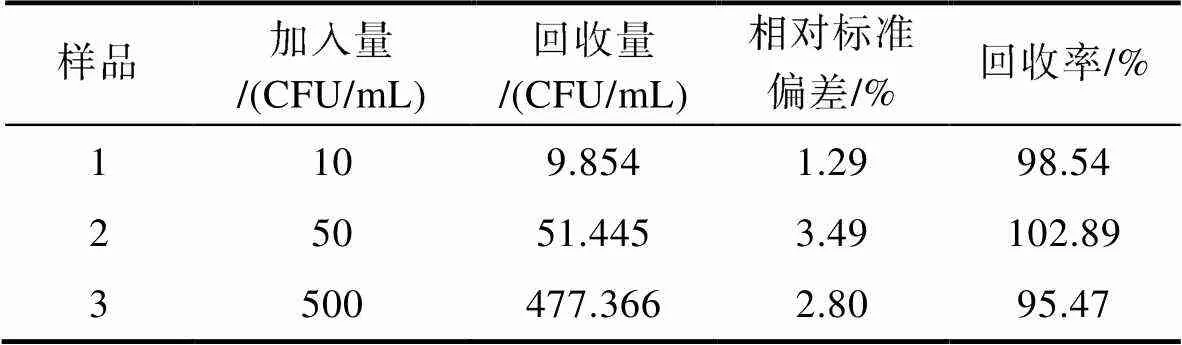
表3 樣品中溶藻弧菌的加標(biāo)回收實(shí)驗(yàn)結(jié)果
3 討論
目前溶藻弧菌的檢測方法主要有傳統(tǒng)的基于微生物培養(yǎng)的方法、以抗體為基礎(chǔ)的免疫檢測法和以弧菌基因?yàn)榘悬c(diǎn)的分子生物學(xué)方法。微生物培養(yǎng)法, 由于需要進(jìn)行微生物的培養(yǎng), 檢測周期較長, 靈敏度也不高, 目前市售的檢測試劑盒基本都采用這一方法, 其對溶藻弧菌的檢測限一般在103~104CFU/mL左右(湯學(xué)敏等, 2019)。以抗體為基礎(chǔ)的免疫檢測法對溶藻弧菌的檢測限則大多在104CFU/mL左右(宋曉玲等, 2001; Su, 2016), 而對副溶血弧菌的檢測限可達(dá)到10 CFU/mL (Wangman, 2017), 對霍亂弧菌的檢測限可到102CFU/mL (Chaivisuthangkura, 2013)。分子生物學(xué)法是目前研究報道最多的方法, 其中針對溶藻弧菌基因的環(huán)介導(dǎo)等溫擴(kuò)增法對溶藻弧菌的檢測限為104CFU/mL (陳昌國等, 2019); 選擇溶藻弧菌的鞭毛基因?yàn)槟康幕? 通過Taqman探針和qPCR體系對溶藻弧菌的檢測限可到102CFU/mL (鐘淵福等, 2016); 而針對、、和基因, 采用DPO引物建立的多重聚合酶鏈反應(yīng)系統(tǒng)對溶藻弧菌的檢測限可達(dá)到1.2 CFU/mL (Xu, 2017)。而我們采用的基于競爭置換作用的核酸適配體檢測復(fù)合物(即MAP檢測復(fù)合物)的方法, 可使最低檢測限達(dá)到1 CFU/mL, 體現(xiàn)出了較好的檢測靈敏度。目前我們應(yīng)用該MAP檢測復(fù)合物對淡水、海水以及養(yǎng)殖水體中的一些樣品進(jìn)行了檢測, 都取得了較好的效果, 后續(xù)將進(jìn)一步研究完善對血液、組織液、水產(chǎn)品等較為復(fù)雜樣品的檢測技術(shù)及前處理方法, 使其能有更廣泛的應(yīng)用價值。
利用核酸適配體來檢測溶藻弧菌的方法也有一些報道。Yu等(2019)等利用核酸適配體VA2建立了酶聯(lián)核酸適配體吸附技術(shù)(VA2-ELASA), 最低可以檢測到5×104CFU/mL的溶藻弧菌。Tang等(2013)等利用核酸適配體和PCR技術(shù), 能檢測到102CFU/mL的滅活溶藻弧菌, 進(jìn)一步改進(jìn)方法后則可檢測到10 CFU/mL (湯學(xué)敏等, 2019)。Zhao等(2016)等利用核酸適配體、納米磁珠、敏感膜電極構(gòu)建的電化學(xué)傳感器, 最低可以檢測到10 CFU/mL的溶藻弧菌。本文則通過構(gòu)建磁珠-核酸適配體-熒光報告探針的MAP檢測復(fù)合物, 利用核酸適配體的競爭置換作用實(shí)現(xiàn)了對溶藻弧菌的定量檢測, 其最低檢測限達(dá)到了1 CFU/mL。與其他檢測方法相比, 本文的檢測限有了明顯的改進(jìn), 這應(yīng)該與核酸適配體復(fù)合物具有較好的競爭置換作用相關(guān), 當(dāng)極微量的溶藻弧菌能置換出MAP檢測復(fù)合物中較多的熒光報告探針時, 這個置換作用就相當(dāng)于一個信號轉(zhuǎn)換和放大作用, 將菌濃度信號放大轉(zhuǎn)換成了熒光報告探針的熒光信號, 從而大大提高了檢測的靈敏度。本文的競爭置換方法, 檢測過程方便快捷, 有較好的特異性和穩(wěn)定性, 體現(xiàn)出了較好的應(yīng)用前景。
4 結(jié)論
以磁珠-核酸適配體-熒光報告探針的MAP檢測復(fù)合物為基礎(chǔ), 利用溶藻弧菌對其核酸適配體的競爭作用置換出熒光報告探針, 建立了一種檢測溶藻弧菌的方法。該方法在1~20、20~100和100~1 000 CFU/mL范圍內(nèi)都呈現(xiàn)出較好的線性關(guān)系, 其最低檢測限可達(dá)到1 CFU/mL, 并具有較好的特異性、穩(wěn)定性和重現(xiàn)性。另外, 對MAP檢測復(fù)合物的制備條件進(jìn)行了優(yōu)化, 確定了其較理想的制備條件為: 100 nmol/L核酸適配體與100 nmol/L熒光報告探針按體積比1︰1混合結(jié)合30 min, 制備出50 nmol/L的AP復(fù)合物, 然后該AP復(fù)合物再與25 μg/mL的磁珠按體積比1︰1混合結(jié)合60 min, 制備出相應(yīng)的MAP檢測復(fù)合物。
湯學(xué)敏, 林文燕, 鄢慶枇, 等, 2019. 基于核酸適配體的PCR法檢測溶藻弧菌及其滅活菌[J]. 中國水產(chǎn)科學(xué), 26(2): 391-396.
李玉寶, 2013. 基于適配子的弧菌PCR檢測技術(shù)的研究[D]. 廈門: 集美大學(xué): 14.
李亞楠, 趙潔, 張傲哲, 等, 2017. 核酸適配體的體外篩選方法的最新研究進(jìn)展[J]. 生物技術(shù)通報, 33(4): 78-82.
余慶, 李菲, 覃仙玲, 等, 2018. 廣西卵形鯧鲹小腦來源細(xì)胞系的建立及特征分析[J]. 廣西科學(xué), 25(1): 74-79.
宋曉玲, 黃倢, 史成銀, 2001. 溶藻弧菌單克隆抗體的制備及應(yīng)用[J]. 水產(chǎn)學(xué)報, 25(6): 522-527.
張曉華, 林禾雨, 孫浩, 等, 2018. 弧菌科分類學(xué)研究進(jìn)展[J]. 中國海洋大學(xué)學(xué)報, 48(8): 43-56.
張穎雪, 蘇潔, 葉仕根, 2019. 養(yǎng)殖貝類病原弧菌的耐藥性及防治方法研究進(jìn)展[J]. 江西水產(chǎn)科技(5): 53-56.
陳昌國, 陳秋圓, 侯兵兵, 等, 2019. 基于LAMP技術(shù)針對溶藻弧菌gyrB基因快速檢測方法的建立[J]. 現(xiàn)代檢驗(yàn)醫(yī)學(xué)雜志, 34(6): 6-9.
鐘淵福, 郭以河, 胡永獅, 等, 2016. 熒光實(shí)時定量PCR檢測溶藻弧菌方法的建立[J]. 現(xiàn)代預(yù)防醫(yī)學(xué), 43(21): 3974-3977.
BLIND M, BLANK M, 2015. Aptamer selection technology and recent advances [J]. Molecular Therapy-Nucleic Acids, 4: e223.
CHAIVISUTHANGKURA P, PENGSUK C, LONGYANT S,, 2013. Evaluation of monoclonal antibody based immunochromatographic strip test for direct detection ofO1 contamination in seafood samples [J]. Journal of Microbiological Methods, 95(2): 304-311.
DA-SILVA E, BAUDART J, BARTHELMEBS L, 2018. Biosensing platforms forbacteria detection based on whole cell and nucleic acid analysis: a review [J]. Talanta, 190: 410-422.
FUTAMI K, KIMOTO M, LIM Y W S,, 2019. Genetic alphabet expansion provides versatile specificities and activities of unnatural-base DNA aptamers targeting cancer cells [J]. Molecular Therapy-Nucleic Acids, 14: 158-170.
LI L Y, LI Q J, LIAO Z Y,, 2018. Magnetism-resolved separation and fluorescence quantification for near-simultaneous detection of multiple pathogens [J]. Analytical Chemistry, 90(15): 9621-9628.
LIU C H, CHENG W, HSU J P,, 2004.infection in the white shrimpconfirmed by polymerase chain reaction and 16S rDNA sequencing [J]. Diseases of Aquatic Organisms, 61(1/2): 169-174.
LUO P, HE X Y, WANG Y H,, 2016. Comparative genomic analysis of six new-found integrative conjugative elements (ICEs) in[J]. BMC Microbiology, 16(1): 79.
MUHAMMAD M, HUANG Q, 2021. A review of aptamer-based SERS biosensors: design strategies and applications [J]. Talanta, 227: 122188.
QI X Y, YAN X C, ZHAO Y L,, 2020. Highly sensitive and specific detection of small molecules using advanced aptasensors based on split aptamers: a review [J]. TrAC Trends in Analytical Chemistry, 133: 116069.
RADUCANU V S, RASHID F, ZAHER M S,, 2020. A direct fluorescent signal transducer embedded in a DNA aptamer paves the way for versatile metal-ion detection [J]. Sensors and Actuators B: Chemical, 304: 127376.
SU Z Z, LI Y, PAN L Q,, 2016. An investigation on the immunoassays of an ammonia nitrogen-degrading bacterial strain in aquatic water [J]. Aquaculture, 450: 17-22.
TANG X M, ZHENG J, YAN Q P,, 2013. Selection of aptamers against inactiveand application in a qualitative detection assay [J]. Biotechnology Letters, 35(6): 909-914.
UEMACHI H, KASAHARA Y, TANAKA K,, 2020. Discovery of cell-internalizing artificial nucleic acid aptamers for lung fibroblasts and targeted drug delivery [J]. Bioorganic Chemistry, 105: 104321.
V?LIMAA A L, TILSALA-TIMISJ?RVI A, VIRTANEN E, 2015. Rapid detection and identification methods forin the food chain - a review [J]. Food Control, 55: 103-114.
WANGMAN P, CHAIVISUTHANGKURA P, SRITUNYALUCKSANA K,, 2017. Development of monoclonal antibodies specific to ToxA and ToxB ofthat cause acute hepatopancreatic necrosis disease (AHPND) [J]. Aquaculture, 474: 75-81.
XU Y G, SUN L M, WANG Y S,, 2017. Simultaneous detection of,,andin seafood using dual priming oligonucleotide (DPO) system-based multiplex PCR assay [J]. Food Control, 71: 64-70.
YAN J H, XIONG H J, CAI S D,, 2019. Advances in aptamer screening technologies [J]. Talanta, 200: 124-144.
YU Q, LIU M Z, WEI S N,, 2021. Research progress and prospects for the use of aptamers in aquaculture biosecurity [J]. Aquaculture, 534: 736257.
YU Q, LIU M Z, XIAO H H,, 2019. Development of novel aptamer-based enzyme-linked apta-sorbent assay (ELASA) for rapid detection of mariculture pathogen[J]. Journal of Fish Diseases, 42(11): 1523-1529.
ZHAO G T, DING J W, YU H,, 2016. Potentiometric aptasensing ofbased on DNA nanostructure-modified magnetic beads [J]. Sensors, 16(12): 2052.
Detection ofBASED ON competition and SUBSTITUTION reactions related to aptamer
LIN Xiao-Jun1, 2, 3, 4, PENG Ying-Lin1, YAN Qing-Pi1, JIANG Xing-Long1, 2, ZHOU Jian-Chuan1, TANG Xue-Min2, FAN Yun-Ting1, ZHENG Jiang1, 2, 3
(1. Fisheries College of Jimei University, Xiamen 361021, China; 2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education, Xiamen 361021, China; 3. Engineering Research Center of Aquaculture Breeding and Healthy of Fujian, Xiamen 361021, China; 4. Fujian Province Key Laboratory of Special Aquatic Formula Feed, Fuqing 350308, China)
is an opportunistic pathogen with stronger pathogenicity in aquaculture. A new detection method based on the competition and substitution reactions related to aptamer was developed for more sensitive and efficient detection of the pathogen. A detection complex composed of magnetic bead, aptamer, and fluorescent reporter probe (MAP detection complex) was designed and prepared at first. Because of the good affinity and specificity betweenand its aptamer,in the tested sample would compete for aptamer in the MAP detection complex, and replace the fluorescent reporter probe bound with the aptamer. The concentration of the bacterium could be reflected by the fluorescence intensity of the replaced fluorescent reporter probe, and thus the quantitative detection ofwas realized. The results show that the present method could detect as low as to 1 CFU/mL of. Moreover, the method had no cross-reaction with other common pathogenic microorganisms in aquaculture such as,,, and. Good linearity was found in the range of 1~20, 20~100 and 100~1000 CFU/mL of. The optimal preparation conditions of the MAP detection complex were realized in the following procedures. The aptamer-fluorescent reporter probe (AP) complex of 50 nmol/L was prepared by mixing 100 nmol/L aptamer with 100 nmol/L fluorescent reporter probe at the volume ratio of 1︰1 for 30 min, and then the 50 nmol/L AP complex was mixed with 25 μg/mL magnetic bead at the volume ratio of 1︰1 for 60 min and the corresponding MAP detection complex was prepared. The detection ofbased on the competition and substitution reactions related to the aptamer showed better sensitivity and specificity with a good application prospect.
aptamer;; competition and substitution reactions; fluorescent reporter probe; magnetic beads
Q939; S917.1
10.11693/hyhz20210600149
*福建省自然科學(xué)基金項(xiàng)目, 2018J01455號, 2021J01823號; 鰻鱺現(xiàn)代產(chǎn)業(yè)技術(shù)教育部工程研究中心開放基金, RE201808號, RE202104號; 福建省水產(chǎn)生物育種與健康養(yǎng)殖工程研究中心開放基金課題, DF201901號; 福建省特種水產(chǎn)配合飼料重點(diǎn)實(shí)驗(yàn)室開放課題, TMKJZ1909號。林筱鈞, 碩士研究生, E-mail: linxj0022021@163.com
鄭 江, 博士, 教授, E-mail: zhengjiang618@163.com
2021-06-27,
2021-08-29
- 海洋與湖沼的其它文章
- 兩種混養(yǎng)方式對異枝江蘺(Gracilaria bailinae)生長性能、表面附生細(xì)菌群落及抗生素抗性基因的影響*
- 基于無人機(jī)高光譜遙感技術(shù)對內(nèi)陸?zhàn)B殖池塘水質(zhì)監(jiān)測的研究*
- 外源神經(jīng)遞質(zhì)5-羥色胺(5-HT)和多巴胺(DA)調(diào)控三疣梭子蟹爭斗行為的初步研究*
- 仿生態(tài)條件下星洲紅魚(Singapore red tilapia)和奧尼羅非魚(Oreochromis niloticus)生長和肌肉營養(yǎng)特性的比較研究*
- 印度洋赤道潛流年際變化特征及其與印度洋偶極子的聯(lián)系*
- 太平洋內(nèi)部副熱帶-熱帶經(jīng)向翻轉(zhuǎn)環(huán)流的季節(jié)變化特征*

