雌性健康和絕經小鼠長骨及頜骨來源骨髓間充質干細胞生物學特性的比較*
胡珊珊,張為,曹煒**,胡小華,林雪***,楊曉紅****
(1.遵義醫科大學附屬口腔醫院 修復科,貴州 遵義 563006; 2.陸軍軍醫大學第一附屬醫院 口腔科, 重慶 400038; 3.遵義醫科大學附屬口腔醫院 頜面外科, 貴州 遵義 563006)
絕經后骨質疏松癥(postmenopausal osteoporosis,POP)是指中老年婦女在雌激素降低、缺乏后的一種以全身骨量減少、骨組織微環境改變所致的骨脆性增加、并發骨折風險上升的全身骨代謝性疾病[1]。一般情況下,絕經后骨組織微環境會發生變化,骨髓間充質干細胞等非造血干細胞發生特定生物學功能障礙,新骨形成不足,引發骨質疏松癥[2]。有報道顯示,頜骨及長骨不僅在胚胎發育的組織來源和細胞的信號傳導機制存在差異,而且在細胞分化和成骨基因等表達方面也有不同[3-4],但膜內成骨的顱頜面骨和軟骨內成骨的長骨兩者之間存在的具體差異未見深入研究。因此,本研究將絕經后骨質疏松狀態與正常健康狀態下小鼠長骨來源的骨髓間充質干細胞(bone-marrow-derived mesenchymal stem cells, BMMSCs)和頜骨來源的骨髓間充質干細胞(jaw mandibular bone marrow mesenchymal stem cells,JMMSCs)進行增殖能力、成脂分化以及成軟骨分化性能對比,觀察兩種狀態下的骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)生物學特性是否存在差異,為臨床頜骨骨缺損治療及修復提供依據。
1 材料與方法
1.1 實驗動物及材料
SPF級雌性健康C57BL/6小鼠,8周齡,體質量(20±2)g,購自重慶騰鑫生物技術有限公司[許可證號 SCXK(京)2019-0010]。α-MEM培養基、胎牛血清(FBS)均購自Gibco公司,胰蛋白酶、磷酸鹽緩沖液(PBS)以及青鏈霉素均購自Hyclone公司,CKK-8檢測試劑盒購自碧云天公司,茜素紅染液、油紅O染液和阿利新藍染液均購自Solarbio公司。
1.2 實驗方法
1.2.1絕經后骨質疏松小鼠動物模型的構建 雌性C57BL/6小鼠(6月齡)36只,麻醉后剃除其背部毛發,用碘伏消毒剃毛部的皮膚,剪開背部皮膚,分層剝離皮下、脂肪及腹腔層,其中18只小鼠找到臟層的雙側卵巢,結扎和剪棄,作為絕經后骨質疏松小鼠模型組(ovariectomies group,OVX組),另外18只小鼠僅剪去卵巢周圍組織作為正常對照組(sham-operated group,SHAM組),兩組小鼠低鈣飼養12周后用于本次實驗。
1.2.2BMSCs的分離、純化與培養 將已成功建模的OVX組及SHAM組小鼠飼養12周后采用頸部脫臼法處死,取其下頜骨和長骨(包括股骨及脛骨),去凈黏附于骨的軟組織和筋膜,然后用1 mL注射器和α-MEM完全培養基(20%FBS,100 U/mL青鏈霉素混合液)反復沖洗骨髓腔,制成骨髓單細胞懸液,共4組,分別為OVX-BMMSCs組、SHAM-BMMSCs組、OVX-JMMSCs組以及SHAM-JMMSCs組。長骨組骨髓單細胞懸液直接放入T25 cm2的培養瓶中培養,頜骨組骨髓單細胞懸液則連同剪碎后的下頜骨組織一同放入T25 cm2的培養瓶中培養,培養液均為5 mL,每3 d換1次培養液,待細胞融合生長達85%后用0.25%胰蛋白酶消化傳代,本實驗所用細胞主要為第3代。
1.3 觀察指標
1.3.1骨組織形態學 將已成功建模的OVX組及SHAM組小鼠飼養12周后采用頸部脫臼法處死,取其下頜骨和長骨并去凈粘附于骨的軟組織和筋膜;4%多聚甲醛室溫固定 48 h,然后用 EDTA 脫鈣液常溫下脫鈣3周,每3 d更換1次脫鈣液;將脫鈣好的標本在流水下沖洗8 h,用酒精行梯度脫水后進行石蠟包埋,以約10 μm切片,HE染色,觀察骨凹陷窩、骨小梁排列形態等病理學指標。
1.3.2BMSCs增殖能力(CCK-8法) 將頜骨及長骨來源的BMSCs以6×103個/孔接種于96孔板中,100 μL/孔,每組每天設5個復孔,7 d共接種7個96孔板,每3 d換1次培養液;第1~7天,每天同一時間取出一個板,每個培養孔加入CCK-8液10 μL和完全培養基90μL,37 ℃孵育2 h,用酶標儀490 nm 波長檢測吸光度值(OD值),繪制增殖曲線。
1.3.3脂滴含量檢測(油紅O染色) 將頜骨及長骨組BMSCs以每毫升1×105個接種于24孔板,每3 d換1次液,待細胞長至板底85%~90%時,更換為成脂誘導培養基。14 d后吸棄誘導培養基,加入細胞固定液固定30 min,加入新配制的60%異丙醇作用5 min;棄去60%異丙醇后加入新制備的ORO Stain液,染色15 min,PBS輕輕洗3 min;加入Mayer蘇木素染色1 min,PBS反復洗滌3遍;加入ORO Buffer液靜置1 min后棄去加入蒸餾水,鏡下觀察脂滴分布圖樣并拍照;拍照完畢后進入定量,加入適量的異丙醇溶液于孔中,靜置10 min,收集溶解的液體,加入96孔專用板中,使用酶標儀在520 mm處檢測溶解的液體的OD值。
1.3.4軟骨基質含量檢測(阿利新藍染色) 將頜骨及長骨組BMSCs以每毫升1×105個的劑量接種于24孔板,每3 d換1次液,待細胞長至板底85%~90%時,更換為成軟骨誘導培養基,每3d替換1次誘導培養基,21 d后棄去誘導培養基,加入細胞固定液作用30 min,PBS輕輕洗滌2遍,加入阿利新藍染色液作用30 min;PBS沖洗3 min,Alcian酸化工作液(工作液∶蒸餾水=1∶2,提前5 min配好)處理1 min;PBS沖洗2次,倒置顯微鏡下觀察軟骨球形成的樣貌并拍照。阿利新藍染液是一種能附著于軟骨細胞的基質藍色染液,其染色越深代表其軟骨基質含量越多。ALP定量分析:去除原培養液,加入適量細胞裂解液(不含蛋白酶抑制劑),置于搖床,冰上裂解30 min;取上清液,測定總蛋白濃度,按照ALP試劑盒說明書測定405 nm處OD值。根據標準品的OD值繪制曲線,計算獲得各組ALP定量結果。
1.4 統計學方法
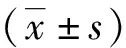
2 結果
2.1 組織形態學觀察
小鼠的下頜骨、股骨 HE染色結果顯示:與SHAM組相比,OVX組小鼠的骨小梁排列較紊亂,骨吸收明顯,出現了較多大小規則不同的骨凹陷窩,見圖1。

注:A為OVX組頜骨,B為SHAM組頜骨;C為OVX長骨,D為SHAM長骨。
2.2 BMSCs的分離、純化與培養
經全骨髓貼壁法培養后,在光學顯微鏡下觀察4組BMSCs的生長情況及細胞形態,可見4組BMSCs 均能貼壁生長,傳至第3代的4組BMSCs形態相似,呈三角形或梭形,有參差不齊的細胞突起。見圖2。

注:A、B 為OVX-BMMSCs組,C、D為SHAM-BMMSCs組;E、F為OVX-JMMSCs組,G、H為SHAM-JMMSCs組。
2.3 BMSCs增殖能力
CCK-8法檢測結果顯示,4組BMSCs細胞隨著培養時間的延長,細胞的增殖活性呈升高趨勢(圖3,P=0.034)。從培養第4 天開始,OVX組和SHAM組細胞增殖速度達對數生長期,且JMMSCs的增殖能力明顯強于BMMSCs組(OVX-JMMSCs組與OVX-BMMSCs組比較,P<0.05;SHAM-JMMSCs組與SHAM-BMMSCs組比較,P<0.05)。

注:A為OVX組,B為SHAM組。
2.4 脂滴含量
油紅O定量分析結果表明:JMMSCs形成的脂滴含量均較少于BMMSCs(P<0.001)。見圖4。

注:A 為SHAM-BMMSCs組,B為SHAM-JMMSCs組,C為OVX-BMMSCs組,D為OVX-JMMSCs組,E為4組細胞油紅O定量結果;(1)與SHAM組BMMSCs比較,P<0.001;(2)與OVX組BMMSCs比較,P<0.001。
2.5 軟骨基質含量
阿利新藍染色結果顯示:4組BMSCs均可見染成藍色的成軟骨基質,呈異染性著色(見圖5)。ALP定量顯示SHAM組和OVX組的JMMSCs與BMMSCs的軟骨基質含量差異無統計學意義(SHAM組JMMSCs與BMMSCs比較,P=0.203;OVX組JMMSCs與BMMSCs比較,P=0.776)。見圖5。

注:A為SHAM-BMMSCs組,B為SHAM-JMMSCs組,C為OVX-BMMSCs組,D為OVX-JMMSCs組,E為4組細胞ALP定量;(1)與SHAM組BMMSCs比較,P=0.203;(2)與OVX組BMMSCs比較,P=0.776。
3 討論
近年來,中國社會老齡化趨勢迅猛,骨質疏松癥已經成為危害老年人健康的重大慢性病之一。據統計,中國人群中患絕經后骨質疏松癥并發骨折的80歲以上人群數量比在50~59歲人群上升4倍多,這為家庭及社會造成巨大的經濟負擔[5]。頜骨作為全身骨骼系統改建較為活躍的一部分,同樣會受到骨質疏松的影響,發生頜骨骨質疏松的危害在口腔相關疾病中的表現主要在于會促使牙槽骨的快速吸收和加快牙周炎的發展,從而對義齒修復、種植和頜面外科手術等口腔科治療帶來困難[6-7]。現今,對骨質疏松癥治療方式主要為藥物治療,包括雌激素替代療法、降鈣素、選擇性雌激素受體調節劑等,但是這些藥物主要針對全身性的骨質疏松癥,且藥物的毒副作用、長期運用的安全性都給臨床治療帶來了挑戰[8-9]。隨著干細胞生物醫學的深入研究,針對干細胞的醫學治療正在興起。
BMSCs作為具有強增殖、自我更新及多向分化潛能的干細胞,能在特定培養條件下向成骨細胞、成纖維細胞、脂肪細胞、軟骨細胞、神經細胞等多向分化,在移植物抗宿主免疫、修復組織損傷及基因靶向治療等方面具有較大應用前景[10-11];盡管均屬于全身骨骼的一部分,但是在組織發生方面,頜骨來源于外胚層的神經嵴細胞,長骨來源于中胚層的間葉細胞;在組織成骨方式方面,頜骨的形成以膜內成骨為主,而長骨則以軟骨內成骨為主[12-14]。在本研究中,將兩種來源的BMSCs分開研究,在同樣的培養條件下,發現無論是在健康狀態還是絕經后骨質疏松狀態下JMMSCs的成脂能力都比BMMSCs弱,分析其原因可能一是兩種細胞的骨形成方式不同,可能造成了頜骨對微環境刺激、細胞因子等生物調節的敏感度不同于長骨;二是頜骨受到咀嚼、言語和吞咽所產生的持續機械刺激,從而刺激骨重塑,使頜骨與長骨之間的骨重塑率不同,有研究發現在犬模型中,下頜骨的周轉率是脛骨的10倍[15],因此可能造成JMMSCs增殖能力強于BMMSCs。此外,本研究所采用的動物模型為嚙齒類動物,其頜骨存在終身生長發育的特點,骨骼肌的不斷刺激使得咀嚼系統不斷改建與完善,這有利于觀察到骨質疏松時骨微環境的變化;而人在出生后,頜骨的生長發育主要有兩種方式,即髁突的軟骨內成骨和膜內成骨,這使得頜骨向垂直、內外及前后不同方向生長,但在青少年時期則發育完全,最晚發育完全的髁突也在20~25歲就停止了[16]。骨形成與破壞的原因主要在于BMSCs分化功能在成脂與成骨等方向不平衡,使得骨微環境中破骨細胞與成骨細胞產生差異,因此本研究模型對今后研究其他種屬的骨改建仍有一定參考意義。
本實驗中發現骨質疏松狀態下BMSCs的生物學特性發生了改變,但調控其分化的機制卻有許多[17-18]。首先在經典的信號通路研究中,BMP/Smads信號通路及OPG/RANK/RANKL信號通路與BMSCs分化有著密不可分的關系[19-21],Hu等[22]更是發現BMP I型受體蛋白也參與了下頜骨骨代謝平衡。此外,一些轉錄因子也參與了BMSCs分化,其中轉錄因子Runx2是BMSCs分化的重要決定因子,Lai等[23]發現Runx2和Osterix上調可以加速骨代謝,促進骨折愈合。近年來,有關非編碼RNA的研究正在興起,研究發現這類RNA能通過調控骨相關信號通路對BMSCs分化產生控制[24],本課題組前期研究就發現敲低小鼠頜骨骨髓間充質干細胞中的miR-705表達,可上調成骨相關基因表達,促進BMSCs向成骨分化[25]。
綜上所述,無論是健康狀態還是絕經后骨質疏松狀態下,小鼠頜骨及長骨來源的BMSCs確實存在增殖及成脂分化能力的差異,研究相應內容時應分開進行,這為干細胞應用和骨組織缺損修復提供了重要參考。

