微小核糖核苷酸-21、異常凝血酶原及甲胎蛋白聯合檢測在肝細胞癌診斷中的價值*
高光劍,王興1,,潘耀振1,**
(貴州醫科大學附屬腫瘤醫院 肝膽外科,貴州 貴陽 550001)
原發性肝癌(primary hepatic carcinoma,PHC)占我國癌癥死因第二位,其5年生存率不足20%[1],且發病出現低齡化的現象[2]。每年全世界肝癌的新發病例約75萬人,而每年約有70萬人死于該病[3],如此之高的死亡率提示必須重視該疾病研究,臨床對于進展期肝癌缺乏有效的治療手段,故而對肝癌的早期診斷及治療顯得越來越重要。在腫瘤發生及發展過程中,腫瘤與宿主相互作用或腫瘤細胞生長過程中釋放、合成一類特殊物質,它們可以反映出腫瘤在體內演變的狀態,這一類物質便是腫瘤標志物,由于肝癌血清學標記物相對于有創檢查在早期篩查等方面具有一定的優勢,故尋找易于采集、檢測方便、準確率高的血清學標記物已迫在眉睫。由于微小核糖核苷酸-21(micro Ribonucleic Acid-21,microRNA-21)和異常凝血酶原(proteins induced by vitamin K absence for factor II,PIVKA-Ⅱ)具有較好的穩定性和對肝細胞癌(hepatic cell carcinoma,HCC)診斷的靈敏度,而甲胎蛋白(Alpha-Fetoprotein,AFP)又作為經典的肝癌血清學標志物,故本實驗旨在探討microRNA-21聯合PIVKA-Ⅱ、AFP在肝細胞肝癌患者的診斷符合率、復發監測的臨床實用價值。
1 資料與方法
1.1 資料
1.1.1研究對象 收集2016年10月—2017年8月205例病歷資料,隨機分為HCC組54例、肝硬化組(LC組)75例和健康體檢組(CG)組76例。HCC組是來自手術后病理證實為HCC的患者54例,其中男性42例、女性12例,年齡28~78歲、平均(56.72±11.36)歲。納入標準:初診為HCC,術前均未接受過藥物化療、放療、肝動脈栓塞或生物治療等處理;Child-Pugh分級A~B級;一般資料完整。排除標準:Child-Pugh分級C級;彌漫型肝癌;排除合并有其他腫瘤或者嚴重感染。LC組為同期消化內科住院的肝硬化患者(包括飲酒、慢性肝病等所致的肝硬化,但排除合并腫瘤、活動性肝炎、妊娠、胚胎源性腫瘤等)75例,其中男性38例、女性37例,年齡29~80歲、平均(55.96±12.74)歲。CG組為同期體檢中心的健康體檢者76例,其中男性32例、女性44例,年齡21~88歲、平均(55.37±14.87)歲。
1.1.2試劑 黑龍江哈爾濱新海基因公司的快速全血miRNA提取試劑盒(貨號B1803),HG Taqman miRNA反轉錄試劑盒(貨號B1802),HG Taqman miRNA-21定量PCR試劑盒(貨號TAP01108),HG Taqman miRNA-16定量PCR試劑盒(內參基因,貨號TAP01511),日本富士瑞必歐公司的PIVKA-Ⅱ試劑盒,珠海麗珠試劑股份有限公司的AFP試劑盒。
1.1.3試驗設備 7500 Fast Real-Time PCR System(applied biosystems,USA)、日本富士瑞必歐公司的Lumipulse G1200電化學發光免疫分析儀、德國西門子的ADVIA Centaur?XP 全自動化學發光免疫分析系統、日本東芝公司的Aquilion TM Prime螺旋CT,以及離心機、真空采血管、EP管、恒溫冰箱等。
1.2 方法
1.2.1PIVKA-Ⅱ及AFP標本收集及處理方法 抽取各組受試者(HCC組和LC組入院時,CG組體檢時)的清晨空腹靜脈血液3 mL置BD促凝分離膠真空管,在室溫下靜置30 min,3 000 r/min離心10 min,取上層清液置于4 ℃冰箱中保存,一部分血清于4 h內完成血清AFP的檢測,另一部分血清用于檢測PIVKA-Ⅱ;HCC組于手術后1月、3月、6月、9月、12月時再次檢測AFP、PIVKA-Ⅱ兩項指標。
1.2.2microRNA-21檢測 抽取3組受試者(HCC組和LC組入院時,CG組體檢時)的清晨空腹靜脈血液5 mL置BD抗凝真空采血管,經細胞裂解、脫水、離心、吸附柱吸附、洗脫,獲得的洗脫產物即為提取的microRNA;經反轉錄后獲得cDNA產物進行realtime PCR反應,收集信號采用FAM染料通道,microRNA-21相對定量用2-ΔΔCt表示[4]。按照microRNA-21指標的定量中位數值,對54例HCC組患者進行高表達和低表達分層,分別于術后1月、3月、6月、9月、12月對HCC組患者進行規律隨訪。
1.3 統計學方法
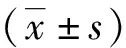
2 結果
2.1 一般資料
3組被檢者的性別、年齡、HBsAg及肝功能分級的數值比較,差異均無統計學意義(P>0.05),具有可比性。見表1。
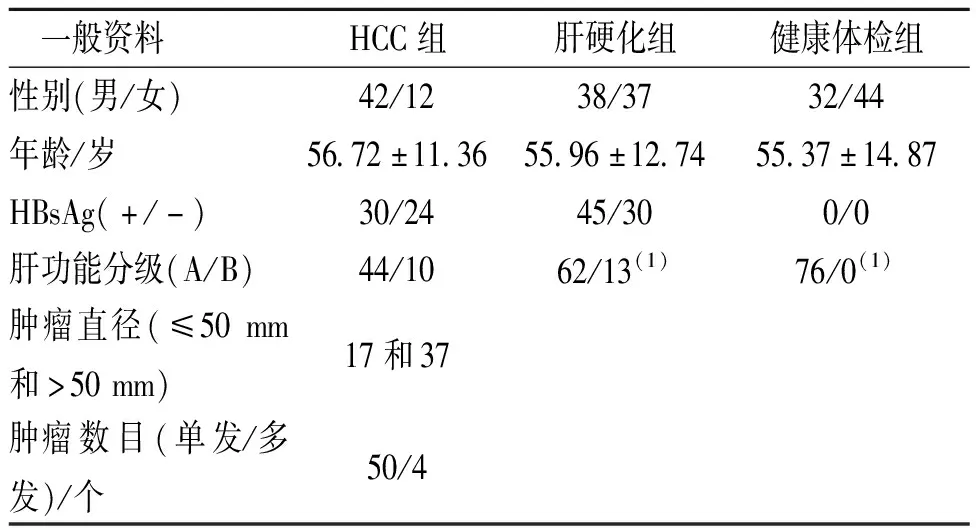
表1 3組被檢者一般資料
2.2 血清microRNA-21、PIVKA-Ⅱ、AFP
HCC組microRNA-21、PIVKA-Ⅱ、AFP血清學指標分別高于肝硬化組和對照組,且差異有統計學意義(P<0.05);而肝硬化組與對照組比較,microRNA-21、PIVKA-Ⅱ、AFP血清學指標差異無統計學意義(P>0.05)。見圖1。
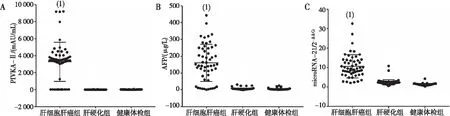
注:A為PIVKA-Ⅱ表達量,B為AFP表達量,C為microRNA-21表達量;(1)與肝硬化組及健康體檢組比較,P<0.05。
2.3 microRNA-21、PIVKA-Ⅱ、AFP單獨或聯合時診斷HCC的效能
microRNA-21、PIVKA-Ⅱ、AFP聯合檢測對HCC診斷的準確度高于任何一項指標單獨或者任意兩項指標聯合的準確度,因此,microRNA-21、PIVKA-Ⅱ及AFP聯合檢測對HCC患者具有更高的診斷率。見表2。
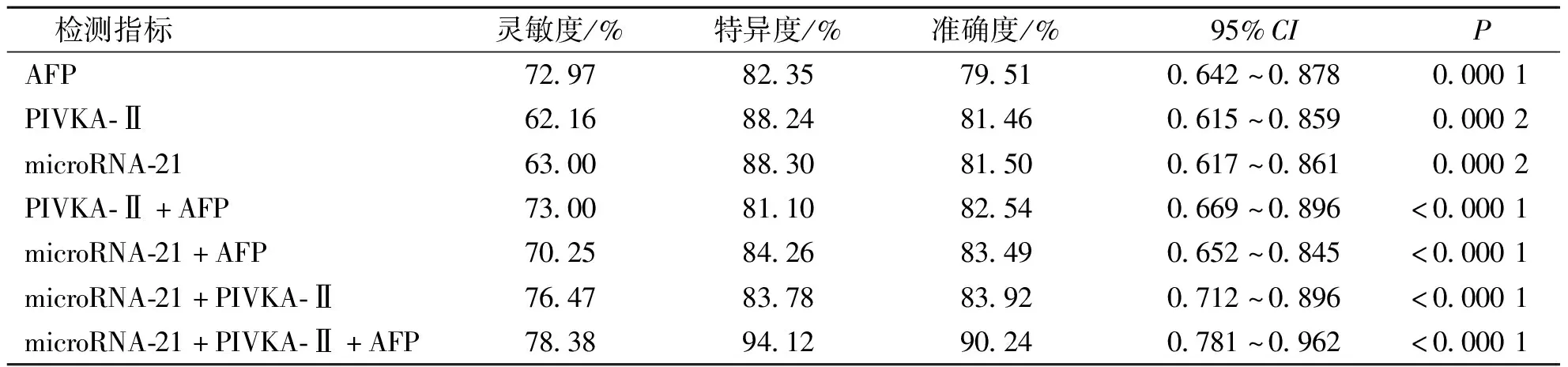
表2 microRNA-21、PIVKA-Ⅱ、AFP單獨或聯合檢測對HCC的診斷效能
2.4 microRNA-21、PIVKA-Ⅱ、AFP單獨或聯合檢測對HCC診斷價值
將實驗數據導入SPSS 19.0軟件中繪制ROC曲線,得到HCC組microRNA-21、PIVKA-Ⅱ、AFP指標單獨及上述3項指標聯合的AUC,microRNA-21、PIVKA-Ⅱ、AFP這3項指標均陽性的AUC大于microRNA-21、PIVKA-Ⅱ、AFP每一項的AUC,證實microRNA-21、PIVKA-Ⅱ及AFP聯合檢測較上述3項指標單獨檢測對HCC具有更高的診斷價值。見圖2。
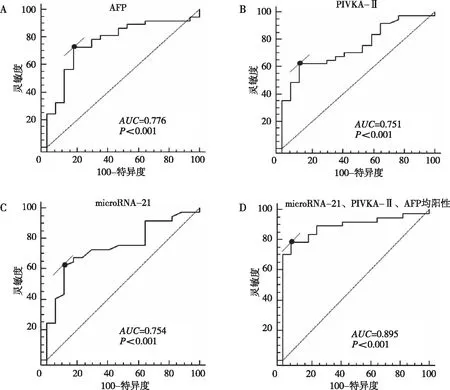
注:A為AFP的ROC曲線,B為PIVKA-Ⅱ的ROC曲線,C為microRNA-21的ROC曲線,D為microRNA-21、PIVKA-Ⅱ及AFP三者聯合的ROC曲線。
2.5 microRNA-21表達水平與HCC患者治療預后
54例的HCC組患者根據中位數值而得到了高表達(n=28)和低表達(n=26)兩個分層,截止隨訪時間結束時未出現失訪者。從復發曲線(圖3)可見microRNA-21高表達分層的無復發曲線明顯低于低表達分層,差異有統計學意義(P<0.05),提示microRNA-21的過表達與HCC患者術后腫瘤復發有著密切聯系。
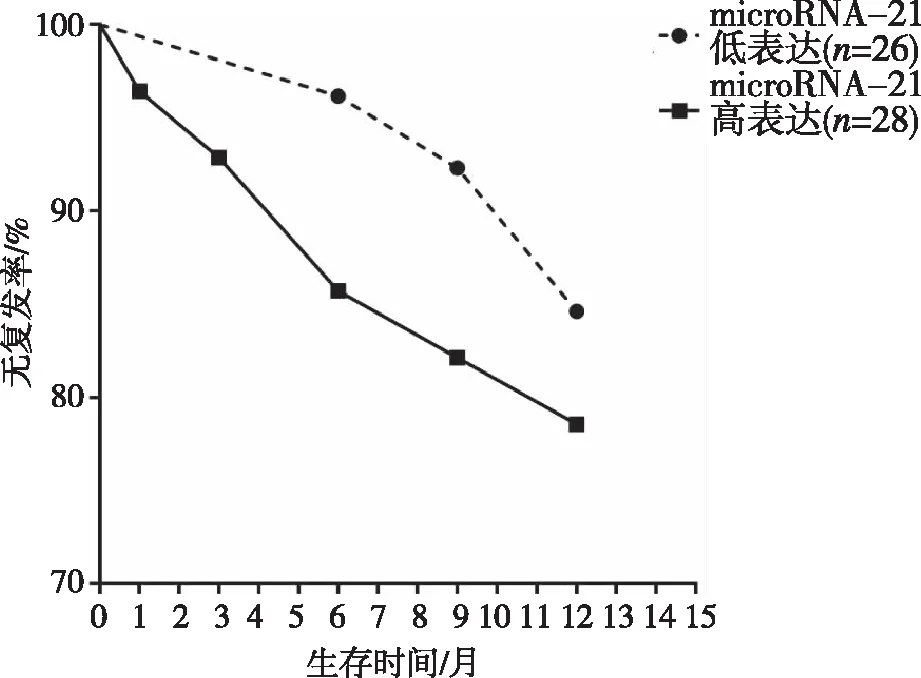
圖3 HCC組中患者腫瘤復發情況
2.6 HCC組患者腫瘤復發的單因素及多因素分析
根據HCC組患者的相關資料分別進行了腫瘤復發的單因素及多因素分析(表3),單因素分析結果顯示腫瘤的復發與腫瘤直徑、PIVKA-Ⅱ、microRNA-21、門靜脈侵犯、腫瘤分化程度、微血管侵犯、AJCC分期有關,差異有統計學意義(P<0.05);多因素分析結果顯示,腫瘤復發與PIVKA-Ⅱ、microRNA-21、門靜脈侵犯、分化程度、微血管侵犯及AJCC分期有關,差異有統計學意義(P<0.05)。
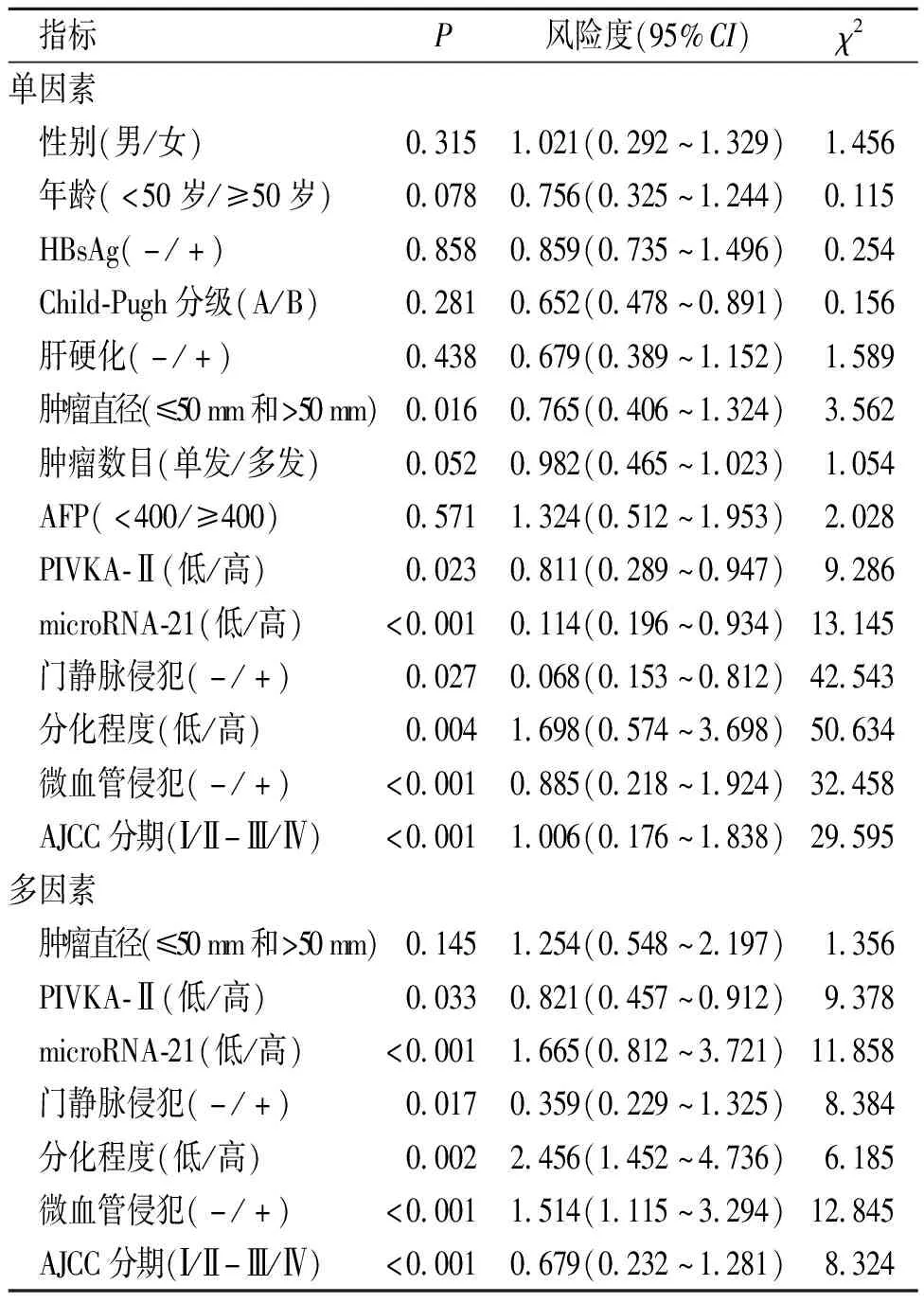
表3 HCC組患者腫瘤復發的單因素和多因素分析
3 討論
肝癌是一種惡性程度高、治療效果欠理想、病死率相對較高的惡性腫瘤之一。隨著研究的進展,以根治性手術為主的綜合治療已逐步建立起來,小肝癌和非小肝癌的手術切除率的差別,在一項研究中得到了證實,分別為95.70%和51.20%,而術后5年生存率亦表現出了顯著的差異,分別為71.90%和15.40%[5],若患者能夠通過體檢早期篩查發現小肝癌,經治療后能夠在很大程度上得到痊愈。自AFP在1963年發現以后被臨床廣泛應用,但是,經過長期且大樣本的分析后發現其對肝癌診斷的敏感性僅為54%~63%,特異性為82%~89%[6],且有30%~40%的的肝細胞肝癌患者呈陰性或低濃度[7],單純依靠AFP診斷肝癌容易漏診和誤診。故而,在肝癌的早期診斷上,需要尋找到更準確的指標進行早期診斷和監測。1984年由Liebman發現的新指標PIVKA-Ⅱ,其在HCC患者血清中會特異性表達。肝細胞微粒體羧化酶系和環氧化物還原酶是合成PIVKA-Ⅱ的重要生物酶系,其主要有4個功能域:1個γ-羧基谷氨酸區(Gla區),2個環狀區和1個催化區。在維生素K充足時,上述的Gla區將全部轉化成γ-羧基谷氨酸,從而形成正常的凝血酶原,反之則無法合成正常的凝血酶原。有實驗表明在肝癌組織中γ-谷氨酸羧化酶活性下降明顯,而正常肝組織中未檢測到γ-谷氨酸羧化酶活性異常,從而肝癌組織中合成了異常凝血酶原[8-9]。肝癌組織產生PIVKA-Ⅱ的原因有很多[10],關于HCC細胞過度分泌PIVKA-Ⅱ具體機制的研究顯示,編碼凝血酶的DNA以及mRNA的過度表達均未發現異常,因此,HCC細胞過度分泌PIVKA-Ⅱ認為發生在轉錄后階段。血清PIVKA-Ⅱ水平的升高與肝癌的腫瘤大小、肝內轉移與否、有無血管侵犯及腫瘤分期等臨床預后指標相關[11],也能預測門脈侵襲性轉移[12]。血清PIVKA-Ⅱ水平能夠預測能否完成根治性手術,還可以預測術后有無復發。大部分肝癌患者行根治性手術后血清PIVKA-Ⅱ水平迅速下降甚至恢復正常水平,而血清AFP水平由于伴有肝炎或者肝硬化仍然高于正常水平,而且術后PIVKA-Ⅱ水平持續升高或下降后又升高常預示手術不徹底或復發[13]。而且肝癌的早期診斷應著重對慢性肝病定期監測,發現了PIVKA-Ⅱ升高的高危人群應定期隨訪并結合影像學等檢查以提高早期肝癌的診斷符合率,從而能夠降低肝癌的漏診率和誤診率[14]。
microRNA是一類在逆轉錄后靶向作用于目的基因的微小核糖核苷酸,并對目的基因的轉錄和翻譯過程起調控作用,其參與細胞增殖、分化代謝、凋亡等多種生物學過程[15]。近年來,microRNA與腫瘤的相互關系、抗癌活性以及安全穩定性得到了廣大醫務工作者的關注,并且逐漸被研究佐證[16]。其中microRNA-21是近幾年研究最為熱門的microRNA之一,現研究發現其在多種腫瘤組織中可顯著升高,其在血液升高可能為HCC瘤體因血供不足,部分腫瘤細胞缺血壞死,導致microRNA-21釋放入血液中,再者HCC患者合并有脈管癌栓的,microRNA-21可直接釋放入血液中,這些均會導致microRNA-21水平上升,這些特性導致microRNA-21在腫瘤發生發展中的生物學作用已不斷被重視。有研究表明microRNA-21是多種消化道腫瘤進行術后復發監測的指標之一,但是缺乏組織特異性[17]。然而,由于microRNA-21具有較好的穩定性及對HCC診斷的靈敏度,即使缺乏組織特異性,與其他腫瘤標志物的聯合檢測對肝癌仍具有較高的研究價值。
本實驗方案中HCC組microRNA-21、PIVKA-Ⅱ、AFP血清學指標分別高于肝硬化組和對照組指標,且差異具有統計學意義(P<0.05);而肝硬化組及對照組比較上述3種血清學指標,差異無統計學意義(P>0.05),排除了其他因素導致的microRNA-21、PIVKA-Ⅱ和AFP結果的偏差,表明肝癌會導致上述3項指標的升高。從表2中可直觀的得出3項血清學指標聯合檢測的準確度高于上述任何1項或者任意2項組合,說明3項指標聯合檢測的準確度明顯高于單一指標,并且能彌補AFP在診斷效能上的不足,對HCC患者的診斷具有重要意義。圖2亦能證明microRNA-21和PIVKA-Ⅱ能彌補AFP在肝癌診斷效能上的不足,具有較單一AFP更高的診斷價值。將HCC組各項資料進行腫瘤復發相關指標的單因素及多因素分析,結果顯示,單因素分析中,腫瘤復發與腫瘤直徑、PIVKA-Ⅱ、microRNA-21、門靜脈侵犯、分化程度、微血管侵犯、AJCC分期有關(P<0.05),而多因素分析顯示,腫瘤復發與PIVKA-Ⅱ、microRNA-21、門靜脈侵犯、分化程度、微血管侵犯、AJCC分期有關(P<0.05),而與腫瘤直徑無明顯關系(P>0.05)。實驗將HCC組共54例患者的microRNA-21定量數值利用中位數分別進行高表達(n=28)和低表達(n=26)分層,分析microRNA-21能否對HCC患者進行復發監測。隨訪時間為1~12月,分別于術后1月、3月、6月、9月、12月對HCC組患者隨診。截止隨訪時間結束時未出現失訪者,使用SPSS 19.0軟件中的Kaplan-Meier生存分析比較了兩種分層在HCC術后隨訪過程中的復發曲線(見圖3)。圖中可見microRNA-21高表達組的復發曲線明顯低于microRNA-21低表達組,說明microRNA-21高表達組的復發率高,microRNA-21的過表達與HCC患者術后腫瘤復發有著密切聯系。
綜上所述,microRNA、PIVKA-Ⅱ和AFP這3項指標能對肝臟的腫瘤起到提高診斷符合率以及復發監測等作用,因此,microRNA、PIVKA-Ⅱ和AFP這3者之間通過優勢互補作用,能明顯提高彼此的診斷效能,對于我國早期肝癌,尤其是HCC患者的早期發現、早期診斷、早期治療具有良好的臨床實用價值,經過早期診斷、早期治療后能夠服務于更多的肝癌患者,為他們的健康牟取福音。

