孢子預培養(yǎng)與形態(tài)控制提高檸檬酸生產(chǎn)效率
金賽,孫福新,胡志杰,李由然,堵國成,石貴陽*,陳堅*
1(糧食發(fā)酵工藝與技術(shù)國家工程實驗室(江南大學),江蘇 無錫,214122) 2(江蘇國信協(xié)聯(lián)能源有限公司,江蘇 無錫,214122)
檸檬酸是三羧酸循環(huán)的中間代謝物,廣泛存在于自然界中,是一種重要的有機酸[1],天然無害,無色無臭,具有令人愉悅的酸味,在食品工業(yè)中作為酸味劑被廣泛應(yīng)用[2]。檸檬酸具有中強酸性,且擁有3個羧基等獨特的化學結(jié)構(gòu)特性,廣泛用于化學工業(yè),被認為是重要的六碳平臺化合物[3]。此外,檸檬酸的應(yīng)用范圍拓展至醫(yī)藥[4]、交聯(lián)劑[5-7]、土壤修復[8-10]等新領(lǐng)域,需求量逐年上升。
當前,檸檬酸主要通過黑曲霉(Aspergillusniger)發(fā)酵獲得:先制備黑曲霉孢子,然后接入種子罐培養(yǎng),種子成熟后再移入發(fā)酵罐中發(fā)酵,最后提取得到檸檬酸產(chǎn)品[11-13]。在當前的種子培養(yǎng)中,孢子先要經(jīng)過激活,然后才膨脹發(fā)芽,并開始菌絲生長。孢子萌發(fā)通常超過8 h,增加了種子培養(yǎng)周期,降低了生產(chǎn)效率[14]。并且,種子培養(yǎng)無法同時匹配孢子萌發(fā)和菌絲生長最適條件,導致孢子發(fā)芽率低、菌絲活力差。另外,孢子間存在吸附作用,容易聚集成團[15],多個凝聚的孢子只能形成一個菌絲球,降低了成球率;且形成的菌絲球大小不一,部分菌絲球直徑較大,中心形成致密區(qū),無法與營養(yǎng)物質(zhì)和氧氣有效接觸,導致菌體轉(zhuǎn)化效率降低[16]。因此,如何改進黑曲霉種子培養(yǎng)方法,提高種子培養(yǎng)效率和改善菌絲球形態(tài)是檸檬酸生產(chǎn)中亟待解決的重要課題。
本研究提出了孢子預培養(yǎng)策略,即先激活孢子、促進發(fā)芽,再利用發(fā)芽孢子進行種子培養(yǎng)。孢子萌發(fā)是絲狀真菌對環(huán)境產(chǎn)生應(yīng)答并開始生長的關(guān)鍵點,但關(guān)于工業(yè)化黑曲霉孢子萌發(fā)的研究報道較少,并且發(fā)芽孢子替代休眠孢子接種對于菌絲球形態(tài)的影響未見報道。基于此,本研究對孢子萌發(fā)的條件進行考察,研究顆粒物添加和振蕩分散對發(fā)芽孢子、菌絲球形態(tài)以及發(fā)酵結(jié)果的影響;最后,在5 000 L規(guī)模進行工藝放大驗證,以期有效提升檸檬酸生產(chǎn)效率。
1 材料與方法
1.1 實驗材料
1.1.1 菌種
黑曲霉,江蘇國信協(xié)聯(lián)能源有限公司。
1.1.2 材料
玉米粉,市售玉米粉碎后過60目篩;α-高溫淀粉酶,諾維信(中國)公司。
1.1.3 培養(yǎng)基
固體培養(yǎng)基:馬鈴薯葡萄糖瓊脂培養(yǎng)基(potato dextrose agar,PDA)。
液化液制備:將玉米粉和60 ℃去離子水按照質(zhì)量比1∶3.2混合,用Ca(OH)2調(diào)pH至5.8~6.0,按照25 U/g玉米粉的比例加入α-高溫淀粉酶,然后用中試液化系統(tǒng)加熱至97 ℃維持2 h得到液化液。70%的液化液經(jīng)過板框壓濾機過濾得到糖液和玉米渣。未過濾的液化液和過濾后的糖液用來配制培養(yǎng)基。
種子培養(yǎng)基:由液化液和硫酸銨配制而成,初始總糖質(zhì)量濃度為100 g/L,總氮質(zhì)量濃度為2 g/L。
發(fā)酵培養(yǎng)基:由玉米液化液和糖液配制而成,初始總糖質(zhì)量濃度為140~170 g/L,總氮質(zhì)量濃度為8.5~10.5 g/L。
1.1.4 儀器與設(shè)備
HYW中試液化系統(tǒng),上海兆光生物工程設(shè)計研究院;XA/MY12板框壓濾機,浙江金鳥公司;YM75立式高壓滅菌鍋,上海三申醫(yī)療器械有限公司;DHZ-LA振蕩搖床,太倉市強樂實驗設(shè)備有限公司;DFC450光學顯微鏡、DM1000顯微照相機,德國Leica公司;發(fā)酵罐(30、500、5 000 L),無錫匯森生物設(shè)備有限公司;UDK159凱氏定氮儀,意大利Velp公司;Waters 1525高效液相色譜儀,美國Waters有限公司。
1.2 實驗方法
1.2.1 黑曲霉孢子制備
將菌種接種至試管斜面,35 ℃培養(yǎng)5~7 d,待孢子成熟后用接種環(huán)轉(zhuǎn)接至茄形瓶中,35 ℃培養(yǎng)6~8 d獲得成熟的黑曲霉孢子。
1.2.2 孢子預培養(yǎng)
在三角瓶中進行孢子預培養(yǎng)。裝液量為50 mL/250 mL。以馬鈴薯葡萄糖培養(yǎng)基為基礎(chǔ)培養(yǎng)基,分別考察碳源(葡萄糖、蔗糖和可溶性淀粉)、氮源(硫酸銨、玉米漿和酵母膏)、Ca2+濃度(0、0.1、1、10、100 mmol/L)、pH(3、4、5、6、7、8)、溫度(25、30、35、40 ℃)、轉(zhuǎn)速(0、50、100、200 r/min)、孢子濃度(2.4×108、1.6×108、0.8×108、0.08×108、0.008×108CFU/mL)和培養(yǎng)時間的影響。
1.2.3 菌絲球形態(tài)控制
在預培養(yǎng)培養(yǎng)基中添加2 g/L玉米渣,考察顆粒物對發(fā)芽孢子凝聚的影響。將種子培養(yǎng)基經(jīng)過8層紗布過濾除去玉米渣,考察對菌絲球形態(tài)的影響,并統(tǒng)計成球率。聚團的發(fā)芽孢子,經(jīng)過振蕩處理,使孢子分散,再轉(zhuǎn)接至種子培養(yǎng)基繼續(xù)培養(yǎng),觀察菌絲球形態(tài),并統(tǒng)計成球率。搖瓶種子培養(yǎng)條件:裝液量為50 mL/250 mL,孢子終濃度為3×105CFU/mL,培養(yǎng)溫度為37 ℃,搖床轉(zhuǎn)速為300 r/min。
1.2.4 菌絲球形態(tài)對發(fā)酵的影響
將1.2.3部分培養(yǎng)得到不同形態(tài)的菌絲球按10%(體積分數(shù))的比例接入發(fā)酵培養(yǎng)基進行搖床培養(yǎng),培養(yǎng)條件同上。
1.2.5 放大驗證
對照組中,休眠孢子接入500 L罐進行培養(yǎng)(裝液量為400 L,孢子終濃度為3×105CFU/mL,通風比例0.8 vvm,罐壓0.07~0.08 MPa,溫度37 ℃,轉(zhuǎn)速300 r/min),種子培養(yǎng)成熟后按照10%(體積分數(shù))比例移入5 000 L罐進行發(fā)酵(裝液量為4 000 L,通風比例0.5 vvm,罐壓0.07~0.08 MPa,溫度37 ℃,轉(zhuǎn)速200 r/min),殘還原糖質(zhì)量濃度低于0.5 g/L停止發(fā)酵。實驗組中先將休眠孢子接入30 L罐內(nèi)進行預培養(yǎng),孢子萌發(fā)后轉(zhuǎn)至500 L罐進行培養(yǎng),種子成熟后移入5 000 L罐進行發(fā)酵(與對照相同)。
1.2.6 孢子萌發(fā)及菌絲球形態(tài)分析
孢子計數(shù):樣品經(jīng)過振蕩處理,將孢子分散均勻,采用血球計數(shù)板計數(shù),有芽管的計為發(fā)芽孢子,每個樣品重復3次。菌絲球計數(shù):用生理鹽水(0.9% NaCl,質(zhì)量分數(shù))稀釋樣品,使菌絲球濃度達到102~103CFU/mL,在顯微鏡下計數(shù),每個樣品重復3次。發(fā)芽孢子和菌絲球用裝有顯微照相機的光學顯微鏡拍照。利用配套的萊卡應(yīng)用軟件(V4 Leica microsystems)對孢子直徑、菌絲長度和菌絲球的直徑進行顯微測量,每個樣品隨機選擇30個樣本,并求平均數(shù)。出芽率和成球率按公式(1)(2)計算:

(1)

(2)
1.2.7 檢測方法
發(fā)酵液采用布氏漏斗過濾,得到菌絲球和濾液。菌絲球用蒸餾水沖洗2遍后105 ℃烘至恒重,稱量得到菌絲體干重。殘總糖和殘還原糖:用斐林滴定法測定,測定殘總糖時先將濾液用硫酸完全水解。檸檬酸:濾液先用0.22 μm微孔濾膜再次過濾,然后進行高效液相檢測。檢測條件:流動相為0.005 moL/L H2SO4,流速為0.6 mL/min,柱溫為35 ℃,紫外檢測波長為210 nm,進樣量為10 μL。總氮:樣品先進行消化,然后采用凱氏定氮儀進行測定。
1.2.8 數(shù)據(jù)分析
實驗中各指標均為3組以上平行,結(jié)果表示為平均值±標準差。采用SPSS 21.0軟件對實驗數(shù)據(jù)進行統(tǒng)計學分析,2組數(shù)據(jù)間的比較采用獨立樣本T檢驗進行分析;3組以上數(shù)據(jù)間的比較采用單因素方差分析(One-way ANOVA)進行兩兩比較分析,顯著性水平均設(shè)定為0.05。
2 結(jié)果與分析
2.1 預培養(yǎng)條件對孢子萌發(fā)的影響
圖1-a顯示,淀粉對黑曲霉孢子萌發(fā)幾乎沒有促進作用,各參數(shù)與對照接近;蔗糖能促進孢子萌發(fā),發(fā)芽率高于對照;葡萄糖能顯著促進孢子萌發(fā)(P<0.05),孢子發(fā)芽率和芽管長度均最高。孢子從休眠到萌發(fā),需要外源物質(zhì)激活,相比于蔗糖和淀粉,葡萄糖更有利于吸收利用,從而促進孢子萌發(fā)。氮源對孢子萌發(fā)具有促進作用,但與無機氮源相比,營養(yǎng)豐富的有機氮源對孢子萌發(fā)影響更顯著(P<0.05),添加玉米漿時,發(fā)芽率和芽管長度均最高(圖1-b)。圖1-c顯示,Ca2+濃度在0~10 mmol/L,發(fā)芽率和芽管長度隨著Ca2+濃度增加而逐漸升高。Ca2+在細胞膜運輸中起到重要作用[17],能幫助輸送營養(yǎng)物質(zhì),能促進孢子萌發(fā)。然而,當Ca2+濃度增加至100 mmol/L時,孢子萌發(fā)被抑制,發(fā)芽率和芽管長度均降低。因此,后續(xù)試驗中Ca2+濃度確定為10 mmol/L。圖1-d顯示,黑曲霉孢子對pH的適應(yīng)性較寬,在pH 3~8內(nèi)均可以萌發(fā),最適的pH為5~7。pH過高或過低均不利于芽管生長,pH為5時芽管長度最高,后續(xù)實驗選擇預培養(yǎng)pH為5。圖1-e顯示,溫度為25 ℃時黑曲霉孢子萌發(fā)較慢;溫度達到40 ℃時,孢子停止萌發(fā),處于休眠狀態(tài);預培養(yǎng)溫度為35 ℃時,孢子發(fā)芽率和芽管長度均最高。圖1-f顯示,靜置培養(yǎng)時,孢子發(fā)芽率較低,大部分孢子仍處于休眠狀態(tài);而在50~150 r/min搖床振蕩培養(yǎng)時,孢子發(fā)芽率均較高,且孢子萌發(fā)情況相差不大,說明孢子萌發(fā)需要供應(yīng)少量氧氣。圖1-g顯示,孢子濃度>0.8×108CFU/mL時,發(fā)芽率幾乎為0;而孢子濃度<0.8×108CFU/mL時,發(fā)芽率和芽管長度均隨著孢子濃度降低而升高。結(jié)果說明,低濃度孢子有利于萌發(fā),濃度過高會抑制孢子萌發(fā)。圖1-h顯示,隨著預培養(yǎng)時間延長,發(fā)芽率和芽管長度逐漸增加。培養(yǎng)10 h后,發(fā)芽率幾乎沒有升高,但芽管長度仍繼續(xù)增加,說明孢子已經(jīng)完成發(fā)芽進入菌絲生長階段。

a-碳源種類;b-氮源種類;c-Ca2+濃度;d-pH;e-溫度;f-搖床轉(zhuǎn)速;g-孢子濃度;h-時間圖1 預培養(yǎng)條件對孢子萌發(fā)的影響Fig.1 Effect of pre-culture conditions on spore germination
2.2 菌絲球形態(tài)的控制
在孢子預培養(yǎng)過程中,孢子容易凝聚成團,形成較大的菌絲球。為控制孢子形成均勻的小菌絲球,考察了顆粒物和振蕩分散處理等方式對孢子凝聚和菌絲球形態(tài)的影響,結(jié)果如圖2所示。休眠孢子直接進行種子培養(yǎng)時,顆粒物對菌絲球形態(tài)影響顯著(圖2-A1和圖2-A2,P<0.05)。孢子預培養(yǎng)中,添加顆粒物時,形成分散的發(fā)芽孢子;而不含顆粒物時,形成聚團的發(fā)芽孢子。結(jié)果表明,孢子萌發(fā)前添加顆粒物,對發(fā)芽孢子的凝聚影響明顯。同時,無論種子培養(yǎng)基是否含有顆粒物,分散的發(fā)芽孢子均能形成大量的小菌絲球(圖2-B1和圖2-B2);而聚團的發(fā)芽孢子均形成少量的大菌絲球(圖2-C1和圖2-C2)。結(jié)果表明,在孢子發(fā)芽后,顆粒物對菌絲球形態(tài)的影響較小,并且菌絲球形態(tài)主要取決于發(fā)芽孢子是否凝聚。另外,將聚團發(fā)芽孢子分散后再進行種子培養(yǎng),也能形成大量的小菌絲球(圖2-D1和圖2-D2)。進一步說明發(fā)芽孢子是否聚團對菌絲球形態(tài)起決定性作用。因此,孢子萌發(fā)前添加顆粒物和孢子聚團后振蕩分散可以控制最終菌絲球形態(tài)。DRIOUCH等[18-20]認為發(fā)酵液添加微粒子可以通過碰撞干擾孢子間的相互作用,阻礙孢子凝集,防止后期形成較大團塊。他研究發(fā)現(xiàn)添加硅酸鹽、滑石粉和氧化鋁等顆粒物,黑曲霉形態(tài)有較大改觀,菌絲球直徑減小。本研究通過添加有機物顆粒,補充營養(yǎng)源的同時也控制了菌絲球形態(tài),對菌體的資源化利用不產(chǎn)生影響,實用價值更強。
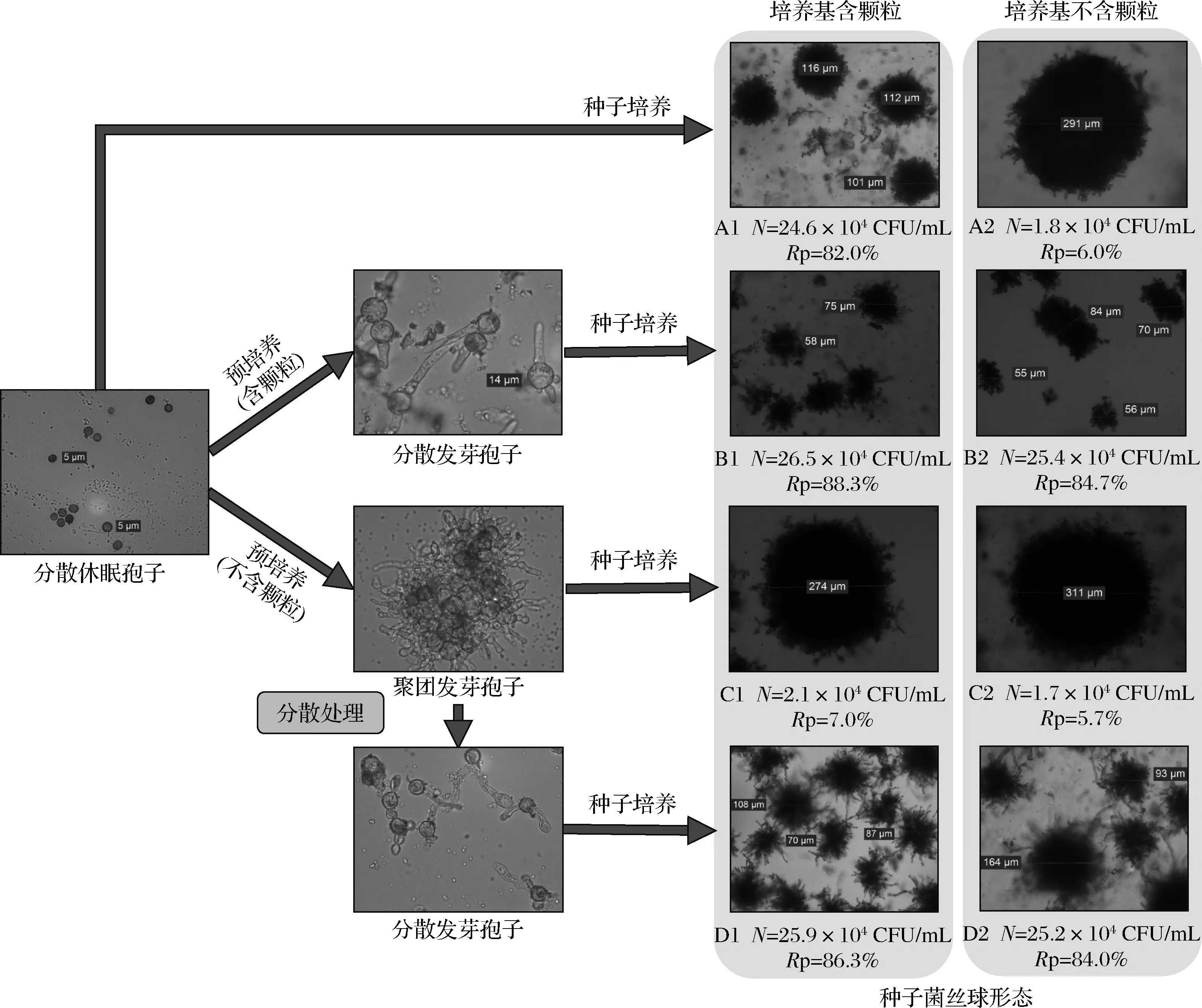
N-菌絲球濃度;Rp-成球率圖2 菌絲球形態(tài)的控制Fig.2 The control of mycelial morphology
2.3 菌絲球形態(tài)對檸檬酸發(fā)酵的影響
菌絲球形態(tài)對檸檬酸發(fā)酵的影響如表1所示。無論是采用休眠孢子接種,還是采用發(fā)芽孢子接種,或是將聚團的發(fā)芽孢子進行分散處理后接種,所有的結(jié)果均顯示,菌絲球大小對發(fā)酵結(jié)果具有顯著性影響,小菌絲球?qū)?yīng)的發(fā)酵強度和單位細胞產(chǎn)酸速率均顯著高于大菌絲球?qū)?yīng)的發(fā)酵結(jié)果(P<0.05)。
大量文獻顯示了相同的規(guī)律。ZHOU等[21]利用培養(yǎng)基和溫度控制戴爾根霉(Rhizopusdelemar)菌體形態(tài)產(chǎn)富馬酸,隨著球團直徑的減小,干細胞質(zhì)量和富馬酸產(chǎn)量有增加的趨勢。WANG等[22]利用菌絲球分散策略分割發(fā)酵生產(chǎn)檸檬酸,相比菌絲球發(fā)酵,菌絲球分散后對應(yīng)的檸檬酸產(chǎn)量更高。
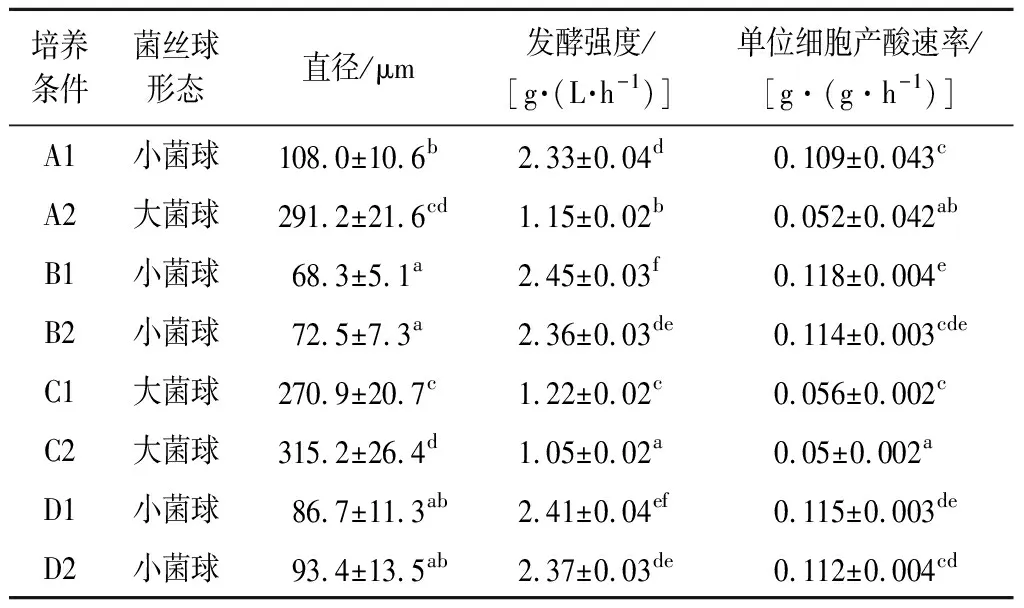
表1 菌絲球形態(tài)對檸檬酸發(fā)酵的影響Table 1 Effect of mycelium morphology on citric acid fermentation
2.4 放大驗證
在優(yōu)化的條件下進行放大驗證,結(jié)果如圖3所示。種子培養(yǎng)時,對照組總糖8 h后開始消耗(圖3-a);酸度和菌絲球直徑也相應(yīng)從8 h開始增加(圖3-b和3-c),原工藝存在約8 h的延滯期。而實驗組菌體快速進入生長階段,幾乎沒有延滯期(圖3-d),節(jié)省了孢子萌發(fā)時間,周期縮短12 h以上,提高了種子培養(yǎng)效率。雖然實驗組需要10 h用于孢子預培養(yǎng),但是預培養(yǎng)具有孢子濃度高、體積小、氧氣和營養(yǎng)消耗少等特點,可以實現(xiàn)大批量集中培養(yǎng)。同時,比較發(fā)酵過程曲線顯示,實驗組糖消耗速度和產(chǎn)酸速度較快(圖3-e和3-f);菌絲球直徑偏小(圖3-g),產(chǎn)酸速率較快(圖3-h),優(yōu)勢較明顯。

a-種子總糖;b-種子酸度;c-種子菌球直徑;d-種子菌體生長速率;e-發(fā)酵總糖;f-發(fā)酵酸度;g-發(fā)酵菌球直徑;h-發(fā)酵產(chǎn)酸速率圖3 孢子預培養(yǎng)工藝放大驗證Fig.3 Scale-up verification of spore pre-culture process
發(fā)酵結(jié)果如表2所示。實驗組提高了孢子分散性,菌絲球濃度和成球率增加非常顯著(P<0.01),分別增加了0.4×104CFU/mL和18.3%;菌絲球平均直徑下降了28 μm,變化顯著(P<0.05)。數(shù)量更多的小菌絲球更有利于營養(yǎng)物質(zhì)吸收和轉(zhuǎn)化,最大產(chǎn)酸速率提高了7.5%,發(fā)酵強度提高顯著(P<0.05),實驗組發(fā)酵周期縮短2 h。最終檸檬酸濃度和糖酸轉(zhuǎn)化率分別增加了2 g/L和1.2%。

表2 工藝放大驗證結(jié)果Table 2 Results of process amplification verification
3 結(jié)論
本研究針對現(xiàn)有檸檬酸生產(chǎn)種子延滯期長,發(fā)酵水平波動大的問題,提出孢子預培養(yǎng)和菌絲形態(tài)控制策略。研究獲得了孢子最佳萌發(fā)條件,并發(fā)現(xiàn)孢子萌發(fā)前添加顆粒物和孢子聚團后振蕩分散可以控制最終菌絲球形態(tài),發(fā)芽孢子是否凝聚對最終菌絲球形態(tài)起決定性作用。另外,小菌絲球?qū)е掳l(fā)酵產(chǎn)酸速率顯著提高。在中試規(guī)模工藝放大中,種子培養(yǎng)周期縮短12 h以上;成球率增加了18.3%,最大產(chǎn)酸速率提高了7.5%,發(fā)酵強度增加0.14 g/(L·h),發(fā)酵效率顯著提升。本研究對絲狀真菌孢子萌發(fā)、形態(tài)控制和生產(chǎn)效率的提升具有重要參考意義。

