活血通絡藥物對膝骨關節炎小鼠凋亡軟骨細胞體外干預的影響
韋佳佳,廖建青,張英杰,王 琦*
(1.云南中醫藥大學第一附屬醫院,昆明 650021;2.云南中醫藥大學,昆明 650500)
骨關節炎(OA)是全世界范圍內常見的慢性、進行性的骨關節疾病[1-3]。生理狀態下,膝關節軟骨細胞增殖和凋亡處于動態平衡,以維持細胞數量及功能的穩定。然而,一旦軟骨細胞發生過度凋亡就會打破這一動態平衡,軟骨細胞出現凋亡是導致膝骨性關節炎軟骨退行性病變的關鍵性因素[4-6]。而近年來中藥治療膝骨關節炎(KOA)、抑制軟骨細胞凋亡的作用機制已成為研究熱點,中醫藥能抑制KOA 炎癥保護關節軟骨、緩解關節疼痛已經得到證實,中醫藥不僅具有整體治療、辨證論治個性化等獨特優勢,還可明顯改善患者的生活質量[7-9]。中醫學認為,瘀血貫穿于整個KOA 病程的始終,故運用活血化瘀通絡治療KOA 也貫穿于整個疾病的治療過程[10]。有研究表明,運用活血通絡中藥治療早期KOA時在總有效率、不良反應率、KSS評分等方面均優于NSAIDs[11]。為了深入研究驗證,本次實驗擬選用正常小鼠軟骨細胞和KOA 小鼠凋亡軟骨細胞進行體外培養、細胞傳代,在培養傳代成功的基礎上,繪制細胞生長曲線,分別以具有活血通絡作用的不同血清濃度骨痹合劑、氨糖美辛、生理鹽水干預后,觀察活血通絡藥物對軟骨細胞凋亡的影響。以此對活血通絡藥物的機制進行初步的驗證,并為下一步實驗提供前期基礎。
1 實驗材料
1.1 實驗動物 取SPF 級正常小鼠、KOA 造模小鼠各80 只。體質量(19.6±0.6)g。動物接收、滅菌后將小鼠置于IVC 動物房中,將小鼠隨機放入小鼠籠中,每籠5 只,共16 籠。正常飼養,室溫20~24 ℃,相對濕度42%~53%,常規飲食,日照時間為每天10~12 h,空氣流通。C57小鼠(南京市江寧區青龍山動物繁殖場,許可證號:SCXK(蘇)2017-0001),IVC 動物飼養系統(蘇州蘇杭科技)。
1.2 實驗試劑及設備 II 型膠原酶(ThermoFisher,17101015),PBS(南京生興,SN331),胰酶(Hyclone,SH30042.01),DMEM/F12(Hyclone,SH30023),細胞培養箱(Thermo Fisher,3131),甲苯胺藍染色 液(Leagene,DB0057),多聚甲醛(aladdin,C104188),II 型膠原酶(ThermoFisher,17101015),DMSO(sigma,C6295-50 mL),FBS(Hyclone,SH30070.03),顯微鏡(Nikon,Ts2R),RPMI-1640 培養基(Hyclone,SH30809),FBS(Hyclone,SH30070),PI-AnnexinV-FITC 細胞凋亡檢測試劑盒(eBioscience,BMS500FI),冷凍離心機(Eppendorf,5430),流式細胞儀(BD,FACScalibur),DMEM/F12(Hyclone,SH30023.01B),胎牛血清(Hyclone,SH30070.03),青霉素/ 鏈霉素(Hyclone,SV30010),血球計數板(上海求精生化),MTT(beyotime,C0009),CO2培養箱(Thermo fisher,3131),酶標儀(Thermo fisher,Multiskan 51119000)。
1.3 實驗藥物 骨痹合劑(滇藥制字(Z)04A01888)由云南中醫藥大學第一附屬醫院制劑中心提供,氨糖美辛腸溶片(國藥準字H20023171)由上海華中藥業有限公司提供。
2 實驗方法
2.1 動物分組 實驗動物SPF 級小鼠80 只,質量20~25 g,20 只用于軟骨細胞取材,其中10 只用于正常軟骨細胞取材,10只用于建立KOA軟骨細胞取材,60 只用于含藥血清制備。
2.2 KOA 小鼠模型的建立 取10 周齡SPF 級C57 雄性小鼠10 只,4%的戊巴比妥鈉腹腔麻醉,小鼠腿部膝關節處剃毛,膝關節部位備皮消毒,取髕旁內側切口顯露膝關節,顯露髕骨向外側脫位,盡量屈曲膝關節顯露前交叉韌帶后切斷,止血后將髕骨復位,關節腔逐層閉合。術后3 d 每天每只肌肉注射青霉素預防感染。剩余10 只為正常組軟骨細胞取材。
2.3 含藥血清的制備方法 骨痹合劑組小鼠以骨痹合劑灌胃,氨糖美辛組小鼠以氨糖美辛腸溶片溶于同體積蒸餾水灌胃,生理鹽水組小鼠以同體積生理鹽水灌胃,每組20 只,藥物劑量和濃度按人與小鼠正常藥量比進行換算(Meeh Rubner 公式)的3 倍,每日上午、和下午各1 次,連續3 d,末次灌胃2 h 后麻醉狀態下腹主動脈采血,4 ℃靜置過夜后離心,取血清56 ℃滅活30 min,過濾除菌,分裝,-20 ℃冰箱保存備用。
2.4 小鼠關節軟骨細胞分離及培養 用手術刀切出脛骨和股骨端部軟骨,放入PBS 中,收集完所有軟骨組織后,切碎,轉移到15 mL 離心管中,1 000 r/min 離心5 min。棄去上清PBS,加入足量II 型膠原酶和胰酶消化3~6 h,收集細胞懸液,轉移到培養瓶中,補足DMEM/F 12 培養基,37 ℃培養,48 h 后換液,觀察細胞狀態。每2 d 更換新的完全培養基,當細胞長至80%~90%時,去除培養基,加入PBS 洗1~2 次,去除PBS 后,加入1 mL 胰酶消化2 min 后,加入3 mL完全培養基中和胰酶終止消化,消化的細胞離心,倒掉上清,加入3 mL 培養基重懸細胞,1:3 傳代至培養皿中,輕輕搖晃均勻后放入培養箱中培養。5 d 后將細胞從培養箱中取出,置于超凈臺中,輕輕去除培養基,加入PBS 洗1 次,去除PBS 后,加入1 mL 胰酶,搖晃均勻后放入培養箱中消化2 min,細胞消化結束后,加入3 mL 完全培養基中和胰酶終止消化,將消化的細胞離心。離心結束后倒掉上清,傳代的細胞加入培養基將細胞重懸后將細胞接種至培養皿中,放入培養箱中培養。當細胞狀態正常,細胞融合度在90%,2 d 后再次將細胞從培養箱中取出,置于超凈臺中,輕輕去除培養基,加入PBS 洗1 次,去除PBS 后,加入1 mL 胰酶,搖晃均勻后放入培養箱中消化2 min,細胞消化結束后,加入3 mL 完全培養基中和胰酶終止消化,將消化的細胞轉移至15 mL 離心管中,1 000 r/min離心5 min。離心結束后倒掉上清,傳代的細胞加入培養基將細胞重懸后將細胞接種至培養皿中,放入培養箱中培養。接種部分細胞至24 孔板中,做甲苯胺藍染色鑒定。需要凍存的細胞,加入細胞凍存液重懸細胞,轉移至細胞凍存管中,標記后放入細胞凍存盒中置于-80 ℃冰箱中凍存。凍存液:FBS 和DMSO 9:1。
2.5 甲苯胺藍染色 將細胞從培養箱中取出,將細胞置于顯微鏡下觀察細胞貼壁情況以及細胞狀態。將24孔板中培養基去除培,用PBS 清洗1 次,加入1 mL多聚甲醛常溫固定細胞10 min,去除多聚甲醛,用PBS 清洗2 次。每孔加入甲苯胺藍工作液500 μL,室溫染色30 min。棄去染色液,用自來水清洗數次顯色。顯微鏡下觀察染色效果,拍照。
2.6 MTT 檢測 將長到培養皿80%~90%的正常軟骨細胞和KOA 軟骨細胞用胰酶消化下來,1 000 r/min離心,去除上清,加入完全培養基重懸細胞,將細胞分別種在96 孔板中,每孔種3 000 個細胞。待細胞貼壁后,加入含藥血清5%、10%、20% 3 個濃度的骨痹合劑、氨糖美辛和生理鹽水的培養基。分別培養2、4、6、8 d 后,加入10 μL MTT(5 mg/mL),在細胞培養箱中繼續培養約3 h。去除培養基,每孔加入150 μL DMSO,搖晃均勻,在570 nm 波長測定吸光度。
2.7 細胞凋亡檢測 正常小鼠和KOA 小鼠軟骨細胞加入骨痹合劑、氨糖美辛以及生理鹽水培養到指定時間點。收集培養上清,用胰酶消化貼壁的細胞,1 000 r/min 離心5 min,棄上清。(將細胞培養上清中的細胞和貼壁細胞全部收集到離心管中)。用預冷的PBS 洗3 次細胞,4 ℃,1 000 r/min 離心5 min,棄上清。加入1 mL binding buffer 洗細胞,4 ℃,1 000 r/min離心5 min,棄上清。加入100 μL binding buffer 重懸細胞,加入5 μL PI 和5 μL FITC-Annexin V,混合均勻,常溫避光孵育15 min,加入400 μL binding buffer 混勻,立刻用流式細胞儀檢測。收集和分析數據,輸出報告。
2.8 統計學分析 采用 SPSS 22.0 軟件進行統計學分析。計量資料以均數±標準差()表示,組間比較采用t檢驗。
3 結果
3.1 小鼠關節軟骨原代細胞形態及鑒定 小鼠關節軟骨細胞成功提取,顯微鏡下觀察可見軟骨細胞呈多角形、梭形單層覆蓋于培養皿底部。培養后見細胞狀態正常,將原代細胞以1:3 傳代至培養皿。正常小鼠軟骨細胞增殖能力較強,KOA 模型的軟骨細胞增殖能力較弱。見圖1。

圖1 為關節軟骨細胞白光圖
將傳代細胞進行甲苯胺藍染色,顯微鏡下軟骨細胞多呈多角形,胞質呈均質狀,較疏松,大部分可見到核仁,少數也可見分裂相,細胞漿和胞膜呈藍色,所有的細胞都被甲苯胺藍著色,表明都是軟骨細胞。見圖2。
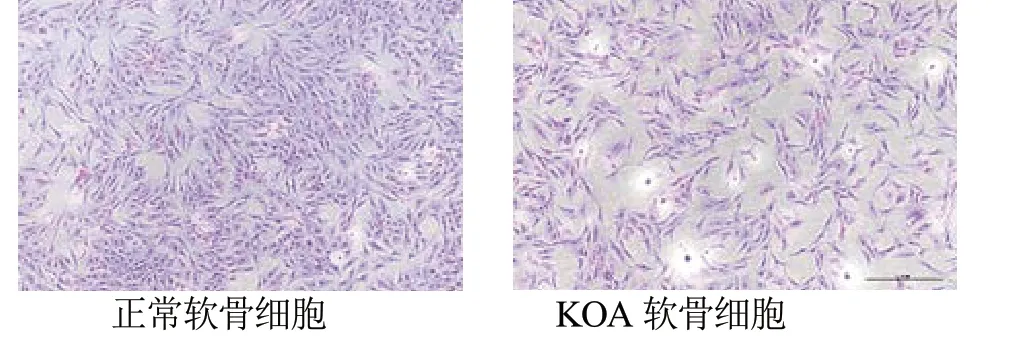
圖2 為分離提取的關節軟骨細胞甲苯胺藍染色結果
3.2 MTT 檢測結果 見圖3。

圖3 不同濃度(骨痹合劑組、氨糖美辛組、生理鹽水組)含藥血清處理軟骨細胞2、4、6、8 d 檢測軟骨細胞生長曲線
從結果中可以看出,骨痹合劑組及氨糖美辛組均可抑制軟骨細胞凋亡,一定程度促進細胞增殖。而在不同濃度骨痹合劑組中,10%含藥血清相對于5%和20%含藥血清濃度更加促進細胞增殖,說明10%含藥血清濃度相對為最佳濃度。并且隨著細胞培養時間的延長,2 d 的時間點各組增殖變化最為明顯。
3.3 骨痹合劑、氨糖美辛以及生理鹽水干預細胞凋亡的觀察 見表1,圖4。

圖4 凋亡結果十字散點圖

表1 骨痹合劑、氨糖美辛以及生理鹽水干預細胞凋亡的觀察
從凋亡結果圖中可以看到畫十字的散點圖,左上象限是死細胞,左下象限是正常活細胞,右下象限是早期凋亡細胞,右上象限是晚期凋亡細胞。實驗中統計的右上象限的細胞的比例。從結果中可以看出相對于對照組正常,KOA 模型分離出的軟骨細胞凋亡較高,在對KOA 組小鼠凋亡的軟骨細胞進行藥物血清干預培養后發現,骨痹合劑和氨糖美辛抑制細胞凋亡,對細胞起保護作用。
4 討論
前期研究及本次實驗觀察發現,KOA 軟骨細胞數量較正常軟骨細胞增殖少,觀察到與正常軟骨相比,KOA 軟骨中的凋亡軟骨細胞更多。大量研究假設,KOA 或軟骨衰老是軟骨細胞凋亡的結果。但是,KOA 也可能導致高水平的軟骨細胞凋亡,這些假設的差異表明軟骨細胞凋亡與軟骨損傷之間的復雜關系[12]。因此,抑制細胞凋亡和促進軟骨細胞存活的藥物開發研究至關重要。軟骨細胞的凋亡受到多種因素的影響,Bcl-2 家族途徑、抗氧化和抗炎途徑、PI3KAkt-mTOR 途徑、HIF1α 途徑,Sox9 途徑和miRNA途徑等等[13-14]。所以,目前通過介導和調控細胞的凋亡途徑來防治骨關節炎已成為目前的熱門研究。抑制凋亡為有效和安全地保護軟骨細胞抵抗KOA 提供了潛在的治療靶點。
結合以上機制,本實驗選取云南省中醫醫院使用多年院內制劑骨痹合劑作為治療研究目標,采用云南省中醫醫院院內制劑骨痹合劑及對照組氨糖美辛不同藥物濃度對軟骨細胞干預觀察,骨痹合劑由以下主要藥物組成:當歸、丹參、紅花、桂枝、全蝎、蜈蚣、桑寄生、杜仲、獨活等。全方以活血通絡為主,又兼具祛風除濕、補益肝腎之效。本方所治病證,乃因風寒濕邪阻于經絡,經絡痹阻,筋骨失養所致。本研究中,在小鼠成功造模及前期實驗完成的基礎上,設計第二階段實驗。在實驗中,骨痹合劑含藥血清組能夠明顯降低軟骨細胞凋亡模型中軟骨細胞的凋亡率,可能與骨痹合劑組能夠抑制軟骨細胞凋亡,延緩關節軟骨的退行性改變,促進關節軟骨修復的作用有關。同時在本實驗中觀察后確定,10%骨痹合劑含藥血清濃度為促進軟骨細胞增殖的相對最佳濃度,培養2 d 后不同組別之間的細胞增殖變化最明顯,為下一步研究中對信號通路調控細胞凋亡的檢測研究,確定給藥濃度及對干預時間點做出預判。

