先天性EDNRB基因缺陷對大鼠海馬區神經細胞凋亡的影響
謝聃 宋贊民 王霞 張擁波
EDNRB基因作為一種臨床致病率表達較高的基因,不僅是腸道形成腸神經系統的關鍵基因,也參與并且介導神經細胞增殖、遷移的主要過程。腦組織EDNRB基因表達上調還具有抗細胞凋亡的作用[1?2]。EDNRB基 因 主 要 表 達 于 胚 胎 的 腦 室 區 以 及腦室下區,并在嬰兒腦組織星形膠質細胞中繼續表達[3?5]。研 究 顯 示,EDNRB基 因 變 異 致 先 天 性 巨 結腸不僅發生于人類,亦見于其他物種如大鼠、小鼠、豬和馬,如先天性巨結腸大鼠模型攜帶EDNRB基因誘導的無癥狀變異[6?7];純合子型大鼠腦組織可檢測到EDNRB基因缺陷,從而干預和調節神經系統發育過程中EDNRB基因介導的神經細胞增殖和凋亡[8]。神經營養因子是一類對神經細胞發育、存活和凋亡起重要作用的蛋白質,腦源性神經營養因子(BDNF)和膠質細胞源性神經營養因子(GDNF)不僅可以促進神經細胞再生,而且是誘導神經干細胞向神經細胞分化的重要因子[9]。增強EDNRB基因活性可使大鼠小腦區域和尾狀核生成更多的BDNF和GDNF[10]。本研究對EDNRB基因缺陷的新生大鼠海馬組織(CA1區、CA3區和齒狀回)進行研究,觀察EDNRB基因缺陷對純合子型(sl/sl)神經細胞凋亡的影響,并與野生型(+/+)、雜合子型(+/sl)相應腦區的神經細胞增殖和凋亡進行比較;同時測定3種基因型新生大鼠海馬組織BDNF和GDNF的表達量,探究EDNRB基因缺陷是否導致BDNF和GDNF表達變化。
材料與方法
一、實驗材料
1.實驗動物與分組本實驗所用動物為先天性301對堿基缺失致EDNRB基因缺陷大鼠,均為+/sl成對雄性和雌性大鼠,由澳大利亞國立大學動物中心飼養(許可證號:Canberra Hospital.03333574001),交配后將同一窩產后2~3 d新生大鼠和雌性大鼠取出(雌性大鼠喂養幼鼠),并根據幼鼠皮毛顏色、基因檢測結果將其分成+/+、+/sl和sl/sl共3種基因型,每組各6~8只。于室溫21~25℃、相對濕度40%~60%、12 h晝-12 h夜循環照明環境中飼養,自由攝食、飲水,本研究經澳大利亞國立大學動物實驗倫理委員會審核批準(審批號:A2012/50)。
2.試劑與儀器(1)主要藥品與試劑:蛋白酶K購自美國Promega生物公司,戊巴比妥和多聚甲醛由澳大利亞國立大學約翰科廷醫學研究中心神經研究所實驗室提供,磷酸鹽緩沖液(PBS)為該實驗室統一配置,BDNF和GDNF酶聯免疫吸附試驗(ELISA)檢測試劑盒分別購自美國BioSource公司和R&D systems公司。(2)主要設備與儀器:聚合酶鏈反應(PCR)循環儀購自美國Biometro T3 thermocycle公司,Gene Quant pro型紫外光分光光度計購自美國Biochrom公司,Nikon A1熒光共聚焦顯微鏡購自日本Nikon公司,Image J軟件購自美國NIH公司。
二、研究方法
1.TUNEL染色檢測海馬組織細胞凋亡每種基因型取出生后2 d的新生大鼠各6只,腹腔注射戊巴比妥(100 mg/kg),開胸顯露心臟,質量分數為4%的多聚甲醛溶液灌注心臟,以50 ml注射器插入左心室、剪開右心耳,快速注入磷酸鹽緩沖液200~300 ml,經體循環和肺循環至右心耳,直至流出清亮液體,以清除體內血液;于顯微鏡下解剖切取腦組織,取出整個海馬組織和齒狀回,于?20℃制備層厚12 mm的冰凍切片。每只新生大鼠選取切片效果及部位最佳的5張標本行4’,6?二脒基?2?苯基吲哚(DAPI)染色和TUNEL染色,細胞呈藍色為DAPI染色陽性,為背景細胞;細胞呈紅色或綠色為TUNEL染色,為凋亡細胞。每只新生大鼠選取切片染色效果最佳的3張標本,于熒光共聚焦顯微鏡下觀察凋亡細胞,采用Image J軟件計數凋亡細胞數目。上述實驗步驟均于隨機取片、基因型雙盲情況下進行。
2.酶聯免疫吸附試驗測定GDNF和BDNF表達量每組選取出生后2 d的新生大鼠各7~8只,切取腦組織方法同前,切片機在?80℃制備層厚12 mm的冰凍切片。每只新生大鼠取6張切片(BDNF和GDNF各3張),孵育至21~25℃,采用ELISA檢測試劑盒測定BDNF和GDNF表達量,行熒光原位雜交(FISH)染色,顯色均勻后20 min內記錄450 nm波長處光密度(OD)值,以pg/g表示。
3.統計分析方法采用SPSS 16.0統計軟件進行數據處理與分析。正態性檢驗采用Shapiro?Wilk檢驗,以P>0.05為符合正態分布;方差齊性檢驗采用Levene檢驗,以P>0.05為符合方差齊性假設。呈正態分布且符合方差齊性假設的計量資料以均數±標準差(±s)表示,采用單因素方差分析,兩兩比較采用Bonferroni法。以P≤0.05為差異具有統計學意義。
結 果
熒光共聚焦顯微鏡觀察顯示,出生后2 d的+/+新生大鼠海馬CA1區和齒狀回偶見凋亡細胞,CA3區凋亡細胞密度更低;sl/sl新生大鼠海馬CA1區、CA3區和齒狀回凋亡細胞數目均多于+/+新生大鼠(圖1,2)。3種基因型新生大鼠海馬凋亡細胞數目差異有統計學意義(P=0.000,表1),其中,sl/sl凋亡細 胞 數 目 高 于+/+(P=0.000)和+/sl(P=0.000),而+/+與+/sl組間差異無統計學意義(P=0.175,表2)。進一步計數海馬各區凋亡細胞數目,CA1區最高,占凋亡細胞總數比例分別為+/+占69.41%、+/sl占64.41%和sl/sl占82.82%;其 次 為CA3區,分 別為+/+占17.84%、+/sl占24.11%和sl/sl占9.92%;以齒狀回最低,分別為+/+占12.83%、+/sl占11.64%和sl/sl占7.31%。表明EDNRB基因在幼鼠海馬結構發育過程中具有抗凋亡作用。
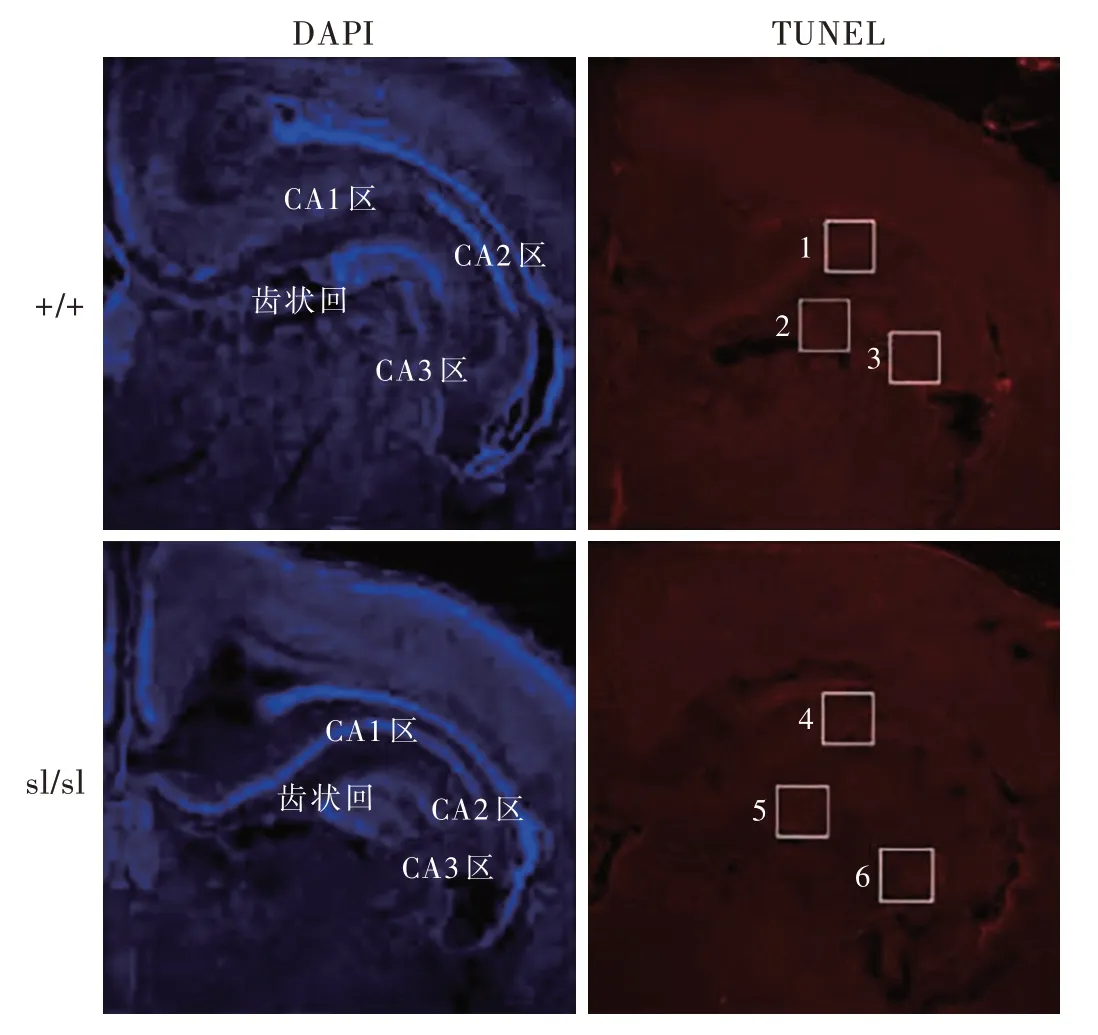
圖1 出生后2 d的+/+和sl/sl新生大鼠海馬組織DAPI和TUNEL染色圖低倍放大Figure 1 DAPI and TUNEL staining images of hippocampal tissues of+/+and sl/sl genotypes rats 2 d postnatal.low power magnified
表1 3種基因型新生大鼠海馬凋亡細胞數目的比較(±s,/mm2)Table 1.Comparison of TUNEL positive cell density in rats of 3 genotypes(±s,/mm2)

表1 3種基因型新生大鼠海馬凋亡細胞數目的比較(±s,/mm2)Table 1.Comparison of TUNEL positive cell density in rats of 3 genotypes(±s,/mm2)
組別+/+組sl/sl組+/sl組只數6 6 6 TUNEL陽性細胞數目11.30±4.90 35.20±7.10 16.20±6.60 F值24.315 P值0.000
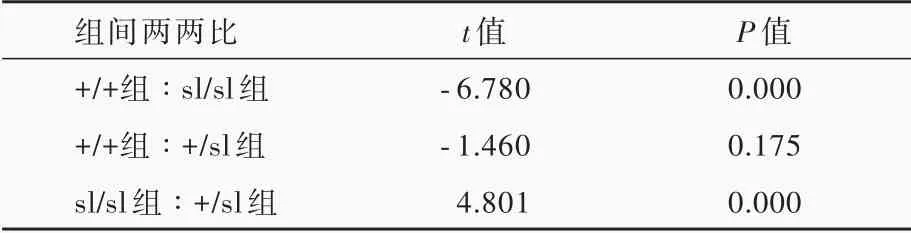
表2 3種基因型新生大鼠海馬凋亡細胞數目的兩兩比較Table 2.Pairwise comparison of TUNEL positive cell density in rats of 3 genotypes
ELISA法顯示,出生后2 d的3種基因型新生大鼠海馬組織BDNF(P=0.479)和GDNF(P=0.107)表達量差異均無統計學意義,提示EDNRB基因缺陷不影響新生大鼠海馬BDNF和GDNF的表達(表3)。
表3 3種基因型新生大鼠海馬BDNF和GDNF表達量的比較(±s,pg/g)Table 3.Comparison of the hippocampus concentrations of BDNF and GDNF in rats of 3 genotypes(±s,pg/g)
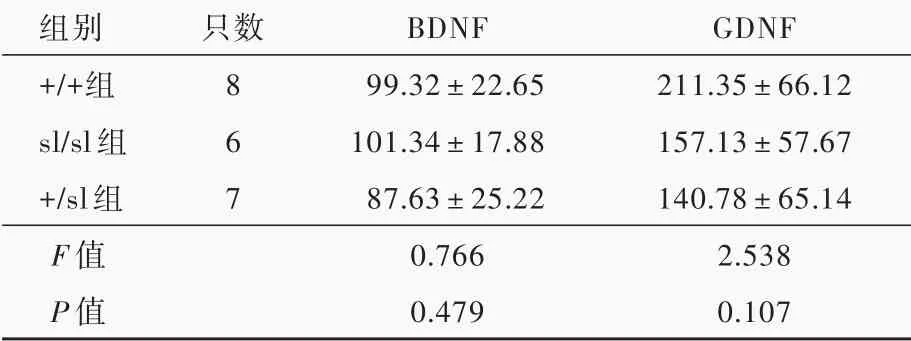
表3 3種基因型新生大鼠海馬BDNF和GDNF表達量的比較(±s,pg/g)Table 3.Comparison of the hippocampus concentrations of BDNF and GDNF in rats of 3 genotypes(±s,pg/g)
BDNF,brain?derived neurotrophic factor,腦源性神經營養因子;GDNF,glial cell line?derived neurotrophic factor,膠質細胞源性神經營養因子
組別+/+組sl/sl組+/sl組F值P值只數8 6 7 BDNF 99.32±22.65 101.34±17.88 87.63±25.22 0.766 0.479 GDNF 211.35±66.12 157.13±57.67 140.78±65.14 2.538 0.107
討 論
本研究檢測EDNRB基因缺陷的新生大鼠海馬神經細胞凋亡以及神經營養因子GDNF和BDNF表達變化,探討3種基因型(+/+、+/sl和sl/sl)在新生大鼠神經系統發育中對神經細胞凋亡和神經因子表達的影響,結果顯示,與+/+相比,sl/sl新生大鼠海馬CA1和CA3區神經細胞凋亡增加,但3種基因型海馬GDNF和BDNF表達差異無統計學意義,表明神經細胞的凋亡與神經營養因子介導的途徑無關。
內皮素家族具有參與調節細胞分化、增殖和細胞營養等多種功能。例如,大腦EDNRB基因激活可促進神經元和星形膠質細胞增殖,上調星形膠質細胞骨架蛋白和多種神經營養因子的表達。在中樞神經系統中,EDNs和EDNRB基因的作用機制是防止神經細胞凋亡,促進神經細胞和施萬細胞前體存活[11?12]。Dembowski等[13]在EDNRB基 因 缺 陷 純 合子型大鼠腦組織中發現,大鼠海馬各區和齒狀回以及小腦神經細胞凋亡明顯增多;這一現象亦可見于其他腦區,如大腦皮質、尾狀核和嗅球等(未發表)。因此我們推測,EDNRB基因缺陷導致的神經細胞凋亡增多涉及全腦,并非僅見于海馬、小腦等特定區域,尚待進一步研究。在神經系統發育過程中,EDNRB基因影響神經細胞的存活和凋亡,其抗細胞凋亡作用可在EDNRB基因缺陷后逆轉,表明EDNRB基因促神經細胞存活和抗凋亡的作用不僅貫穿胚胎大鼠神經系統形成的全過程,還一直延續至大鼠出生后神經系統的發育過程中。
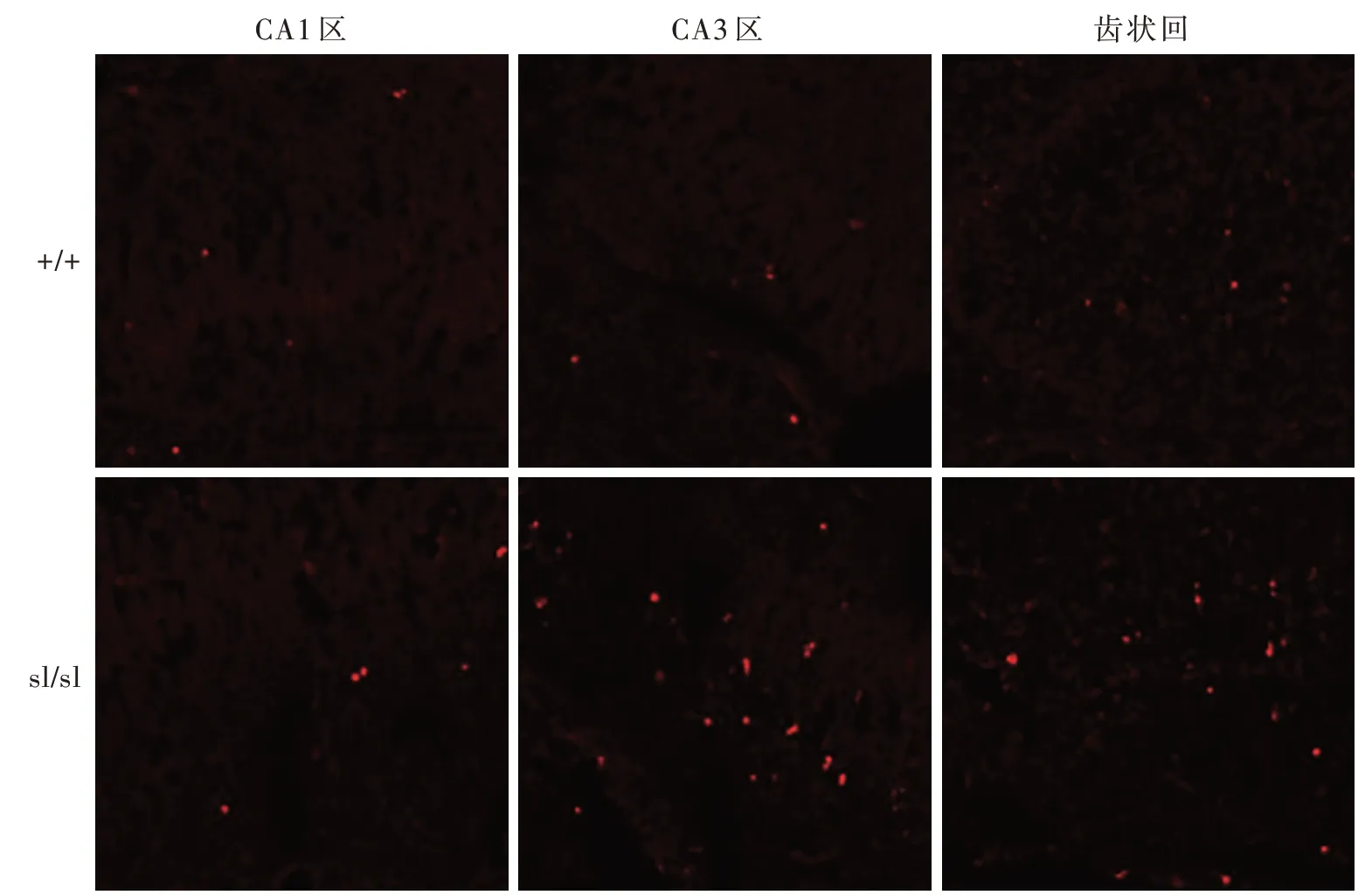
圖2 熒光共聚焦顯微鏡觀察顯示,出生后2 d的sl/sl新生大鼠海馬CA1區、CA3區和齒狀回凋亡細胞數目多于+/+TUNEL染色低倍放大Figure 2 Confocal fluorescence microscopy showed the number of TUNEL positive cells of sl/sl rats 2 d postnatal was significantly increased compared with that of+/+rats.TUNEL staining low power magnified
值得注意的是,本研究顯示,正常新生大鼠的所有腦區一直存在較低密度和頻率的神經細胞凋亡,+/+海馬神經細胞凋亡數目平均為11個/mm2[2],小 腦 為4個/mm2、尾 殼 核9個/mm2、嗅 球1個/mm2、大腦皮質6個/mm2(未發表)。我們課題組的既往研究顯示,BrdU標記的細胞核分布與TUNEL染色陽性細胞相背離,如+/+大鼠BrdU標記的細胞密度在齒狀核最高,表明該區域細胞增殖最旺盛,但TUNEL染色陽性細胞數目最少(占12.80%),提示該區域神經細胞凋亡處于最低水平;而CA1區與齒狀核恰好相反,BrdU標記的細胞增殖數目最低,而TUNEL染色陽性細胞數目最高,且這種趨勢在3種基因型中均可見[14]。EDNRB基因缺陷的純合子型先天性巨結腸大鼠特定腦區細胞增殖減少和細胞凋亡增加,可能導致對應區域腦體積縮小,遠期可出現相應神經功能缺損癥狀,但是由于純合子型先天性巨結腸大鼠通常于出生1~2周后死于營養不良和小腸結腸炎等,目前尚無針對sl/sl成年大鼠腦結構和功能改變的探索。宋贊民教授與澳大利亞墨爾本大學醫學院Stamp教授合作,成功制備sl/sl大鼠結腸造口模型[15],使sl/sl大鼠存活至成年(出生后4周后處死),從而能夠進一步觀察腦結構和功能改變。業已證實,sl/sl大鼠存在小腦神經細胞增殖減少和細胞凋亡增加[2],小腦主要參與調節運動協調控制和平衡功能,海馬則在學習記憶功能中發揮重要作用,因此,成熟的腦功能損傷研究將主要圍繞上述神經功能展開。
神經營養因子BDNF和GDNF的主要功能是支持正常神經細胞發育和修復損傷神經細胞。BDNF可以防止腦缺血后谷氨酸持續釋放引起的細胞外鈣離子內流和細胞內鈣離子釋放,從而維持細胞內鈣離子水平,降低神經細胞損傷;并可增加運動和感覺神經細胞軸突切斷后的存活率,促進神經細胞修復和再生,減少運動神經細胞凋亡等[16?17]。GDNF可以提高多巴胺能神經元的存活率,抑制發育過程中運動神經細胞的程序性死亡,促進神經細胞軸突定向生長以及運動神經細胞損傷修復和神經再生等[18?19]。成年 大 鼠 中 樞神經 系 統 表 達GDNF,主 要集中于紋狀體,其他部位則局限于多巴胺能神經元分布腦區[20]。發生腦缺血時,海馬齒狀回GDNF mRNA水平明顯增加,提示GDNF對神經細胞的缺血性損傷有保護作用[21]。神經營養因子在抗神經損傷方面具有重要的作用,且內源性或外源性給予神經營養因子可預防和治療神經細胞損傷業已證實[22]。GDNF和內皮素?3激活后予以特定標記,可用于定位神經細胞的遷移、分化和存活[23]。Koyama等[24?25]發現,BDNF和GDNF的激活及其對神經細胞增殖的影響與EDNRB基因存在相關性。動物模型顯示,成年大鼠腦室內注射EDNRB受體激動劑,其尾狀核星形膠質細胞增殖增加[23]。EDNRB受體的激活可促進星形膠質細胞表達mRNA和多肽,增加GDNF的 合 成[24?26],這 一 現 象 亦 可 見 于 大 鼠 海 馬 和大腦星形膠質細胞[24]。是否EDNRB基因缺陷同樣影響sl/sl大鼠各腦區神經生長因子的表達呢?本研究顯示,3種基因型新生大鼠海馬組織GDNF和BDNF表達差異無統計學意義,與我們課題組既往研究 小 腦BDNF和GDNF表達 變 化 結 果 相 一 致[2,22]。究其原因,新生大鼠出生后BDNF和GDNF水平相對較低,至出生后第2周其水平方升高,即神經膠質細胞的成熟過程中[27?28],可能影響本研究結果。此外,本研究和我們課題組既往研究均顯示,新生大鼠各腦區BDNF基線水平差異較大,小腦表達量較高(約500 μg/g)[2],海馬較低(本研究為100 μg/g),大腦皮質最低(<20 pg/g)。因此,BDNF在小腦中的差異性表達最具代表性。
綜上所述,本研究探討EDNRB基因缺陷的新生大鼠海馬神經細胞凋亡以及神經營養因子GDNF和BDNF的表達變化,與+/+相比較,EDNRB基因缺陷sl/sl新生大鼠海馬CA1和CA3區神經凋亡細胞顯著增加,提示EDNRB基因在神經細胞凋亡的誘導中發揮重要作用,但其作用是否一直持續存在并影響成年大鼠,造成其相應腦區神經細胞凋亡,從而出現局灶性神經功能缺損,尚待進行成年大鼠相關實驗進一步探討。
利益沖突無

