實驗引導與啟迪思維相結合發展學生“證據推理與模型認知”的核心素養*
尚曉凱,趙 鈺,車 瓊,張一芳,張 甜,馮 勛
(洛陽師范學院化學化工學院,河南 洛陽 471934)
1 問題的提出
“電化學基礎”模塊知識是以原電池、電解池為核心,結合了氧化還原反應、離子反應、水溶液中的離子平衡等方面的知識,具有理論性強、內容抽象、綜合性強的特點,因此在高考中備受青睞。經過對最近五年全國卷中電化學題目的分析得出:試題一般以陌生復雜的新型情境出現,側重考查學生的信息的處理加工能力、知識的整合遷移能力、分析與推測能力、歸納與論證能力的考查[1]。所以,得分率并不理想,根本原因是:“題海戰術”已經不能滿足學生的需要,深入理解原理和本質才是教學的重點。
《普通高中化學課程標準(2017年版)》明確提出:重視開展“素養為本”的教學,倡導真實問題情境的創設,開展以實驗為主的探究活動[2]。并且在化學學科核心素養中,專門把“證據推理與模型認知”作為一個方面進行描述,也說明了基于證據的邏輯推理能力和對模型的認知應用能力在學生核心素養發展中的重要作用。
經過對48名中學一線教師的調查,在五個維度的化學學科核心素養中,有60.42%的教師認為在電化學中學生最欠缺的和最應該培養的是“證據推理與模型認知”,并且提出可以用原理分析和模型構建的方法來幫助學生學習這部分知識。因此,以“電化學基礎”教學作為發展學生證據推理與模型認知能力的載體,具有一定的合理性和可操作性。
2 發展學生證據推理與模型認知能力的方法探索
2.1 實驗引導,喚醒證據意識
通過推理可以得出重要的結論,但是沒有證據的推理往往只是一種猜測,可能是臆造事實上不成立的問題;即使猜測的是事實,沒有證據也不具有說服力[3]。化學是以實驗為基礎的科學,以實驗教學為手段對學生進行思維能力培養是化學學科的最顯著的特點。隨著課程改革的不斷深入,實驗探究必將成為化學課堂教學的重要組成部分。通過對教材中實驗的進一步改進和優化,用實驗現象來喚醒學生的證據意識,讓學生發現實驗在科學探究中的魅力,有助于培養學生善于從實驗中獲取信息、勤于思考、樂于探究的學科思維。
2.2 問題驅動,助力推理分析
“學起于思,思源于疑。”問題是學習的源頭,是啟發學生思維的最積極因素。在教學中,設計有情景、有層次的問題鏈,有利于驅動學生思維發展,引發學生主動思考、同化和順應知識。同時,問題鏈需要符合以下要求:有合適的難度,控制在學生的最近發展區之內,通過仔細思考可以解決;有一定的梯度,環環相扣,讓學生的思維沿著問題拾級而上[4];有一定的效度,經過逐個問題的解決,理解知識。這樣的問題鏈才能真正的引發學生推理分析的熱情與動機。
2.3 構建模型,啟迪思維
建構主義學習觀認為:學習是學習者對外部信息的主動選擇、加工和處理,生成個人認知結構的過程[5]。學生在得到結論后將其同化為個人認知結構的時候,通常只是簡單的歸納整合,這樣的方式學生往往得到的是短時記憶,容易造成知識體系不完整。依托思維導圖建立的知識網絡和體系,有利于學生從整體上將知識內化,然后通過對思維導圖的簡化,重新構建認知模型,利用知識模型形成認知體系,用解題模型進行訓練,會高效促進模型認知能力的發展。
3 實驗引導和啟迪思維相結合解決初學原電池疑難問題
現場及課后發現:學生存在以下幾個疑難問題:
(1)銅鋅原電池實驗中,電流表指針發生偏轉,能說明有電流產生,但為什么得出鋅是負極、銅是正極的結論?
(2)單液原電池存在哪些缺陷?為什么要選擇雙液原電池?
(3)在做練習題時,遇到很多原電池裝置中有離子交換膜,加離子交換膜有什么作用和優點呢?
基于上述問題,設計出以下實驗方案,用實驗引導和啟迪思維相結合幫助學生在克服學習困難的同時,提升分析推理能力。
3.1 實驗探究1:認識原電池
3.1.1 實驗方案
A.在干電池的兩端串聯一個電流表(見圖1),觀察電流表指針偏轉方向[6]。
B.將鋅片和銅片插入盛有稀硫酸的燒杯中,用導線在鋅片和銅片之間串聯一個電流表(見圖2),觀察現象。
圖1 實驗A裝置圖Fig.1 Device diagram of experiment A
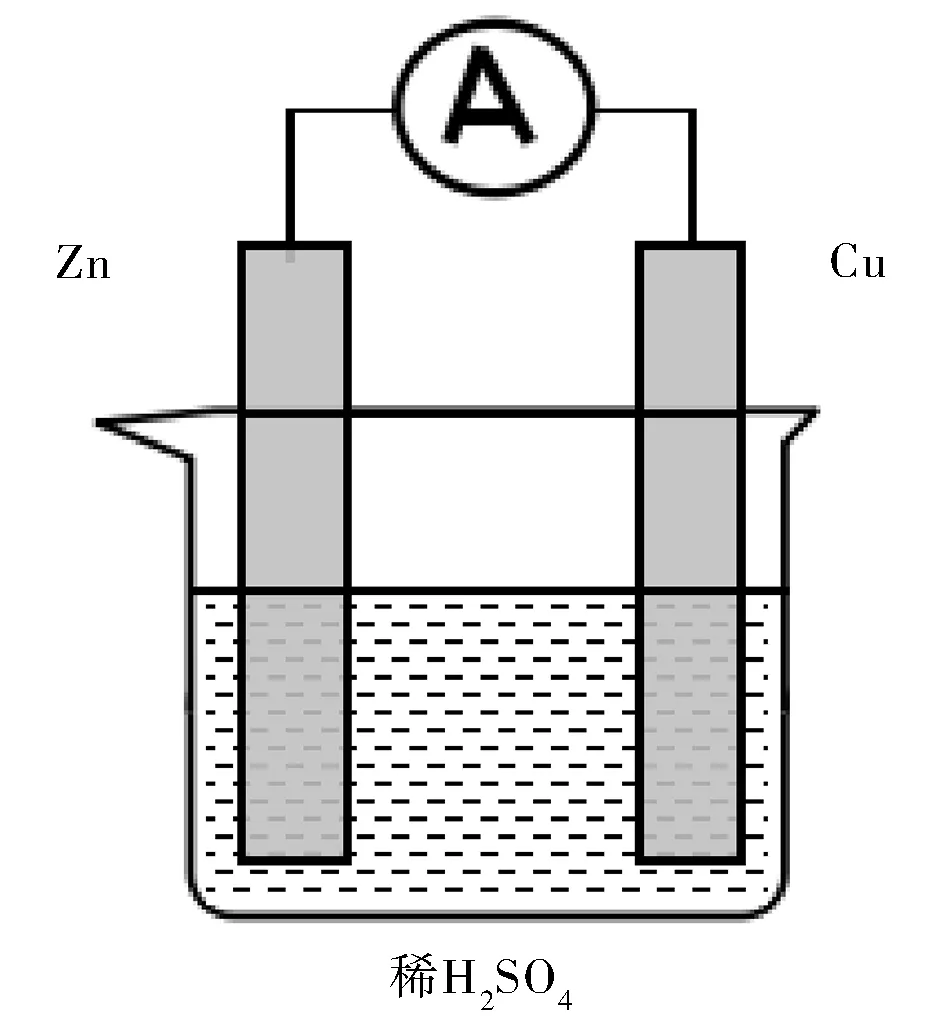
圖2 實驗B裝置圖Fig.2 Device diagram of experiment B
3.1.2 實驗現象
干電池的電流表指針向正極方向偏轉;銅鋅原電池中,鋅片逐漸溶解,在鋅片、銅片上均有氣泡產生,電流表指針偏向銅片一端。

表1 探究原電池工作原理Table 1 Explore the working principle of galvanic cells
3.2 實驗探究2:再探單液原電池
3.2.1 實驗方案
C.將鋅片和銅片浸入硫酸銅溶液中,并用導線串聯一個電流表(見圖3),觀察電流表指針偏轉角度,一段時間后,觀察現象。
D.將鋅片和銅片分別浸入硫酸鋅溶液和硫酸銅溶液中,并用導線串聯一個電流表(見圖4),觀察現象。
E.在D 裝置中的兩個燒杯之間加入鹽橋(含有KCl飽和溶液的瓊脂)(見圖5),觀察現象。

圖3 實驗C裝置圖Fig.3 Device diagram of experiment C
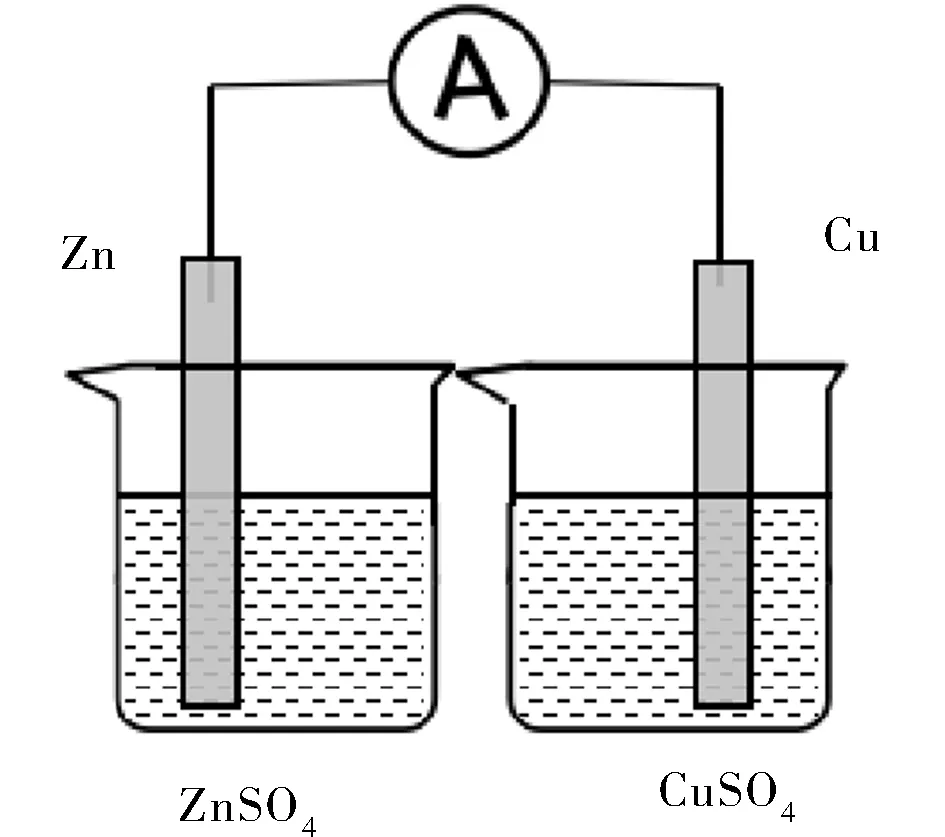
圖4 實驗D裝置圖Fig.4 Device diagram of experiment D
3.2.2 預測現象
提問:預測3.2-C的實驗中鋅片和銅片兩極有什么現象,并找出實際現象與預測現象有何不同?
分析:根據原電池工作原理,鋅是原電池的負極,失去電子發生氧化反應,生成鋅離子,且電子沿著導線流向銅片;銅是原電池正極,溶液中的銅離子得到電子發生還原反應,生成銅單質,所以現象應該是銅片表面有紅色物質產生。
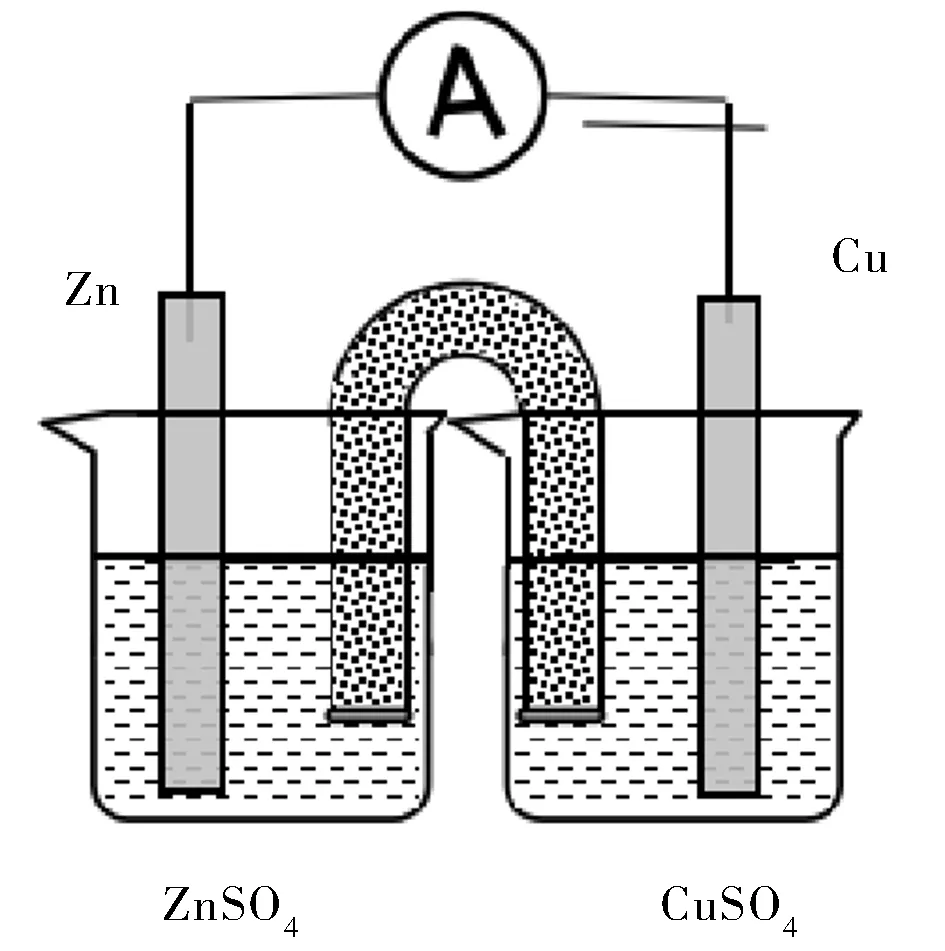
圖5 實驗E裝置Fig.5 Device diagram of experiment E
3.2.3 實驗現象
C實驗銅片上有紅色物質產生,鋅片上也有紅色物質產生,一段時間后,鋅片表面逐漸被紅色物質覆蓋,同時電流表示數逐漸降低;D實驗無明顯現象,電流表指針無偏轉;E實驗銅片上有紅色物質產生,電流表指針偏轉且電流恒定。

表2 探究雙液原電池的優點Table 2 Explore the advantages of dual liquid galvanic cells
3.3 實驗探究3:探究離子交換膜電池
3.3.1 提出問題
雙液鹽橋原電池在一定程度上解決了單液原電池由于氧化劑與還原劑直接接觸產生的問題,但是在鹽橋中的電解質是一定量的,隨著K+和Cl-分別進入兩個電解質溶液中,就無法保證電池產生持續的電流,那么,如何解決鹽橋容量有限的問題呢?
知識拓展:
離子交換膜的原理是一類具有離子交換功能的高分子材料。在溶液中它能將本身的離子與溶液中的同號離子進行交換。按交換基團性質的不同,離子交換樹脂可分為陽離子交換樹脂和陰離子交換樹脂兩類。由于離子交換作用是可逆的,因此用過的離子交換樹脂一般用適當濃度的無機酸或堿進行洗滌,可恢復到原狀態而重復使用,這一過程稱為再生。陽離子交換樹脂可用稀鹽酸、稀硫酸等溶液淋洗;陰離子交換樹脂可用氫氧化鈉等溶液處理,重新利用。
3.3.2 實驗方案
改進銅鋅原電池裝置,在溶液之間加入離子交換膜(見圖6),離子交換膜使離子選擇性定向遷移,能夠平衡整個電解質體系中離子電荷守恒。
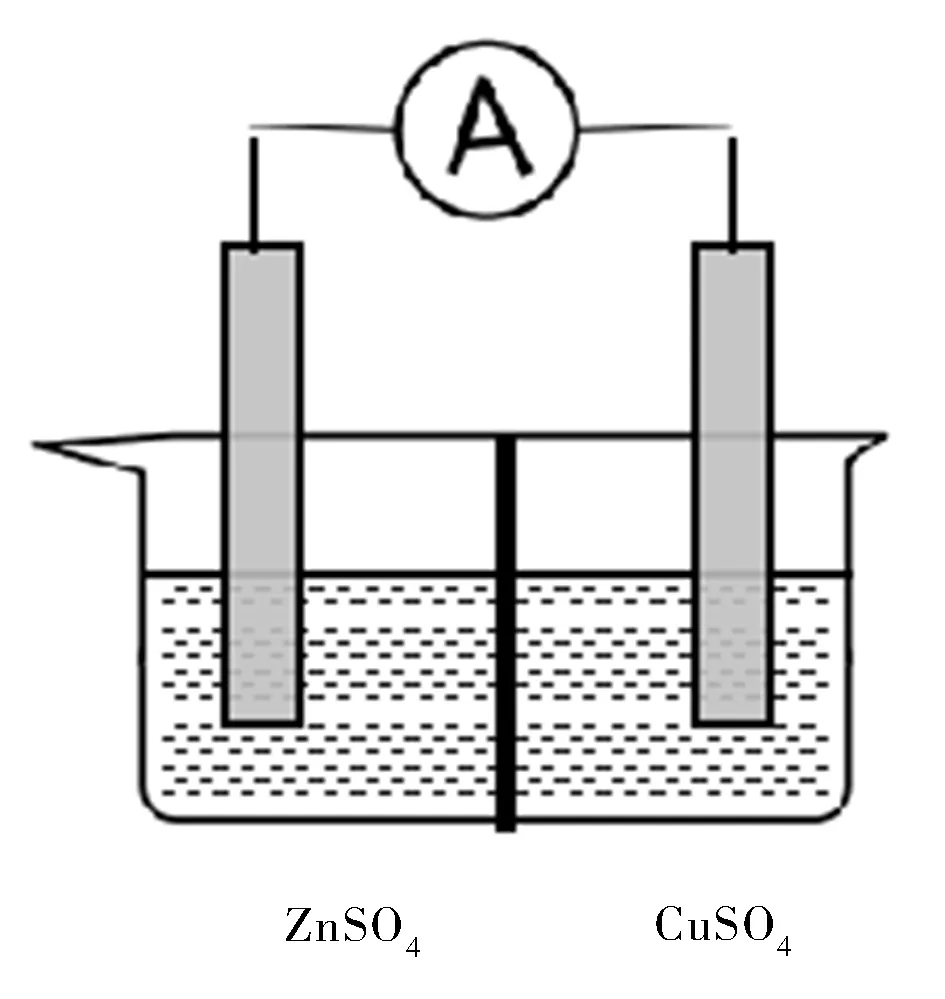
圖6 實驗F裝置圖Fig.6 Device diagram of experiment F
3.3.3 實驗現象
銅片上有紅色物質產生,鋅片上無紅色物質產生,電流表指針會偏轉且指針偏轉位置固定。
3.3.4 結 論
含有離子交換膜的原電池能夠一直保持電解質溶液的電中性,產生持續穩定的電流。
4 模型的構建與分析
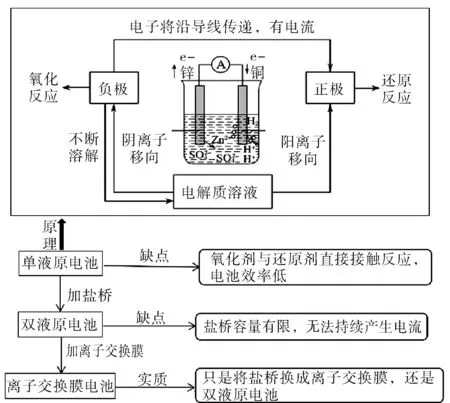
圖7 雙液原電池知識結構模型圖Fig.7 Knowledge structure model diagram of dual-liquid galvanic cell
在日常教學中,大部分教師會采用提綱式的歸納法將知識簡單地加工整合,缺少結構化的整理,學生得到的依然是零散的知識碎片。以“模型認知”素養為基礎,結合上述探究過程,構建以下知識結構模型(見圖7),啟發學生在學習過程中要用整體的思維完善知識體系,減輕記憶負擔。
利用模型可以簡化核心知識,整合知識體系,解決實際問題,模型的構建需要準確的理解知識間的邏輯結構。課堂上,通過“認識原電池——再探單液原電池——探究離子交換膜電池”的逐步學習,在教師的引導下進行推理分析,符合認知規律的教學更能刺進對知識的理解,所以在教學實踐中,學生可以明顯感覺到知識的邏輯性,并且思路清晰的進行科學探究,符合化學學科核心素養的要求。而證據推理也需要借助“宏觀辨識與微觀探析”、“科學探究與創新意識”等素養的配合才能完成,因此,實驗引導與啟迪思維相結合發展學生證據推理與模型與認知能力是落實化學學科核心素養的有效途徑。

