丁酸鈉對染氟小鼠骨礦含量及骨微結構的影響
楊鳳梅 李洋杰 吳利 劉杰 孫璐 張卓
沈陽醫學院1公共衛生學院,2基礎醫學院(沈陽 110034);3遼寧省疾病預防控制中心放射衛生所(沈陽 110015)
氟是人體正常生長發育過程中必不可少的微量元素[1-3]。自然環境中氟化物含量豐富,飲用水是人體氟化物的主要來源。現已證明,在推薦劑量下的氟攝入對機體健康是有益的,對骨骼和牙齒的礦化起著至關重要的作用。然而,過量氟攝入可引起慢性氟中毒,引發骨骼和關節周圍組織的一系列特征性變化,并導致患者出現不同程度的運動功能障礙[4-6]。已有實驗表明低濃度氟中毒促進成骨細胞增殖,高濃度氟中毒則抑制成骨細胞的增殖[7]。目前,氟中毒的發病機制尚未明確,也缺乏行之有效的防治藥物,特別是在氟中毒流行地區,氟攝入過量受累人數眾多,這已然引起了學者們的廣泛關注。
丁酸鈉是丁酸的鈉鹽形式之一,丁酸現已被證明影響成骨細胞的增殖與分化[8]。研究發現丁酸鈉與機體健康密切相關,在調節腸道健康、提高免疫力及抗炎抑癌等方面意義重大[9-11]。丁酸鈉抑制牙周膜干細胞(periodontal ligment stem cells,PDLSCs)的成骨細胞分化能力作用已被證實[12]。隨著研究深入,學者們發現[13-14],丁酸鈉在預防實驗性大鼠骨質疏松和刺激人成骨細胞礦化等方面有積極作用。由于目前關于丁酸鈉對氟中毒小鼠的拮抗作用尚不清楚。因此,本研究旨在觀察丁酸鈉對氟中毒小鼠骨代謝及骨顯微結構的影響,為進一步探索防治氟中毒性骨病的有效方法提供理論依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物清潔級初斷乳雄性ICR小鼠24只,體質量(20±2)g,購自遼寧長生生物科技有限公司,實驗動物合格證號:SCXK(遼)2015-0001,飼養于沈陽醫學院動物實驗中心,溫度(24±2)℃,相對濕度(55±5)%,小鼠自由飲水、進食。適應性喂養1周后,進入正式實驗。本實驗經沈陽醫學院動物倫理委員會批準(批號:SYYXY2021031502)。
1.1.2 主要試劑與儀器氟化鈉(NaF)(Sigma,美國,純度% ≥ 99%);丁酸鈉(SB)(Macklin,中國,純度 ≥98.5%),均為白色粉末狀;Micro-CT(Sky-Scan1276,Switzerland);YLS-16A 小動物骨強度測定儀(YLS-16A,濟南益延);原子吸收儀(AA-7000,日本島津);氟離子選擇電極(PXS-270,上海雷磁)。
1.2 方法
1.2.1 動物處理24只初斷乳雄性ICR小鼠,按照體質量均衡的原則隨機分為對照組、氟中毒組(100 mg/L NaF)、丁酸鈉組(100 mg/L NaF+500 mg/kg丁酸鈉)3組,每組8只。對照組小鼠飲用蒸餾水,氟中毒組和丁酸鈉組小鼠飲含F-濃度為100 mg/L的蒸餾水,各組均飼普通飼料,持續13周;隨后,丁酸鈉組每只小鼠按500 mg/kg丁酸鈉灌胃,對照組和氟中毒組則以生理鹽水灌胃,各組攝食飲水方式與前期保持不變,持續時間7周。動物實驗結束后,各組小鼠脫頸處死,取左側股骨和脛骨,剔除肌肉組織后,用生理鹽水濕潤的紗布包裹,封袋后-80℃冰箱保存備用。
1.2.2 Micro-CT將處理好的股骨垂直放置于標本管內,用濕紙巾纏繞固定,Micro-CT掃描后,采集的樣本數據集使用配套軟件進行分析并三維重構。股骨遠骨端骨小梁掃描選擇距生長板0.215 mm,厚度為1.72 mm的骨髓腔區域。骨小梁物理參數如下:骨小梁骨密度(trabecular bone mineral density,Tb.BMD),骨體積分數(bone volume/total volume,BV/TV)能夠反映不同樣本骨小梁骨量的多少,骨小梁厚度(trabecula thickness,Tb.Th)表示骨小梁平均厚度,骨小梁數目(trabecular number,Tb.N)代表感興趣區域中,每mm中骨組織與非骨組織交點數量的平均值,骨小梁間隙(trabecular separation,Tb.SP)表示骨小梁之間髓腔平均寬度,Tb.Th、Tb.N、Tb.SP是評價骨小梁空間形態結構的主要指標,骨小梁結構模型指數(structure model index,SMI)描述小梁結構組成結構中板層結構和桿狀結構比例的參數,發生骨質疏松時,骨小梁從板狀向桿狀轉變,該值增大。Tb.Th、Tb.N、Tb.SP、SMI數值是由CTAn軟件分析得出的值。
1.2.3 骨結構強度實驗取脛骨,經室溫環境平衡1 h后,將其放入骨骼強度測定儀中進行壓碎實驗,壓碎速率為1.2 mm/s,檢測骨組織結構強度。
1.2.4 骨礦物質含量測定股骨烘干、炭化后,轉移至550℃馬弗爐中,干法消化6 h。消化完全后,骨灰溶解于5%硝酸溶液中備用。原子吸收法測定股骨中鈣、鎂、鋅的含量,比色法測定股骨中磷的含量,氟離子選擇電極法檢測股骨中氟的含量。
1.3 統計學方法實驗數據通過SPSS 26.0進行統計分析。氟中毒組與對照組及丁酸鈉組與氟中毒組均采用獨立樣本t檢驗處理數據,結果以均數±標準差表示,P<0.05或P<0.01表示差異有統計學意義。
2 結果
2.1 各組小鼠的一般情況實驗期間,各組小鼠無患病及死亡情況發生,攝食、飲水、皮毛及行為活動未見明顯差異,體質量均呈現上升趨勢。實驗結束時,氟中毒組與對照組相比,小鼠終末體質量顯著降低(P<0.01);丁酸鈉組與氟中毒組相比,小鼠終末體質量明顯高于氟中毒組(P<0.05),見圖1A。
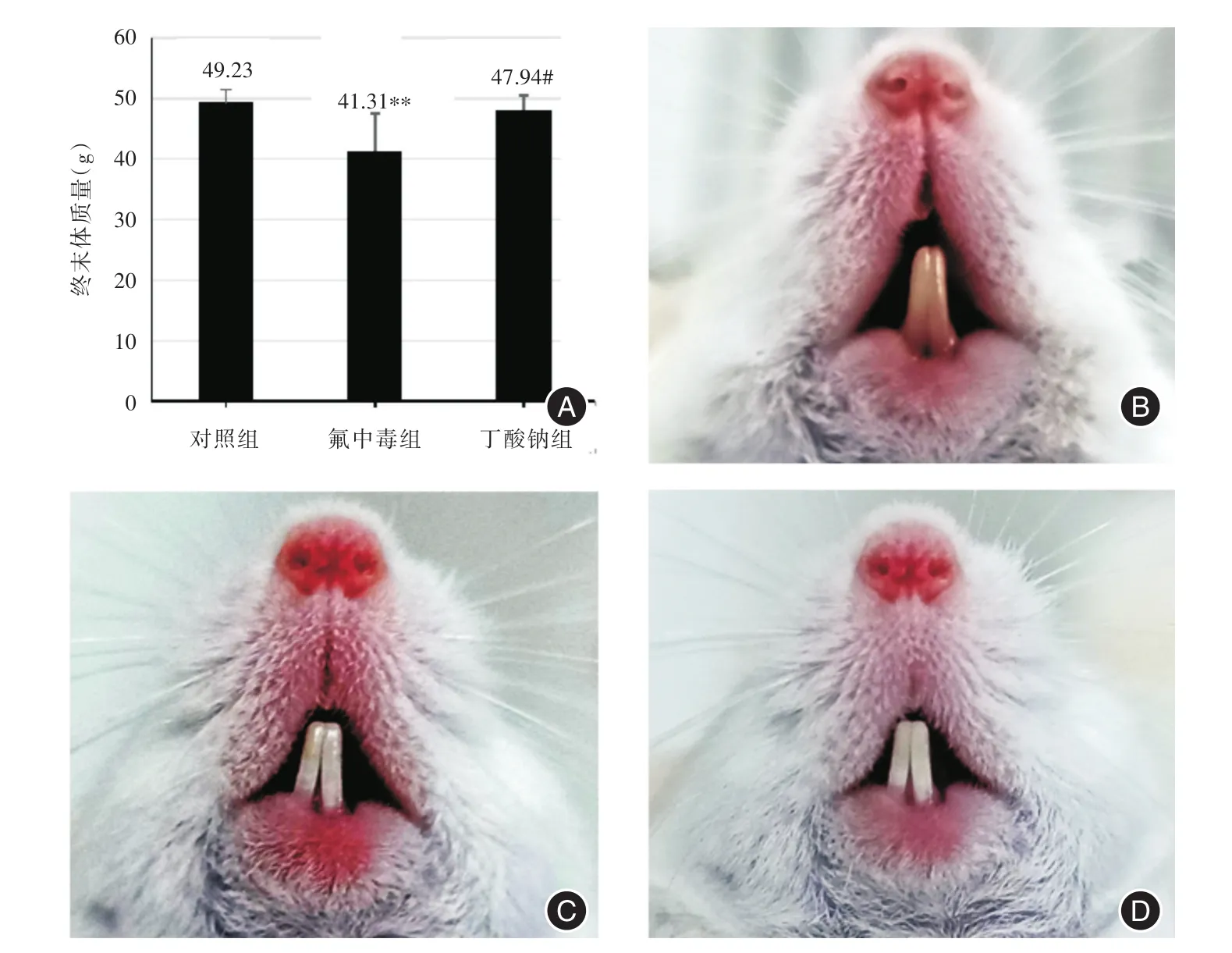
圖1 各組小鼠終末體質量和門齒變化Fig.1 Changes in final body weight and incisor of mice in each group
此外,對照組小鼠門齒表面光滑有光澤,牙面呈棕黃色,半透明狀,牙齒無破損,無氟斑牙形成(圖1B);其他兩組小鼠均出現不同程度氟斑牙,氟中毒組左右門齒可見棕白橫紋,牙齒表面著色不勻(圖1C);丁酸鈉組部分小鼠門齒光澤減退,表面粗糙,呈白堊樣改變(圖1D)。
2.2 各組小鼠骨小梁Micro-CT參數表1結果顯示,氟中毒組小鼠的Tb.BMD、BV/TV、Tb.N三項指標均顯著低于對照組(P<0.01或P<0.05),而Tb.SP和SMI均明顯增高(P<0.05)。丁酸鈉組與氟中毒組相比,丁酸鈉組各項指標中,僅Tb.BMD顯著增高(P<0.05)。
表1 各組小鼠股骨骨小梁物理參數Tab.1 Physical parameters of femoral trabecular bone of mice in each group ±s,n=3
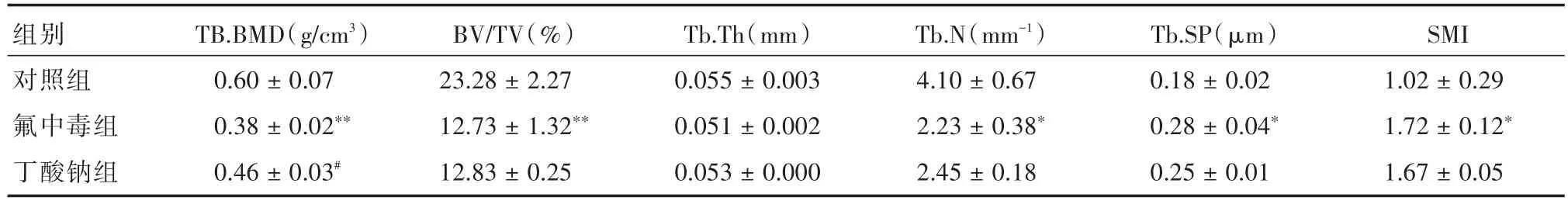
表1 各組小鼠股骨骨小梁物理參數Tab.1 Physical parameters of femoral trabecular bone of mice in each group ±s,n=3
注:氟中毒組與對照組比較,*表示P<0.05,**表示P<0.01;丁酸鈉組與氟中毒組比較,#表示P<0.05
組別對照組氟中毒組丁酸鈉組SMI 1.02±0.29 1.72±0.12*1.67±0.05 TB.BMD(g/cm3)0.60±0.07 0.38±0.02**0.46±0.03#BV/TV(%)23.28±2.27 12.73±1.32**12.83±0.25 Tb.Th(mm)0.055±0.003 0.051±0.002 0.053±0.000 Tb.N(mm-1)4.10±0.67 2.23±0.38*2.45±0.18 Tb.SP(μm)0.18±0.02 0.28±0.04*0.25±0.01
2.3 各組小鼠骨小梁三維結構由圖可見,對照組小鼠股骨骨小梁結構緊密,粗細均勻,連續性良好,網狀結構正常(圖2A)。氟中毒組骨小梁結構稀疏、粗細不均,部分區域出現骨小梁斷裂和缺失,呈現明顯的骨微結構破壞(圖2B)。丁酸鈉組與氟中毒組相比,骨小梁結構相對緊密,雖也呈現出骨微結構破壞,但其程度相對較輕(圖2C)。
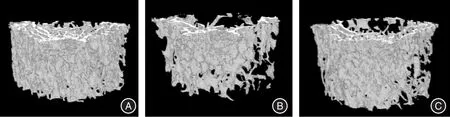
圖2 各組小鼠股骨骨小梁三維結構Fig.2 Three-dimensional structure of femoral trabecular bone of mice in each group
2.4 各組小鼠脛骨骨結構強度生物力學測試結果顯示,氟中毒組小鼠的脛骨骨結構強度顯著低于對照組(P<0.01)。丁酸鈉組與氟中毒組相比,骨結構強度高于氟中毒組,差異有統計學意義(P<0.05)。

圖3 各組小鼠脛骨骨結構強度Fig.3 Tibia bone structure strength of mice in each group
2.5 各組小鼠股骨骨礦含量與對照組比較,氟中毒組小鼠骨鈣、骨鎂、骨鋅含量均顯著降低(P<0.01或P<0.05),骨氟和骨磷含量均明顯增高(P<0.01)。丁酸鈉組小鼠骨鈣、骨鎂、骨鋅含量均高于氟中毒組(P<0.01或P<0.05),而骨氟和骨磷含量均低于氟中毒組(P<0.01或P<0.05)。
3 討論
在我國,地方性氟中毒地區分布范圍廣,潛在受累人數多,屬全身中毒性疾病,其典型病癥為以骨代謝紊亂為主的氟骨癥[15]。本次研究使用高氟自來水制備飲水型氟中毒小鼠,結果可見,氟中毒小鼠出現不同程度的氟斑牙,且骨組織中氟含量顯著增加,說明氟中毒模型制備成功。
表2 各組小鼠股骨骨礦含量Tab.2 Femoral bone mineral content of mice in each group ±s,n=8

表2 各組小鼠股骨骨礦含量Tab.2 Femoral bone mineral content of mice in each group ±s,n=8
注:氟中毒組與對照組比較,*P<0.05,**P<0.01;丁酸鈉組與氟中毒組比較,#P<0.05,##P<0.01
分組對照組氟中毒組丁酸鈉組氟(μg/g)1 224.08±114.84 2 728.99±480.94**1 934.87±278.35##鈣(mg/g)177.15±46.24 132.81±26.06*160.39±18.42#磷(mmol/g)3.23±0.74 6.69±0.85**5.74±0.72#鎂(mg/g)4.60±1.05 1.79±0.61**2.83±0.67##鋅(μg/g)179.48±42.67 139.75±16.30*183.00±19.52##
已有研究[16-17]顯示,氟對骨組織的影響呈雙向病理變化,即在低劑量條件下氟可激活成骨細胞,促進成骨作用;反之則抑制成骨過程。本次實驗觀察到,氟中毒小鼠骨鈣含量顯著降低,同時伴有鎂、鋅元素含量的降低及骨磷含量的增加,說明高氟條件下,實驗小鼠呈現骨礦代謝紊亂狀態[18-19];此外,三維立體影像顯示,氟中毒小鼠股骨骨小梁結構稀疏、粗細不均,部分區域出現骨小梁斷裂和缺失,呈現明顯的骨微結構破壞,同時骨CT參數變化也印證了上述骨小梁結構的破壞性改變,這與BIAN等[20-21]的研究結果相似。正因如此,生物力學測試結果就正好解釋了為什么氟中毒小鼠的骨結構強度顯著降低。
近些年研究發現,短鏈脂肪酸在調控骨代謝方面作用積極,并可作為骨質疏松癥防治的有效干預措施之一。作為短鏈脂肪酸的重要成員,丁酸及其鹽類在增加骨量、改善骨微結構和預防骨質疏松等方面已得到動物實驗證實[26]。其可能機制:一是通過誘導破骨前體細胞代謝的重編程,或通過誘導調節性T細胞間接抑制破骨細胞分化,減少破骨細胞數量,調節骨穩態;二是,經由Wnt信號通路促進成骨細胞分化,減少骨質流失,改善骨微結構[24];三是,激活細胞核因子E2相關因子2/抗氧化反應元件信號通路,增強細胞抗氧化能力[25-26]。既然如此,本研究中丁酸鈉糾正氟中毒小鼠骨礦含量紊亂、修正骨小梁物理參數及改善骨微結構等結果,均可能與上述骨代謝調節機制密不可分。還需指出的是,丁酸鈉能顯著降低氟中毒小鼠骨氟含量,這就提示,丁酸鈉通過干擾氟吸收或促進氟代謝亦可能是其拮抗氟毒性的機制之一。
總之,丁酸鈉可以緩解氟中毒小鼠骨礦含量紊亂狀態,改善骨微結構,增強骨結構強度。

