從“脾之液為涎”探討嶺南特色炮制枳殼的減燥作用及機制研究?
龍江玲, 黃瑩瑩, 楊 婷, 李沁如, 徐啟鍵, 趙婷秀, 夏 荃△
(1.廣州中醫藥大學中藥學院, 廣州 510006; 2.廣州中醫藥大學基礎醫學院, 廣州 510006)
中藥藥性理論是中藥理論體系的基礎與核心[1]。“燥性”是中藥性能之一,但目前有關中藥燥性的研究相對較少[2]。炮制可以改變或調整藥性,探究中藥炮制前后的差異、闡釋可能的藥性變化規律是研究中藥藥性的思路之一[3]。枳殼是一味常用中藥,來源于蕓香科植物酸橙CitrusaurantiumL.及其栽培變種的干燥未成熟果實,具有理氣寬中、行滯消脹的功能[4]。一般認為生枳殼“燥性”過強,久服易傷陰耗液,故常通過炮制達到緩和“燥性”的目的[5]。在廣東、香港等嶺南地區,多采用先發酵后蒸制的炮制工藝以緩解枳殼的“燥性”[6],但對于這種嶺南特色炮制枳殼減燥作用的相關研究并不多見。
有研究發現,長期高劑量服用生枳殼后,大鼠會出現24 h糞便量減少等表現,故從影響腸道燥性的角度出發,論述了枳殼的燥性以及麩炒減燥的作用[7]。但本課題組在前期研究中發現,生枳殼所致大鼠腸道燥性的癥狀并不明顯,但可影響大鼠的唾液量、飲水量和胃腸道神經肽含量。枳殼歸脾、胃經,中醫藏象理論認為“脾在液為涎”,故本實驗從影響唾液分泌和唾液腺神經肽的角度,探討嶺南特色炮制枳殼的減燥作用,也為中藥燥性的研究提供思路。本研究通過廣州中醫藥大學實驗動物倫理委員會批準(批號ZYD-2020-137)。
1 材料
1.1 動物
SPF級雄性SD大鼠30只,體質量(200±20)g,購自浙江維通利華實驗動物技術有限公司,實驗動物許可證號SYXK(粵)2019-0202。動物飼養于廣州中醫藥大學中藥學院SPF級動物房,光照12 h明暗交替,室溫22 ~ 24 ℃,濕度40% ~ 60%,普通飼料喂養,自由進食飲水,常規適應性飼養1周后開始實驗。
1.2 藥物
生、制枳殼飲片(批號200501),購自廣州至信中藥飲片有限公司,經廣州中醫藥大學中藥鑒定教研室張丹雁教授鑒定,確認為蕓香科植物酸橙的干燥未成熟果實的合格飲片。
1.3 主要試劑與儀器
戊巴比妥鈉(廣州市齊云生物技術有限公司,貨號GH-40C0);蘇木精、伊紅(北京索萊寶科技有限公司,貨號G1108、G1140);血管活性腸肽(vasoactive peptide,VIP)試劑盒、5-羥色胺(5-hydroxytryptamine,5-HT)試劑盒、P物質(substance P,SP)試劑盒、水通道蛋白5(aquaporin5,AQP5)試劑盒(江蘇酶免生物科技有限公司,貨號分別為MM-0445R1、MM-0442R1、MM-0444R1、MM-0474R1);DAB顯色試劑盒(中杉金橋有限公司,貨號212300304);AQP5抗體(英國Affinity公司,貨號AF5169);山羊抗兔IgG(江蘇親科生物研究中心有限公司,貨號7074S)。
MICROM STP 120型石蠟脫水機、HISTOSTAR型石蠟包埋機、HM304E型石蠟切片機、A81500101型自動染片機,美國賽默飛世爾科技有限公司;BX53型光學顯微鏡,日本奧林巴斯有限公司;Multiskan Go 1510型全波長酶標儀,美國賽默飛世爾科技有限公司;LUKYM-1型樣品冷凍研磨儀,廣州露卡測序儀器有限公司;3-18R型臺式高速冷凍離心機,湖南可成儀器設備有限公司。
2 方法
2.1 生、制枳殼水煎液的制備
取一定量生、制枳殼飲片加水煎煮2次,第1次加入10倍量水,浸泡30 min后煎煮1 h;第2次加入8倍量水煎煮30 min,合并2次濾液,減壓濃縮至含生藥量1 g/mL,4 ℃冷藏備用。
2.2 分組及給藥方法
30只SD大鼠隨機分為空白組、生枳殼低劑量組、生枳殼高劑量組、制枳殼低劑量組、制枳殼高劑量組,生、制枳殼給藥劑量按照大鼠與人的等效劑量換算公式計算。空白組大鼠給予1 mL/100 g 0.9%氯化鈉溶液,生、制枳殼低劑量組大鼠按1 g/kg劑量灌胃,生、制枳殼高劑量組大鼠按10 g/kg劑量灌胃,每天給藥1次,連續給藥4周。
2.3 處死與取材
末次給藥后禁食不禁水12 h,大鼠腹腔注射1%戊巴比妥鈉麻醉,劑量為0.5 mL/100 g。麻醉后剪開大鼠頸部皮膚,摘取雙側頜下腺,用0.9%氯化鈉溶液沖洗干凈,一側頜下腺固定于4%多聚甲醛中用于HE染色和免疫組化,一側組織勻漿用于Elisa檢測,取材后脫頸處死大鼠。
2.4 指標檢測
2.4.1 大鼠飲水量測定 將大鼠單獨飼養于代謝籠中,每天定時添加飲水并測定水瓶總質量,以前1天水瓶總質量M1與當天水瓶總質量M0的差值作為大鼠的每日飲水總量,連續測定28 d大鼠的日飲水量,計算每組大鼠飲水量均值。
2.4.2 大鼠唾液流率的測定 在給藥后第7天、第14天、第21天、第28天測定每只大鼠的唾液流率。將大小適當的潔凈小棉球進行稱重,獲得棉球的干重,然后將棉球塞入大鼠口頰內,放置3 min后取出,立即使用電子天平獲得棉球的濕重,再按公式計算出唾液分泌量和唾液流率。唾液分泌量(mg) = 棉球的濕重(mg) - 棉球的干重(mg);唾液流率(mg/min) = 唾液分泌量(mg)/3。
2.4.3 大鼠頜下腺指數的測定 取出頜下腺后,用0.9%氯化鈉溶液洗凈,濾紙擦干表面多余的液體后稱重,頜下腺指數=頜下腺質量(g)/大鼠體質量(g)。
2.4.4 HE染色觀察頜下腺病理學變化 將頜下腺組織固定24 h后常規脫水,石蠟包埋。用切片機將其切成4 μm厚的切片,HE染色,光學顯微鏡下觀察頜下腺組織病理學變化。
2.4.5 Elisa法測定頜下腺VIP、5-HT、SP、AQP5含量 根據試劑盒說明書步驟,Elisa法測定大鼠頜下腺組織中VIP、5-HT、SP、AQP5的含量。
2.4.6 免疫組化法測定頜下腺AQP5蛋白表達 石蠟切片置于檸檬酸鹽緩沖液(pH=6.0)中進行抗原修復后,加入適量的內源性過氧化物阻斷劑,滴加AQP5一抗(1∶100)4 ℃孵育過夜。再加入辣根過氧化物酶標記的二抗,37 ℃孵育30 min后,加入DAB顯色液在室溫下孵育30 s,終止染色,蘇木精復染細胞核后中性樹膠封片。采用Image-pro plus 6.0軟件分析頜下腺組織棕黃色區域的平均光密度值,計算AQP5蛋白表達水平。
2.5 統計學方法

3 結果
3.1 各組大鼠飲水量比較
表1示,與空白組比較,各給藥組大鼠的飲水量均升高(P<0.01);各給藥組之間比較,生枳殼高劑量組大鼠的飲水量升高最明顯(P<0.01),即制枳殼也可升高大鼠飲水量但相較于生枳殼高劑量組,大鼠飲水量明顯降低(P<0.01)。生、制枳殼高劑量組大鼠的飲水量均高于低劑量組且呈劑量依賴性。
表1 枳殼炮制前后對各組大鼠飲水量的影響
3.2 各組大鼠唾液流率比較
表2示,與空白組比較,生枳殼組和制枳殼高劑量組大鼠的唾液流率顯著降低(P<0.01,P<0.05),與制枳殼低劑量組比較差異無統計學意義;與生枳殼高劑量組比較,制枳殼組大鼠唾液流率升高(P<0.01,P<0.05);生、制枳殼高劑量組大鼠的唾液流率均低于低劑量組且呈劑量依賴性。
表2 枳殼炮制前后對各組大鼠唾液流率的影響
3.3 各組大鼠頜下腺指數比較
表3示,與空白組比較,其他給藥組大鼠的頜下腺指數均有所降低。相較于生枳殼組,制枳殼組大鼠的頜下腺指數升高,但各組間比較差異無統計學意義(P>0.05)。
表3 枳殼炮制前后對各組大鼠頜下腺指數的影響
3.4 各組大鼠頜下腺組織病理學觀察結果
圖1示,空白組大鼠頜下腺漿液腺數量較多且密集,呈正常的卵狀形,導管無擴張,無淋巴細胞浸潤;生枳殼低劑量組大鼠頜下腺漿液腺數量有所減少,腺泡形態改變,而生枳殼高劑量組大鼠頜下腺腺泡數量明顯減少且大小不一,腺泡形態由卵形變為長條形。與生枳殼組比較,制枳殼組大鼠頜下腺泡數量增加,且制枳殼高劑量組明顯多于制枳殼低劑量組,腺泡結構有所改善。
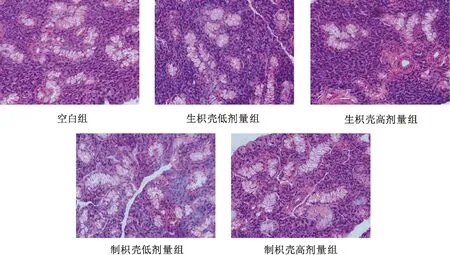
圖1 各組大鼠頜下腺組織病理學觀察結果比較(HE×400)
3.5 各組大鼠頜下腺神經肽VIP、5-HT、SP含量比較
表4示,與空白組比較,生枳殼組大鼠頜下腺VIP和5-HT含量均降低,其中生枳殼高劑量組顯著降低(P<0.05,P<0.01);與生枳殼高劑量組比較,生、制枳殼低劑量組大鼠頜下腺中VIP含量均明顯升高(P<0.05),制枳殼高劑量組大鼠頜下腺中5-HT含量明顯升高(P<0.05),各給藥組大鼠頜下腺中SP含量比較差異無統計學意義。
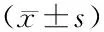
表4 枳殼炮制前后對各組大鼠頜下腺神經肽VIP、5-HT、SP含量影響
3.6 各組大鼠頜下腺組織AQP5含量比較
表5示,與空白組比較,生枳殼組大鼠頜下腺中AQP5含量顯著降低(P<0.01,P<0.05),制枳殼組大鼠頜下腺AQP5含量升高,其中制枳殼高劑量組AQP5含量明顯升高(P<0.05);與生枳殼高劑量組比較,制枳殼組大鼠AQP5含量明顯升高(P<0.01,P<0.05)。
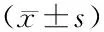
表5 枳殼炮制前后對各組大鼠頜下腺AQP5含量影響
3.7 各組大鼠頜下腺組織AQP5的免疫組化染色結果
圖2示,空白組大鼠頜下腺中AQP5分布在腺泡的頂膜、側膜及基膜,表現為較強染色的棕黃色顆粒。與空白組比較,其他實驗組大鼠頜下腺染色降低,其中生枳殼低、高劑量組大鼠頜下腺陽性染色顯著降低(P<0.01,P<0.05),差異有統計學意義;與生枳殼高劑量組比較,制枳殼低、高劑量組棕黃色顆粒明顯增多(P<0.05)。
4 討論
燥性是中藥固有的性能之一。燥能除濕是中藥發揮的治療作用,但燥性太過會使機體損耗津液,引起干燥失潤的表現[8],如《證治要訣》中提到的“凡辛溫燥烈之品無不傷陰耗血之弊”。但是,不同藥物燥性傷陰的具體表現有差異。如本課題組在前期研究中發現,生枳殼給藥后,大鼠腸道燥性的表現不明顯,但唾液分泌減少、飲水量增加等癥狀顯著。在臨床中也觀察到部分患者服用枳殼后會有口渴、咽干等不適癥狀。

注:與空白組比較,*P<0.05,**P<0.01;與生枳殼高劑量組比較,#P<0.05;與生枳殼低劑量組比較,ΔP<0.05;AQP5(aquaporin5,水通道蛋白5)圖2 各組大鼠頜下腺AQP5的免疫組化染色比較(×400)
中醫稱唾液為涎、唾,由于二者都分泌于口,臨床實際中很難截然分開,故常合而稱之[9]。《素問·宣明五氣篇》曰:“五臟化液……脾為涎。”脾主運化水谷與水濕精微,若功能失常則會導致涎液分泌異常[10]。枳殼歸脾胃經,生枳殼辛燥峻烈,易耗傷津液、損傷中氣,經炮制后可緩和燥性,增強其理氣健脾的功效[11]。故本實驗基于“脾在液為涎”的理論,從影響唾液分泌和唾液腺神經肽的角度探討嶺南特色炮制枳殼的減燥作用。
在本實驗中發現,高劑量的生枳殼可使大鼠的唾液分泌量降低、飲水量增加,表現出燥性耗液傷津的癥狀;相比于生枳殼,制枳殼可使大鼠唾液分泌量增加,飲水量降低,說明枳殼炮制后能夠緩解其生品的燥性。
唾液分泌的生理機制較為復雜,受多種因素調控和影響,其中頜下腺神經肽和水通道蛋白的表達是重要的影響因素[12]。VIP是體內重要的血管活性肽,可增加頜下腺局部的血管流量,直接影響唾液的分泌,同時也可通過磷酸化途徑調控頜下腺中環磷酸腺苷(cyclic adenosine monophosphate,cAMP)信號通路,從而間接影響唾液的分泌[13]。5-HT分布于大鼠頜下腺導管、漿液性腺泡、副交感神經節等部位,對唾液的分泌起著重要的作用,5-HT含量的升高可使大鼠唾液分泌量增加[14]。SP存在于頜下腺組織顆粒曲管內,是有效的舒張血管活性物質,可維持頜下腺腺泡形態和功能,參與調節頜下腺腺泡液體的分泌[15]。在本實驗中,生枳殼高劑量可明顯降低大鼠頜下腺VIP和5-HT含量,結果表明生枳殼所致唾液分泌量的減少與VIP和5-HT含量降低有關,且呈現劑量依賴的負相關性;制枳殼低劑量組大鼠頜下腺VIP含量高于生枳殼低、高劑量組,制枳殼高劑量組大鼠頜下腺5-HT含量明顯高于生枳殼高劑量組,結果提示制枳殼可通過調控VIP和5-HT含量使大鼠唾液分泌量增多,從而緩和生枳殼的燥性。在各組間大鼠頜下腺中SP含量差異無統計學意義,說明生、制枳殼影響大鼠唾液分泌的作用機制可能與SP含量無關。
唾液的分泌不僅與頜下腺神經肽含量的改變有關,還與頜下腺中水通道蛋白的表達有關。其中AQP5是最早被確定分布在唾液腺腺泡頂膜、側膜、閏管和導管上皮細胞中的一種蛋白,AQP5的異常表達和分布被認為可能是唾液分泌失調的重要因素之一[16]。在本實驗中發現,生枳殼組大鼠頜下腺中AQP5的表達降低且呈劑量依賴;給予制枳殼后,AQP5表達升高,大鼠唾液分泌量升高,提示制枳殼炮制減燥的作用機制可能與升高AQP5表達有關。
綜上所述,大鼠唾液分泌減少、飲水量增加等表現,為枳殼“燥性”的重要生物學表征,其內在機制可能與頜下腺神經肽及水通道蛋白的分泌與表達異常有關。枳殼經嶺南特色炮制方法炮制后,可以在一定程度上糾正這些異常,起到炮制緩燥的作用。本研究既是炮制原理的初探,也可為中藥藥性理論、“脾在液為涎”等中醫基礎理論的研究提供一些思路。但是研究目前只關注了枳殼炮制前后對頜下腺分泌功能的影響,關于枳殼的“燥性”尚需更深入的研究,如燥性物質基礎的明晰、全面的燥性生物學表征的構建等,都是值得思考與探究的問題。

