低溫等離子體改性糧油植物蛋白結構的研究進展
李 琦,支 愛,何學明,沈 飛 ,邢常瑞,Firew Tafesse Mamo
(南京財經大學食品科學與工程學院1,南京 210023) (江蘇高校現代糧食流通與安全協同創新中心2,南京 210023) (巴赫達爾大學埃塞俄比亞生物技術研究所3,亞的斯亞貝巴 5954)
蛋白質是人體細胞、組織和器官的重要組成成分,是人類飲食中的關鍵營養物質,在維持人體健康方面起著至關重要的作用[1]。與動物蛋白相比,糧油植物蛋白的功能性相對較低,如水溶性差、對環境脅迫條件如酸度、鹽和溫度的敏感性及復雜性限制了其在各工業領域的應用發展[2]。但植物蛋白具有低脂、不含膽固醇,富含膳食纖維、活性物質等優勢,且攝入高質量的植物蛋白可降低患多種代謝疾病的風險[3]。糧油植物蛋白主要來源于谷物(小麥、玉米、高粱等)、豆類(大豆、豌豆、蕓豆等)、油籽(花生、芝麻、油菜籽等)等農作物及其副產品[4],具有抗氧化性[4]、乳化性[5]、持水性和凝膠性[6]等功能,被廣泛應用于食品、藥品、化妝品及包裝材料等領域。因此,植物蛋白質被認為是經濟成本低、環境友好型和可再生性的動物蛋白質的替代品[7]。我國的糧食作物含有較多植物蛋白,其中大豆蛋白占比較高,不僅是我國重要的糧食作物,還是植物中蛋白含量最豐富,氨基酸組成最均衡,最有望成為動物蛋白替代品的農產品。對于蛋白而言,其結構決定功能,故合理有效的蛋白質改性方法可改善其功能特性、營養價值和感官特性,進而拓寬植物蛋白在各領域的應用[8]。目前,蛋白質的改性方法包括物理改性、化學改性、酶法改性和基因工程改性[3],新興的幾種物理改性介紹如表1所示。
低溫等離子體是一種非熱、安全、環保的物理改性技術,被廣泛應用于污水凈化、高分子材料印刷、聚合材料改善等領域,是當下食品非熱加工的一個研究熱點[15]。低溫等離子體是通過自身產生的活性氧(Reactive Oxygen Species,ROS)、活性氮(Reactive Nitrogen Species,RNS)、自由基及高速電子打破蛋白質中共價鍵并引發各種化學反應而對食品表面進行改性的方法[16],適用于熱敏性食品[17],可在無外源添加劑的條件下對食品進行清潔、殺菌和改性[18],既能較好保持食品營養價值,也能改善食品功能特性。

表1 幾種蛋白質物理改性方法介紹
因此,低溫等離子體技術在食品加工領域具有重要的探索意義,國外已廣泛將該技術用于植物蛋白改性,但國內研究較少,故本文對該技術在植物蛋白質改性中的應用進行了概述,并對低溫等離子體改性蛋白的機理及蛋白質結構與功能之間的關系進行了簡要闡述,以期為今后進行該領域的研究提供參考。
1 低溫等離子體作用原理
低溫等離子體(Cold plasma)是指中性氣體在室溫條件下,通過微波、光脈沖、交流電和直流電等多種激發源產生的帶電粒子(電子、離子)和不帶電粒子(分子、激發態原子、亞穩態原子、自由基)以及紫外線、γ射線、β射線等,被稱為繼固態、液態、氣態之外的第四態[19,20]。目前,國內在低溫等離子體改性蛋白質領域進行了諸多研究,但對蛋白質改性的機制解析鮮見報道。因此,以現有低溫等離子體在食品殺菌、農殘降解、材料改性等方面的研究為基礎,對低溫等離子體對蛋白質改性機理進行簡要概括,其改性機理見圖1。
低溫等離子體對蛋白質改性的機理一般包括ROS、RNS及自由基的氧化作用,紫外線的光子蝕刻作用,以及激發態或非激發態原子和分子的蝕刻作用,其具體作用為:
pH作用:經研究,pH降低主要與幾個原因有關:1)等離子體中的ROS、RNS及自由基等一些活性成分直接或間接參與蛋白質氧化產生酸性物質[21];2)空氣氣體經電場作用產生氮氧化物與水作用生成亞硝酸(HNO2)和硝酸(HNO3)[22];3)高能電子或離子轟擊蛋白質溶液產生酸性離子(H3O+)[23]。這些物化反應均會改變處理樣品的 pH。蛋白質屬于兩性電解質,其解離程度取決于所處溶液的酸堿度。在蛋白質等電點(pI)處,蛋白質溶解度最小,會發生變性沉淀[24,25]。當溶液 pH 偏離蛋白質等電點 0.5 pH單位以上時,蛋白質溶解度增加[24]。因此,蛋白質在不同 pH 條件下會發生不同程度的變性,且環境中的酸性、堿性基團也會在其他因素作用下與蛋白質發生反應,進而對蛋白質改性。但是,等離子體處理樣品時,pH 值作用多適用于液體樣品,通過水的電離及與CO2間的相互作用使溶液呈酸性進而改性蛋白質;所以,當樣品水分含量低時,樣品 pH 幾乎不變,作用效果一般。
紫外光作用:等離子體形成過程會伴隨著光輻射,其中包括紫外線和可見光[20]。紫外光子的光解作用會打破蛋白質分子間鍵,破壞其氨基酸的結構,使蛋白質失活[26]。由于紫外線可被色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)等芳香族氨基酸吸收,所以紫外線輻射會誘導蛋白結構變化,產生化學修飾[27]。Kumar 等[28]證實了紫外光會誘導小麥粉中蛋白主鏈及其構像改變,進而影響小麥粉蛋白的功能性質。有研究證明,正常條件下,紫外線極易被空氣和水等介質吸收,所以對蛋白質溶液改性的作用有限[29,30]。紫外線的產生需要低溫等離子體在高壓條件下激發,較低電壓的等離子體處理產生的紫外線極少,部分還被介質吸收,故對蛋白改性的效果極微;較高電壓的等離子體處理可產生較多的紫外線,但較高電壓會對蛋白功能特性產生不利影響。因此,紫外光作用對蛋白改性具有局限性。

圖1 蛋白質改性機理
活性粒子氧化作用:低溫等離子體體系中反應物經電場作用產生大量氧自由基(·O)、羥自由基(·OH)、臭氧(O3)、二氧化氮(NO2)等活性物質,這些活性物質會與蛋白質分子相互作用,對蛋白質氨基酸殘基進行修飾,進而改變蛋白質的結構和性質[31,32]。劉志偉等[33]在介質阻擋放電等離子體處理誘導氧化降低 IgG/IgE 的結合能力并提高甘氨酸的功能性研究中表明,甘氨酸的IgG/IgE結合能力下降與氨基酸間肽鍵的氧化及敏感氨基酸(Trp、Tyr、Phe)的氧化有關,這些氧化修飾會破壞分子間氫鍵和氨基酸間的其他非共價相互作用,導致蛋白質改性。低溫等離子體改性蛋白質的關鍵物質是活性氧與活性氮,它們可誘導蛋白質發生化學鍵的變化及氨基酸側鏈的氧化等結構變化,進而改變蛋白質功能特性。蛋白質與活性粒子間的相互作用通常發生在蛋白質表面幾納米到幾十納米之間,故活性粒子的氧化作用多作用于蛋白質表面,蛋白改性程度與蛋白質和活性粒子接觸的比表面積有關。因此,利用等離子體處理蛋白粉末時,可采用過篩的方法控制蛋白粉末的粒徑,進一步擴大蛋白粉的比表面積,從而達到良好的改性目的。
高速粒子蝕刻作用:低溫等離子體的產生是一個能量不斷傳遞的過程,即外加電場使電子獲得能量撞擊周圍氣體,使氣體被激發電離形成大量電子,且系統中部分原子或分子在放電后期也會被激發生成一些高能活性粒子,這些粒子會與未被激發的粒子發生非彈性碰撞,并得到大量活性自由基[34,35]。高能活性粒子在電場作用下會不斷轟擊蛋白表面產生蝕刻現象,且會將自身能量傳遞給物質表面,誘導物質表面的共價鍵破裂或新化學鍵形成,進而啟動一系列化學反應[36],此現象導致的理化變化包括化學鍵的斷裂、化學降解和低分子質量片段的去除等[37]。但共價鍵的破裂和新化學鍵形成等變化只能發生在蛋白質表面,改性程度有所限制。研究表明,由于放電過程中的蝕刻作用影響,低溫等離子處理能夠增加聚合物表面的粗糙度或使蛋白表面產生空穴,進而對蛋白進行改性[38]。高速粒子蝕刻作用不僅會使蛋白產生空穴現象,還會使蛋白粒徑減小,從而加大蛋白與活性粒子的接觸面,更有利于蛋白的改性。
2 低溫等離子體對植物蛋白質結構的影響
蛋白質是由多種氨基酸按一定順序通過肽鍵彼此連接形成的具有特定空間結構的生物大分子,是生命的物質基礎[39]。大多數蛋白質分子至少存在 3 個水平的構像結構,包括一級結構、二級結構和三級結構,具體結構情況見圖2。蛋白質功能特性可分為三類:蛋白質與水相互作用,如溶解性、持水力等;蛋白質與蛋白質相互作用,凝膠性、沉淀等;蛋白質界面性質,乳化性、起泡性等[40]。通常,蛋白質的一級結構決定高級結構,高級結構是蛋白質行使功能性質的基礎,而蛋白質各種功能性質又是其結構的表現。因此,在研究蛋白質功能改性以拓寬其應用時,應對蛋白結構進行全面探討。
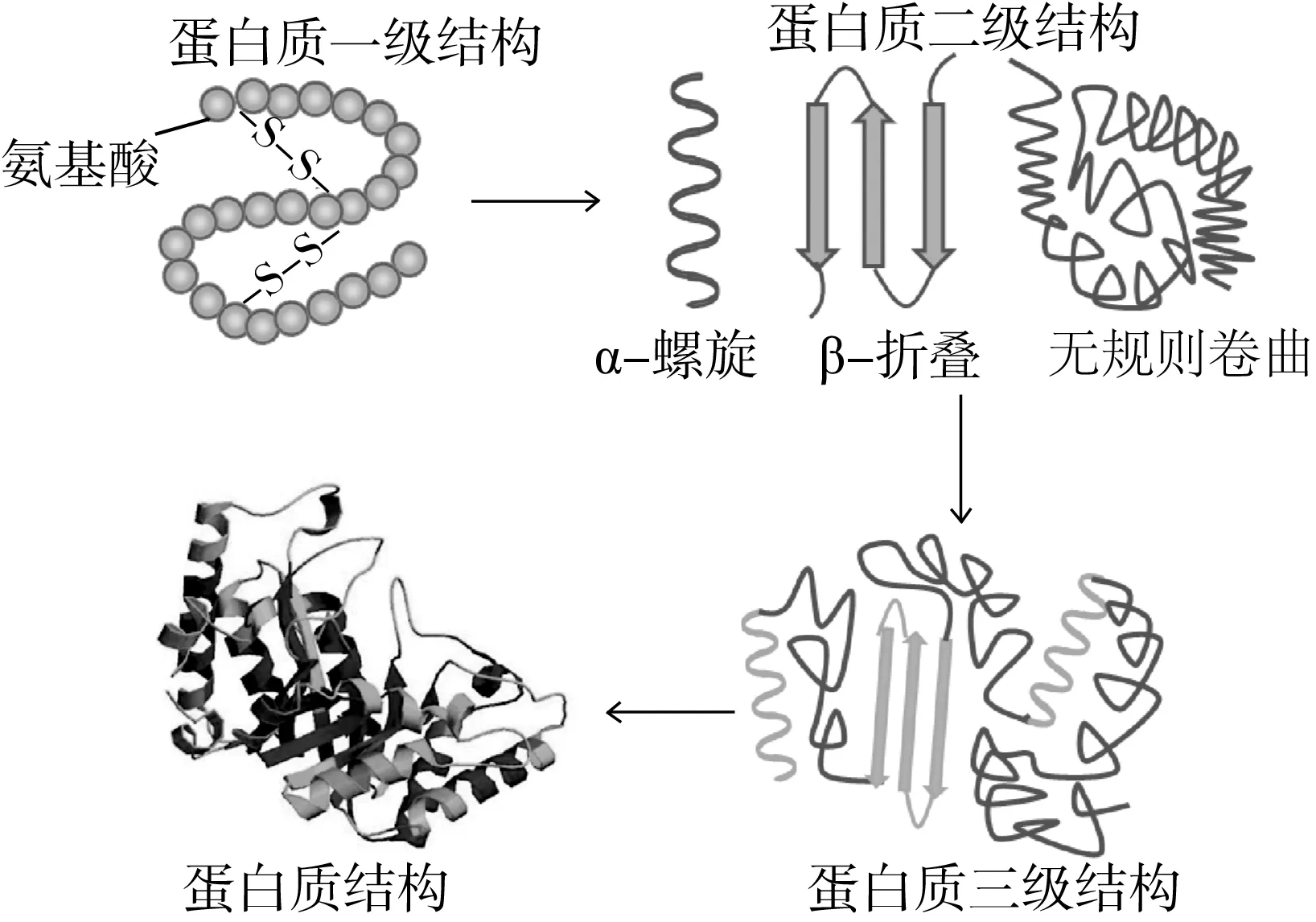
圖2 蛋白質構像結構
2.1 表面微觀結構
低溫等離子體處理作為一種有效的表面改性技術,能顯著改變材料表面的形貌。如低溫等離子體產生的高能粒子在電場作用下會不斷撞擊蛋白質分子表面,以改變蛋白質外觀,對其產生一定的物理修飾作用[39];存在的活性粒子及自由基會與蛋白質表面的氨基酸殘基發生氧化反應,對蛋白質產生化學修飾,進而改變蛋白質形態。通常采用掃描電子顯微鏡觀察低溫等離子體處理前后蛋白質表面微觀結構的變化。Dong 等[42]分別采用 50、75、100、125 V電壓的大氣低溫等離子體處理玉米蛋白粉,結果表明低溫等離子體處理后的蛋白質表面粗糙,未處理樣品的表面光滑,隨處理電壓升高,光滑表面逐漸消失,出現不規則扭曲和破裂,處理電壓達到75 V 時,樣品表面出現明顯的空腔現象,是由低溫等離子體處理時產生的高速粒子碰撞造成,且隨電壓增大,粒子間碰撞越激烈,蛋白表面越粗糙,但功能性在高電壓下會變差。Sharafodin 等[43]探究介質阻擋放電低溫等離子體在大豆分離蛋白理化性質修飾中的潛在應用時,分別采用不同時間和電壓處理樣品,結果表明,等離子體處理的樣品表面根據處理電壓不同出現不同大小的孔穴,主要由高速等離子體流產生的太陽風使蛋白質分子間相互碰撞及等離子體中的高能電子、離子和其他類型活性粒子與蛋白表面相互作用這兩種方式造成,并表明不是蛋白表面改性越大,蛋白功能特性越優異,當其電壓達到20 kV并處理15 min 時,蛋白功能特性出現顯著下降。低溫等離子體處理可通過蝕刻作用改變蛋白質分子表面,對蛋白質產生物理修飾作用,但研究者需通過控制蛋白處理量及處理條件來達到相應的改性效果。此外,低溫等離子體對蛋白表面的作用程度并不與蛋白的功能特性成正相關,且處理不同蛋白時的作用效果不同,故使用等離子體改性蛋白時應對其處理條件進行探索。
2.2表面疏水性
蛋白質表面疏水性是指蛋白質表面與極性溶液環境接觸時的疏水基團數量,主要取決于芳香族和脂肪族氨基酸殘基的暴露程度[44]。疏水相互作用被認為是維系蛋白質高級結構的主要作用力,在三級結構的形成和穩定中起著重要的作用[45]。蛋白質表面疏水基團的數量會影響蛋白質分子在水溶液中的膠束大小,進而影響蛋白質的溶解性。因此,蛋白質表面疏水性是研究蛋白質分子結構的重要參數,通常采用 ANS 發射熒光探針測定蛋白質表面的疏水性。Ji 等[46]采用 35 V 介質阻擋放電低溫等離子體分別對花生分離蛋白溶液處理 1、2、3、4 min 后發現,花生分離蛋白表面疏水性隨處理時間的增加逐漸降低,表明蛋白間疏水相互作用減少,親水作用增加,蛋白質的溶解度也相應增加,疏水性的降低是由蛋白內部疏水基團暴露引起。經研究證明,蛋白疏水性的變化主要由親水基團的引入和蛋白內部疏水基團的暴露有關。此外,蛋白質粒徑的大小也會因比表面積的變化來影響疏水基團的暴露比,進而影響蛋白質的疏水性。Dong等[41]在接觸角分析中也得出相應的結論。有研究認為,低溫等離子體處理后親水性提高可能與樣品表面引入的含氧基團有關,可增加了樣品表面的潤濕性[47-49]。但是,低溫等離子體處理蛋白質并不總是降低蛋白表面的疏水性,季慧等[50]在常壓低溫等離子處理提高花生分離蛋白水合性質的研究中表明處理時間在3 min內時,疏水性逐漸下降,花生分離蛋白對水的結合能力增強,其凝膠持水性(WHC)也相應增強,但3 min后,由于蛋白質分子展開,暴露更多內部疏水基團,使得蛋白質疏水性又有所增強。因此,低溫等離子體不同處理條件對蛋白疏水性的影響也不同,且影響疏水性會受蛋白種類、粒徑、pH等因素的影響,但低溫等離子體可通過高壓電場作用產生的活性氧、活性氮等活性粒子對蛋白改性,故采用不同氣體包裝蛋白粉或在處理器中充斥不同氣體成分均會對蛋白質產生不同程度的改性,但尚未發現相關研究,后續研究應針對不同氣體成分對蛋白結構及功能特性的影響進行系統研究。
2.3 二級結構
蛋白質的二級結構是指蛋白質多肽鏈借助氫鍵進行自身盤繞折疊的方式,主要有α-螺旋、β-折疊、β-轉角和無規則卷曲,是蛋白質形成立體結構的前提[51]。傅里葉變換紅外光譜(FTIR)是一種很好的生物分析方法[52],可用于研究化學鍵的變化,故用來測定蛋白質的二級結構。在 FTIR 光譜研究中通常選用酰胺Ⅰ帶(1 600~1 700 cm-1)的變化分析蛋白質二級結構的變化,該區域代表了蛋白質主干中最突出、最敏感的振動帶[53]。研究表明,蛋白質二級結構對應條帶為:α-螺旋(1 650~1 660 cm-1)、β-折疊(1 618~1 640和1 670~1 690 cm-1)、β-轉角(1 660~1 670和1 690~1 700 cm-1)、無規則卷曲(1 645 cm-1)[54]。Ji 等[55]在大氣壓低溫等離子體(ACP)處理花生蛋白分離物的研究中表明,ACP 處理 3 min 時,處理組樣品與未處理組相比,β-轉角含量呈增加的趨勢,但β-折疊含量則出現明顯下降;當處理時間超過 3 min 時,β-折疊和無規卷曲含量增加,而α-螺旋和β-轉角的含量有所下降,花生分離蛋白的結構經處理后被破壞,蛋白構象從致密、折疊變成展開、松散,該研究的二級結構變化與 Misra 等[69]在大氣低溫等離子體處理小麥粉的研究結果一致。蛋白質二級結構的展開、松散與電場下高速粒子的蝕刻作用和活性粒子對蛋白基團的氧化作用有關,在多種作用下,蛋白質的化學鍵被打開、重新折疊或氧化,從而改變蛋白質的二級結構,進而影響蛋白質的功能特性。有研究結果表明α-螺旋、β-折疊均與樣品疏水性有關,α-螺旋含量越低、β-折疊含量越高其疏水性越大,溶解性就相對較差,乳化活性也就相對越好[73]。Ji 等[58]表明,較高的β-折疊和無規則卷曲含量可以提高溶解度、持水性和起泡性。因此,并不是β-折疊含量高,其溶解性差,這還要根據其分子內外的β-折疊含量比、疏水基團與親水基團間的比例等因素影響,結構變化是對功能性的一種解釋手段,但是否存在必然關系,其關系如何需進一步研究。大量研究表明,低溫等離子體處理過程中的蝕刻作用會使蛋白質結構展開,產生的活性粒子也會氧化蛋白質的氨基酸基團,導致蛋白質二級結構改變,最終起到改變蛋白質的溶解性、乳化性、起泡性等功能性質的作用。
2.4 游離巰基
巰基(-SH)和二硫鍵(S-S)是蛋白質基食品中表達功能性質的兩個重要功能基團,二者間的轉換或變化代表著蛋白質結構的變化[58]。維持蛋白質三級結構穩定的主要作用力——二硫鍵,是蛋白質分子中巰基氧化形成。氨基酸側鏈基團中含有對氧敏感的巰基和芳香基,易被活性粒子氧化,其中半胱氨酸最為敏感[59]。此外,蛋白質結構中的共價鍵(S—S 鍵、C—S 鍵)之間的裂解能較低,在等離子體處理過程中很容易發生裂解[60]。巰基和二硫鍵的變化會改變蛋白質的結構,進而改變其功能特性,是研究蛋白質結構的重要參數,通常采用分光光度法測定。Segat 等[61]在大氣壓低溫等離子體(ACP)處理乳清分離蛋白模型溶液的研究中表明,與對照組相比,處理組樣品中的游離巰基隨處理時間延長,游離巰基的含量逐漸降低,在 ACP 處理 10 min時,-SH含量降到初始值的一半,故表明ACP會誘導蛋白質結構中存在的半胱氨酸巰基丟失。研究結果表明,巰基經過氧化會轉變成分子間的二硫鍵,從而加強分子間的穩定性,與薄膜結構間存在良好的相關性。季慧等[62]在低溫等離子體處理對花生分離蛋白溶解行為的研究中分別采用 1、2、3、4 min處理樣品,結果顯示,經處理后花生蛋白中的總巰基含量逐漸減少,在處理3 min時,總巰基含量與未處理樣品相比,降低了50%,這與巰基被氧化成二硫鍵有關,隨后總巰基含量有所增加是因為高能粒子的轟擊使生成的二硫鍵斷裂重新形成巰基。故低溫等離子體處理蛋白時,巰基含量的變化趨勢并不是一成不變的,當處理條件不同時,不同的作用方式會對巰基含量產生不同的影響。游離巰基并不是隨處理時間的延長而無限增加的,適當的等離子體處理會使蛋白分子中的巰基氧化生成二硫鍵,過度處理則會使形成的二硫鍵再次斷裂。而且,低溫等離子體是一個復雜的體系,其處理對蛋白質的影響是相互作用的結果,故在用低溫等離子體改性蛋白時應針對不同蛋白探索相應的處理參數,并將該蛋白質性能修飾到最佳效果。
2.5 分子質量分布
蛋白質大多是由多個亞基通過二硫鍵結合而成的大分子物質,若二硫鍵被破壞,構成蛋白質的亞基分開,其結構和分子質量也會相應發生改變。因此,測定蛋白質分子質量是研究蛋白質結構改變的重要參數,通常采用十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)測定,表征蛋白質一級結構和其組成。SDS-PAGE 可通過SDS消除蛋白質分子間原有的電荷差異和分子形狀差異,從而使該電泳速度只取決于蛋白質分子質量大小。Mahdavian 等[63]對草豆(甘草豆)分離蛋白(GPPI)納米顆粒分別采用 9.4、18.6 kVpp的大氣低溫等離子體處理300、600 s,其 SDS-PAGE 結果顯示,非還原條件下,草豆分離蛋白在高壓和長時間處理后分子質量發生改變,且在酸性和堿性條件下的亞基也存在不同程度的變化,還會出現新的亞基條帶,新亞基條帶的出現主要是由物理和化學蝕刻作用使原始蛋白聚集體破壞,使其碎片化造成的。根據 Segat 等[59]的研究表明,蛋白分子質量的變化主要與二硫鍵的變化或硫醇在等離子體處理過程中過度氧化有關。通常,蛋白質是由肽鏈經二硫鍵連接并折疊盤區而成的,二硫鍵的斷裂會使蛋白小亞基條帶增多,相反,二硫鍵的形成會出現較大亞基條帶,但二硫鍵的變化不會影響蛋白質的一級結構。這表明二硫鍵的斷裂會使原蛋白聚集體解聚,形成小分子亞基,但蛋白質的主要條帶不變,即該處理不會改變蛋白質的一級結構。因此,適當低溫等離子體處理可在不改變蛋白質分子主要條帶的前提下使蛋白質分子展開,改善蛋白質功能。但較高電壓或較長處理時間的等離子體處理會因二硫鍵的再次形成而使較小分子亞基間鍵合形成較大亞基,但是否會對蛋白質分子主要條帶產生影響還需進一步研究。
3 結語及展望
在糧油食品加工過程中,由于低溫等離子體處理屬于非熱加工,所以對處理樣品的理化性質及感官性質影響較小,可最大程度的保持原有品質。低溫等離子體改性蛋白質的機理主要是高速粒子對蛋白表面的蝕刻作用和活性粒子與蛋白質氨基酸殘基的相互作用,不會改變植物蛋白的一級結構及氨基酸組成,且植物蛋白中脂肪含量低,活性粒子的氧化作用并不會引起大量脂肪酸氧化,進而影響植物蛋白的營養價值及感官品質。但低溫等離子體的作用機理均局限于蛋白表面,無法使蛋白徹底改性,且處理條件、處理樣品的種類及樣品內部結構均會影響蛋白質的改性效果,故距離現實應用還需要進一步研究。
隨著低溫等離子體(CP)在蛋白質改性領域的應用,CP對蛋白質結構和功能的作用機制需要更深入的探索。此外,單一 CP處理對蛋白質的改性存在一定的局限性,可與一些傳統蛋白質改性方法相結合,如酶法與CP處理結合、糖基化與CP處理結合等,以提高蛋白質改性的效果。當前,大多低溫等離子體改性蛋白的研究均采用介質阻擋低溫等離子體,且多將樣品置于培養皿內處理,其處理面積及作用效果均受到限制,后續可針對蛋白改性設計相應的等離子體處理器,將樣品直接置于處理器內,并向處理器中充入相應的改性氣體,從而達到蛋白改性的目的。最后,CP改性后的蛋白質是否存在過敏性、處理本身是否安全或是否會存在其他的安全隱患均需進行大量毒理學實驗,以確保 CP改性蛋白質的食用安全及使用安全,進而為大規模的產業化發展打下基礎。

