頸動脈竇電刺激對肺動脈高壓右心室重塑的影響
胡志玲 陳 潔 代地林 胡邦望 張 艷 吳 園 舒 玲 包明威
肺動脈高壓(pulmonary hypertension,PH)因其起病隱匿、病因眾多、病理生理機制復雜、臨床預后差,有“心血管疾病中的癌癥”之稱。PH以肺動脈壓力和肺血管阻力進行性升高,肺血管重構為特征,最終導致右心力衰竭(right ventricular failure, RVF)[1]。目前PH全球患病率約為1%,65歲以上人群中患病率增加至10%[2]。PH患者的臨床癥狀、生活質量及遠期預后取決于右心室(right ventricular, RV)代償能力。在代償階段,RV通過向心性肥大,增加心肌收縮力,以維持心排出量。然而,持續升高的肺動脈壓力使得RV失代償,導致RV重塑和功能障礙,RV功能障礙是 PH 病死率的最強預測因子。盡管PH藥物取得了長足的進步,主要靶向藥物有內皮素受體拮抗劑、前列環素、磷酸二酯酶抑制劑等,以擴張肺血管、改善內皮功能為主[3]。目前可用PH 療法都沒有直接針對RVF,PH所致RVF 3 年生存率僅為55%[4]。
研究顯示,交感神經系統(sympathetic nervous system, SNS)持續激活在PH的發生、發展中發揮重要作用[1]。CH暴露引起SNS激活,而SNS持續激活是PH遠期預后的獨立危險因素。肺動脈主干和分叉周圍的脂肪和結締組織中發現豐富的交感神經,例如酪氨酸羥化酶陽性神經纖維、神經肽Y1(neuropeptide-Y type 1, NPY1)陽性神經纖維[5]。SNS激活時,血漿中去甲腎上腺素(norepinephrine, NE)和NPY1含量增加,刺激肺動脈上α1腎上腺素受體(α1-adrenergic receptor 1,α1-AR)和 NPY1受體,促進細胞周期相關蛋白如Cyclin A、Cyclin E的表達,使細胞從G0/G1期進入G2/M+S期,加速了細胞周期進程,促進肺動脈平滑肌增殖,進而使肺血管重塑惡化,肺動脈壓進行性增高,最終導致RVF[5, 6]。
頸動脈竇是人體壓力感受器,其產生的興奮由頸動脈竇神經傳入大腦延髓心血管中樞,進而精密調節植物神經功能。頸動脈竇電刺激(carotid baroreceptor stimulation,CBS)可以增強傳入神經到延髓心血管中樞的刺激,從而持久有效地降低交感神經張力[7, 8]。在高血壓、心力衰竭等伴有SNS張力升高的心血管疾病的治療中,CBS有確切效果[9, 10]。因此,筆者假設CBS 通過抑制SNS張力,抑制PH大鼠RV重塑,改善右心功能。
材料與方法
1.CH誘導PH模型的建立和分組:SD雄性大鼠(180~200g,6周齡)32只,動物實驗方案經武漢大學人民醫院動物倫理學委員會批準(倫理審批號:WDRM20191201)。大鼠適應性飼養1 周后植入CBS。術后恢復1周,于第 2 周末,Con-sham組和Con-CBS 組置于SPF環境(21%±1% O2),CH-Sham 組和 CH-CBS 組置于缺氧箱(10%±1% O2),Con-CBS組和CH-CBS組開啟CBS電刺激,Con-Sham和CH-Sham組不開啟電刺激。于第8周末行心臟超聲檢查后處死大鼠,分離RV行相應檢測。
2.頸動脈竇電刺激儀的植入:大鼠腹腔注射戊巴比妥鈉(45mg/kg)麻醉后,通過股動脈穿刺插管記錄動脈壓。分離頸動脈竇,用金屬電極包繞,連接電刺激儀(中國杰升生物科技有限公司)。采用脈寬 2ms,頻率20Hz,上下移動電極,尋找可迅速引起血壓和心率下降的部位,固定電極。將電刺激儀(脈寬 2ms,頻率 20Hz,電壓 0~30V 可調,刺激 10min 間隔 20min)埋藏于頸背部皮下。調試電壓,選擇可引起血壓下降的最低電壓的 80%刺激頸動脈竇。術后1周Con-CBS組和CH-CBS組開啟CBS,Con-Sham組和CH-Sham組不開啟CBS。
3.DHE免疫熒光:RV組織用 PBS沖洗后,放置于-80℃ 冰箱冷藏后制作冷凍切片(10μm),與10μmol/L的二氫乙啶(dihydroethidium,DHE) 在37℃避光孵育30min,在熒光顯微鏡400倍下每個樣品隨機選取5個視野拍照,并用Image Pro Plus 6.0軟件分析RV中ROS 的平均光密度(IOD/AREA)。
4. RT-PCR:使用Trizol 試劑提取RV組織總RNA。采用Prime-Script衰減轉錄試劑盒對 RNA(0.2~0.5μg)進行衰減轉錄反應。SYBRs Premix Ex TaqTM(DRR42OA,日本TaKaRa公司)和ABI 7300系統用于定量分析。PCR循環參數如下:95℃初始孵育10min,然后95℃變性(15s)40個循環,60℃退火(60s)。比較Ct法進行數據分析。GAPDH用于標準化mRNA的表達。引物序列詳見表1。

表1 引物序列
5.TUNEL染色:采用凋亡檢測試劑盒進行TUNEL染色。在光學顯微鏡400倍下每個樣品隨機選取5個視野拍照,計算TUNEL陽性心肌細胞百分比。
6.Western blot法檢測:RV組織均質化勻漿用于提取和分析GADPH和Bcl-2。BCA 蛋白質測定用于測定總蛋白質濃度。將等量的蛋白質(50μg樣品)加載到梯度凝膠上,轉移至膜封閉。加入相應抗體后在 4℃孵育過夜。抗GADPH 1∶1000稀釋,抗Bcl-2 1∶1000 稀釋。
7.大鼠心臟超聲檢測:大鼠采用異氟烷麻醉后,使用VINNO6VET型超聲心動儀15Hz的大鼠超聲探頭進行數據采集。通過胸骨旁軸測量RVEDT,通過心尖四腔心切面測量并計算RVFAC。

結 果
1.CBS對PH大鼠RV氧化應激的影響:DHE染色示,與Con-Sham 組比較,CH-Sham組ROS表達明顯升高(19.97±0.65 vs 25.64±1.57,P=0.00,圖1)。與CH-Sham組比較,CH-CBS組ROS表達減少(25.64±1.57 vs 22.75±1.47,P=0.014,圖1)。CBS干預可減少PH大鼠RV中ROS產生,從而抑制氧化應激對心肌細胞的損害。

圖1 右心室ROS表達A.右心室DHE染色圖(×400);B.右心室DHE染色統計結果。與Con-Sham組比較,*P<0.05;與CH-Sham組比較,#P<0.05
2.CBS對PH大鼠RV纖維化、肥大的影響:RT-PCR結果顯示,與Con-Sham組比較,CH-Sham組MMP2 mRNA表達明顯增加(1.14±0.27 vs 1.76±0.54,P=0.004,圖2A)、MMP9 mRNA表達明顯增加(0.79±0.19 vs 1.11±0.20,P=0.001,圖2B)、MYH7 mRNA表達明顯增加(1.14±0.27 vs 1.76±0.54,P=0.005,圖2C)。與CH-sham組比較,CH-CBS組MMP2 mRNA表達減少(1.76±0.54 vs 1.33±0.35,P=0.041,圖2A)、MMP9 mRNA表達減少(1.11±0.20 vs 0.89±0.23,P=0.017,圖2B)、MYH7 mRNA表達減少(1.76±0.54 vs 1.25±0.38,P=0.017,圖2C)。CBS干預可減輕PH大鼠RV纖維化、肥大,進而延緩RV重構。
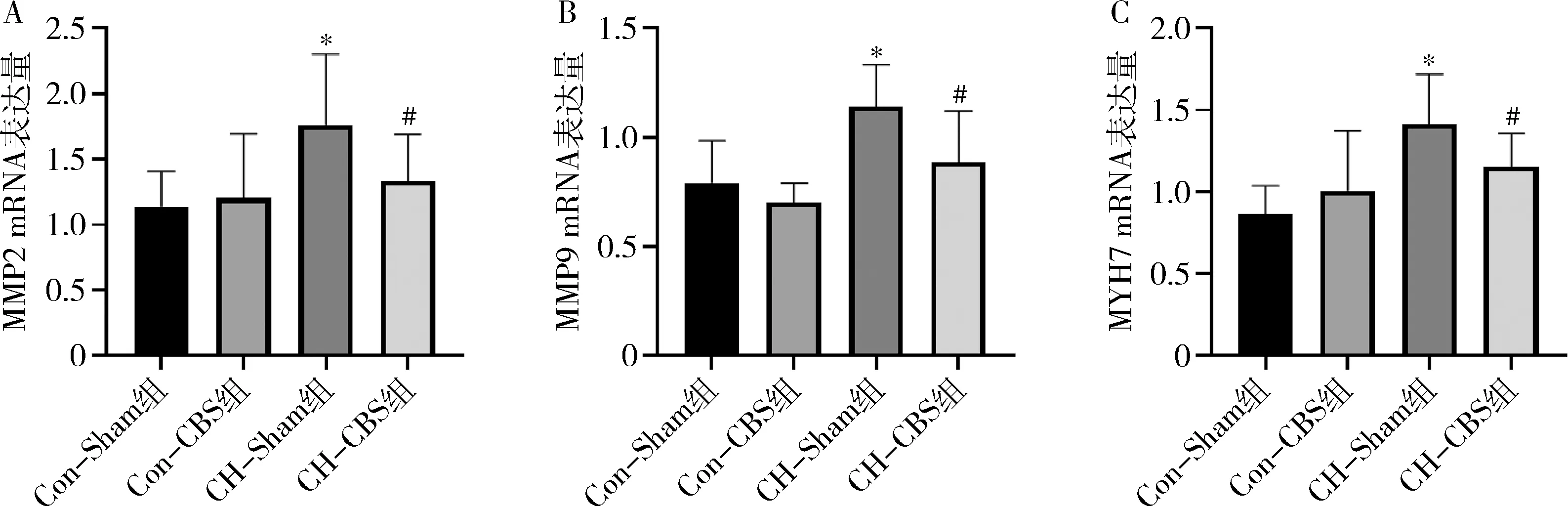
圖2 右心室MMP2、MMP9、MYH7 mRNA表達量A.MMP2 mRNA表達量;B.MMP9 mRNA表達量;C.MYH7 mRNA表達量。與Con-Sham組比較,*P<0.01;與CH-Sham組比較,#P<0.05
3.CBS對PH大鼠心肌細胞凋亡的影響:TUNEL染色結果顯示,與Con-Sham組比較,CH-Sham組RV中TUNEL染色陽性細胞明顯增加(4.02%±0.85% vs 29.84%±4.43%,P=0.001,圖3);蛋白印跡結果顯示,Bcl-2蛋白含量減少(0.73±0.16 vs 0.49±0.08,P=0.019,圖4)。與CH-Sham組比較,CH-CBS組RV中TUNEL染色陽性細胞明顯減少(29.84%±4.43% vs 5.58%±1.22%,P=0.001,圖3);Bcl-2蛋白表達增加(0.49±0.08 vs 0.68±0.06,P=0.019,圖4)。CBS干預可減輕PH大鼠心肌細胞凋亡。

圖3 右心室TUNEL染色A.右心室TUNEL染色圖(×400);B.右心室TUNEL染色統計結果。與Con-Sham組比較,*P<0.01;與CH-Sham組比較,#P<0.01
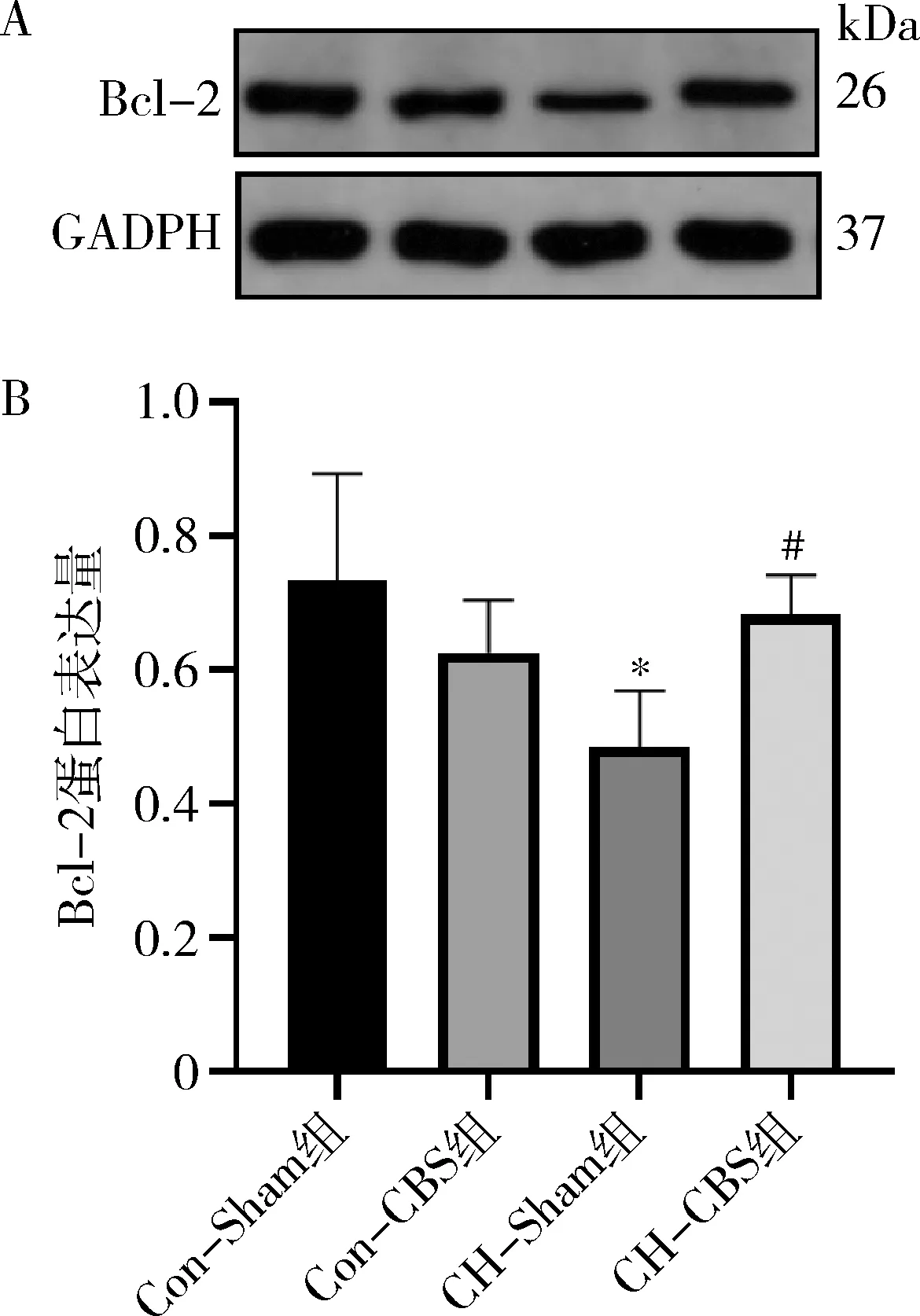
圖4 右心室Bcl-2蛋白表達量A.Western blot法條帶圖;B.右心室Bcl-2統計結果。與Con-Sham組比較,*P<0.05;與CH-Sham組比較,#P<0.05
4.CBS對PH大鼠右心功能的影響:心臟彩超結果顯示,與Con-Sham組比較,CH-Sham組RVEDT明顯增加(0.61±0.06mm vs 0.86±0.05mm,P=0.001,圖5A);RVFAC明顯減少(43%±30% vs 31%±2%,P=0.008,圖5B)。與CH-sham組比較,CH-CBS組RVEDT減少(0.86±0.05mm vs 0.72±0.07mm,P=0.029,圖5A),RVFAC增加(31%±2% vs 40%±3%,P=0.032,圖5B)。CBS干預可改善PH大鼠右心功能。
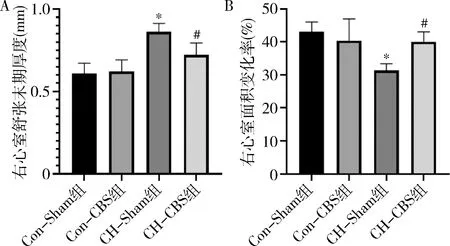
圖5 心臟超聲A.右心室舒張末期厚度;B.右心室面積變化率。與Con-Sham組比較,*P<0.01;與CH-Sham組比較,#P<0.05
討 論
本研究結果顯示,CBS干預可改善PH大鼠的氧化應激、纖維化、肥大、心肌細胞凋亡,進而改善右心室重塑和右心功能。PH時,肺循環血流動力學變化,缺氧誘導的化學感受器反射增強,右心室后負荷增加及心肌張力改變等均可促進SNS興奮。PH患者SNS活性增加,循環血NE和NPY1含量較高、尿中腎上腺素排泄明顯增加、肌肉交感神經活動(muscle sympathetic nerve activity, MSNA)頻繁[5, 11]。MSNA 是PH患者嚴重惡化的唯一獨立預測因子,MSNA活動每增加1次,患者死亡風險就會增加6%[11]。肺動脈去神經術可通過抑制交感神經活性,從而降低PH患者肺動脈壓,改善右心功能、提高6min步行距離,減少再住院率[5, 12]。
右心功能決定PH患者的臨床癥狀及遠期預后,右心室射血分數降低 1%,PH患者臨床惡化風險增加 4.9%、死亡風險增加 2.1%[13]。相對左心室而言,RV的特點是壁薄,冠狀動脈血流持續,與肺循環相連接。通常肺循環壓力<20mmHg,PH時肺循環壓力明顯增加,是RV適應性肥大的首要觸發因素,而PH時SNS過度激活是RV重塑和RVF的重要病理生理機制。長期SNS過度激活導致進入循環血中NE增多,而NE以濃度依賴的方式增加心肌細胞內ROS, ROS堆積直接導致心肌細胞壞死和凋亡增加,這種效應可被哌唑嗪阻斷[14]。細胞水平的ROS增加會促進氧化應激,氧化應激可氧化修飾心肌收縮蛋白、干擾新陳代謝和細胞內離子穩態、破壞線粒體、促進心肌細胞死亡,進而導致心臟結構、功能障礙。
氧化應激還可以加速基質金屬蛋白酶2(matrix metalloproteinase 2, MMP2)、基質金屬蛋白酶(matrix metalloproteinase 9, MMP9)的轉錄,抑制ROS產生可減少基質金屬蛋白酶(matrix metalloproteinases, MMPs)的活化[15]。MMP2和MMP9通過調節細胞外基質穩態參與心室纖維化和肥大進程,在心室重塑中發揮核心作用。在心力衰竭中MMPs表達、活性、豐度增加,可反映心室重塑的嚴重程度,并且血漿MMPs水平可以評估心力衰竭患者的遠期預后[16]。擴張型心肌病患者MMP2表達增加與血漿NE水平升高有關,NE通過β-腎上腺素受體激活ERK1/2通路,促進MMP2、MMP9的表達[15, 17]。NE還可以促進心臟肥大標志物β-肌球蛋白重鏈(myosin heavy chain 7, MYH7)的表達,MYH7沉默顯著抑制了異丙腎上腺素誘導的心肌肥大[18]。
RV肥大是PH的標志,實驗結果提示MYH7 mRNA表達上調,RVEDT增加,表明RV肥大、順應性下降。RV從代償性肥大到失代償功能障礙的轉變過程中,心肌細胞大量壞死和凋亡。Bcl-2作為細胞病理性凋亡的內在調節因子,在決定細胞存活方面發揮著核心作用。在離體心肌細胞中,NE抑制經典抗凋亡蛋白Bcl-2的轉錄、翻譯,以劑量-時間依賴性誘導新型促凋亡蛋白Axud1表達,Axud1通過激活Wnt/β-catenin信號通路介導心肌細胞凋亡[19]。CBS干預減輕PH大鼠RV氧化應激、纖維化、肥大、心肌細胞凋亡,從而改善RV重塑。RVFAC 是反映RV 收縮功能的敏感指標,實驗結果顯示,PH大鼠RVFAC減少, CBS干預可增加RVFAC。CBS干預還可降低RV舒張末期前后徑及RV流出道內徑[20]。這表明CBS干預可改善PH大鼠右心功能。
綜上所述,筆者發現CBS干預可以改善PH大鼠RV重塑及右心功能,其機制與抑制SNS過度激活、調節局部神經激素受體異常表達和信號轉導有關。與其他藥物或非藥物的植物神經功能干預手段比較,CBS 可直接、靶向抑制SNS,干預強度可精確調節。CBS為PH的治療提供了一種新選擇,但目前CBS的臨床轉化仍然面臨困擾,需要開展進一步探索。

