畜禽糞污中7種磺胺類和8種氟喹諾酮類獸藥殘留UPLC-MS/MS檢測方法研究
宋艷紅,李燕秀,馮俊吾*,武晉孝,趙平偉,張 薇,米彥飛,郭 禹,馬晉東
(1.山西省檢驗檢測中心,太原 030027;2.山西農業大學,山西太谷 030801)
磺胺類和氟喹諾酮類廣譜抗菌藥作為畜牧業投入品,被廣泛應用于畜禽養殖生產中,除治療外,還可預防、促生長,提升動物源食品產量和質量[1]。然因此類獸藥在畜禽體內不能被完全吸收、代謝和降解,大部分殘留藥物及代謝物會隨著畜禽糞污排出體外,進入自然環境中,這些同樣具有生物活性[2]的殘留藥物及代謝產物,會對環境、動植物和人體造成直接或者間接的危害。隨著養殖業規模化、集約化飛速發展,我國畜禽糞污量同比大幅增加。據統計,目前我國年產畜禽糞污已達40億噸[3],畜禽糞污中獸藥殘留污染問題已經成為一個不容忽視的問題。因此,為了更好地掌握畜禽糞污中殘留獸藥的現狀,有必要建立一種方便、高效、準確的畜禽糞污多獸藥殘留檢測方法。目前,獸藥殘留檢測方法通常有液相色譜法、微生物法、電化學檢測、免疫分析法、高效液相色譜-質譜法、生物芯片法等[4]。與其他檢測方法相比,超高效液相色譜-質譜進行檢測具有較高的特異性和靈敏度,抗干擾能力強,定量分析及定性分析更為準確[5-7]。因此,本文擬利用固相萃取及超高效液相色譜-串聯質譜技術,建立同時測定豬、雞、牛、羊糞污中7種磺胺及8種氟喹諾酮類常用獸藥的分析方法,為畜禽養殖場實時監測獸藥使用情況提供技術支撐,對解決我國畜禽糞污中獸藥殘留污染問題具有重要意義。
1 材料與方法
1.1 儀器與設備 超高效液相色譜-串聯質譜儀:UPLC TQ-S,美國Waters公司;電子天平:TP-1102,1100~0.01 g,丹佛儀器有限公司;電子天平:BP211D,210~0.01 mg,北京賽多利斯天平有限公司;高速冷凍離心機:Biofuge stratos,德國郝黎氏公司;氮吹儀:N-EVAP,美國Organomation Associates公司;渦旋震蕩器:MS-3,德國IKA公司;固相萃取裝置:SPE-24,美國Supelco公司。
1.2 試藥與試劑 磺胺嘧啶(SD)、磺胺甲噁唑(SMZ)、磺胺二甲基嘧啶(SM2)、磺胺甲氧噠嗪(SMP)、磺胺間甲氧嘧啶(SMM)、磺胺喹噁啉(SQ)、磺胺二甲氧嘧啶(SDM)(美國Dr.E公司,純度分別為99.2%、99.5%、99.4%、99.7%、94.2%、98.9%、99.4%);環丙沙星(Cipro.)、達氟沙星(Dano.)、恩諾沙星(Enro.)、沙拉沙星(Sara.)(美國Dr.E公司,純度分別為92.3%、94.2%、99.9%、85.82%);諾氟沙星(Nor.)、培氟沙星(Pe.)、洛美沙星(Lome.)、氧氟沙星(O.)(中國獸醫藥品監察所,純度分別為99.4%、99.6%、98.6%、99.5%);甲醇、乙腈、乙酸乙酯、氨水,色譜純;其余均為分析純;高純氮;高純氬;試驗用水均為一級水;固相萃取柱:Oasis HLB(3cc/60 mg),美國Waters公司。
1.3 儀器條件
1.3.1 液相色譜條件 色譜柱:ACQUITY UPLC?BEH C18(1.7 μm,2.1×100 mm);流動相:A 為 0.1%的甲酸水,B 為 0.1%的甲酸乙腈。采用梯度洗脫,柱溫:30 ℃;流速:0.3 mL/min;進樣量:5 μL,梯度洗脫方法見表1。

表1 梯度洗脫表Tab 1 Gradient elution table
1.3.2 質譜條件 離子源:電噴霧正離子模式(ESI+);檢測方式:多反應監測(MRM);電離電壓:2.7 kV;源溫:150 ℃;脫溶劑溫度:350 ℃;脫溶劑氣流量:800 L/h;錐孔氣流量:150 L/h;碰撞氣流量:0.15 mL/min;15種獸藥的定性/定量離子對、錐孔電壓及碰撞能量見表2。

表2 15種獸藥的質譜參數Tab 2 Mass spectrometric parameters of 15 veterinary drugs
1.4 樣品制備
1.4.1 標準溶液的制備
1.4.1.1 單標儲備液的配制 分別精密稱取適量的各標準物質共計15種,分別置于10 mL容量瓶中,加甲醇超聲使其溶解,放至室溫,用甲醇稀釋至刻度,搖勻,制成1 mg/mL的單標儲備液。
1.4.1.2 混合標準儲備液的配制 精密吸取上述15種1 mg/mL的單標儲備液,各0.1 mL,置同一100 mL容量瓶中,加甲醇稀釋至刻度,搖勻,即得1 μg/mL的混合標準儲備液。
1.4.1.3 混合標準工作液的配制 分別精密吸取1 μg/mL的混合標準儲備液10、20、50、100、200、500、1000 μL,置于不同10 mL容量瓶中,用復溶液定容,搖勻,即得濃度為1、2、5、10、20、50、100 ng/mL的混合標準工作液。
1.4.2 試液的制備
1.4.2.1 提取液的配制 分別取2%氨化乙腈50 mL和0.1 mol/L氫氧化鈉溶液50 mL,充分混勻,即得。
1.4.2.2 磷酸鹽緩沖液的配制 精密稱取0.8 g磷酸二氫鉀和0.2 g磷酸氫二鉀,加80 mL水充分溶解后,定容至100 mL,混勻,即得。
1.4.2.3 酸性洗脫液的配制 取1 mL甲酸,置100 mL容量瓶中,加甲醇稀釋至刻度,混勻,即得。
1.4.2.4 堿性洗脫液的配制 取2 mL的濃氨水,加入50 mL甲醇、50 mL乙酸乙酯,混勻,即得。
1.4.2.5 復溶液的配制 取20 mL乙腈,加入80 mL 0.1%甲酸水,混勻。
1.4.3 空白糞污樣品的篩選 選擇太原市及周邊多家豬、雞、牛、羊養殖場,通過現場確認以及畜禽用藥原始記錄,有針對性地選取30 d內未使用過磺胺類和氟喹諾酮類藥物的養殖場進行新鮮空白糞污樣品的采集,方法確立前使用顧欣等建立的豬糞便中獸藥殘留量檢測方法[6]進行樣品前處理,上液質聯用儀檢測,選擇對15種獸藥均無明顯干擾的樣品作為相應基質的空白樣品。
1.4.4 樣品溶液的制備 采集的新鮮糞污樣品,充分混勻,置-20 ℃冷凍保存。檢測時,稱取完全解凍的糞污樣品1.00±0.02 g(精確到 0.01 g),置于50 mL離心管中,準確加入提取液10 mL,充分渦旋30 s,震蕩5 min,4 ℃下8000 r/min離心5 min,移出上清液。剩余殘渣再加10 mL提取液重復提取一次,合并兩次上清液,混勻,作為備用液1。
精密吸取2 mL備用液1于10 mL離心管中,40 ℃水浴條件下氮吹至近干。加入3 mL磷酸鹽緩沖液溶解,渦旋30 s,4 ℃下8000 r/min離心5 min,取上清液作為備用液2。
取HLB 固相萃取小柱(3cc/60 mg)依次用3 mL甲醇、3 mL磷酸鹽緩沖液進行活化。取備用液2過柱,用3 mL5%甲醇水溶液進行淋洗,抽干。用2 mL酸性洗脫液洗脫,抽干,作洗脫液1。再用2 mL堿性洗脫液洗脫,抽干,作洗脫液2。收集洗脫液1、2于同一個15 mL離心管中。于40 ℃水浴條件下氮吹至近干,用1 mL復溶液溶解殘渣,溶液過0.22 μm濾膜(聚四氟乙烯膜),供UPLC-MS/MS檢測分析。
1.4.5 基質匹配標準溶液的制備 準確稱取豬、雞、牛、羊空白糞污樣品各6份,每份1.00 g(精確至0.01 g),按照1.4.4項下的方法進行提取、凈化、氮吹,于六份空白樣品中分別加入1 mL 的 1、2、5、10、20(豬、雞、羊糞污)、50(牛糞污)、100 ng/mL 的混合標準工作液復溶,充分震蕩,使殘渣溶解,制成濃度為 1、2、5、10、20(豬、雞、羊糞污)、50(牛糞污)、100 μg/mL的基質匹配標準溶液。進行超高效液相色譜-串聯質譜測定,每個濃度溶液重復進樣三次。獲得15種獸藥的基質匹配標準溶液濃度和峰面積,分別作為橫坐標和縱坐標,繪制出相對應的目標獸藥標準曲線。
1.4.6 空白樣品溶液的制備 準確稱取已初步篩選好的空白豬、雞、牛、羊糞污樣品1.00±0.02 g(精確到 0.01 g),置于50 mL離心管中,照1.4.4項下步驟同步平行操作,得空白樣品溶液。
1.4.7 檢出限(LOD)與定量限(LOQ) 分別稱取豬、雞、牛、羊糞污空白樣品各1 g,精密加入一定體積的混合標準儲備液,按照1.4.4項下步驟處理樣品,上機,計算信噪比(S/N),以響應值最弱的組分信噪比為3時,對應的添加濃度為方法的檢出限,以響應值最弱的組分信噪比為10時,對應的添加濃度為方法的定量限。
1.4.8 準確度和精密度樣品溶液的制備 稱取豬、雞、牛、羊空白糞污樣品各54份,每份1 g,分成3批,每批均精密加入一定體積的混合標準儲備液,渦旋混勻,制成50、100、500 μg/kg低、中、高三個不同添加濃度的加標樣品,每個濃度做6個平行樣,按1.4.4項下步驟處理樣品,照1.3項下儀器條件上機測定,用單點外標法定量,計算回收率和相對標準偏差;其中采用同批6個回收率數據計算批內相對標準偏差,采用3批平均回收率數據計算批間相對標準偏差。
2 結果與分析
2.1 基質效應 取上述1.4.5項下制備的10 ng/mL各基質匹配標準溶液,以及1.4.1.3項下純溶劑配制的相同濃度的混合標準工作液,按照1.3項下儀器條件注入液質聯用儀,以兩者同一種獸藥質譜響應值比值的百分數來評價基質效應(Matrix Effect,ME),若ME大于100%,則存在基質增強效應;若ME小于100%,則存在基質抑制效應;若ME接近100%,則不存在基質效應。結果顯示,15種獸藥除磺胺嘧啶(SD)和諾氟沙星(Nor.)部分結果出現基質增強效應外,其余獸藥均存在不同程度的基質抑制效應,尤其是磺胺喹噁啉(SQ)、磺胺二甲氧嘧啶(SDM)以及沙拉沙星(Sara.)基質抑制效應略微顯著(圖1)。為盡可能減少基質效應干擾,本實驗采用基質標準曲線進行定量,雖然各個待測物存在不同程度的基質效應,但不影響檢測結果。
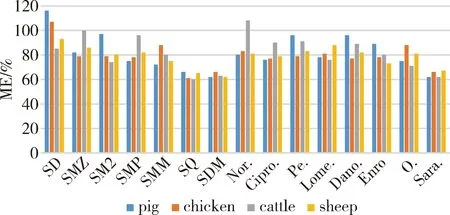
圖1 15種獸藥在豬、雞、牛、羊糞污中的基質效應Fig 1 Matrix effect of 15 veterinary drugs in pig, chicken, cattle and sheep manure
2.2 基質標準曲線 按照1.4.5項下步驟,豬、雞、羊糞污制成濃度為 1、2、5、10、20、100 μg/mL基質匹配標準溶液,牛糞污制成濃度為 1、2、5、10、50、100 μg/mL基質匹配標準溶液,供超高效液相色譜-串聯質譜儀測定。X軸為基質匹配標準溶液濃度C,Y軸為定量離子對應的色譜峰面積A,繪制15種獸藥基質匹配標準曲線。結果表明:豬、雞、牛、羊糞污中15種獸藥在1~100 μg/mL濃度范圍內線性關系均較良好,試驗結果見表3。15種獸藥基質匹配標準溶液及對應空白基質樣品溶液色譜圖見圖2~圖9。
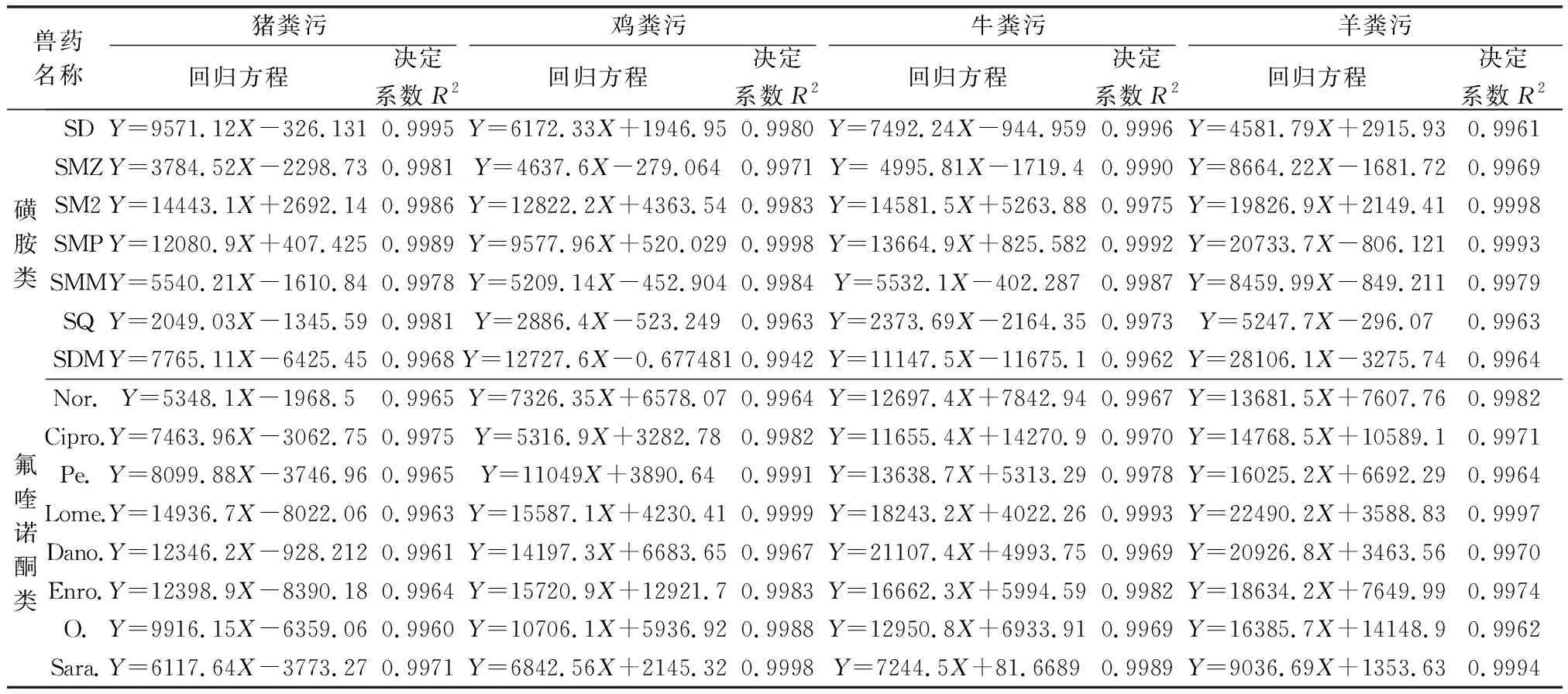
表3 豬、雞、牛、羊糞污中15種獸藥基質匹配標準曲線回歸方程及決定系數Tab 3 Regression equation and coefficient of determination of matrix matching standard curve for 15 veterinary drugs in pig, chicken, cattle and sheep manure
圖2 空白豬糞污樣品溶液色譜圖Fig 2 Chromatogram of sample solution of blank pig manure

圖3 豬糞污基質匹配標準溶液色譜圖(濃度50 μg/kg)Fig 3 Chromatogram of matched standard solution of pig manure matrix (concentration 50 μg/kg)注:1-SD、2-Nor.、3-O.、4-Cipro.、5-Pe.、6-Dano.、7-Lome.、8- SM2、9-Enro.、10-SMP、11-Sara.、12-SMM、13-SMZ、14-SQ、15-SDM。
圖4 空白雞糞污樣品溶液色譜圖Fig 4 Chromatogram of sample solution of blank chicken manure
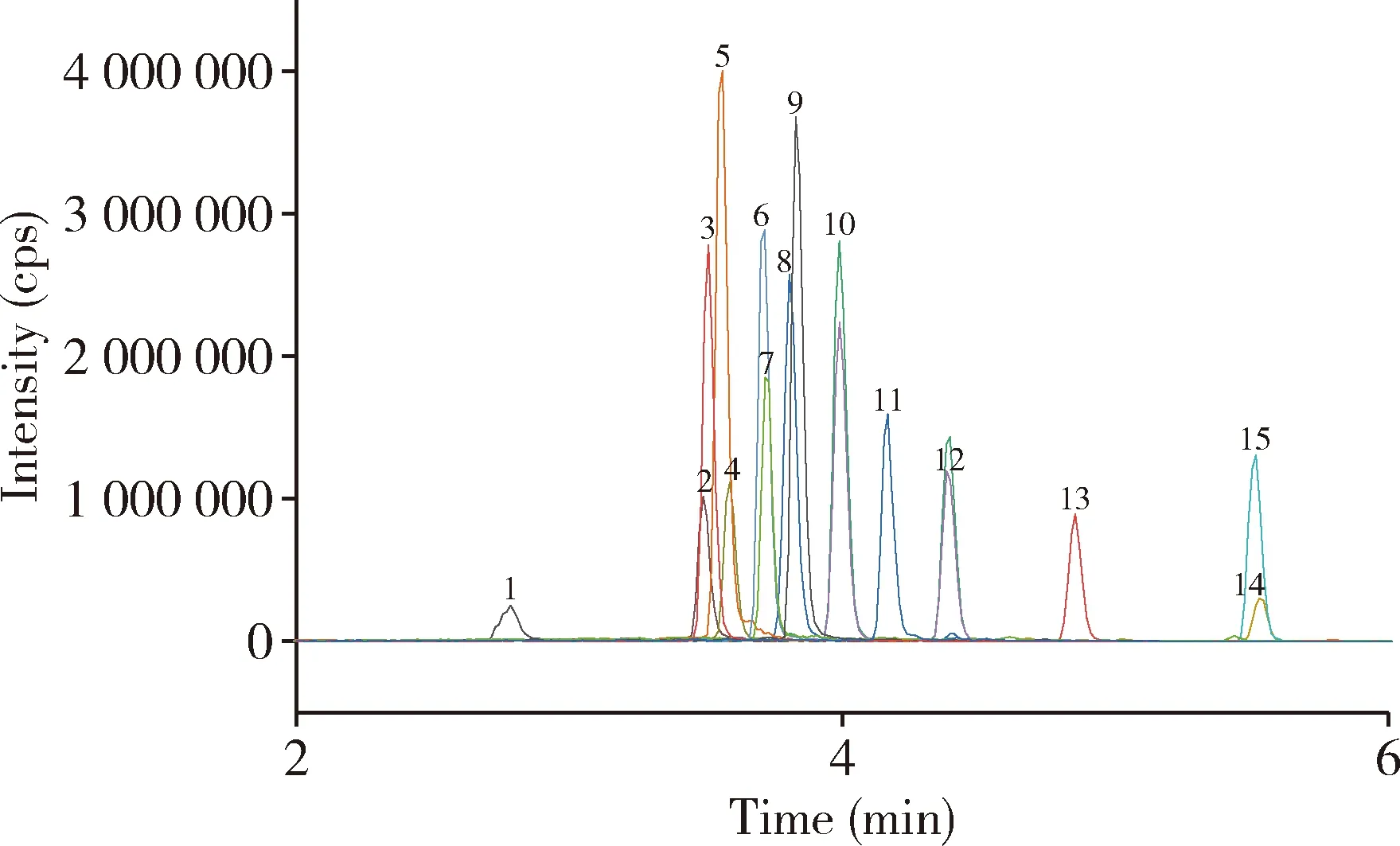
圖5 雞糞污基質匹配標準溶液色譜圖(濃度50 μg/kg)Fig 5 Chromatogram of matched standard solution of chicken manure matrix (concentration 50 μg/kg)注:1-SD、2-Nor.、3-O.、4-Cipro.、5-Pe.、6-Dano.、7-Lome.、8- SM2、9-Enro.、10-SMP、11-Sara.、12-SMM、13-SMZ、14-SQ、15-SDM。
圖6 空白牛糞污樣品溶液色譜圖Fig 6 Chromatogram of sample solution of blank cattle manure
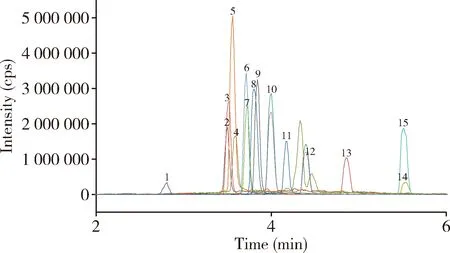
圖7 牛糞污基質匹配標準溶液色譜圖(濃度50 μg/kg)Fig 7 Chromatogram of matched standard solution of cattle manure matrix (concentration 50 μg/kg)1-SD、2-Nor.、3-O.、4-Cipro.、5-Pe.、6-Dano.、7-Lome.、8- SM2、9-Enro.、10-SMP、11-Sara.、12-SMM、13-SMZ、14-SQ、15-SDM。
圖8 空白羊糞污樣品溶液色譜圖Fig 8 Chromatogram of sample solution of blank sheep manure

圖9 羊糞污基質匹配標準溶液色譜圖(濃度50 μg/kg)Fig 9 Chromatogram of matched standard solution of sheep manure matrix (concentration 50 μg/kg)1-SD、2-Nor.、3-O.、4-Cipro.、5-Pe.、6-Dano.、7-Lome.、8- SM2、9-Enro.、10-SMP、11-Sara.、12-SMM、13-SMZ、14-SQ、15-SDM。
2.3 檢出限(LOD)和定量限(LOQ) 測定結果表明,豬、雞、牛、羊糞污中15種獸藥殘留檢測方法的檢出限為20.0 μg/kg,定量限為50.0 μg/kg。
2.4 準確度與精密度 分別取3批制備好的50、100、500 μg/kg低、中、高三個不同添加濃度各6個平行的加標樣品溶液,上機測定,計算回收率和RSD,結果見表4。

表4 豬、雞、牛、羊糞污中15種獸藥添加回收率與精密度Tab 4 Recovery and RSD of 15 veterinary drugs added to pig, chicken, cattle and sheep manure

續表
結果顯示,在50、100、500 μg/kg三個添加濃度下,豬、雞、牛、羊糞污中15種獸藥平均回收率為60.5%~115.5%,批內RSD(n=6)為1.2%~17.6%,批間RSD(n=3)為0.2%~17.6%。結果表明,該方法準確度、精密度良好。
2.5 樣品測定 隨機抽取從養殖場采回的8個畜禽糞污樣品,用已建立的分析方法進行測定,每份樣品取2個平行樣,結果取平均值(表5)。

表5 畜禽糞污樣品中15種獸藥殘留檢測結果(n=2)Tab 5 Detection results of 15 veterinary drug residues in livestock and poultry manure samples (n=2)
由表5結果可知,恩諾沙星檢出率75%,環丙沙星檢出率62.5%,磺胺間甲氧嘧啶和諾氟沙星檢出率均為25%,磺胺二甲基嘧啶、達氟沙星和氧氟沙星檢出率均為12.5%,其余組分未檢出。因數據有限無法體現山西省畜禽糞污獸藥殘留真實狀況,需積累更多的樣品數據,利用專業的統計學軟件進行全方位多角度地分析。
3 討論與結論
3.1 提取條件的選擇 目前抗菌藥物的提取主要采用有機試劑,部分使用無機試劑進行提取。甲醇、乙腈等有機試劑極性強,但是有一定的毒性作用,試驗過程中曾采用水相提取試劑,分別采用磷酸鹽緩沖液兩次提取以及EDTA溶液和磷酸鹽緩沖液分步提取的方式,后者較前者的回收率高,但ND代表未檢出或檢測結果低于檢出限。
是回收率未達到60%以上,考慮與提取試劑的使用順序有關,決定將EDTA和磷酸鹽緩沖液區分前后順序進行提取。結果:先用EDTA溶液再用磷酸鹽緩沖液提取時,整體回收率未達到60%以上,先用磷酸鹽緩沖液再用EDTA溶液提取時,磺胺類回收率達60%,氟喹諾酮仍然無法達到60%以上,因此,決定采用有機試劑進行提取,根據磺胺類和氟喹諾酮類抗菌藥物的理化特性,采用堿性有機試劑進行提取,并對提取液和震蕩時間進行考察。改變單一變量,以回收率作為評價指標,確定最終前處理方法。試驗過程中發現震蕩時間過長回收率略有降低,可能是震蕩時間過長導致抗菌藥物發生降解,影響提取效果,同涂宏建,錢詩穎等研究結果一致[8-9]。最終通過對比回收率確定將2%氨化乙腈+0.1 mol/L氫氧化鈉溶液(50∶50,V/V)作為提取液,震蕩5 min進行提取,回收率能夠滿足要求。
3.2 凈化條件的選擇 為了確定固相萃取方法步驟,課題組先后對固相萃取柱類型(C18柱、HLB3cc、HLB6cc)、復溶液、洗脫液以及淋洗液進行了一一考察。在保持其他前處理方法步驟一致的情況下,只改變單一變量,以回收率結果作為評價指標,選回收率高的變量為最終確定的方法。其中針對洗脫液的篩選優化,程家興驗證不同種類洗脫液對磺胺類和氟喹諾酮類的洗脫效果不同,結果酸性甲醇的洗脫效果總體較好[10]。但本試驗單獨采用酸性洗脫液或者堿性洗脫液,均不能使磺胺類和氟喹諾酮類的回收率達到“雙贏”的結果,經多次反復試驗,考慮到目標抗菌藥物具有酸堿兩性,最終采取酸性、堿性洗脫液分步洗脫的方式,兩類目標抗菌藥物的回收率均能同時滿足要求。最終確定最佳的凈化方式是提取液過HLB3cc固相萃取柱,5%甲醇水溶液淋洗,酸性洗脫液(1%甲酸甲醇)和堿性洗脫液(甲醇/乙酸乙酯/氨水,50/50/2,V/V/V)分步洗脫,濃縮,最后選用乙腈:0.1%甲酸水(20/80,V/V)進行復溶。
3.3 方法優化 本課題建立的檢測方法能兼顧磺胺類及氟喹諾酮類藥物均達到滿意的回收率,且方法穩定性、精密度良好。對比國內外抗菌藥物殘留液質聯用檢測方法[11-12],后期需要在確保雜質凈化效果的前提下,進一步簡化前處理步驟,提高方法的檢測限,以便能建立更加高效、準確、快速、靈敏的畜禽糞污抗菌藥殘留檢測方法。
本研究建立了一種SPE-UPLC-MS/MS同時適用于豬、雞、牛、羊糞污中7種磺胺類、8種氟喹諾酮類獸藥殘留檢測方法。通過考察,該方法準確度、精密度良好,方法可行。該方法的建立為后期進行山西省不同地區不同規模的養殖場糞污中的抗菌藥物檢測提供技術支撐,并為進一步研究獸藥在環境中的遷移,對環境的影響提供檢測方法和數據支持。

