2021ESC共識(shí)文件《急性深靜脈血栓的診斷和管理》解讀*
尹琪楠,韓麗珠,邊原,黃雪飛,雷洋,宋玉潔,童榮生
(四川省醫(yī)學(xué)科學(xué)院·四川省人民醫(yī)院/電子科技大學(xué)附屬醫(yī)院藥學(xué)部·個(gè)體化藥物治療四川省重點(diǎn)實(shí)驗(yàn)室,成都 610072)
自2017年歐洲心臟病學(xué)會(huì)(European Society of Cardiology,ESC)《急性深靜脈血栓的診斷和管理》[1]共識(shí)文件發(fā)布以來,涌現(xiàn)了大量關(guān)于急性深靜脈血栓診斷和治療的新證據(jù)。此外,非維生素K拮抗劑口服抗凝劑(non-vitamin K antagonists oral anticoagulants,NOACs)的問世,其益處和安全性受到進(jìn)一步重視。2021年7月,ESC主動(dòng)脈和外周血管疾病工作組以及肺循環(huán)與右心功能工作組整合數(shù)據(jù),指導(dǎo)臨床醫(yī)生對(duì)延長(zhǎng)抗凝、癌癥患者的治療、血栓后綜合征(post-thrombotic syndrome,PTS)的預(yù)防和治療、抗凝期間出血的管理以及妊娠期深靜脈血栓(包括激素相關(guān)的深靜脈血栓和血栓形成傾向)管理,對(duì)《急性深靜脈血栓的診斷和管理》共識(shí)文件進(jìn)行更新[2]。筆者在本文對(duì)更新內(nèi)容進(jìn)行解讀,以期為我國(guó)臨床急性深靜脈血栓的診斷和治療提供參考。
1 深靜脈血栓的危險(xiǎn)因素
一項(xiàng)社區(qū)靜脈血栓栓塞性疾病(venous thromboembolic disease,VTE)流行病學(xué)研究顯示,在高達(dá)50%的深靜脈血栓患者中,沒有預(yù)先發(fā)現(xiàn)可識(shí)別的危險(xiǎn)因素。深靜脈血栓的危險(xiǎn)因素主要分為3種,高危風(fēng)險(xiǎn)因素:近期重大手術(shù)[(骨科和神經(jīng)系統(tǒng))/重大創(chuàng)傷;<3個(gè)月內(nèi)因急性心臟病而住院治療;既往靜脈血栓栓塞;抗磷脂綜合征;活動(dòng)性癌癥(取決于癌癥類型和階段)/化療]。中危風(fēng)險(xiǎn)因素:膝關(guān)節(jié)關(guān)節(jié)鏡下手術(shù);靜脈導(dǎo)管;口服避孕/激素替代療法/體外受精(取決于激素的劑量和類型);妊娠或圍產(chǎn)期;炎癥和自身免疫性疾病;感染;活動(dòng)性癌癥(取決于癌癥類型和階段)/化療;充血性心力衰竭或呼吸衰竭;遺傳性血栓形成傾向;淺表靜脈血栓[距離隱股交界處(SFJ)或深靜脈交界處(PJ)>3 cm,且長(zhǎng)度>5 cm];卒中伴遺留偏癱/偏癱。輕危風(fēng)險(xiǎn)因素:臥床休息(>3 d)/制動(dòng)(長(zhǎng)時(shí)間坐位,如旅行);年齡;肥胖;淺表靜脈血栓;靜脈曲張/慢性靜脈功能不全;腹腔鏡手術(shù)[2]。目前發(fā)現(xiàn),新型冠狀病毒肺炎(corona virus disease 2019,COVID-19)是一個(gè)新的血栓中-高危風(fēng)險(xiǎn)因素,COVID-19感染可導(dǎo)致血液高凝狀態(tài),盡管進(jìn)行抗凝預(yù)防,但靜脈和動(dòng)脈血栓栓塞事件的發(fā)生率仍較高。近期的一項(xiàng)薈萃分析報(bào)告COVID-19住院患者的VTE發(fā)病率,18 093例總體VTE發(fā)病率為17.0%,其中病房患者為7.1%,重癥監(jiān)護(hù)病房為27.9%[3]。
2 深靜脈血栓的診斷和管理
2.1深靜脈血栓的診斷 與2017年的共識(shí)文件相比,診斷上沒有明顯的差異,圖1總結(jié)深靜脈血栓的評(píng)估和管理流程[2]。如果懷疑肺栓塞(pulmonary embolism,PE),可參考2019年ESC[4]關(guān)于PE診斷和管理的指南。
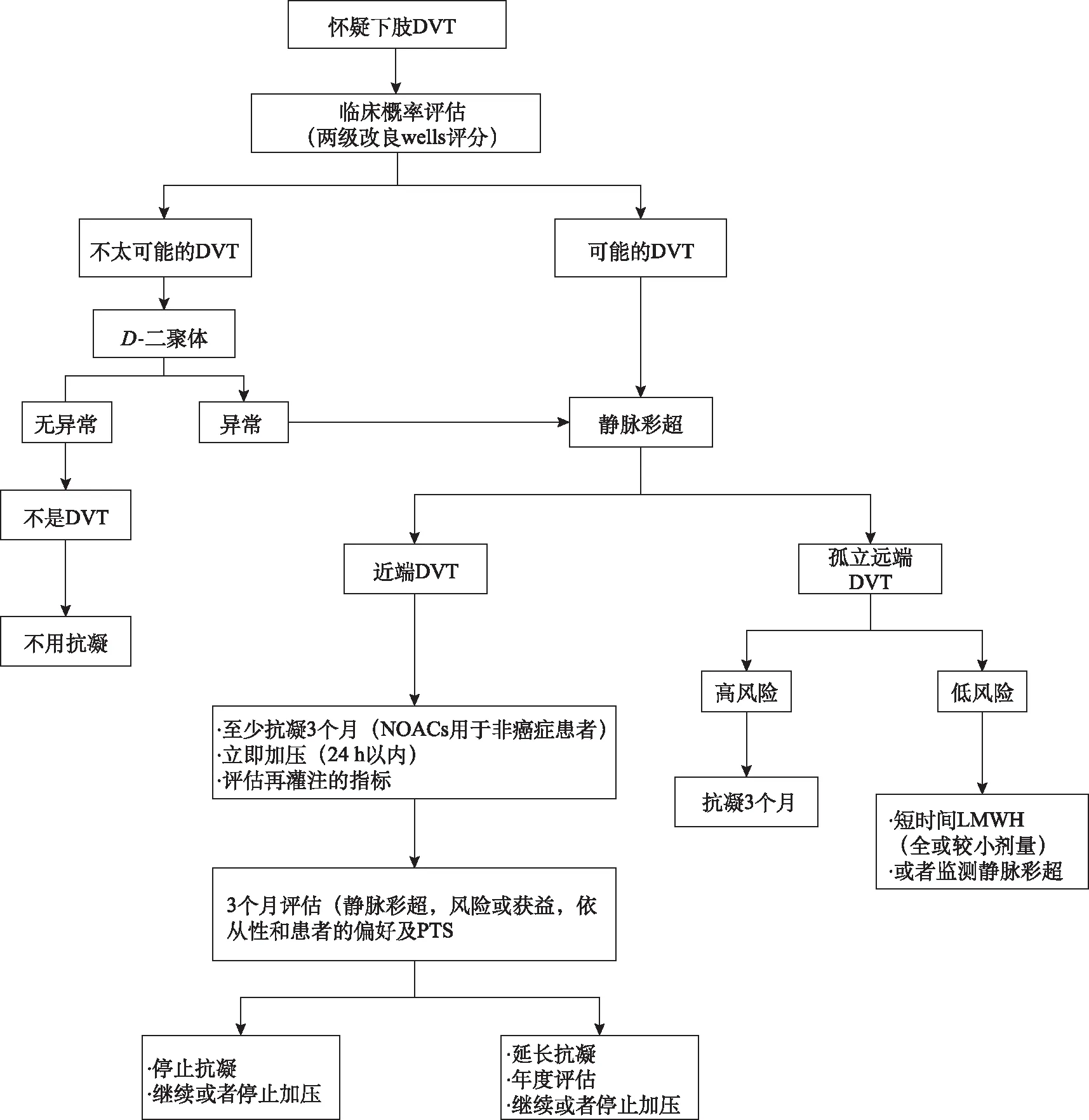
圖1 深靜脈血栓的評(píng)估和管理Fig.1 Assessment and management of DVT
2.2深靜脈血栓的管理 深靜脈血栓的管理分為初始階段(最初的5~21 d,3周內(nèi)),長(zhǎng)期階段(最初3個(gè)月),延長(zhǎng)階段(在最初3個(gè)月之后)。不同藥物管理方法不同。①阿哌沙班,初始階段劑量為10 mg,bid,7 d;長(zhǎng)期階段為5 mg,bid;延長(zhǎng)階段為5 mg,bid或2.5 mg,bid(超過6個(gè)月)。②達(dá)比加群,先給予低分子量肝素(low-molecular-weight heparin,LMWH)5~10 d,然后給予達(dá)比加群150 mg,bid或110 mg,bid[對(duì)于年齡>80歲或肌酐清除率(CLcr)30~50 mL·min-1者]。③艾多沙班,先給予LMWH5~10 d, 再給予艾多沙班60 mg,qd或30 mg,qd(對(duì)于CLcr 30~50 mL·min-1,聯(lián)合P-糖蛋白(P-gp)抑制劑或體質(zhì)量<60 kg者);④利伐沙班,初始階段劑量為15 mg,bid,21 d;長(zhǎng)期階段為20 mg,qd,延長(zhǎng)階段為20 mg,qd或10 mg,qd(超過6個(gè)月)。⑤維生素K拮抗劑(VKA),先給予LMWH5~10 d, 再給予VKA,目標(biāo)國(guó)際標(biāo)準(zhǔn)化比值(INR)2~3[2]。
2.2.1癌癥與非癌癥患者的抗凝策略 與其他慢性病種患者比較,癌癥患者抗凝策略有所不同。對(duì)于非癌癥患者,與2017年共識(shí)文件一致[1],共識(shí)建議在沒有禁忌證的情況下,NOACs應(yīng)首選作為一線抗凝治療。然而,對(duì)于COVID-19患者,特別是住院患者感染的急性期,由于感染可能導(dǎo)致多器官衰竭,發(fā)生快速臨床惡化的高風(fēng)險(xiǎn),共識(shí)建議首選普通肝素(unfractionate heparin,UFH)或LMWH。此外,抗病毒藥物、免疫調(diào)節(jié)劑或通過CYP3A4和P-gp途徑的藥物,與NOACs有潛在的藥物相互作用,共識(shí)建議NOAC避免使用。相反,在急性期后或出院后,在沒有藥物相互作用的情況下,NOACs仍然是首選。
對(duì)于癌癥患者,VTE治療的最初階段(前5~10 d)中,LMWH可能優(yōu)于UFH。對(duì)于長(zhǎng)期的治療,CLOT試驗(yàn)[5]首次證明LMWH比VKA更有效地降低癌癥患者VTE復(fù)發(fā)的風(fēng)險(xiǎn),主要出血風(fēng)險(xiǎn)差異無統(tǒng)計(jì)學(xué)意義。四項(xiàng)隨機(jī)臨床試驗(yàn)比較NOACs與LMWH對(duì)癌癥患者的療效和安全性[6-9],包含艾多沙班、利伐沙班、阿哌沙班分別與達(dá)肝素在癌癥患者中的比較,在這些研究中,NOACs在VTE復(fù)發(fā)方面至少不劣于LMWH(利伐沙班顯示出優(yōu)越性),出血事件顯著增加(阿哌沙班與達(dá)肝素比較除外,兩組出血發(fā)生率相似,并且提示,若胃腸道癌癥不切除,胃腸道出血也會(huì)增加,包括LWMH組),但僅局限于胃腸道癌癥患者。盡管癌癥患者進(jìn)行抗凝治療,但VTE復(fù)發(fā)率仍很高。使用VKA治療觀察到年復(fù)發(fā)率為20%,通過長(zhǎng)期使用LMWH可使其降低一半。根據(jù)現(xiàn)有的艾多沙班或利伐沙班證據(jù),使用NOACs可能會(huì)進(jìn)一步減少VTE復(fù)發(fā),但發(fā)生大出血的風(fēng)險(xiǎn)增加,尤其是在胃腸道癌癥患者中。阿哌沙班至少有和LMWH一樣的安全性和有效性,但不推薦在原發(fā)性或轉(zhuǎn)移性腦癌或急性白血病患者中使用,因?yàn)檫@些患者不包括在Caravaggio研究[10]中。在具有NOACs藥物相互作用及上消化道手術(shù)影響NOACs吸收的患者中,更多推薦LMWH。此外,嚴(yán)重血小板減少以及惡心、嘔吐患者也應(yīng)使用LMWH。總之,抗凝藥物應(yīng)根據(jù)患者的特點(diǎn)和偏好以及癌癥的特點(diǎn)和治療方法進(jìn)行個(gè)性化治療,見圖2。
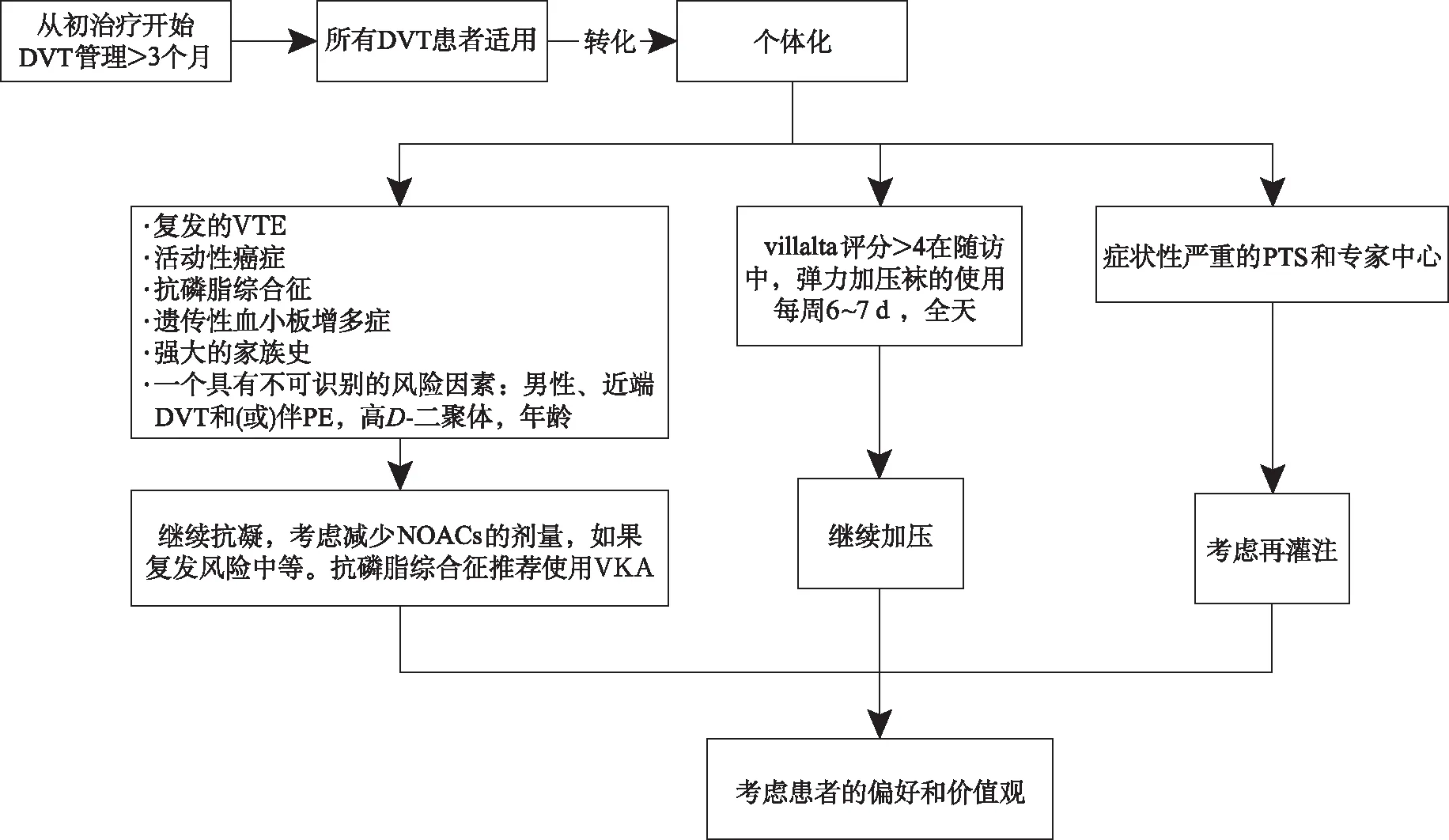
圖2 深靜脈血栓管理的轉(zhuǎn)變Fig.2 Changes in the management of DVT
2.2.2孤立性遠(yuǎn)端DVT(isolated distal DVT,IDDVT)患者的抗凝策略 IDDVT是否應(yīng)接受抗凝治療仍存在爭(zhēng)議。與近端深靜脈血栓相比,低風(fēng)險(xiǎn)患者對(duì)IDDVT的VTE復(fù)發(fā)風(fēng)險(xiǎn)較低,而對(duì)高危患者則相似。IDDVT患者VTE復(fù)發(fā)的危險(xiǎn)因素分類如下,低風(fēng)險(xiǎn)因素:石膏、固定、創(chuàng)傷、長(zhǎng)途旅行等,在避孕或替代激素治療期間(如果治療已中斷)。高風(fēng)險(xiǎn)因素:既往VTE、男性、年齡>50歲、活躍的癌癥、無誘因的IDDVT、持續(xù)制動(dòng)。IDDVT涉及:腘靜脈三支和(或)>1根小腿靜脈,雙側(cè)的,存在誘發(fā)性疾病(如炎癥性腸病),遺傳性血栓形成傾向,軸向與肌肉的IDDVT。CACTUS試驗(yàn)[11]表明,在低風(fēng)險(xiǎn)IDDVT患者中,LMWH和安慰藥的癥狀VTE發(fā)生率比較差異無統(tǒng)計(jì)學(xué)意義(3.3%和5.4%,P=0.54);LMWH組出血發(fā)生率更高(4%和0%,P=0.03)。IDDVT的管理應(yīng)該是個(gè)性化,VTE高危患者可用全劑量抗凝劑治療至少3個(gè)月,與近心端DVT治療相似,近端DVT停止抗凝劑后VTE復(fù)發(fā)的風(fēng)險(xiǎn)見表1。LMWH治療短療程(4~6周)、小劑量或靜脈彩色超聲監(jiān)測(cè)可能對(duì)低風(fēng)險(xiǎn)患者是有效和安全的。在沒有臨床試驗(yàn)的情況下,最近兩個(gè)前瞻性研究表明,NOACs對(duì)IDDVT患者具有證據(jù)意義的有效性和安全性[12-13]。
2.3延長(zhǎng)階段的管理 在仔細(xì)評(píng)估個(gè)體復(fù)發(fā)風(fēng)險(xiǎn)、出血、患者依從性和偏好以及長(zhǎng)期深靜脈驗(yàn)證檢查并發(fā)癥的影響后,應(yīng)確定最初3個(gè)月階段后的抗凝治療。治療停止后第1年復(fù)發(fā)較高,隨著時(shí)間的推移而減少,但不會(huì)完全無風(fēng)險(xiǎn)。有60% DVT和40% PE患者出現(xiàn)復(fù)發(fā)性VTE。一旦停止抗凝治療,VTE復(fù)發(fā)風(fēng)險(xiǎn)因指標(biāo)事件特征不同而不同,無可識(shí)別危險(xiǎn)因素的患者VTE復(fù)發(fā)風(fēng)險(xiǎn)比有可識(shí)別危險(xiǎn)因素的患者高出1倍以上,見表1。傳統(tǒng)上,如果復(fù)發(fā)風(fēng)險(xiǎn)1年<5%,5年<15%,則停止抗凝治療是合適的。延長(zhǎng)抗凝治療可減少80%~90%的復(fù)發(fā),但面臨不可預(yù)測(cè)的出血并發(fā)癥的風(fēng)險(xiǎn)。尤其是在低出血風(fēng)險(xiǎn)患者和低劑量使用的患者中,延長(zhǎng)NOACs治療相關(guān)的大出血風(fēng)險(xiǎn)低于VKA。已有臨床預(yù)測(cè)模型來檢測(cè)低復(fù)發(fā)風(fēng)險(xiǎn)的患者,然而,它們?cè)诘统鲅L(fēng)險(xiǎn)的NOACs時(shí)代的作用存在爭(zhēng)議。與高出血風(fēng)險(xiǎn)相關(guān)的因素包括:老年、癌癥、腎功能或肝功能不全,抗血栓性藥物以及既往大出血史。
2.4非癌癥和癌癥患者的抗凝治療持續(xù)時(shí)間 對(duì)于近端深靜脈血栓(伴有或不伴有PE),如果復(fù)發(fā)風(fēng)險(xiǎn)較低,3個(gè)月的抗凝治療是最佳選擇。如果出血風(fēng)險(xiǎn)較低,無限期抗凝治療是高風(fēng)險(xiǎn)復(fù)發(fā)患者的最佳選擇,未確定風(fēng)險(xiǎn)因素和低出血風(fēng)險(xiǎn)的深靜脈血栓患者可在最初3個(gè)月后延長(zhǎng)抗凝時(shí)間。將VTE分為有誘因和無誘因來進(jìn)行指導(dǎo)治療似乎很簡(jiǎn)單,但研究表明,有誘因的VTE患者比無VTE病史患者復(fù)發(fā)風(fēng)險(xiǎn)更高,延長(zhǎng)抗凝也沒有顯示獲益,因此,需要個(gè)性化進(jìn)行治療管理。在沒有禁忌證的情況下,在非癌癥患者中應(yīng)首選NOACs作為一線延長(zhǎng)抗凝治療,但對(duì)于抗磷脂綜合征患者只推薦VKA。在中等復(fù)發(fā)風(fēng)險(xiǎn)的患者中,兩個(gè)隨機(jī)對(duì)照組比較“全劑量和減少劑量阿哌沙班與安慰劑”[14]以及“全劑量和減少劑量的利伐沙班與阿司匹林”[15]表明,減少劑量的阿哌沙班與全劑量有效性相當(dāng),與安慰劑或阿司匹林的出血風(fēng)險(xiǎn)相當(dāng)。對(duì)于癌癥患者,由于復(fù)發(fā)風(fēng)險(xiǎn)較高,應(yīng)根據(jù)抗凝持續(xù)時(shí)間進(jìn)行單獨(dú)評(píng)估,包括癌癥類型、分期、活動(dòng)、化療、預(yù)期壽命等,以及癌癥的活躍或緩解狀態(tài)。需要定期對(duì)持續(xù)抗凝治療的風(fēng)險(xiǎn)效益比進(jìn)行重新評(píng)估,因?yàn)閺?fù)發(fā)和出血的風(fēng)險(xiǎn)可能隨時(shí)間而異。長(zhǎng)程的抗凝劑可能包括口服抗凝劑。服用VKA的癌癥患者(INR達(dá)標(biāo))的VTE復(fù)發(fā)需要更改為L(zhǎng)MWH。使用LMWH的患者VTE復(fù)發(fā)可增加劑量,特定患者可選擇腔靜脈過濾器。關(guān)于深靜脈血栓癌癥患者長(zhǎng)期治療NOACs的數(shù)據(jù)非常有限。
2.5PTS的預(yù)防與處理 PTS是最常見的慢性DVT并發(fā)癥,30%~50%患者在近端DVT后2年內(nèi)發(fā)生。5%~10%患者PTS癥狀很嚴(yán)重[16]。PTS的病理生理學(xué)尚未完全闡明。既往同側(cè)深靜脈血栓檢查、髂靜脈位置和殘余靜脈阻塞是PTS最重要的危險(xiǎn)因素,因此強(qiáng)調(diào)個(gè)性化的治療管理方式。幾十年來,彈性壓縮襪一直是PTS管理的支柱,基于兩個(gè)開放標(biāo)簽隨機(jī)對(duì)照試驗(yàn)[17-18],均顯示PTS發(fā)展的相對(duì)風(fēng)險(xiǎn)降低50%。最近的兩項(xiàng)臨床試驗(yàn)表明,良好的依從性(每周至少6 d)和高依從率(>80%)與顯著降低PTS發(fā)生率相關(guān),并且建議彈性壓縮襪的使用時(shí)間可以是個(gè)性化的[19-20]。
2.6隨訪 對(duì)患者進(jìn)行隨訪,避免復(fù)發(fā)風(fēng)險(xiǎn)以及深靜脈血栓相關(guān)和抗凝相關(guān)并發(fā)癥,回顧治療、實(shí)驗(yàn)室檢查和患者信息。在抗凝期間,每年進(jìn)行評(píng)估,監(jiān)測(cè)調(diào)節(jié)抗凝治療的因素(腎功能不全、懷孕、體質(zhì)量減輕、嚴(yán)重的高血壓)。應(yīng)評(píng)估治療的依從性以及效益/風(fēng)險(xiǎn)平衡。應(yīng)對(duì)PTS的發(fā)展情況進(jìn)行評(píng)估。在停止抗凝治療之前,靜脈彩超評(píng)估有助于確定基線殘余靜脈血栓,不是推動(dòng)抗凝治療的持續(xù)時(shí)間,而是在出現(xiàn)新癥狀時(shí)區(qū)分新舊血栓。抗凝停藥后,應(yīng)提供有關(guān)未來高血栓風(fēng)險(xiǎn)的信息。
3 特殊情況
3.1妊娠期深靜脈血栓 懷孕使VTE的風(fēng)險(xiǎn)增加4~5倍[21]。股動(dòng)脈和(或)(孤立的)髂靜脈血栓通常發(fā)生于妊娠患者,主要是由于解剖學(xué)原因出現(xiàn)在左側(cè)。42%女性妊娠相關(guān)DVT有發(fā)生PTS的風(fēng)險(xiǎn),7%發(fā)生嚴(yán)重的PTS風(fēng)險(xiǎn)[22],妊娠期深靜脈血栓的危險(xiǎn)因素包括:既往因素(既往的VTE,嚴(yán)重的血栓形成傾向,靜脈曲張,吸煙,體質(zhì)量指數(shù)>30 kg·(m2)-1,系統(tǒng)性紅斑狼瘡);產(chǎn)科特定的危險(xiǎn)因素(劇吐、剖宮產(chǎn)尤其是緊急情況、早產(chǎn)、子癇前期、輔助生育);其他危險(xiǎn)因素(產(chǎn)后感染或大出血、輸液、制動(dòng))。治療包括治療劑量肝素(不穿過胎盤,母乳中不明顯),優(yōu)先選擇LMWH而不是UFH,推薦每日一次,不建議常規(guī)進(jìn)行抗Xa監(jiān)測(cè)和劑量調(diào)整(極端體質(zhì)量或腎功能不全者可考慮)。是否可以在妊娠期間的將抗凝劑減量作為二級(jí)預(yù)防尚缺乏證據(jù)。圍產(chǎn)期需要多學(xué)科團(tuán)隊(duì)進(jìn)行,抗凝治療應(yīng)持續(xù)產(chǎn)后至少6周,并且直到至少3個(gè)月的抗凝治療。在母乳喂養(yǎng)的婦女中,可以繼續(xù)給予LMWH或切改用VKA[給母乳喂養(yǎng)的新生兒服用少量維生素K(每周1 mg)]。在無安全數(shù)據(jù)的情況下,在妊娠/哺乳期禁止使用NOACs。
3.2口服避孕藥 使用復(fù)方口服避孕藥增加VTE的風(fēng)險(xiǎn),在最初幾個(gè)月風(fēng)險(xiǎn)最高,持續(xù)使用期間比非使用者增加3~8倍[23]。血栓形成傾向的存在進(jìn)一步增加激素相關(guān)VTE的風(fēng)險(xiǎn),激素相關(guān)VTE女性的VTE復(fù)發(fā)風(fēng)險(xiǎn)低于無誘因VTE女性的風(fēng)險(xiǎn)[HR=0.5,95%CI(0.3,0.8)][24]。因此,大多數(shù)女性接受3個(gè)月的治療是足夠的。如果同時(shí)使用治療性抗凝劑,可以在不增加復(fù)發(fā)風(fēng)險(xiǎn)的情況下使用口服避孕藥。然而,在口服避孕藥停藥后,DVT的風(fēng)險(xiǎn)增加仍持續(xù)3個(gè)月,因此有必要使用低VTE風(fēng)險(xiǎn)的避孕方法作為替代。
3.3上肢DVT(UEDVT) UEDVT占所有DVT的10%,每年發(fā)生率為(0.4~1.0)/10 000人[25-26]。由于中央靜脈導(dǎo)管、心臟起搏器和除顫器的使用不斷增加,發(fā)病率增加。20%~30%的UEDVT是由解剖異常或持續(xù)的體力勞動(dòng)引起[27]。繼發(fā)性靜脈血栓包括靜脈導(dǎo)管和器械相關(guān)并發(fā)癥、癌癥、懷孕以及近期臂/肩手術(shù)或創(chuàng)傷。靜脈彩超是首選的診斷檢查。除特定嚴(yán)重病例外,不建議使用溶栓。
3.4腦靜脈血栓(cerebral vein thrombosis,CVT)患者 一項(xiàng)隨機(jī)臨床試驗(yàn)[28]評(píng)估NOACs對(duì)120例CVT患者的療效和安全性,患者在使用LMWH或UFH治療5~15 d后,接受達(dá)比加群(150 mg,bid)或調(diào)整劑量的VKA 24周。研究發(fā)現(xiàn),兩組在復(fù)發(fā)VTE和出血方面差異無統(tǒng)計(jì)學(xué)意義,表明兩種藥物在CVT患者中可能安全有效。
3.5電生理相關(guān)手術(shù)過程中的靜脈血栓栓塞 股靜脈為電生理相關(guān)手術(shù)中心導(dǎo)管插入的選擇性途徑。然而,此類手術(shù)VTE風(fēng)險(xiǎn)的數(shù)據(jù)有限。在最近的一篇系統(tǒng)綜述[29]中,非房顫和房顫手術(shù)后DVT的合并發(fā)生率分別為0.24%[95%CI(0.08%,0.39%)]和0%[95%CI(0,0.0003%)],后者的較低發(fā)生率與術(shù)中系統(tǒng)使用抗凝治療有關(guān),房顫(1%)比非房顫(0.3%)消融更頻繁。此外,包括歐洲心律學(xué)會(huì)(EHRA)[30]在內(nèi)的共識(shí)文件支持在干預(yù)期間維持口服抗凝劑(如果已經(jīng)不足),按程序使用肝素和術(shù)后抗凝。在其他手術(shù)中,特別是在不需要抗凝的右側(cè)腔室,在手術(shù)過程中使用肝素是可選的,需要進(jìn)行進(jìn)一步研究以平衡血栓與出血風(fēng)險(xiǎn)。
4 抗凝期間出血的管理
接受嚴(yán)重大出血治療的患者應(yīng)靜脈注射維生素K和凝血酶原復(fù)合物濃縮物(PCCs),以快速逆轉(zhuǎn)抗凝血。在接受NOACs治療的患者中,依達(dá)塞珠單抗是目前在歐洲可用于直接因子Ⅱa抑制劑達(dá)比加群的特異性逆轉(zhuǎn)劑。直接因子Ⅹa抑制劑的逆轉(zhuǎn)劑是andexanet alfa,這是一種人類凝血因子Xa的重組改構(gòu)產(chǎn)物,目前被美國(guó)食品藥品管理局(FDA)和歐洲藥物管理局(EMA)批準(zhǔn)用于急性大出血患者,如果沒有逆轉(zhuǎn)劑,使用直接因子Ⅹa抑制劑和危及生命的出血治療的患者應(yīng)接受PCCs,目前還沒有關(guān)于氨甲環(huán)酸在直接因子Ⅹa抑制劑和危及生命的出血患者治療的有效性和安全性的數(shù)據(jù)。
5 結(jié)束語
本文分別從深靜脈血栓的風(fēng)險(xiǎn)評(píng)估,癌癥與非癌癥患者的管理,特殊情況的處理,抗凝出血的管理等4個(gè)方面,詳細(xì)解讀該共識(shí)文件,以期為臨床提供參考。本共識(shí)文件強(qiáng)調(diào)個(gè)體化的治療管理模式,并對(duì)抗凝藥物的選擇予以相應(yīng)的推薦,雖然納入較多新的文獻(xiàn),提供更多新的數(shù)據(jù),也提出一些新的觀點(diǎn)與理念,但是仍然存在一些無法解決的具體問題,需要相關(guān)的醫(yī)務(wù)人員進(jìn)行更多的試驗(yàn)與相關(guān)的研究,來提供更強(qiáng)力的臨床指導(dǎo)推薦。

