硝苯地平緩釋片在中國健康受試者體內(nèi)的生物等效性研究*
余恒毅,區(qū)淑蘊,劉東,梁標(biāo)志,高永堅,任秀華
(1.華中科技大學(xué)同濟醫(yī)學(xué)院附屬同濟醫(yī)院藥學(xué)部,武漢 430030;2.華中科技大學(xué)同濟醫(yī)學(xué)院附屬同濟醫(yī)院Ⅰ期臨床試驗研究室,武漢 430030;3.國藥集團廣東環(huán)球制藥有限公司,佛山 528305)
硝苯地平是具有代表性的鈣拮抗劑藥物,為治療心絞痛和高血壓的首選藥物之一,臨床上通常使用緩控釋制劑[1]。前期研究以日本拜耳藥品株式會社生產(chǎn)的Adalat?-L10為參比制劑(R),對國藥集團廣東環(huán)球制藥有限公司已上市的硝苯地平緩釋片(Ⅰ)T1進行質(zhì)量一致性評價,體外釋放度研究結(jié)果表明制劑T1與參比制劑R體外釋放行為不一致,修改處方工藝后的制劑T2與參比制劑R體外釋放曲線一致[2]。筆者在本文就該公司已上市的硝苯地平緩釋片(Ⅰ)T1、修改處方工藝后的制劑T2與參比制劑R在中國健康受試者體內(nèi)的藥代動力學(xué)及生物等效性進行研究。
1 材料與對象
1.1材料
1.1.1試藥 硝苯地平緩釋片(Ⅰ)(受試制劑T1,國藥集團廣東環(huán)球制藥有限公司,批號:140101,規(guī)格:每片10 mg);變更處方工藝后硝苯地平緩釋片(Ⅰ)(受試制劑T2,國藥集團廣東環(huán)球制藥有限公司,批號:20140201,規(guī)格:每片10 mg);硝苯地平緩釋片(參比制劑R,商品名:Adalat?-L10,日本拜耳藥品株式會社,批號:JPR4392,規(guī)格:每片10 mg);硝苯地平對照品(中國食品藥品檢定研究院,批號:100338-201404,含量:99.0%);硝苯地平-d6對照品(內(nèi)標(biāo),加拿大Toronto Research Chemicals公司,批號:457002,含量:98%);HPLC級乙腈、甲醇購于美國TEDIA公司,水為實驗室制備超純水。
1.1.2儀器 LC-20AD型高效液相色譜儀(日本島津)。API4000 Plus三重四級桿質(zhì)譜儀(美國愛博才思)。MS105DU型電子分析天平(瑞士梅特勒-托利多)。Vortex-2 GENIE混合器(美國Scientific Industries)。Neofuge 13R型高速冷凍離心機(香港力康)。Scientific Heraeus Multifuge X1低溫臺式離心機(德國賽默飛世爾)。Elga Purelab Felx 3型超純水機(英國ELGA);DW-86L626型立式超低溫保存箱(青島海爾)。
1.2受試者選擇 本試驗研究方案與知情同意書等研究文件獲得華中科技大學(xué)同濟醫(yī)學(xué)院倫理委員會批準(zhǔn),所有受試者自愿簽署知情同意書。
1.2.1入組標(biāo)準(zhǔn) ①男性;②年齡18~40歲;③體質(zhì)量≥50 kg,且體質(zhì)量指數(shù)在19~24 kg·(m2)-1;④試驗前2周內(nèi)未服用其他任何藥物。
1.2.2排除標(biāo)準(zhǔn) ①經(jīng)生命體征檢查、體格檢查、實驗室檢查結(jié)果異常且有臨床意義者;②既往有嚴重疾病史者;③篩選前3個月內(nèi)參加過其他藥物臨床試驗者;④對研究藥物及同類藥物過敏者;⑤有藥物濫用史,嗜煙、嗜酒者;⑥試驗前1個月內(nèi)獻血者;⑦研究者認為不能入組的其他情況者。
1.3試驗入組與完成情況 空腹試驗共篩選104名男性受試者,30例合格入組。其中2例脫落(1例于第1周期給藥前主動退出試驗、1例于第2周期給藥前主動退出試驗),28例完成試驗,年齡(23.86±2.79)歲,身高(172.14±6.07)cm,體質(zhì)量(63.96±7.13)kg,體質(zhì)量指數(shù)(19.30~23.77)kg·(m2)-1。
餐后試驗共篩選124名男性受試者,30例合格入組。其中1例脫落(第2周期給藥前主動退出試驗),29例完成試驗,年齡(24.07±2.98)歲,身高(172.83±6.87)cm,體質(zhì)量(64.69±7.28)kg,體質(zhì)量指數(shù)(19.05~23.99)kg·(m2)-1。
2 方法與結(jié)果
2.1給藥方案與血樣采集 本研究采用單中心、隨機、開放、三周期、三序列、三交叉單次給藥試驗設(shè)計。空腹試驗和餐后試驗各入組30名健康男性受試者。30名受試者隨機分成3組(R-T1-T2、T1-T2-R和T2-R-T1組),每組10人,每周期分別在空腹或餐后狀態(tài)下服用硝苯地平緩釋片10 mg,清洗期為7 d。
受試者于每周期給藥前1 d入住I期病房,統(tǒng)一進食晚餐后禁食過夜(空腹至少10 h),服藥前2 h內(nèi)禁水。空腹試驗受試者在空腹?fàn)顟B(tài)下口服試驗藥物10 mg,溫水200 mL送服。餐后組受試者在服藥前30 min內(nèi)完成高脂餐進食[每份標(biāo)準(zhǔn)餐含能量3352~4190 J(1 cal=4.19 J),其中蛋白質(zhì)約628.5J、碳水化合物1047.5 J、脂肪2095~2514 J],在餐后狀態(tài)下口服試驗藥物10 mg,溫水200 mL送服。在服藥后2 h內(nèi)受試者禁水,服藥后避免劇烈運動。服藥后4 h和10 h后進食標(biāo)準(zhǔn)中餐和晚餐,試驗期間受試者禁止吸煙、飲用酒類和咖啡類飲料。
研究人員在受試者服藥前1 h、服藥后2,4 h測量其生命體征(包括體溫、脈搏、呼吸、血壓),并密切觀察可能出現(xiàn)的低血壓反應(yīng)(例如頭暈、頭痛、臉色蒼白、直立性眩暈、四肢冷、心悸等)及其他不良反應(yīng),在出組時進行實驗室檢查,心電圖檢查。
采血點設(shè)置為每周期的0 h(給藥前1 h)及給藥后0.5,1,1.5,2,2.5,3,4,5,6,9,12,24 h,研究護士于避光條件下采集受試者肘靜脈血約4 mL,將血樣置于含肝素鈉抗凝劑的真空采血管中輕柔顛倒混勻,置于低溫離心機中離心10 min(4 ℃、2260×g)。分離血漿于凍存管中,置于-80 ℃超低溫冰箱貯存待測。
2.2測定方法與樣品處理 采用液相色譜-串聯(lián)質(zhì)譜法(LC-MS/MS)法。因硝苯地平光不穩(wěn)定[3],溶液配制與血樣處理相關(guān)操作均在黃光燈下進行(波長570~580 nm)。
2.2.1色譜條件 色譜柱:Dikma Diamonsil C18(2.1 mm×150 mm,5 μm);流動相A:水;流動相B:乙腈,梯度洗脫程序: 0~0.5 min,20%B;0.51~1.9 min,20%→90%B;1.91~3.0 min,90%B;3.01~3.1 min,90%→20%B;3.11~5.0 min,20%B;流速:0.36 mL·min-1;柱溫:40 ℃;自動進樣器溫度:4 ℃;進樣量:10 μL。
2.2.2質(zhì)譜條件 離子源為電噴霧離子化源(ESI),正離子模式檢測,毛細管電壓5.5 kV,源溫度550 ℃;Curtain gas 25 L·min-1,Gas1 40 L·min-1,Gas2 40 L·min-1。掃描方式為多反應(yīng)監(jiān)測:硝苯地平檢測離子對為m/z347.2→315.1(DP 55V,EP 10,CE 12 eV,CXP 15 V);硝苯地平-d6(氘代內(nèi)標(biāo))檢測離子對m/z353.2→257.2(DP 55V,EP 10,CE 26 eV,CXP 10 V)。
2.2.3血漿樣品處理 于1.5 mL棕色EP管中加入血漿樣品200 μL、內(nèi)標(biāo)工作液20 μL(硝苯地平-d6:1200 ng·mL-1)和乙腈600 μL,渦旋混合1 min后,于4 ℃、12 000×g條件下離心10 min,取上清液200 μL進樣分析。
2.3方法學(xué)考察與評價
2.3.1專屬性 取6例健康志愿者的空白血漿,每例受試者的空白血漿分別不加硝苯地平與內(nèi)標(biāo)、僅加定量下限(LLOQ)濃度的硝苯地平、僅加內(nèi)標(biāo),按照“2.2.3”項進行操作后進樣、分析。結(jié)果見圖1。在硝苯地平及其內(nèi)標(biāo)的離子通道及保留時間窗中(均為3.78 min),血漿內(nèi)源性物質(zhì)的峰面積均小于硝苯地平LLOQ峰面積的20%,小于內(nèi)標(biāo)峰面積的5%,顯示血漿內(nèi)源性物質(zhì)對樣品測定無干擾,方法專屬性好。
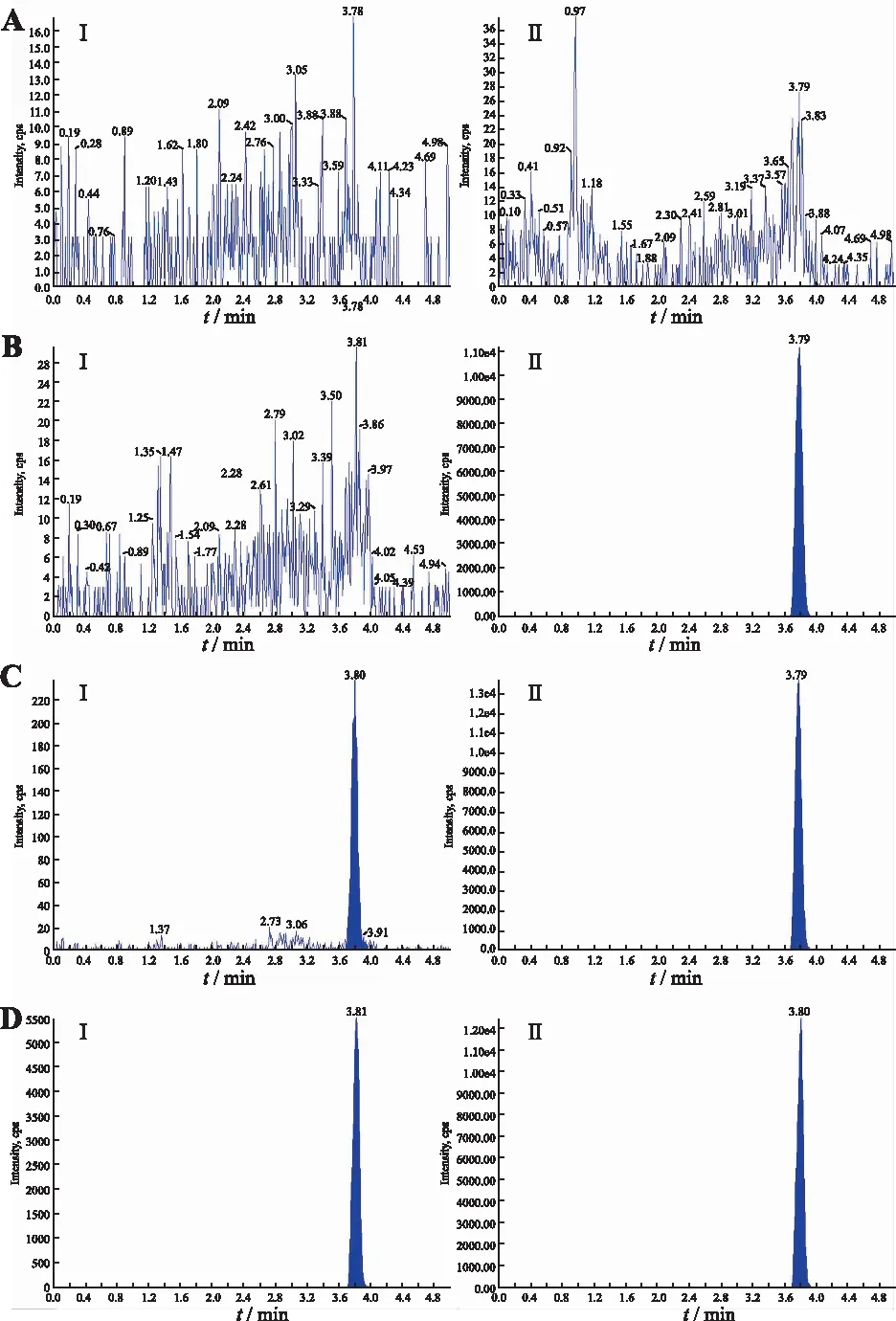
A.空白血漿樣本(不加內(nèi)標(biāo));B.空白血漿樣本(加內(nèi)標(biāo));C.定量下限(0.39 ng.mL-1)質(zhì)控樣本;D.健康受試者服藥后樣本;I為硝苯地平;II為硝苯地平-d6。圖1 血漿中硝苯地平及硝苯地平-d6的典型色譜圖A.blank plasma (without IS);B.blank plasma with nifedipine-d6 (IS);C.nifedipine at LLOQ (0.39 ng·mL-1) and IS;D.sample after administration of 10 mg nifedipine sustained-release tablet;I .nifedipine ; II nifedipine-d6.Fig.1 Typical multiple reaction monitoring chromatograms of nifedipine and nifedipine-d6
2.3.2標(biāo)準(zhǔn)曲線與定量下限 標(biāo)準(zhǔn)曲線血漿樣品(0.39,1.56,3.90,7.80,39.00,78.00 ng·mL-1)按“2.2.3”項下處理后進樣,以硝苯地平與內(nèi)標(biāo)峰面積之比為縱坐標(biāo)(Y),以硝苯地平濃度為橫坐標(biāo)(X),采用加權(quán)(ω=1/X2)最小二乘法進行線性回歸得回歸方程為Y=0.039 4X-0.000 212(R2=0.997 3)。結(jié)果表明,硝苯地平在0.39~78.00 ng·mL-1范圍內(nèi)線性良好,定量下限為0.39 ng·mL-1。
2.3.3精密度及準(zhǔn)確度 質(zhì)控血漿樣品(0.78,6.24,62.40 ng·mL-1)及定量下限血漿樣品(0.39 ng·mL-1)按“2.2.3”項下處理后進樣,于連續(xù)2 d內(nèi)完成3次檢測,每個濃度水平配制5個重復(fù),使用隨行標(biāo)準(zhǔn)曲線計算各質(zhì)控樣品及定量下限的濃度,計算批內(nèi)、批間精密度及準(zhǔn)確度,結(jié)果顯示,定量下限及所有質(zhì)控樣品的批內(nèi)及批間準(zhǔn)確度均值在標(biāo)示值的±15%范圍內(nèi),批內(nèi)及批間變異系數(shù)均在15%范圍內(nèi)[4]。
2.3.4提取回收率 質(zhì)控血漿樣品(0.78,6.24,62.40 ng·mL-1)按“2.2.3”項下處理后進樣,每個濃度水平配制5個重復(fù)。配制含空白血漿樣品提取液的化合物溶液使其濃度與質(zhì)控樣品進樣濃度相同,比較兩者峰面積比來評價化合物的提取回收率。結(jié)果顯示,低、中、高3個質(zhì)量濃度水平的提取回收率分別為(110.2±4.1)%、(91.9±3.0)%和(98.8±3.8)%,硝苯地平提取過程對真實結(jié)果影響較小。
2.3.5基質(zhì)效應(yīng) 分別配制同質(zhì)控樣品進樣濃度相同的含空白血漿樣品提取液的化合物溶液及同質(zhì)控樣品進樣濃度相同的化合物溶液,進樣測定后以兩者經(jīng)內(nèi)標(biāo)校正后的比值來比較硝苯地平的基質(zhì)效應(yīng)。結(jié)果顯示,低、高濃度質(zhì)控樣品的校正后基質(zhì)效應(yīng)分別為99.9%和99.8%,變異系數(shù)在15%范圍內(nèi),空白血漿中內(nèi)源性物質(zhì)不影響硝苯地平的測定。
2.3.6穩(wěn)定性試驗 取低、高質(zhì)控血漿樣品(0.78,62.40 ng·mL-1),每個濃度水平設(shè)5個重復(fù),分別考察質(zhì)控血漿室溫放置24 h,-70 ℃條件凍融循環(huán)3次,及在-70 ℃條件下放置30,60 d的穩(wěn)定性。質(zhì)控血漿樣品(0.78,62.40 ng·mL-1)按“2.2.3”項下處理后,置于儀器進樣盤中24 h考察其穩(wěn)定性。結(jié)果顯示,每一濃度的均值與標(biāo)示濃度的偏差在±15%范圍內(nèi),表明硝苯地平血漿樣品在室溫、冷凍保存、反復(fù)凍融條件下穩(wěn)定性良好。
2.4統(tǒng)計學(xué)方法 采用DAS 2.1軟件,以非房室數(shù)學(xué)模型分析方法估算受試制劑和參比制劑的藥動學(xué)參數(shù),主要參數(shù)包括出峰時間(tmax)(實測值)、峰濃度(Cmax)(實測值)、血漿濃度-時間曲線下面積(AUC0-t)、AUC0-∞、和消除半衰期(t1/2)。
采用DAS 2.1軟件進行生物等效性分析,對主要評價參數(shù)Cmax、AUC0-t、AUC0-∞進行對數(shù)轉(zhuǎn)換后進行方差分析,然后用雙單側(cè)檢驗并計算90%置信區(qū)間(CI)。當(dāng)受試制劑與參比制劑主要評價參數(shù)的幾何均值比的90%CI在80%~125%等效區(qū)間內(nèi)認為兩制劑生物等效[5]。
2.5血藥濃度-時間曲線 健康受試者空腹/餐后狀態(tài)下單次口服硝苯地平緩釋片受試制劑T1、受試制劑T2和參比制劑10 mg后,血漿中硝苯地平的平均濃度-時間曲線見圖2所示。

圖2 空腹(A)和餐后(B)狀態(tài)下受試者單次口服硝苯地平緩釋片受試制劑T1、T2與參比制劑R后平均血藥濃度-時間曲線Fig.2 Mean plasma concentration-time curve of nifedipine after single oral test preparations T1,T2 and reference preparation R under fasting (A,n=28) or fed (B,n=29) state in healthy
2.6藥動學(xué)參數(shù) 受試者空腹/餐后狀態(tài)下單次口服硝苯地平緩釋片受試制劑T1、受試制劑T2和參比制劑10 mg的主要藥動學(xué)參數(shù)見表1。
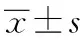
表1 空腹和餐后狀態(tài)下受試者單次口服硝苯地平緩釋片受試制劑T1、T2與參比制劑R的主要藥動學(xué)參數(shù)Tab.1 The main pharmacokinetic parameters of nifedipine in healthy volunteers after taking the tests T1,T2 and reference R preparations under fasting or fed state
2.7生物等效性評價 納入生物等效性集的57例受試者空腹/餐后給予硝苯地平緩釋片受試制劑T1、受試制劑T2和參比制劑10 mg的生物等效性評價結(jié)果見表2。如表2中所示, T1和參比制劑在空腹?fàn)顟B(tài)下的AUC0-t、Cmax生物不等效,在餐后狀態(tài)下Cmax生物不等效。而改良后受試制劑T2和參比制劑在空腹及餐后狀態(tài)下Cmax、AUC0-t、AUC0-∞的90%CI均在80%~125%內(nèi),符合生物等效性要求,判定為生物等效[5]。
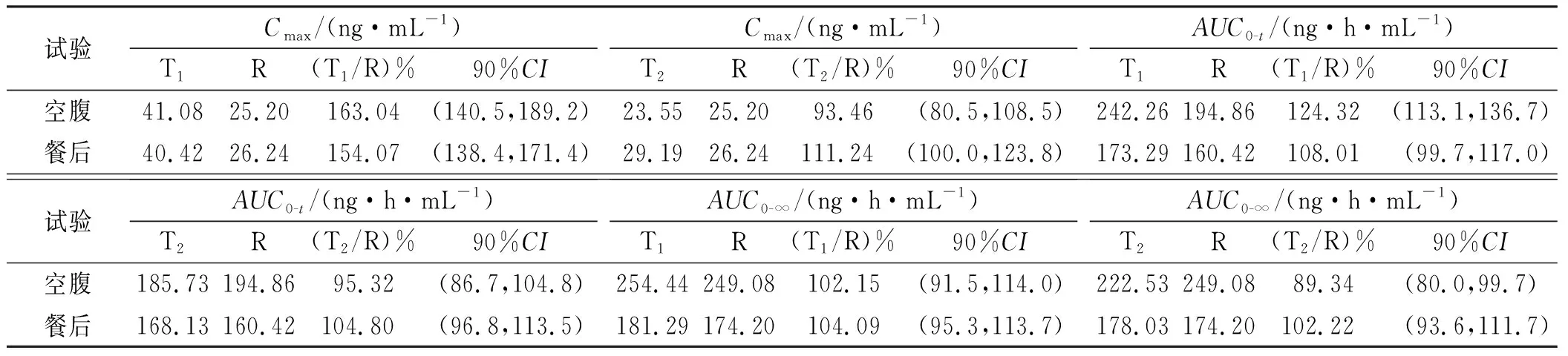
表2 空腹和餐后狀態(tài)下受試者單次口服硝苯地平緩釋片受試制劑T1、T2與參比制劑R的生物等效性評價結(jié)果Tab.2 The parameter for the test preparations T1,T2 and reference preparation R of sustained-release tablets taken by healthy subjects under fasting and fed state
2.8安全性評價 整個試驗期間未發(fā)生不良事件,給藥前后實驗室檢查未見異常值,表明在中國健康受試者中硝苯地平緩釋片單次給藥10 mg后的耐受性和安全性良好。
3 討論
硝苯地平為第一個二氫吡啶類鈣離子拮抗劑,因其療效已得到充分肯定,且價格低廉,故在臨床廣泛用于高血壓和心絞痛等的治療,但其血藥濃度極易出現(xiàn)波動,使得其在臨床應(yīng)用中的有效性和安全性存在個體差異。研究表明,制劑、種族、基因多態(tài)性、食物、合并用藥等因素均會對硝苯地平口服制劑的藥動學(xué)產(chǎn)生影響,進而可能導(dǎo)致降壓效果的改變及不良反應(yīng)的發(fā)生[6]。
雖然國內(nèi)外已有不少關(guān)于液相色譜-質(zhì)譜(LC-MS)法測定人血漿中硝苯地平濃度的方法學(xué)報道[7-9],但關(guān)于中國人群服用硝苯地平緩釋片的藥動學(xué)及生物等效性研究報道并不多見,且有限的報道均見于2016年我國開展仿制藥質(zhì)量和療效一致性評價工作前,而既往研究設(shè)計中所選取的參比制劑均為當(dāng)時上市的國產(chǎn)仿制制[10-13],非原研制劑,對現(xiàn)今工作的指導(dǎo)意義有限。如2011年WANG等[14]報道20例中國健康男性受試者空腹單次服用某國產(chǎn)硝苯地平緩釋片10 mg藥動學(xué)參數(shù):Cmax(40.6±8.0)ng·mL-1、tmax(3.15±0.88)h、t1/2(7.53±2.10)h、AUC0-t(281.2±99.4)ng·h·mL-1、AUC0-∞(293.1±103.9)ng·h·mL-1,這與原研制劑Adalat?-L10說明書中公布6例日本健康受試者的部分藥動學(xué)參數(shù):Cmax(26.1±2.2)ng·mL-1和tmax(2.47±0.40)h存在一定差異[15]。
鑒于參比制劑在仿制藥一致性評價中的關(guān)鍵作用,國家藥品監(jiān)督管理局藥品評審中心于2016年起陸續(xù)發(fā)布仿制藥參比制劑目錄,并在第八批仿制藥參比制劑目錄中列出多種規(guī)格的硝苯地平緩釋片、控釋片、軟膠囊的一致性評價工作均應(yīng)選擇拜耳公司Adalat系列產(chǎn)品作為參比制劑[16]。本項研究選擇日本拜耳公司生產(chǎn)的10 mg硝苯地平緩釋片(Adalat?-L10)作為參比制劑,結(jié)果顯示受試制劑T1和參比制劑不等效,而改良后的受試制劑T2和參比制劑在空腹及餐后狀態(tài)下生物等效。本研究也首次報道中國健康男性受試者空腹?fàn)顟B(tài)下單次口服Adalat?-L10的主要藥動學(xué)參數(shù), 結(jié)果顯示Cmax、tmax等參數(shù)較既往報道[14]與Adalat?-L10說明書中日本健康受試者報道的數(shù)據(jù)更加接近[15],反映參比制劑選擇的重要性。
此外,進食對不同劑型甚至同一劑型不同制劑的硝苯地平藥動學(xué)可能產(chǎn)生不同的影響。CHALLENOR等[17]曾考察標(biāo)準(zhǔn)早餐(總能量約2800 J)對8例健康男性受試者單次服用10 mg硝苯地平膠囊的影響,結(jié)果顯示飲食會顯著延長tmax和降低Cmax(P<0.05),但對AUC0-t的降低差異無統(tǒng)計學(xué)意義。HIRASAWA等[18]考察標(biāo)準(zhǔn)早餐(總能量2790 J)對10例患者單次服用硝苯地平膠囊10 mg的影響,結(jié)果顯示餐后狀態(tài)下Cmax較空腹時顯著降低(P<0.001),但tmax的延長和AUC0-t的降低差異無統(tǒng)計學(xué)意義。SCHUG等[19]通過四周期、四交叉試驗考察高脂餐對24位健康男性受試者單次服用兩種60 mg硝苯地平緩釋片的影響,結(jié)果顯示餐后狀態(tài)下仿制制劑Nifedicron的藥動學(xué)參數(shù)Cmax、AUC0-t、AUC0-t較空腹?fàn)顟B(tài)下顯著提高(P<0.05),但原研制劑Adalat OROS的相關(guān)參數(shù)并未發(fā)生顯著變化。在SCHUG開展的另一項納入24位健康男性受試者的類似研究中,11位受試者在餐后狀態(tài)下服用溶蝕骨架緩釋制劑CORAL?的Cmax為空腹?fàn)顟B(tài)下的3~4倍,而緩釋制劑Adalat OROS的藥動學(xué)未發(fā)生顯著變化[20]。
李江峰等[21]將90名健康受試者分為空腹組和餐后組,單次服用90 mg硝苯地平緩釋片(未注明廠家)以考察高脂餐對其藥動學(xué)的影響,結(jié)果顯示餐后組tmax、Cmax和AUC0-t較空腹?fàn)顟B(tài)下分別升高31.9%、77.4%和30.0%(P<0.05),而t1/2、AUC0-∞僅略有升高,差異無統(tǒng)計學(xué)意義。本研究中,餐后組受試者單次口服Adalat?-L10的Cmax和tmax與空腹組差異無統(tǒng)計學(xué)意義,但AUC0-t、AUC0-∞和t1/2較空腹組均有顯著降低。因本研究目的在于考察生物等效性而非飲食對硝苯地平緩釋片藥動學(xué)的影響,故試驗設(shè)計上無法判斷上述情況是否由受試者的個體差異造成。筆者認為,食物對硝苯地平緩釋片生物利用度的影響較為復(fù)雜,未來有必要開展更多臨床研究。
美國食品藥品管理局(FDA)關(guān)于硝苯地平緩釋片生物等效性指導(dǎo)原則中未說明該藥物是高變異藥物,本研究采用三交叉設(shè)計,受試制劑T1、T2分別與參比制劑比較。據(jù)既往研究的藥動學(xué)數(shù)據(jù),個體內(nèi)變異≤20%。以藥動學(xué)參數(shù)(AUC、Cmax)為主要分析指標(biāo),假定單側(cè)α=0.05,β=0.1,Intra-CV=20%,受試制劑和參比制劑均值比值0.95,生物等效區(qū)間=80.00%~125.00%,采用SAS9.4軟件計算,樣本例數(shù)為26例。若以脫落率15%計,則空腹試驗和餐后試驗各入組30例受試者。
此外,體外溶出試驗結(jié)果顯示,3種制劑在不同pH值溶出介質(zhì)中的釋放行為相對穩(wěn)定,但不同制劑間在溶解速率上差異有統(tǒng)計學(xué)意義。其中,受試制劑T1在4 h的釋放率達到90%,而參比制劑和受試制劑T2在8~12 h后方達到90%的釋放率。體外溶出實驗結(jié)果顯示,T1的體外釋放比R和T2要快,與本文三制劑的體內(nèi)生物等效性試驗結(jié)果一致。

