缺氧誘導因子1α聯合c-myc預測三陰性乳腺癌病人術后生存
楊建國 楊紅利 王樂
三陰性乳腺癌(triple-negative breast cancer,TNBC)是臨床上一種特殊的乳腺癌分子亞型,占所有乳腺癌10%~20%[1]。因其雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone,PR)和人表皮生長因子受體-2(human epidermal growth factor receptor-2,HER-2)三者均為陰性表達,缺乏內分泌治療及抗HER-2的分子靶向治療的相應靶點,給治療上造成了較大困難。TNBC具有組織學分級高、分期晚、腫瘤侵襲性強、早期復發風險高等臨床特點,預后往往較差,5年生存率<30%[2-4]。TNBC的分子標志物表達仍不明確,尋找有效的生物標志物來篩選不良預后病人成為臨床急需解決的問題。
既往多個研究表明,缺氧誘導因子1α(hypoxia inducible factor-1α,HIF-1α)在乳腺癌組織中處于高表達狀態,與乳腺癌復發轉移風險增加、放化療抵抗、免疫逃逸、預后不良相關[5-6]。c-myc作為發現較早的原癌基因之一,在乳腺癌和其他腫瘤的許多研究中均為高表達[7-9],但c-myc在TNBC這一特殊亞型乳腺癌中的表達情況及其預后價值少見報道。因此,本研究檢測HIF-1α及c-myc在TNBC中的表達,并探究其對臨床病理參數的影響,基于列線圖建立TNBC的術后生存預測模型。
對象與方法
一、對象
本研究選用包含161例TNBC病人臨床及隨訪數據的組織芯片(芯片來源:中科光華智能生物科技有限公司,編號:BRC1657),隨訪時間為2016年7月至2019年12月。年齡30~81歲,平均(51.2±17.3)歲,中位年齡為52歲。腫瘤直徑>2 cm者91例;術后病理組織學Ⅰ級10例,Ⅱ級87例,Ⅲ級64例;淋巴結陽性80例;TNM分期Ⅰ期34例,Ⅱ期99例,Ⅲ期28例。Ki-67占比<15%者15例,≥15%者146例。
二、方法
統計該組織芯片中病人手術時的年齡、腫瘤直徑、組織學分級、淋巴結狀態、腫瘤TNM分期、病理報告中Ki-67占比等資料。對芯片進行免疫組織化學(Immunohistochemistry,IHC)染色,以檢測HIF-1α及c-myc蛋白的表達情況。若IHC陽性著色細胞數占比≤10%,則判定為陰性,>10%則判定為陽性。根據IHC結果,將病人分為HIF-1α陰性組和HIF-1α陽性組,或c-myc陰性組和c-myc陽性組。
三、統計學分析
采用SPSS 16.0和GraphPad Prism 7軟件分析數據。采用χ2檢驗和Mann-Whitney秩和檢驗分析HIF-1α及c-myc蛋白的表達與TNBC病人臨床病理參數之間的關系。分別采用Cox單因素和多因素回歸分析找出影響其預后的影響因素和獨立危險因素。基于Cox多因素分析結果分別繪制ROC曲線和列線圖,從而建立預測模型。使用R版本3.5.0生成列線圖。P<0.05為差異有統計學意義。
結果
1.HIF-1α及c-myc蛋白與TNBC病人臨床病理參數的關系:免疫組織化學染色結果顯示,乳腺癌組織中HIF-1α和c-myc蛋白的陽性表達率分別為45.3%(73/161)和59.0%(95/161)。χ2檢驗和Mann-Whitney秩和檢驗分析結果顯示,HIF-1α表達與年齡、組織學分級、淋巴結狀態、腫瘤TNM分期顯著相關(P<0.05);c-myc表達與腫瘤直徑、組織學分級、淋巴結狀態、腫瘤TNM分期顯著相關(P<0.05)。在高齡病人中HIF-1α表達量更高,而在組織學Ⅲ級、淋巴結陽性、TNM分期Ⅲ期的病人中,HIF-1α和c-myc均明顯升高。這意味著,高表達的HIF-1α、c-myc與高惡性程度的TNBC密切正相關,但HIF-1α、c-myc的表達與Ki-67均未見顯著關系(P>0.05),見表1。

表1 HIF-1α及c-myc與乳腺癌臨床病理特征的關系(例,%)
2.影響TNBC病人術后生存的Cox回歸分析:所有病人隨訪4~42個月,平均隨訪(24.6±7.1)個月,中位隨訪時間為23個月。其中,有56例死亡,3年總生存率為65.2%(105/161)。總生存期為1.8~37.2個月,平均(29.5±3.9)個月,中位總生存期為31個月。Cox單因素及多因素回歸分析中可知:組織學Ⅲ級(P=0.039)、淋巴結陽性(P=0.017)、TNM分期Ⅲ期(P=0.026)、HIF-1α及c-myc陽性(P<0.001)為三陰性乳腺癌病人術后生存的獨立危險因素,可以用來預測3年預后。其HR值依次為:HIF-1α及c-myc(HR=3.057),淋巴結狀態(HR=2.912),組織學分級(HR=1.785),TNM分期III期(HR=1.631),見表2。
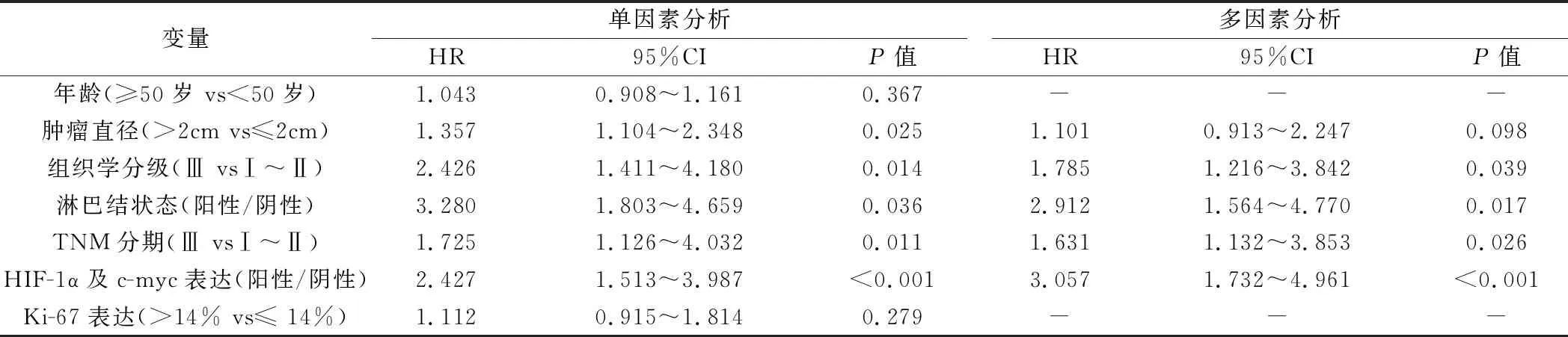
表2 TNBC術后生存的Cox回歸分析
3.TNBC病人術后生存預測模型的ROC曲線:以Cox多因素回歸分析個體死亡概率對結局變量“死亡”做ROC曲線,評估該模型的預測能力。ROC曲線下面積為0.820(0.796~0.854),說明該模型具有較高的預測價值,見圖1。

圖1 TNBC病人術后生存預測模型的ROC曲線
4.TNBC病人術后生存預測模型的列線圖:根據Cox多因素回歸分析結果,可納入組織學分級、淋巴結狀態、腫瘤TNM分期、HIF-1α及c-myc表達等四個獨立危險因素制作列線圖。其中HIF-1α及c-myc表達可分為四種情況:HIF-1α和c-myc均陰性、HIF-1α陰性c-myc陽性、HIF-1α陽性c-myc陰性、HIF-1α和c-myc均陽性。
根據列線圖上每一個參數對應的評分,計算出總評分,從而預測每例TNBC病人的死亡的概率。在列線圖中,通過病人所有的變量值找到“評分”標尺上垂直直線對應的評分,累計所有變量值的評分,再在累計后的“總評分”標尺上找到對應的點,從而換算為“3年死亡概率”標尺上對應的概率,即為該病人的3年死亡概率。將每例病人臨床信息納入該列線圖進行匹配分析,其敏感度為83.4%,特異性為76.8%,同樣證明該列線圖具有較高的預測價值,如圖2。

圖2 TNBC病人術后生存預測模型的列線圖
討 論
TNBC具有發病年輕、低分化、侵襲性高、易轉移等特點,預后極差,且當前無確切的分子靶向治療手段,尋找有效的生物標志物來篩選不良預后病人成為當前研究的熱點和難點[3-4]。
有文獻報道,HIF-1α在包括乳腺癌在內的多種腫瘤中高表達,其可參與腫瘤細胞的凋亡、增殖、遷移、侵襲和新血管生成等過程[10]。作為腫瘤細胞對缺氧環境應激的轉錄因子,HIF-1α可調控多種下游基因,從而增加腫瘤的侵襲能力,并且使得腫瘤對外界治療的抗性增加,可能是TNBC對放化療不敏感和高度侵襲性的原因之一[11]。張燕等[12]發現,HIF-1α和PD-L1在TNBC中共同高表達提示預后不良,提示HIF-1α可能是TNBC術后生存的危險因素。
c-myc作為早期發現的原癌基因之一,是一種序列特異性轉錄因子[13]。和HIF-1α類似,c-myc基因在乳腺癌、前列腺癌、宮頸癌和結腸癌等腫瘤中高表達,并出現重排現象。c-myc與腫瘤細胞生長、凋亡、周期及腫瘤發生、進展有關[14]。Rao等[15]發現,在良性增生、非典型增生、乳腺癌中,c-myc的基因擴增是逐漸遞增的,認為c-myc在腫瘤發生的早期已被激活并且參與了腫瘤發生、發展的整個過程。曾劍鋒等[16]報道了c-myc與TNBC術后復發轉移的關系,發現c-myc在高級別的TNBC中高表達,認為c-myc與TNBC病程進展有關,但c-myc對TNBC術后生存的影響并未研究。
本研究通過免疫組化的檢測方法顯示,乳腺癌組織中HIF-1α和c-myc蛋白的陽性表達率分別為45.3%和59.0%。χ2檢驗和Mann-Whitney秩和檢驗分析結果提示高表達的HIF-1α、c-myc與高惡性程度的TNBC密切正相關。Cox單因素和多因素回歸分析結果顯示,HIF-1α及c-myc陽性、組織學Ⅲ級、淋巴結陽性、TNM分期Ⅲ期為TNBC病人術后生存的獨立危險因素,可以用來預測3年預后。具體而言,HIF-1α及c-myc均陽性的TNBC病人術后3年死亡風險是HIF-1α及c-myc均陰性病人的3.057倍,淋巴結陽性、組織學Ⅲ級、TNM分期Ⅲ期相對于淋巴結陰性、組織學Ⅰ~Ⅱ級和TNM分期Ⅰ~Ⅱ期術后3年死亡風險分別提高了1.912倍、0.785倍和0.631倍。以Cox多因素回歸分析個體死亡概率對結局變量“死亡”做ROC曲線,曲線下面積為0.820,具有較高的預測價值。列線圖可以根據每例TNBC病人的臨床資料,計算出術后3年死亡的大致概率,其敏感度為83.4%,特異性為76.8%,同樣證明該列線圖具有較高的預測價值。對于臨床醫生來說,一旦接診到具有上述獨立危險因素的TNBC病人,需要對病人手術后的預后進行評估,盡早為病人制定科學合理的干預方案。
本研究表明,HIF-1α和c-myc高表達以及組織學Ⅲ級、淋巴結陽性、腫瘤Ⅲ期提示TNBC病人預后不良,可以用來預測其術后生存。

