不同硒源及濃度對偏關苜蓿種子萌發及物質轉化的影響
張士敏, 朱慧森, 趙嬌陽, 衛 凱, 夏方山
(山西農業大學草業學院, 山西 太谷 030801)
硒是人和動物的必需元素。主要以硒蛋白的形式參與各項生命活動,起到抗氧化和提升機體免疫水平等作用[1-3]。同時,適宜的硒濃度可通過增強植物的抗氧化能力來促進植物的生長,因此,硒被認為是植物的準必需微量營養素或有益營養素[4],在富硒土壤中生長的植物如黃芪(Astragalusbisulcatus;豆科)、赤柱花(Stanleyapinnata;十字花科)等,可以將硒積累到高達 10 000 mg·kg-1DW的濃度,且主要以有機硒的形式進行存儲,可作為人和動物的重要補硒載體[5-6]。然而,我國三分之二地區屬缺硒地區,其中黃土高原中北部是典型的缺硒區,土壤硒含量低于 0.1 μg·g-1,而土壤缺硒會對飼草及糧食作物的生產造成不利影響,甚至威脅人和動物的健康[7-9],因此,如何科學的進行動植物補硒成為一個亟待解決的問題。由于目前補硒試劑大多為無機硒化物或人工合成有機硒,直接添加到食品或飼料中存在較大的安全隱患,且容易受到加工工藝、生產成本等各種因素的影響,質量難以保證[10]。因而將硒轉移到牲畜和人類食物鏈的一個更為安全有效的方式是向飼草、作物及蔬菜施加外源硒,以提高食物鏈的硒水平,進而提升補硒效率[11]。
近年來,多位學者已針對糧食作物小麥[11](TriticumaestivumL.)、豌豆[12](PisumsativumL.)、水稻[13](OryzasativaL.)及蔬菜[14]等開展硒的生物強化研究。對飼草富硒研究表明,紫花苜蓿(MedicagosativaL.)對硒有超強的吸收和富集能力,是將無機硒轉化為有機硒的重要載體,可通過食物鏈對動物和人體進行安全、高效補硒[15-16]。
在植物中,低濃度的硒經常被報道對植物的生長和發育有利。如低濃度(<15 μmol·L-1亞硒酸鹽和硒酸鹽)施硒對生菜[17](LactucasativaL.)、(≤14 mg·L-1)白芥菜(BrassicajunceaL.)、(<107 mg·L-1)油菜[18](BrassicacampestrisL.)和(15~60 μmol·L-1亞硒酸鹽)大米[19-20]等作物種子萌發和營養品質均有顯著的促進作用。但高濃度的硒卻可通過降低碳水化合物水解相關酶的活性干擾種子的萌發,并可導致胚的死亡[19]。目前,關于硒對紫花苜蓿種子萌發的研究,多以無機硒為硒源[21-23],關于有機硒對紫花苜蓿種子的萌發研究較少,主要集中在蛋氨酸硒對豇豆[24](VignasinensisL.)、南瓜[25](Cucurbitamoschata(Duch.ex Lam.)Duch.ex Poiret)、厚皮甜瓜[26](Cucumismelo)等生長發育的影響。本研究通過比較兩種硒源對苜蓿種子發芽階段形態變化及物質轉化影響的差異性,確定苜蓿種子萌發過程中亞硒酸鈉、蛋氨酸硒作為外源浸種劑的最佳濃度,為硒對紫花苜蓿的營養代謝及促生作用提供理論依據。
1 材料與方法
1.1 供試材料
本試驗所用紫花苜蓿為地方培育品種‘偏關’苜蓿(Medicagosativa‘Pianguan’),由山西農業大學草業學院種質資源庫提供。
硒肥:無機硒為亞硒酸鈉(Na2SeO3,AR),含硒量45.01%,購于成都化夏化學試劑有限公司;有機硒為蛋氨酸硒(C5H11NO2Se,AR),含硒量0.2%,購于成都施普諾科技有限公司。
1.2 培養條件
試驗于2020年6月在山西農業大學草學實驗室進行。試驗選取飽滿均勻的苜蓿種子于1.0% NaClO溶液中消毒5 min,蒸餾水沖洗3~4次,吸水紙吸干,置于墊有兩層濾紙的直徑9 cm的培養皿中,每皿100粒種子,4個重復,每個培養皿中加5 mL硒溶液,對照(CK)加5 mL蒸餾水。亞硒酸鈉濃度設定為0.3,0.6,1.2,2.4,4.8,9.6 mg·L-1,蛋氨酸硒濃度設定為1,5,10,20,40 mg·L-1,采用Y1,Y2,Y3,Y4,Y5,Y6及D1,D2,D3,D4,D5來表示,所對應的純硒濃度分別為0.14,0.27,0.54,1.08,2.16,4.32 mg·L-1和0.40,2.01,4.03,8.06,16.12 mg·L-1。將培養皿置于人工氣候培養箱中,光強5 000 lx,光周期為12 h/12 h,溫度20℃恒溫,相對濕度80%進行發芽。為保證硒溶液濃度穩定,采用稱重法每天補充適量蒸餾水。
每24 h記錄種子發芽情況(以胚根伸出種皮作為發芽標準),于處理第4 d時統計種子的發芽勢,第10 d時統計種子的發芽率,測量苜蓿幼苗的胚芽長、胚根長、胚根直徑(胚根基部直徑最大處)、單株鮮重,計算發芽指數、活力指數、干重占比,并測定幼苗的還原糖、總氨基酸含量及硝酸還原酶(Nitrate reductase,NR)活性。
1.3 測定方法
種子發芽勢、發芽率采用常規統計方法測定:發芽勢(%)=(4 d內正常發芽種子數/供試種子數)×100,發芽率(%)=(10 d內正常發芽種子數/供試種子數)×100。胚芽長、胚根長及胚根直徑的測定:發芽第10 d時,每處理隨機選取20株幼苗,采用精度為0.01 mm的游標卡尺分別測量胚芽長、胚根長、胚根直徑,求平均值。幼苗單株鮮重的測定:發芽第10 d時,每處理隨機選取40株幼苗,用吸水紙擦干后,稱量其鮮重,求平均值。幼苗干重占比:在每個重復取樣完成后,將剩余的幼苗用吸水紙擦干稱量鮮重,然后在105℃殺青10 min,65℃下烘至恒重,稱其干重,并計算干重占比。發芽指數(GI)= ∑(Gt/Dt),活力指數(VI)=GI×S。其中,Gt為在t日的發芽種子數,Dt為發芽天數,S為單株鮮重。
還原糖含量采用3,5-二硝基水楊酸法測定[27],總氨基酸采用茚三酮比色法測定[28],硝酸還原酶(NR)測定參考高俊鳳等[29]的方法,以上各指標重復3次。
1.4 數據處理與分析
采用Microsoft Excel整理數據,SAS 9.2軟件進行方差分析及相關性分析,用Duncan法進行多重比較,差異顯著性定義為(P<0.05,結果采用“平均值±標準差”表示。
2 結果與分析
2.1 不同硒源及濃度對紫花苜蓿種子萌發的影響
施硒可影響紫花苜蓿種子的發芽,如圖1所示,本試驗所用兩種硒源對種子發芽參數的影響趨勢基本一致,均為先促進后抑制,即有明顯的濃度效應。在0.6 mg·L-1亞硒酸鈉濃度下,苜蓿種子發芽勢、發芽率及發芽指數相比CK分別增加了4.40%,3.25%,5.83%;但當亞硒酸鈉濃度為4.8 mg·L-1時,苜蓿種子發芽率已顯著下降(P<0.05),當濃度達到9.6 mg·L-1時,其活力指數則顯著下降(P<0.05),降幅分別為4.79%,20.87%。由圖1B和1C可知,苜蓿種子在1 mg·L-1蛋氨酸硒處理下,發芽率相比CK增幅為2.29%,而用5 mg·L-1蛋氨酸硒處理時,其活力指數相比CK有10.13%的增幅。但苜蓿種子除發芽勢在40 mg·L-1蛋氨酸硒處理下顯著下降外,其余發芽指標均在20 mg·L-1蛋氨酸硒處理時已開始顯著下降(P<0.05)。

圖1 不同硒源及濃度對紫花苜蓿種子萌發的影響Fig.1 Effects of different selenium sources and concentrations on seed germination of alfalfa注:相同硒源處理,不同大寫字母表示差異顯著(P<0.05),下同Note:In the same selenium sources,different capital letters indicate significant difference at the 0.05 level,the same as below
2.2 不同硒源及濃度對紫花苜蓿種子萌發后表型變化的影響
不同硒源及濃度對苜蓿種子形態變化影響的趨勢不同,由圖2B可知,0.3 mg·L-1亞硒酸鈉及1 mg·L-1蛋氨酸硒處理下可顯著提高苜蓿幼苗的胚根長(P<0.05),增幅分別為19.63%及19.04%;而當亞硒酸鈉及蛋氨酸硒濃度分別達到9.6,20 mg·L-1時,胚根的伸長被顯著抑制(P<0.05);由圖2A,2C,2D,2E可知,苜蓿幼苗的胚芽長、單株鮮重、胚根直徑及干重占比,均在0.3 mg·L-1亞硒酸鈉濃度下達到最大值,但各指標在不同硒濃度處理下差異均不顯著。1,5 mg·L-1蛋氨酸硒處理均可顯著提高苜蓿幼苗的胚根直徑(P<0.05),增幅分別為35.57%,40.11%。當蛋氨酸硒濃度達到40 mg·L-1時,苜蓿幼苗的單株鮮重顯著降低(P<0.05)。
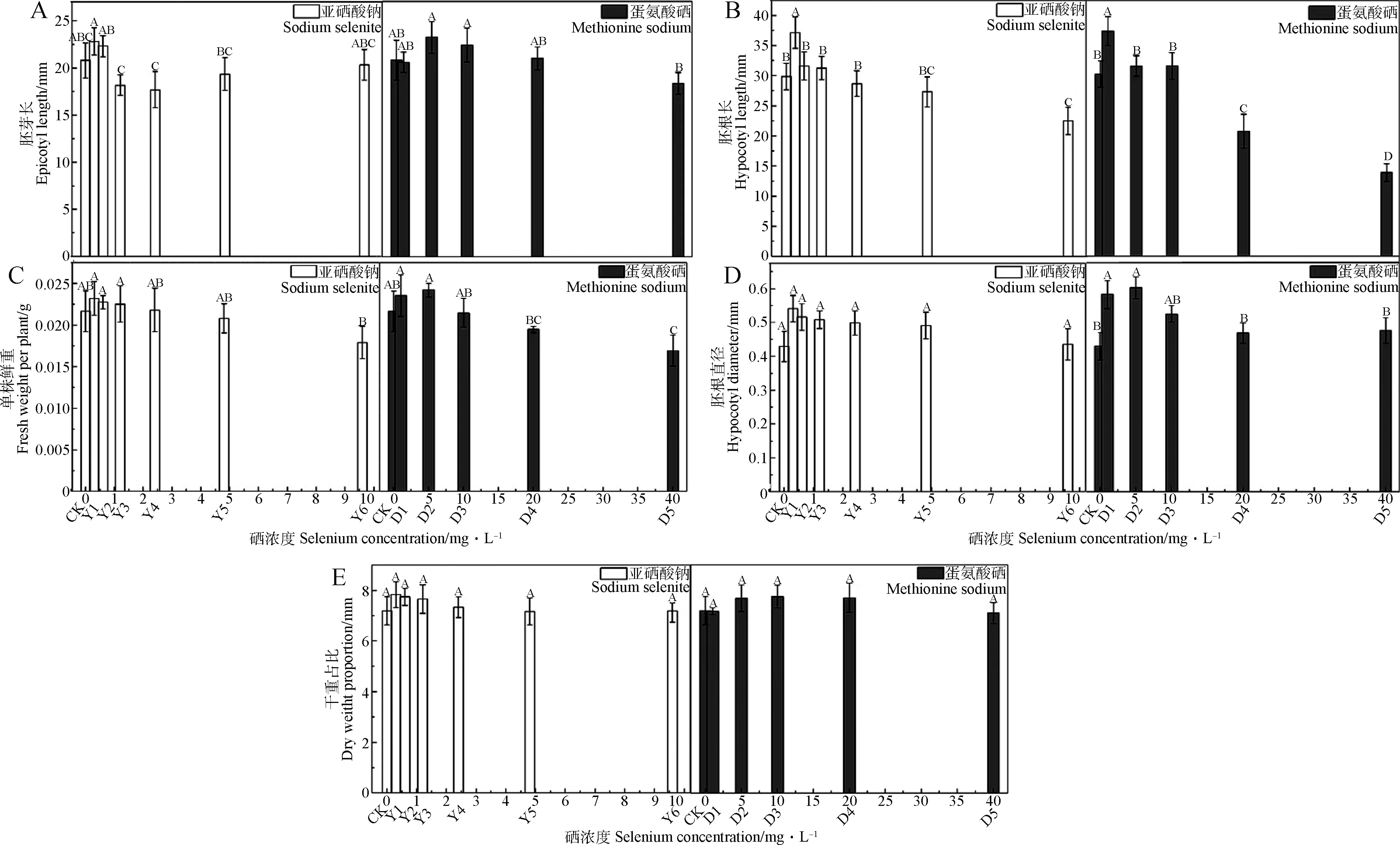
圖2 不同硒源及濃度對紫花苜蓿種子萌發后表型變化的影響Fig.2 Effects of different selenium sources and concentrations on phenotypic changes of alfalfa seeds germination
2.3 不同硒源及濃度對紫花苜蓿種子萌發后還原糖積累及氮轉化的影響
施硒對苜蓿幼苗生理指標的影響如圖3所示,由圖3A可知,在0.3,0.6 mg·L-1亞硒酸鈉處理下,苜蓿幼苗還原糖含量均顯著提高,增幅分別為10.83%和14.45%,而采用5,10 mg·L-1蛋氨酸硒處理時,苜蓿幼苗的還原糖含量相比CK也顯著提高(P<0.05);由圖3B可知,除4.8 mg·L-1亞硒酸鈉處理外,各濃度均可顯著提高苜蓿幼苗的硝酸還原酶活性(P<0.05),而采用1,5,10 mg·L-1蛋氨酸硒處理時,苜蓿幼苗的硝酸還原酶活性也顯著提高(P<0.05),增幅分別為152.72%,76.70%,81.76%。但無論是還原糖含量和硝酸還原酶活性均隨硒濃度的升高呈現先升后降的總體變化趨勢。由圖3C可知,在0.3 mg·L-1亞硒酸鈉處理下,苜蓿幼苗總氨基酸含量顯著提高(P<0.05),增幅可達20.66%,而40 mg·L-1蛋氨酸硒處理下,苜蓿幼苗的總氨基酸含量也顯著提高(P<0.05)。
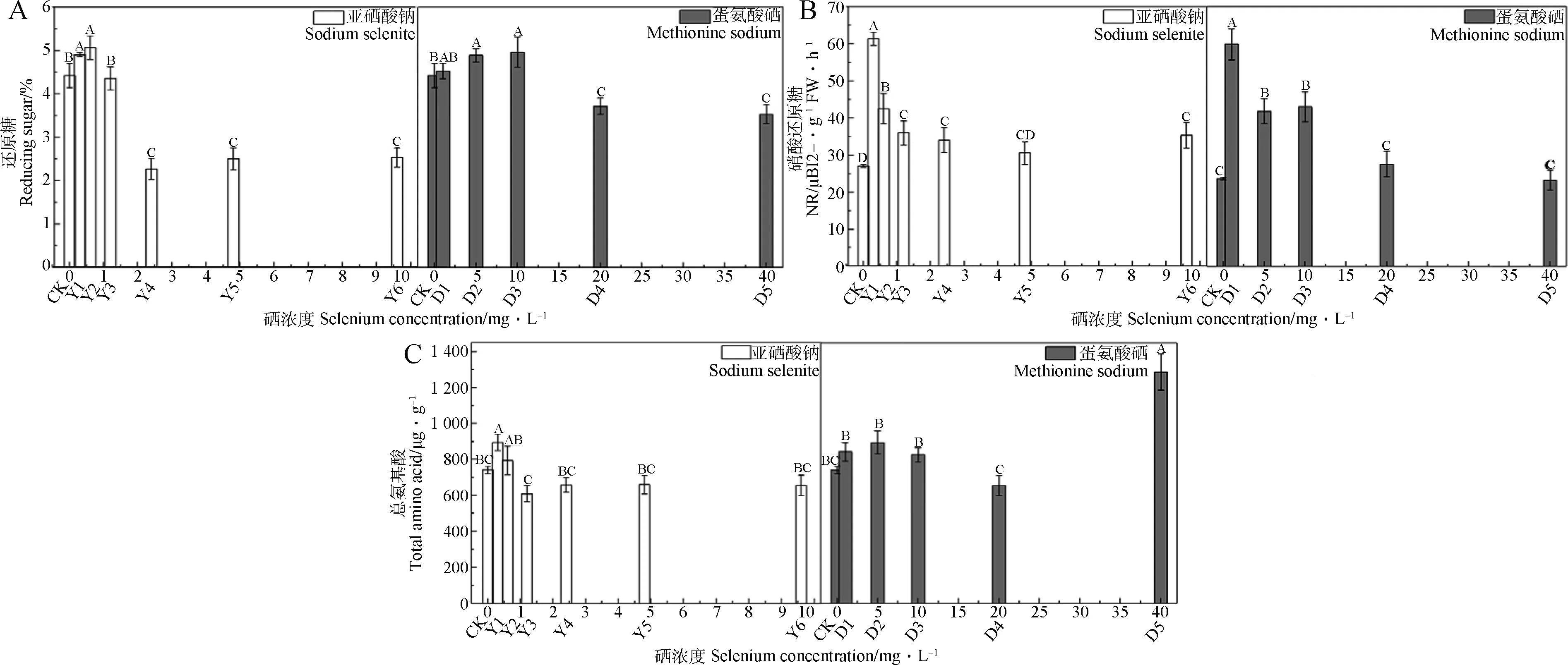
圖3 不同硒源及濃度對紫花苜蓿幼苗還原糖積累及氮轉化的影響Fig.3 Effects of different selenium sources and concentrations on reducing sugar accumulation and nitrogen transformation of alfalfa
2.4 不同硒源及濃度對紫花苜蓿種子發芽階段影響的綜合比較及相關性分析
在適宜硒濃度下,兩種硒源對苜蓿種子萌發及幼苗生長均能產生促進作用(表1)。在蛋氨酸硒濃度為D2時可顯著提高苜蓿幼苗的胚根直徑(P<0.05)。在Y1和D2硒濃度處理下,苜蓿幼苗總氨基酸含量顯著提高(P<0.05)。施硒對苜蓿幼苗生長及生理指標的影響要大于種子萌發指標。在Y2亞硒酸鈉濃度處理下,苜蓿幼苗還原糖含量相比CK顯著提高(P<0.05);Y1和D1硒濃度處理下,苜蓿幼苗的胚根長和硝酸還原酶活性相比CK顯著提高(P<0.05),且D1相比Y1硒濃度處理仍能顯著提高苜蓿幼苗的硝酸還原酶活性(P<0.05)。
施硒與紫花苜蓿種子發芽參數的相關性分析(表1)表明:硒濃度與苜蓿種子的發芽勢、發芽率、發芽指數及活力指數呈極顯著負相關(P<0.01)。硒源與發芽指數呈極顯著負相關(P<0.01),與活力指數呈顯著負相關(P<0.05)。硒源×硒濃度與發芽勢、發芽率、發芽指數及活力指數均有顯著的交互作用。硒濃度與胚根長、單株鮮重呈極顯著負相關(P<0.01)。硒源與胚根直徑呈顯著正相關(P<0.05)。硒源×硒濃度與苜蓿幼苗生長指標胚芽長有顯著的交互作用(P<0.05),與胚根長有極顯著的交互作用(P<0.01)。硒濃度與硝酸還原酶活性呈顯著負相關(P<0.05),與總氨基酸含量呈極顯著的正相關(P<0.01)。硒源與硝酸還原酶活性及總氨基酸含量呈顯著正相關(P<0.05)。硒源×硒濃度與苜蓿幼苗硝酸還原酶活性有顯著交互作用(P<0.05),與還原糖及總氨基酸含量有極顯著的交互作用(P<0.01)。
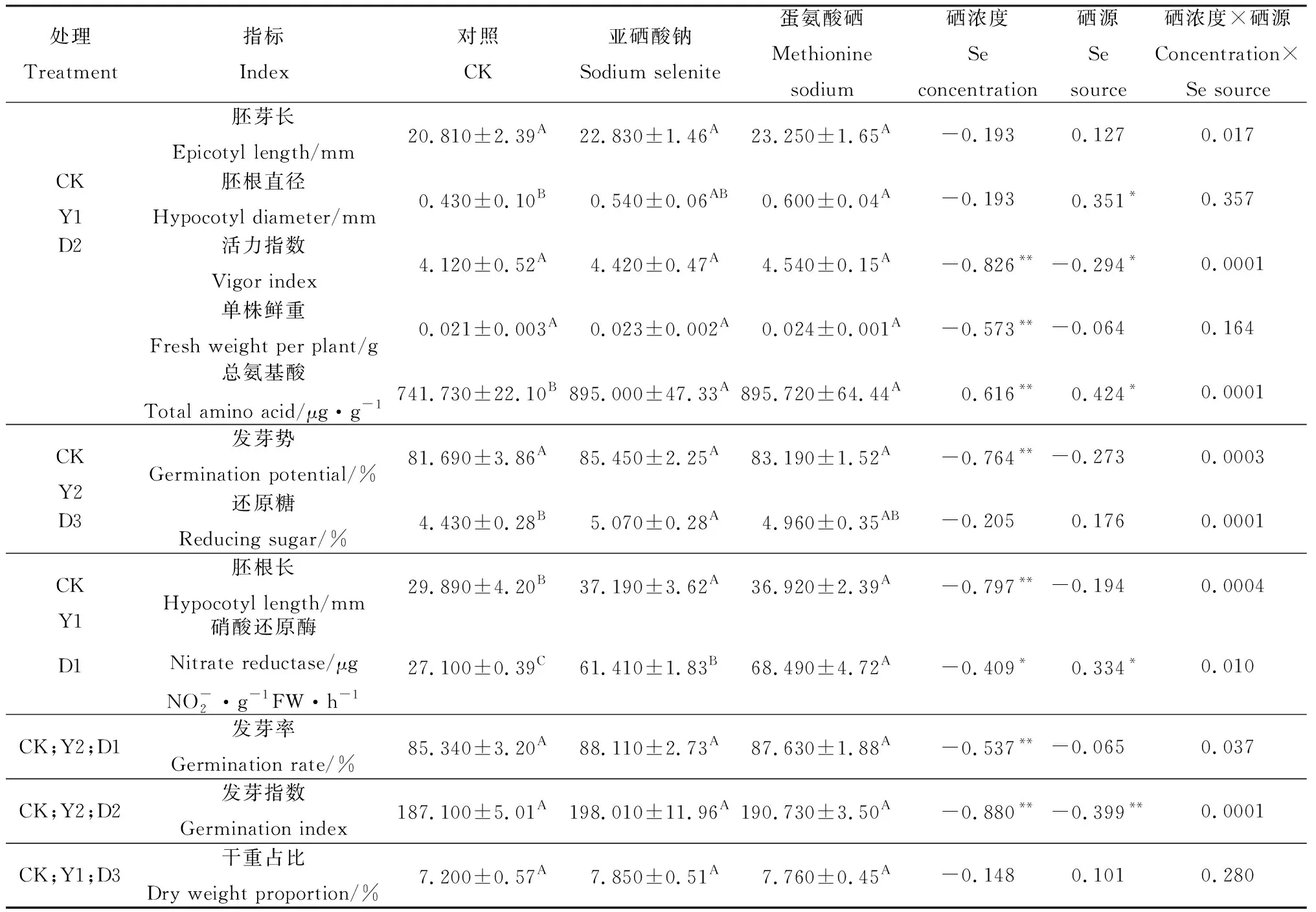
表1 不同硒源及濃度下紫花苜蓿種子發芽參數綜合比較及相關性分析Table 1 Comprehensive comparison and correlation analysis of germination parameters in alfalfa treated by different selenium sources and concentration
3 討論
3.1 不同硒源及濃度對紫花苜蓿種子萌發的影響
發芽率與發芽勢是反映種子萌發特性的重要指標,發芽勢是種子生活力和幼苗整齊度的體現,發芽率是指活種子占供試種子的比例,能夠反映種子的出苗情況。發芽指數反映了種子的發芽速率和整齊程度,而活力指數反映了種子在各種生境條件下迅速發芽和生長的整齊度的能力[30]。研究發現,適宜的亞硒酸鈉濃度(2,4,6 μmol·L-1;15~60 μmol·L-1)可提高芥菜發芽率[31],并有利于水稻出苗和幼苗生長[19]。本試驗中,0.3,0.6 mg·L-1亞硒酸鈉處理,有提高苜蓿種子的發芽勢與發芽率的趨勢,而蛋氨酸硒只在濃度為10 mg·L-1時,有提高苜蓿種子發芽勢的趨勢,表明適宜的亞硒酸鈉濃度在種子萌發階段更能促進種子內部的物質轉化,從而加速形態轉化,即提高種子發芽率。適宜的亞硒酸鈉濃度(0.3,0.6 mg·L-1)可提高苜蓿種子的發芽指數,表明亞硒酸鈉能夠改善苜蓿種子的發芽質量,彭琪等通過硒對苜蓿種子萌發試驗的研究,也得出與此一致的結論[21]。蛋氨酸硒在最適濃度5 mg·L-1時,依然沒能顯著促進苜蓿種子的發芽指數,這與其對苜蓿種子發芽勢及發芽率影響不顯著有關。另外,隨著亞硒酸鈉及蛋氨酸硒濃度的增加,苜蓿種子的發芽勢、發芽率、發芽指數及活力指數都呈下降趨勢,表明苜蓿種子的萌發對硒的響應存在濃度效應,即苜蓿種子萌發指標與硒濃度呈顯著的負相關性。雖然蛋氨酸硒對苜蓿種子萌發指標的促進作用要弱于亞硒酸鈉,但此階段苜蓿種子對其耐性更強,適宜的硒濃度范圍更廣,說明苜蓿種子對無機硒更敏感,而對有機硒則表現出一定的耐受性。
3.2 不同硒源及濃度對紫花苜蓿種子萌發后表型變化的影響
研究表明,低劑量的硒肥可促進種子萌發后幼苗的生長,以獲得更健康的植株,增加作物產量,改善營養品質[32]。種子萌發時,胚根一般先突破種皮伸出種子之外,而根系作為植物體生長最活躍的吸收器官和合成器官,可直接反映發芽種子內部的物質轉化速率,且其發育水平可直接影響地上部的生長和健康狀況。在幼苗生長過程中,胚芽長、胚根長、胚根直徑、幼苗單株鮮重及干重占比是反映幼苗生長狀況的關鍵指標。據報道,施用亞硒酸鈉可將芥菜種子萌發過程中根長及地上部長度分別提高88.3%和18.2%[31]。本試驗中,在0.3,0.6 mg·L-1亞硒酸鈉在處理下,苜蓿幼苗的胚根長有增加的趨勢,而在亞硒酸鈉濃度為0.3,0.6及1.2 mg·L-1時,其單株鮮重均有增加的趨勢,但僅在最低濃度0.3 mg·L-1時,提高了胚根長,表明以上指標對亞硒酸鈉濃度的敏感性排序為胚根長>胚芽長>單株鮮重。與CK相比亞硒酸鈉各濃度均不能顯著提高苜蓿幼苗的胚根直徑與干重占比,表明其對胚根發育及幼苗干物質積累的促進作用有限。5,10 mg·L-1蛋氨酸硒有促進苜蓿種子胚芽長的趨勢,1,5 mg·L-1蛋氨酸硒處理下胚根直徑顯著增大,單株鮮重也有增加的趨勢。但僅在1 mg·L-1蛋氨酸硒處理下,可顯著促進其胚根長的發育,由此表明上述指標對蛋氨酸硒濃度的敏感性排序為胚根長>單株鮮重>胚芽長>胚根直徑,與CK相比蛋氨酸硒各濃度同樣沒能顯著促進苜蓿幼苗干物質的積累,但綜合以上分析表明,適宜濃度下,蛋氨酸硒相比亞硒酸鈉更能促進苜蓿幼苗胚芽及胚根的發育,從而提高苜蓿幼苗的單株鮮重,為苜蓿苗期的生長發育奠定基礎。
3.3 不同硒源及濃度對紫花苜蓿種子萌發后還原糖積累及氮轉化的影響
硒可通過提高碳水化合物代謝的能力來促進植物的生長[33],主要表現在硒可誘導淀粉酶活性的增加,從而將淀粉水解成單糖等可溶性糖[34],而可溶性糖的積累在維持滲透平衡方面起重要作用,因為還原糖多為可溶性糖,所以還原糖含量的增加,可通過調控苜蓿幼苗機體的滲透平衡,而提高其抗逆性[36-37]。本試驗中在亞硒酸鈉濃度為0.3,0.6 mg·L-1及蛋氨酸硒濃度為5,10 mg·L-1時,均可顯著促進苜蓿幼苗還原糖的積累,表明苜蓿幼苗還原糖的積累可適應較大的硒濃度范圍,尤其能適應較高濃度的蛋氨酸硒。Khaliq等[19]通過對芥菜種子施硒,發現其幼苗還原糖、總糖含量顯著提高,與本研究結果一致。NR是一種氧化還原酶,可使硝酸鹽轉換成亞硝酸鹽,然后在亞硝酸鹽還原酶的作用下轉化為銨,最后用于蛋白質的合成。因此,NR在氮代謝,尤其是蛋白質的合成過程中,發揮著重要作用。另外,糖積累(特別是蔗糖和葡萄糖)可通過控制蛋白質周轉和由特定蛋白介導的磷酸化狀態來影響NR的實際酶活,在NR的活性調節中起主要作用[38]。由此可推測,施硒通過促進糖的積累而影響NR的活性,進而調節氮代謝。研究發現,適量施用蛋氨酸硒可顯著提高厚皮甜瓜果肉硝酸還原酶活性[24]、可溶性糖及游離氨基酸含量[39],也再次印證了本試驗的研究結果。同時,施硒可顯著提高芥菜幼苗蛋白質、氨基酸和氮的含量[19],而硫代謝對氮代謝有直接影響,因此可初步推斷,施硒通過調控硫代謝而對氨基酸和蛋白質的生物合成產生影響[40]。
本試驗中,亞硒酸鈉各濃度及蛋氨酸硒在1,5,10 mg·L-1濃度下,均能提高NR的活性,而9.6 mg·L-1的亞硒酸鈉與10 mg·L-1的蛋氨酸硒所對應的純硒含量接近,說明苜蓿幼苗的NR活性對兩種硒源的耐受濃度相近,且1,5,10 mg·L-1蛋氨酸硒可同時促進還原糖積累及NR的酶活性。雖然亞硒酸鈉各濃度所對應的兩者曲線關系相比蛋氨酸硒吻合度稍差,但仍有較高的相關性,因此本試驗也驗證了還原糖積累與NR酶活的高度相關性。同時,苜蓿幼苗總氨基酸的積累與NR酶活的變化趨勢也基本一致,尤其是蛋氨酸硒濃度變化所誘導的NR酶活性與總氨基酸積累量相一致。40 mg·L-1蛋氨酸硒所對應的總氨基酸含量異常升高,推測可能是由于較高的蛋氨酸硒濃度使苜蓿幼苗氮代謝失衡,導致大量的功能蛋白質分解為氨基酸,使得氨基酸總量異常升高,抑制了幼苗的生長。
4 結論
綜上所述,亞硒酸鈉促進苜蓿種子萌發的效果要優于蛋氨酸硒,但其有益范圍較窄,濃度超過1.2 mg·L-1就會對種子萌發產生抑制作用,而蛋氨酸硒濃度在10 mg·L-1時,對苜蓿種子的發芽勢和發芽率仍有一定的促進作用,其中發芽指數和活力指數以5 mg·L-1蛋氨酸硒處理效果最佳。蛋氨酸硒對苜蓿幼苗生長的促進作用要優于亞硒酸鈉,尤以5 mg·L-1蛋氨酸硒處理下苜蓿幼苗的胚芽長、單株鮮重及胚根直徑效果最佳,且胚根直徑顯著大于對照和亞硒酸鈉處理組。施硒通過對胚根發育的促進作用,也間接提高了苜蓿幼苗地上部的生長。適量的硒濃度還可促進還原糖的積累,而還原糖含量的提高又可激活硝酸還原酶,進而影響氮代謝,但各生理指標對亞硒酸鈉濃度的變化也較為敏感,稍高的濃度就會引起劇烈的生理變化及物質轉化,而5 mg·L-1蛋氨酸硒可顯著提高苜蓿幼苗還原糖含量及硝酸還原酶活性,進而增加總氨基酸含量,因此苜蓿種子發芽階段使用5 mg·L-1蛋氨酸硒作為促生長劑進行硒生物強化效果最為理想。

