不同光強(qiáng)的LED紅藍(lán)光對綠蘿生長及其甲醛去除效果的影響
張紫研 楊青 鄭紫凌 孔令翀 張俊文 方治國
摘 要 不同光強(qiáng)會顯著影響植物的生長代謝、光合作用及光形態(tài)建成,而植物的生長狀態(tài)與其甲醛去除能力之間有密切關(guān)系。以綠蘿為研究對象,試驗(yàn)設(shè)置光強(qiáng)分別為 25、50、75、100 μmol·m-2·s-1的紅藍(lán)光對綠蘿(Epipremnum aureum)進(jìn)行連續(xù)光照,研究不同光強(qiáng)的紅藍(lán)光對綠蘿生長及其甲醛去除效果的影響。結(jié)果表明,光強(qiáng)為100 μmol·m-2·s-1條件下的綠蘿生長狀況最好,其鮮重、莖長、根長和葉面積均為所有處理中的最大值,并且可溶性蛋白和葉綠素含量最高,分別為15.39 mg·g-1和2.54 mg·g-1,抗氧化酶活性最低;綠蘿的最大熒光產(chǎn)量(Fm)、最大光合效率(Fv/Fm)、最大光化學(xué)量子產(chǎn)量(Fv/F0)在光強(qiáng)為100 μmol·m-2·s-1紅藍(lán)光條件下達(dá)到最高,分別為0.473、0.710、2.463;不同處理下綠蘿對甲醛去除試驗(yàn)發(fā)現(xiàn),經(jīng)過4 h的熏蒸吸附,光強(qiáng)為100 μmol·m-2·s-1紅藍(lán)光條件下種植的綠蘿對甲醛去除效果最好,讓甲醛濃度從2.5±0.3 mg·m-3降為 0.29 mg·m-3,吸附率高達(dá)87.20%。
關(guān)鍵詞 綠蘿;紅藍(lán)光;光合作用;光形態(tài)建成;甲醛去除;熒光參數(shù)
中圖分類號:S682.36 文獻(xiàn)標(biāo)志碼:A DOI:10.19415/j.cnki.1673-890x.2022.01.001
室內(nèi)環(huán)境與人們的健康密切相關(guān),成年人約有80%~90%的時(shí)間是在室內(nèi)度過的,而一些行動不便的老人、嬰兒等可能有高達(dá)95%的時(shí)間生活在室內(nèi)[1-2]。目前,室內(nèi)環(huán)境質(zhì)量整體情況不容樂觀,世界范圍內(nèi)每年有超過500萬人死于室內(nèi)空氣污染[3-6]。室內(nèi)環(huán)境中的污染物主要來源于家具和各種裝修材料,長期暴露在高濃度室內(nèi)污染物的環(huán)境下會嚴(yán)重影響人體健康[7]。甲醛在室溫下是一種無色有刺激性的氣體,為室內(nèi)主要污染物[8-9],長期處于較高濃度甲醛環(huán)境中,會對人眼、鼻、呼吸道產(chǎn)生強(qiáng)烈的刺激作用[10-12]。此外,甲醛已被世界衛(wèi)生組織國際癌癥研究機(jī)構(gòu)列入致癌物清單。如何高效治理室內(nèi)空氣污染物,減少其對人們健康的不良影響已成為科研人員關(guān)注的重點(diǎn)方向[13]。
目前,可以使用物理、化學(xué)和生物等方法有效去除室內(nèi)環(huán)境中的甲醛,其中植物修復(fù)由于成本低廉、對環(huán)境友好、不產(chǎn)生二次污染而被廣泛關(guān)注[14-16]。研究表明,綠色植物可以高效吸收大部分氣態(tài)有機(jī)污染物,如綠蘿(Epipremnum aureum)、虎尾蘭(Sansevieria trifasciata Prain)等植物對甲醛有很好的去除作用[17-19];白鶴芋(Spathiphyllum kochii Engl. & K. Krause)和鵝掌柴[Schefflera octophylla (Lour.) Harms]可以有效去除室內(nèi)空氣中的苯系污染物[20-21];花葉萬年青(Dieffenbachia picta Lodd.)和非洲天門冬[Asparagus densiflorus (Kunth) Jessop]對2-乙基己醇有較好的去除作用[22]。植物去除室內(nèi)環(huán)境污染物的能力與其生長狀況密切相關(guān),而光照是影響植物生長發(fā)育和光形態(tài)建成的主要因子[23-25],不同光強(qiáng)會影響植物的光合作用、光形態(tài)建成及相關(guān)酶活性[26]。王滿蓮等發(fā)現(xiàn)強(qiáng)光可以顯著降低地楓皮(Illicium difengpi K. I. B. et K. I. M.)和塊根紫金牛(Ardisia corymbifera Mez var. tuberifera C. Chen)的凈光合速率,增大秀麗海桐(Pittosporum pulchrum Gagnep.)的光合速率[27];Anastasia等認(rèn)為較高或較低的光強(qiáng)會影響葉面厚度、葉肉細(xì)胞層、葉綠素含量和葉面氣孔結(jié)構(gòu)等[28],不同光強(qiáng)也會導(dǎo)致植物體內(nèi)總抗氧化性及保護(hù)酶活性產(chǎn)生相應(yīng)變化[29-30];Porter等發(fā)現(xiàn)隨著光強(qiáng)增加,植物對甲苯的去除效率提高,可能是由于氣孔導(dǎo)度增加及植物更活躍的代謝活動導(dǎo)致的[17,31-32]。此外,有研究表明紅藍(lán)光對植物的生長發(fā)育和光合特性具有積極的作用[26,33-34]。因此,我們可以提出假設(shè),不同光強(qiáng)的紅藍(lán)光會顯著影響綠蘿的生長狀態(tài),那么不同光強(qiáng)紅藍(lán)光條件下種植的綠蘿對甲醛的去除效果是否有顯著差異?綠蘿對甲醛的去除效果與哪些因素密切相關(guān)呢?基于此,選取綠蘿為研究對象,研究了不同光強(qiáng)紅藍(lán)光對綠蘿生長特征及光合作用的影響機(jī)制,探究了不同光強(qiáng)紅藍(lán)光條件下種植的綠蘿的甲醛去除作用差異,揭示綠蘿的生長特征、光合作用與綠蘿對甲醛去除效果之間的關(guān)系,可為植物去除室內(nèi)污染物提供新的思路,具有重要的實(shí)際指導(dǎo)意義。
1? 材料與方法
1.1? 試驗(yàn)材料
1.1.1? 植物來源
試驗(yàn)選用綠蘿為供試植物,購買于杭州花鳥市場,從同一批購買的綠蘿苗中選取生長狀況良好、大小基本一致、株高 15~20 cm 的進(jìn)行試驗(yàn),將挑選出的綠蘿除去自帶的土壤后盆栽種植。
1.1.2? LED光源
試驗(yàn)所用的紅藍(lán)光LED燈購自杭州漢徽光電科技有限公司,選用的光強(qiáng)分別為25 μmol·m-2·s-1(RB25)、50 μmol·m-2·s-1(RB50)、75 μmol·m-2·s-1(RB75)和100 μmol·m-2·s-1(RB100),利用這4種光強(qiáng)對綠蘿進(jìn)行光照培養(yǎng),比較這4種光強(qiáng)下綠蘿的生長特征及其對甲醛的去除效果差異。每個(gè)光處理組下放置5盆供試植物。培養(yǎng)溫度為25 ℃,光周期為12 h/12 h,培養(yǎng)時(shí)間為75 d。
1.1.3? 甲醛去除熏蒸室
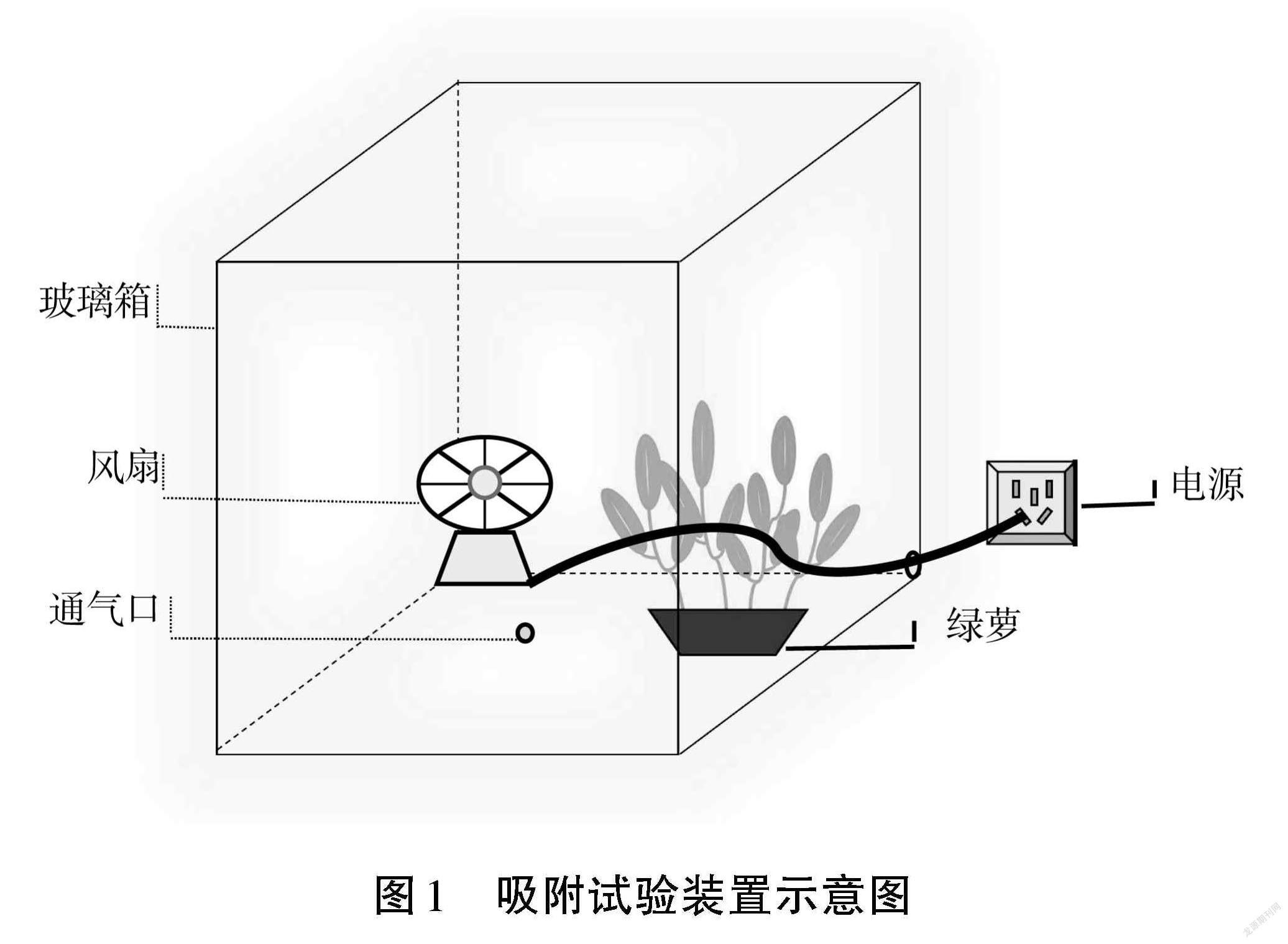
選用規(guī)格為 60 cm×60 cm×60 cm 的密封性較好的玻璃箱(見圖1),箱子頂部的玻璃蓋可以拆卸,能順利把供試植物放入玻璃箱里,箱子正面和右側(cè)各有1個(gè)小圓孔,正面小圓孔用于通入甲醛氣體和甲醛濃度測定儀的傳感器伸入箱內(nèi)進(jìn)行甲醛濃度的測定,右側(cè)小圓孔用于接通小風(fēng)扇的電源線。在試驗(yàn)之前箱體需要全部密封,以保證甲醛氣體不外散。
1.1.4? 甲醛濃度測定儀器
甲醛濃度測定選用甲醛檢測儀(儀器型號為Interscan-4160-19.99 ppm,美國Interscan公司生產(chǎn))。
1.2? 綠蘿相關(guān)指標(biāo)測定
1.2.1? 鮮重、葉長、葉寬、莖長、根長、葉離心率和葉面積測定
試驗(yàn)之前和光照培養(yǎng)結(jié)束后測定綠蘿初始鮮重、葉長、葉寬、莖長、根長、葉離心率和葉面積。用稱量法測定鮮重,用量尺測量葉長、葉寬、莖長和根長,葉離心率用以下公式進(jìn)行計(jì)算,葉片離心率=葉長/葉寬,用紙張稱重法測定葉面積[35]。
1.2.2? 可溶性蛋白、丙二醛(Malondialdehyde, MDA)含量和酶活性測定
可溶性蛋白含量采用考馬斯亮藍(lán)染色法進(jìn)行測定[36];MDA可采用硫代巴比妥酸法進(jìn)行測定[37];超氧化物歧化酶(Superoxide dismutase, SOD)采用氮藍(lán)四唑法進(jìn)行測定[38];過氧化氫酶(Catalase, CAT)采用紫外吸收法進(jìn)行測定[39];甲醛脫氫酶(Formaldehyde dehydrogenase, FADH)利用酶促反應(yīng)物對應(yīng)的NADH(煙酰胺腺嘌呤二核苷酸還原態(tài))的產(chǎn)生情況檢測相應(yīng)的酶活性[40]。
1.2.3? ?葉綠素含量及葉綠素?zé)晒馓匦詼y定
葉綠素含量采用丙酮法進(jìn)行測定[41]。
葉綠素?zé)晒鈪?shù)采用脈沖幅度調(diào)制熒光計(jì)(Maxi-version of the Imaging-PAM, Heinz Walz GmbH, Germany)進(jìn)行測定。在每種光照處理下選取3片綠蘿葉片,暗處理 20 min后,利用葉綠素?zé)晒鈨x測定葉綠素?zé)晒鈪?shù)。將樣品放入樣品室,在實(shí)時(shí)熒光 Ft穩(wěn)定后,按 “F0(初始熒光)、Fm(最大熒光產(chǎn)量)”按鈕,儀器會自動給出熒光基本參數(shù)F0、Fm、Fv/Fm,其他熒光參數(shù)可根據(jù)以下公式計(jì)算:
可變熒光(Fv)=Fm-F0 (1)
PSⅡ最大光合效率(Fv/Fm) =(Fm-F0)/Fm (2)
PSⅡ最大光化學(xué)量子產(chǎn)量(Fv/F0) =(Fm-F0)/F0 (3)
1.3? ?綠蘿對甲醛的吸附試驗(yàn)
用1.1.3設(shè)計(jì)的熏蒸室進(jìn)行甲醛吸附試驗(yàn),每個(gè)處理組選取3株具有代表性的植株,將綠蘿根部土壤去除,用聚四氟乙烯薄膜將植株根部密封包裹后放入玻璃箱中。用循環(huán)空氣泵向熏蒸室中通入甲醛,使其濃度穩(wěn)定在2.5±0.3 mg·m-3,其中 1 個(gè)熏蒸室不放置綠蘿作為空白對照,其余3個(gè)熏蒸室放入綠蘿,當(dāng)熏蒸室中甲醛氣體保持平衡之后(大約10~15 min),開始進(jìn)行甲醛吸附試驗(yàn),試驗(yàn)時(shí)長為 4 h,每隔 1 h測量1次熏蒸室中的甲醛濃度(綠蘿吸附甲醛的試驗(yàn)過程處于室內(nèi)自然光環(huán)境下)。
2? ?結(jié)果與分析
2.1? 不同光強(qiáng)紅藍(lán)光種植的綠蘿對甲醛去除效果的影響
2.1.1? 不同光強(qiáng)紅藍(lán)光種植的綠蘿對甲醛吸附量的影響
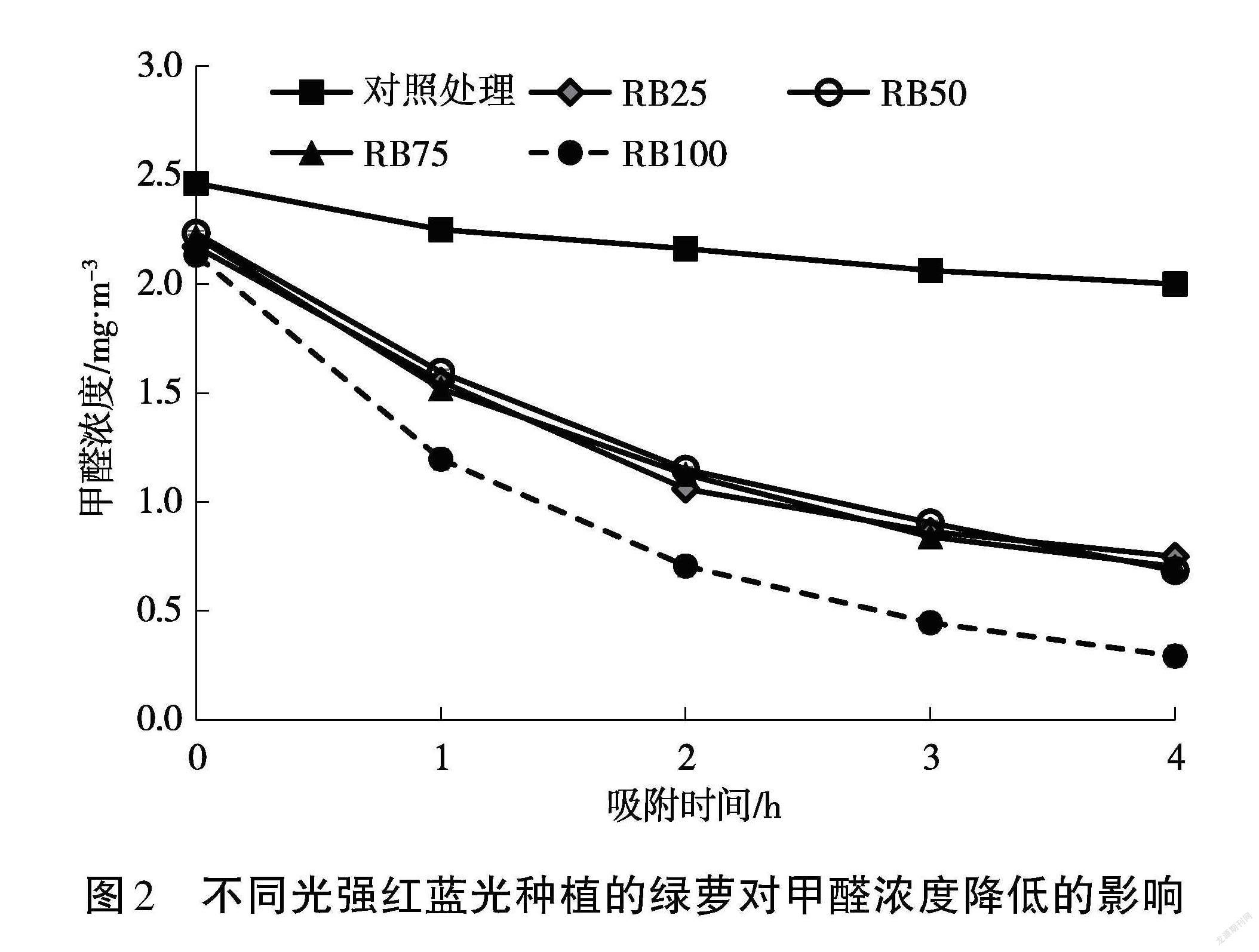
試驗(yàn)采用單因素方差分析(One-way ANOVA)檢驗(yàn)處理組之間的差異性。圖2是不同光強(qiáng)紅藍(lán)光條件下種植的綠蘿對甲醛吸附量的影響。熏蒸室體積為 0.216 m3,甲醛初始濃度為 2.5±0.3 mg·m-3。由于玻璃箱的密封性和有機(jī)氣體的不穩(wěn)定性,經(jīng)過 4 h放置之后,對照處理組的甲醛濃度降為 2.06 mg·m-3。放置了RB100、RB75、RB50 和 RB25 條件下培養(yǎng)的綠蘿的熏蒸室經(jīng)過 4 h吸附試驗(yàn),玻璃箱中甲醛濃度分別為 0.29 mg·m-3、0.70 mg·m-3、0.69 mg·m-3、0.75 mg·m-3。從圖中可以看出,不同條件下種植的綠蘿對甲醛的吸附量影響顯著,RB100條件下種植的綠蘿對甲醛的吸附效果顯著高于RB25、RB50和RB75處理組(P<0.05),而RB25、RB50、RB75處理組之間沒有顯著差異(P>0.05)。
2.1.2? 不同光強(qiáng)紅藍(lán)光種植的綠蘿對甲醛去除率的影響
圖3 是不同光強(qiáng)紅藍(lán)光條件下種植的綠蘿對甲醛去除率的影響,可以看出,各處理組綠蘿的甲醛去除率差異顯著。RB100、RB75、RB50、RB25處理組的甲醛去除率分別為87.20%、68.24%、69.40%、65.49%。從圖中可以看出,RB100處理組綠蘿的甲醛去除率顯著高于 RB25、RB50、RB75(P<0.05),而RB25、RB50、RB75處理組之間沒有顯著差異(P>0.05)。結(jié)合2.1.1可知,與較低紅藍(lán)光強(qiáng)培養(yǎng)的綠蘿相比,較高紅藍(lán)光強(qiáng)培養(yǎng)的綠蘿對甲醛去除效果較好。
2.2? 不同光強(qiáng)紅藍(lán)光對綠蘿生長特征的影響
2.2.1? 不同光強(qiáng)紅藍(lán)光對綠蘿鮮重、莖長、根長的影響
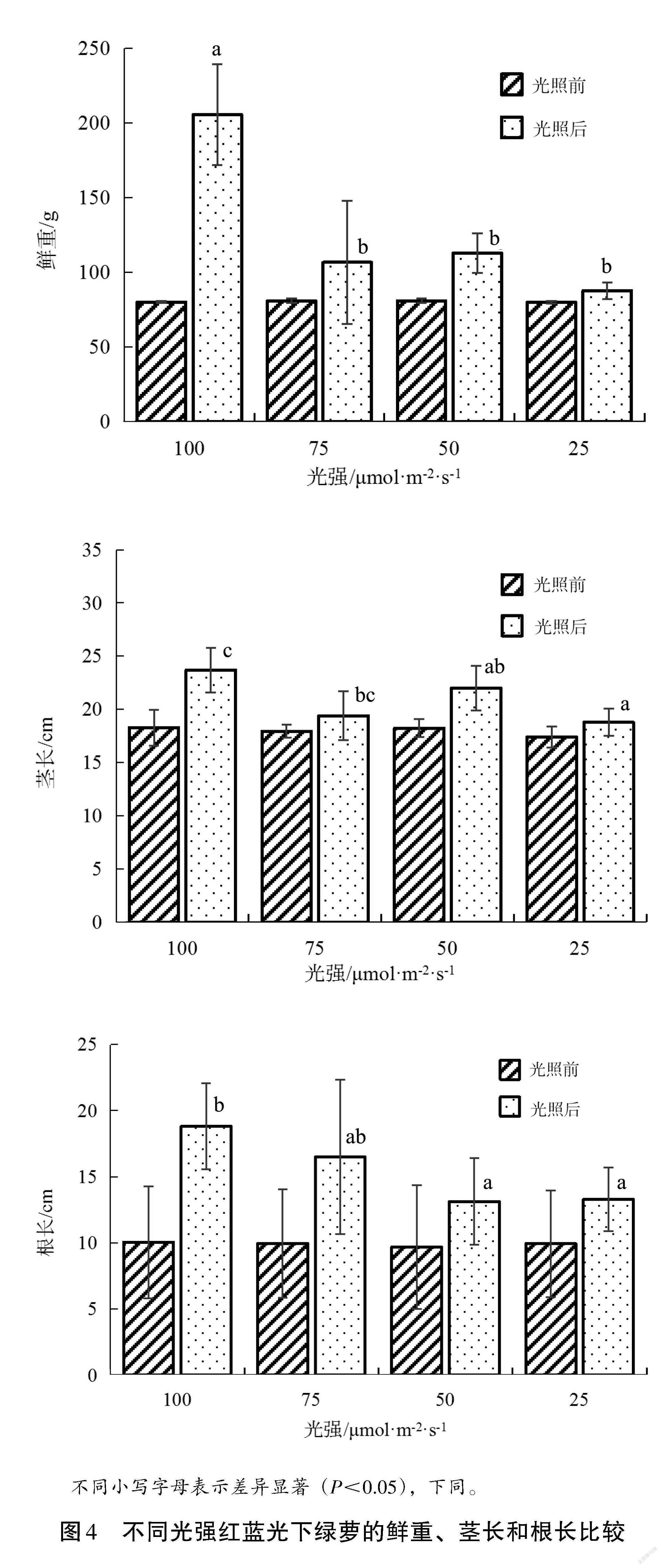
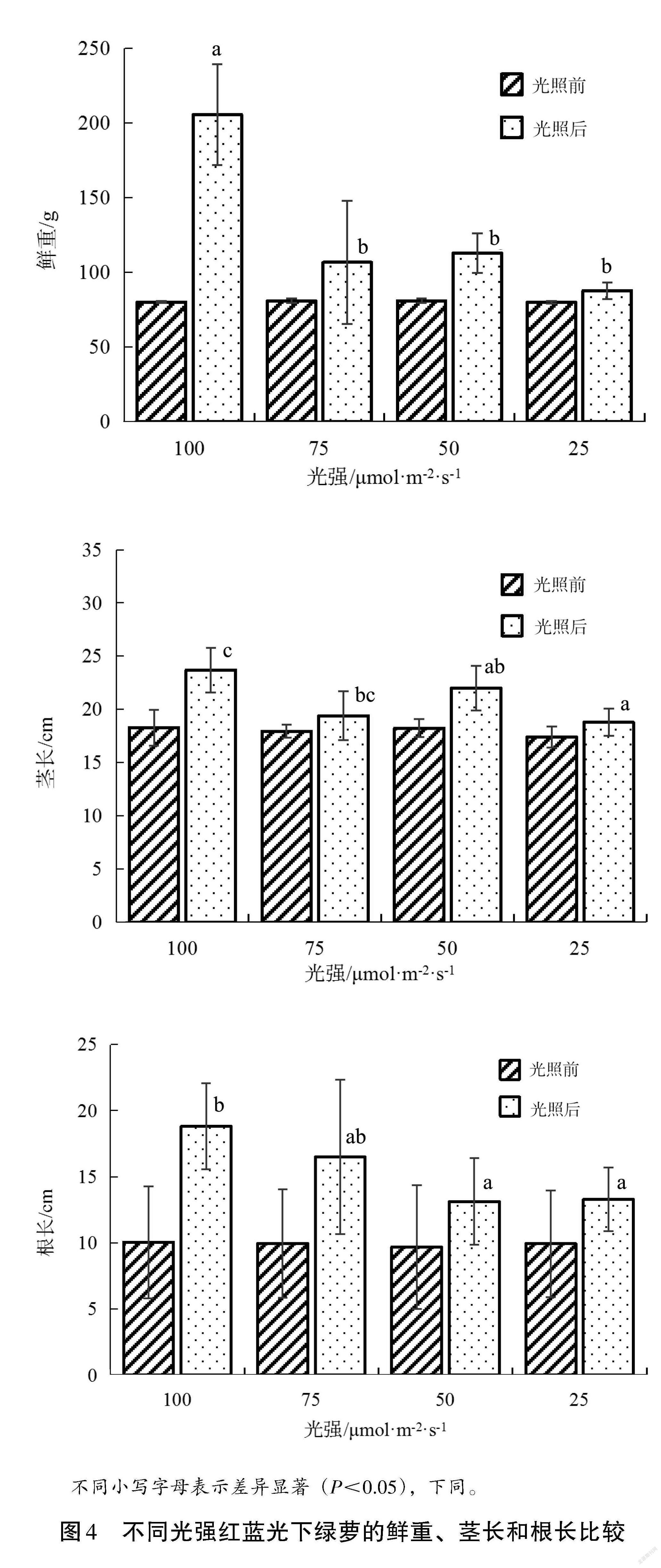
圖 4 是不同光強(qiáng)紅藍(lán)光對綠蘿生長特征的影響,試驗(yàn)前不同光照處理組的綠蘿鮮重、莖長、根長基本一致;試驗(yàn)后,不同處理組的綠蘿鮮重差異顯著。可以看出,RB100 處理組綠蘿鮮重為205.6 g,顯著高于RB25、RB50、RB75(P<0.05),但RB25、RB50、RB75處理組之間的綠蘿鮮重沒有顯著差異(P>0.05),其鮮重分別為87.8 g、112.8 g、106.6 g;在莖長和根長方面,RB100處理組的綠蘿莖長、根長分別為23.7 cm、18.8 cm,顯著高于 RB25和RB50處理組(P<0.05),RB25、RB50、RB75處理組綠蘿的莖長分別為18.8 cm、22.0 cm、19.4 cm,根長分別為13.3 cm、13.1 cm、16.5 cm。綠蘿的鮮重、莖長、根長在較高的紅藍(lán)光強(qiáng)條件下表現(xiàn)較好,并隨著紅藍(lán)光強(qiáng)增大,綠蘿的鮮重、莖長、根長也呈增大趨勢。
2.2.2? 不同光強(qiáng)紅藍(lán)光對綠蘿葉片特征的影響
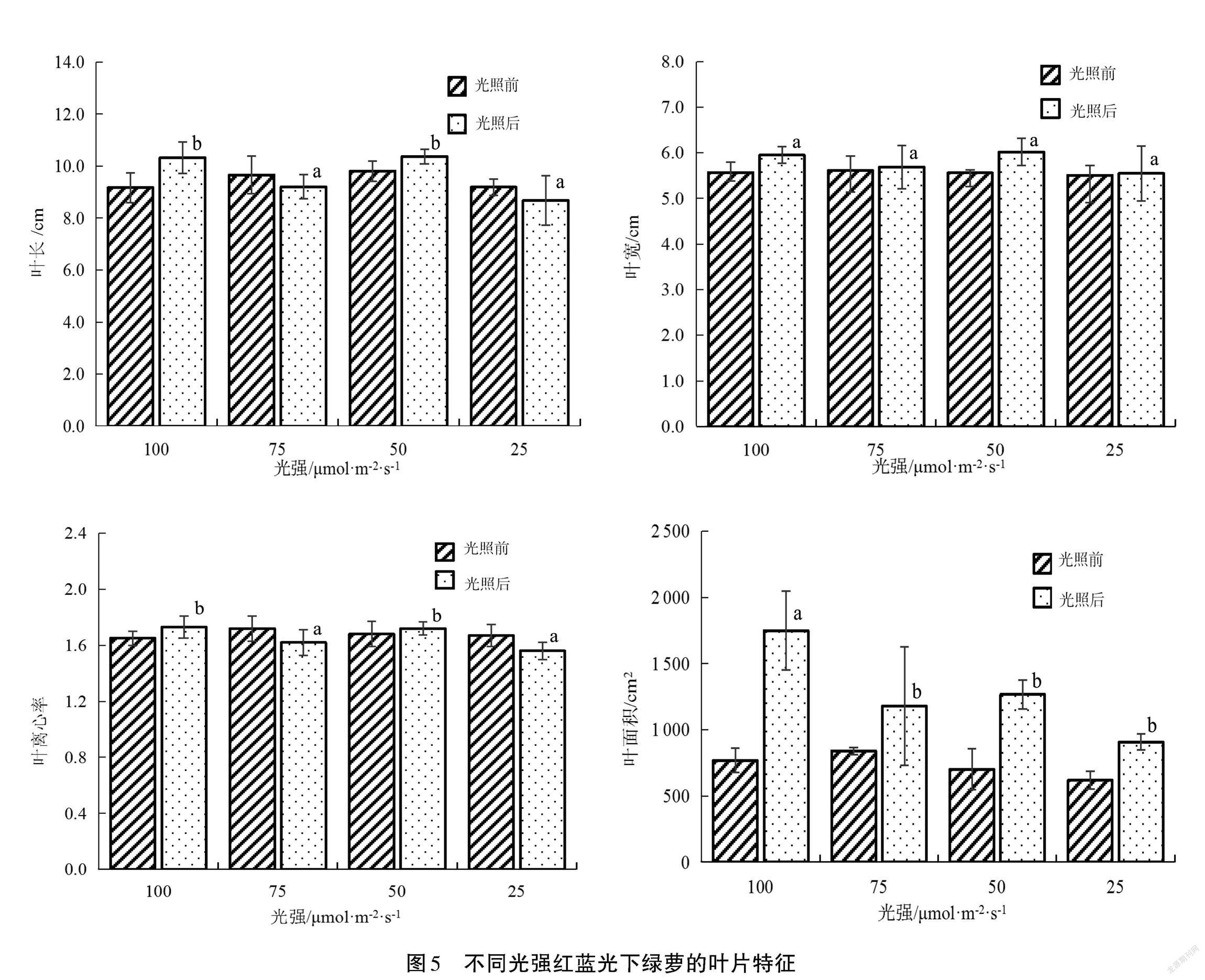
圖5為不同光強(qiáng)紅藍(lán)光對綠蘿葉片特征的影響。試驗(yàn)前不同光照處理的綠蘿平均葉長、葉寬、葉離心率和葉面積基本一致;試驗(yàn)后,RB100、RB50處理組綠蘿的葉長和葉離心率顯著高于 BR75、RB25處理組(P<0.05),RB25、RB50、RB75、RB100的葉長分別為8.68 cm、10.37 cm、9.21 cm、10.32 cm,葉離心率分別為1.56、1.72、1.62、1.73。不同處理組的葉寬沒有顯著差異(P>0.05),RB25、RB50、RB75、RB100處理組綠蘿的葉寬分別為5.55 cm、6.02 cm、5.69 cm、5.95 cm。RB100處理組綠蘿的葉面積為1 749.13 cm2,顯著高于RB25、RB50和RB75(P<0.05),RB25、RB50和RB75的葉面積分別為906.81 cm2、1 267.5 cm2和1 180.14 cm2,且這3組處理之間沒有顯著差異(P>0.05)。綠蘿的葉片特征在較高的紅藍(lán)光強(qiáng)條件下表現(xiàn)較好,隨著紅藍(lán)光強(qiáng)增大,綠蘿的葉面積呈增大趨勢,葉長、葉寬、葉離心率變化并不顯著。
2.3? 不同光強(qiáng)紅藍(lán)光對綠蘿生化特性的影響
2.3.1? 不同光強(qiáng)紅藍(lán)光對綠蘿可溶性蛋白和葉綠素含量的影響
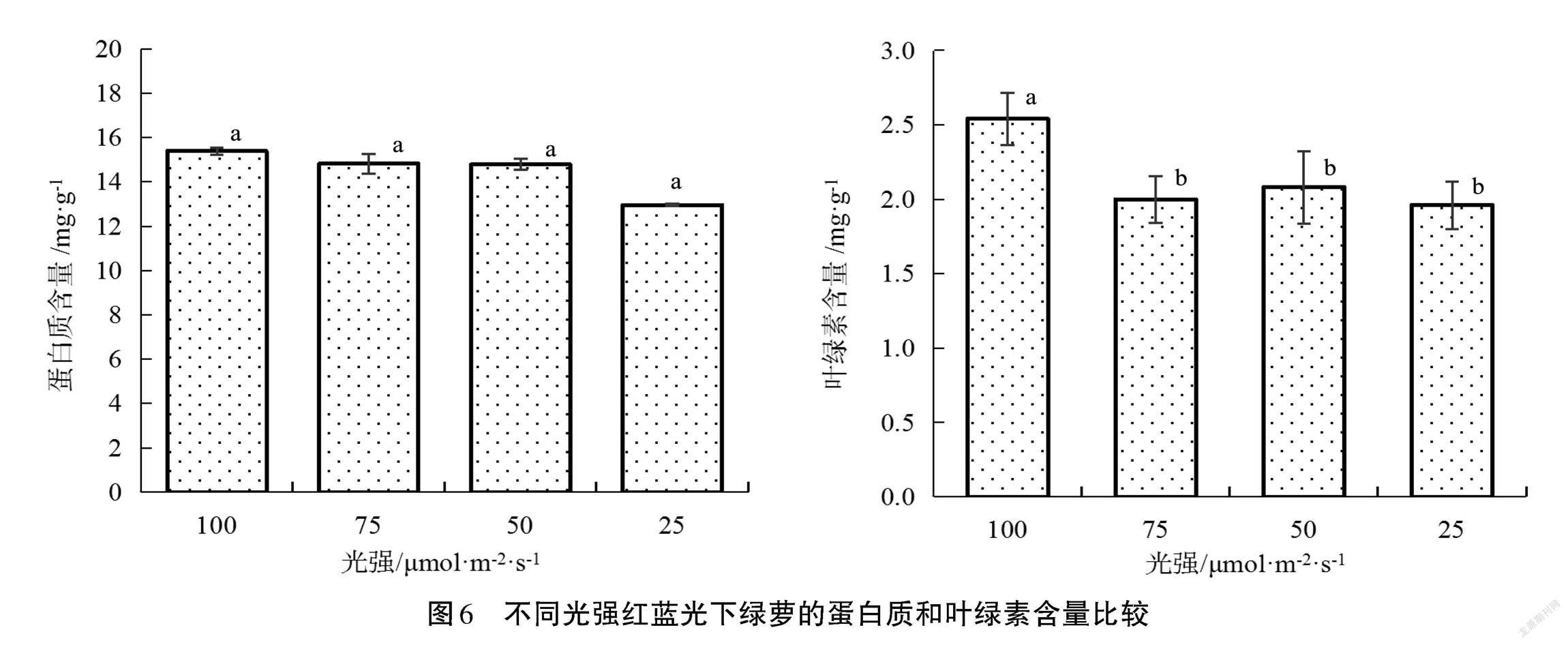
由圖6可見,RB25、RB50、RB75、RB100處理組綠蘿的可溶性蛋白含量沒有顯著差異(P>0.05),分別為12.96 mg·g-1、14.78 mg·g-1、14.82 mg·g-1、15.39 mg·g-1。RB100處理組綠蘿的葉綠素含量顯著高于RB25、RB50、RB75(P<0.05),RB25、RB50、RB75、RB100處理組綠蘿的葉綠素含量分別為1.95 mg·g-1、2.07 mg·g-1、2.00 mg·g-1、2.54 mg·g-1,并且隨著紅藍(lán)光強(qiáng)增大,綠蘿葉綠素含量也隨之升高。
2.3.2? 不同光強(qiáng)紅藍(lán)光對綠蘿 SOD、MDA、CAT 、FADH的影響
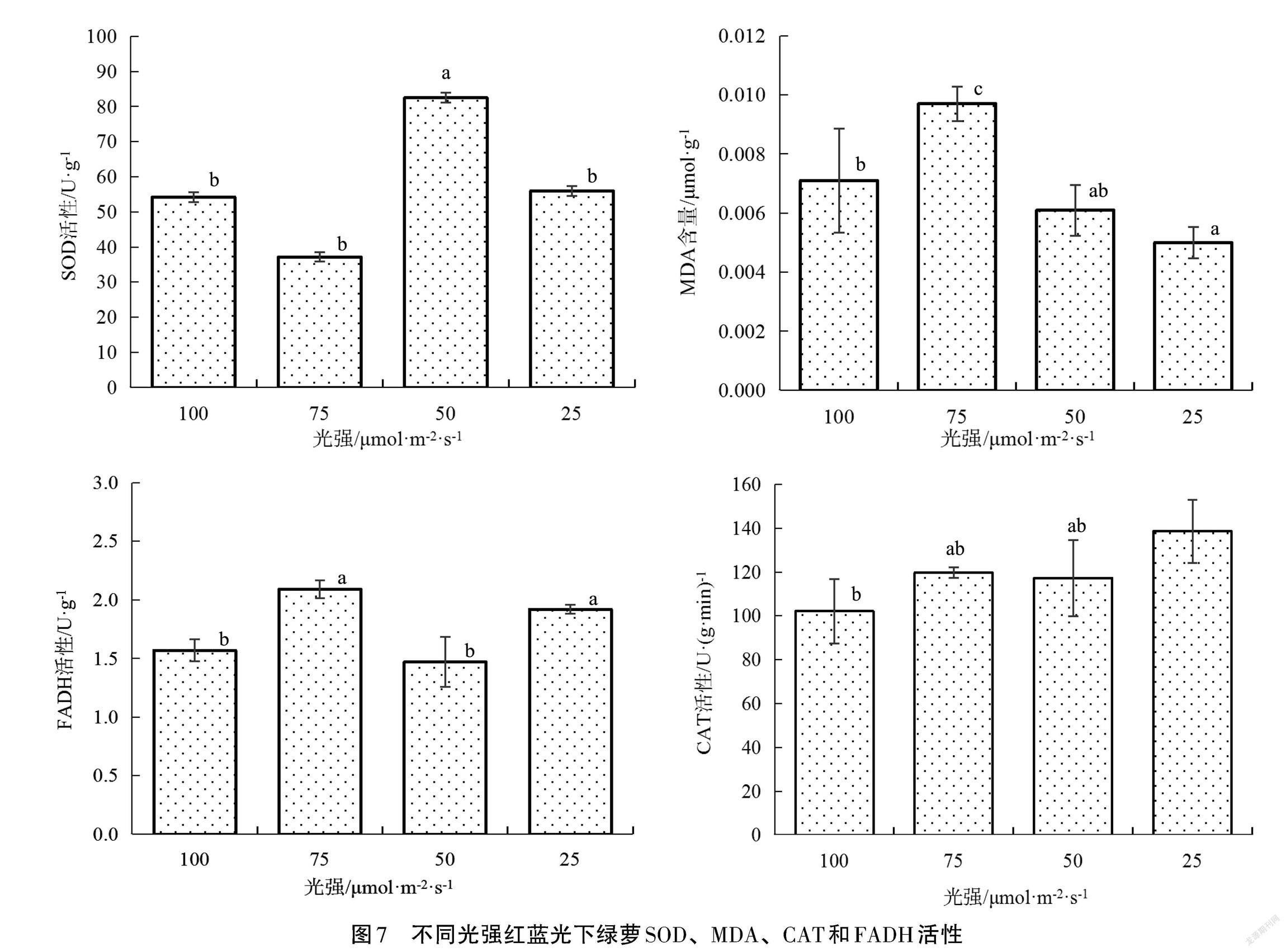
由圖7可以看出,綠蘿經(jīng)過RB25、RB50、RB75、RB100光照條件培養(yǎng)后,其SOD酶活性分別為55.96 U·g-1、82.51 U·g-1、37.71 U·g-1、54.22 U·g-1,RB100條件下的綠蘿SOD 酶活性顯著低于RB50(P<0.05)。RB100光照條件下的綠蘿MDA含量為 0.0071 μmol·g-1,顯著低于 RB75(P<0.05),RB25、RB50、RB75處理組的綠蘿MDA含量分別為0.005 0 μmol·g-1、0.006 1 μmol·g-1、0.009 7 μmol·g-1。
綠蘿CAT隨紅藍(lán)光強(qiáng)增強(qiáng)大致呈下降趨勢,RB25、RB50、RB75、RB100條件下的綠蘿CAT活性分別為138.59 U·(g·min)-1、117.2 U·(g·min)-1、119.69 U·(g·min)-1、102.09 U·(g·min)-1,RB100光照條件下的綠蘿 CAT 活性顯著低于 RB25(P<0.05)。隨著光強(qiáng)的增加,F(xiàn)ADH 活性沒有明顯的變化規(guī)律,RB50、RB100條件下的綠蘿FADH活性分別為 1.48 U·g-1、1.55 U·g-1,顯著低于 RB25(1.92 U·g-1)、RB75(2.09 U·g-1)。
2.4? 不同光強(qiáng)紅藍(lán)光對綠蘿葉綠素?zé)晒鈪?shù)的影響
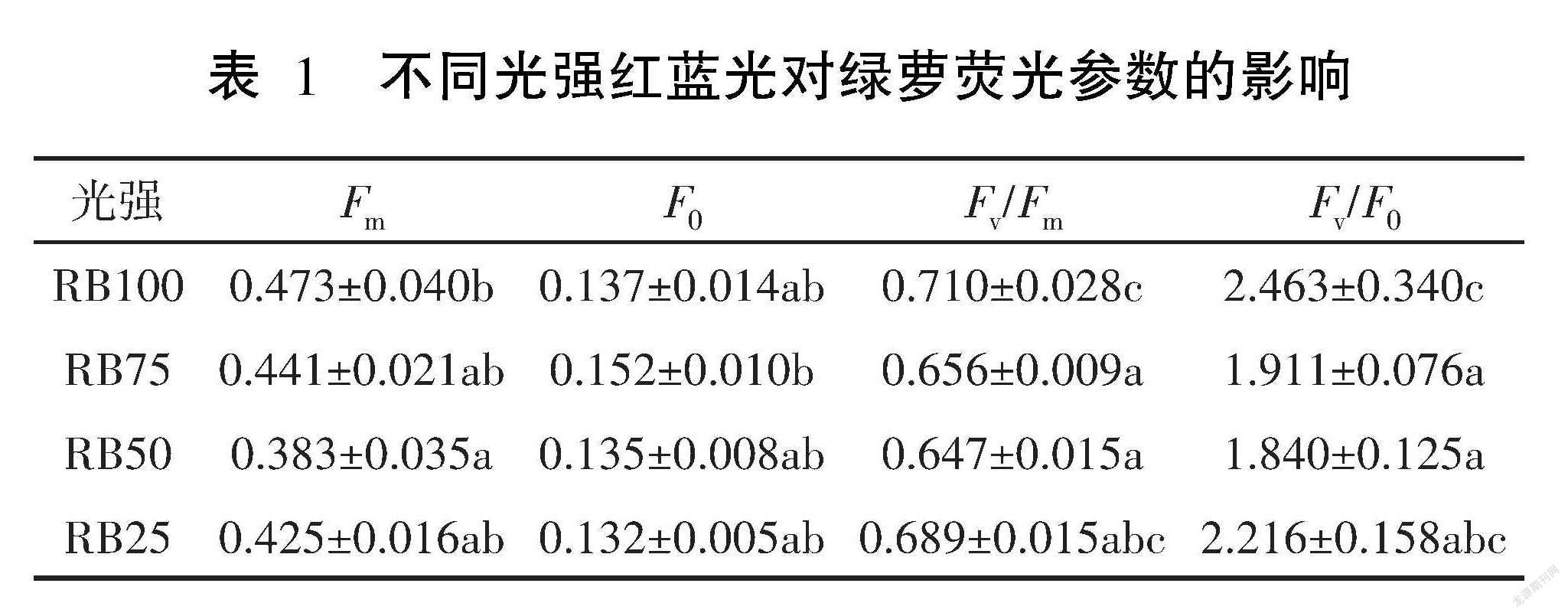
表1是不同光強(qiáng)紅藍(lán)光對綠蘿熒光參數(shù)的影響,4個(gè)處理的熒光參數(shù)F0 沒有顯著差異(P>0.05)。在RB100光照條件下,綠蘿的Fm、Fv/Fm、Fv/F0分別為0.473、0.710、2.463,均為各處理組中的最大值。RB100條件下的綠蘿熒光參數(shù)Fm顯著高于 RB50(P<0.05),F(xiàn)v/Fm和Fv/F0顯著高于RB50和RB75(P<0.05)。隨著紅藍(lán)光強(qiáng)增大,綠蘿的Fv/Fm、Fv/F0呈現(xiàn)先減小后增大趨勢,并且在紅藍(lán)光100 μmol·m-2·s-1條件下達(dá)到最大值,說明綠蘿在較高光強(qiáng)條件下的光合性能比低光強(qiáng)條件下的好。
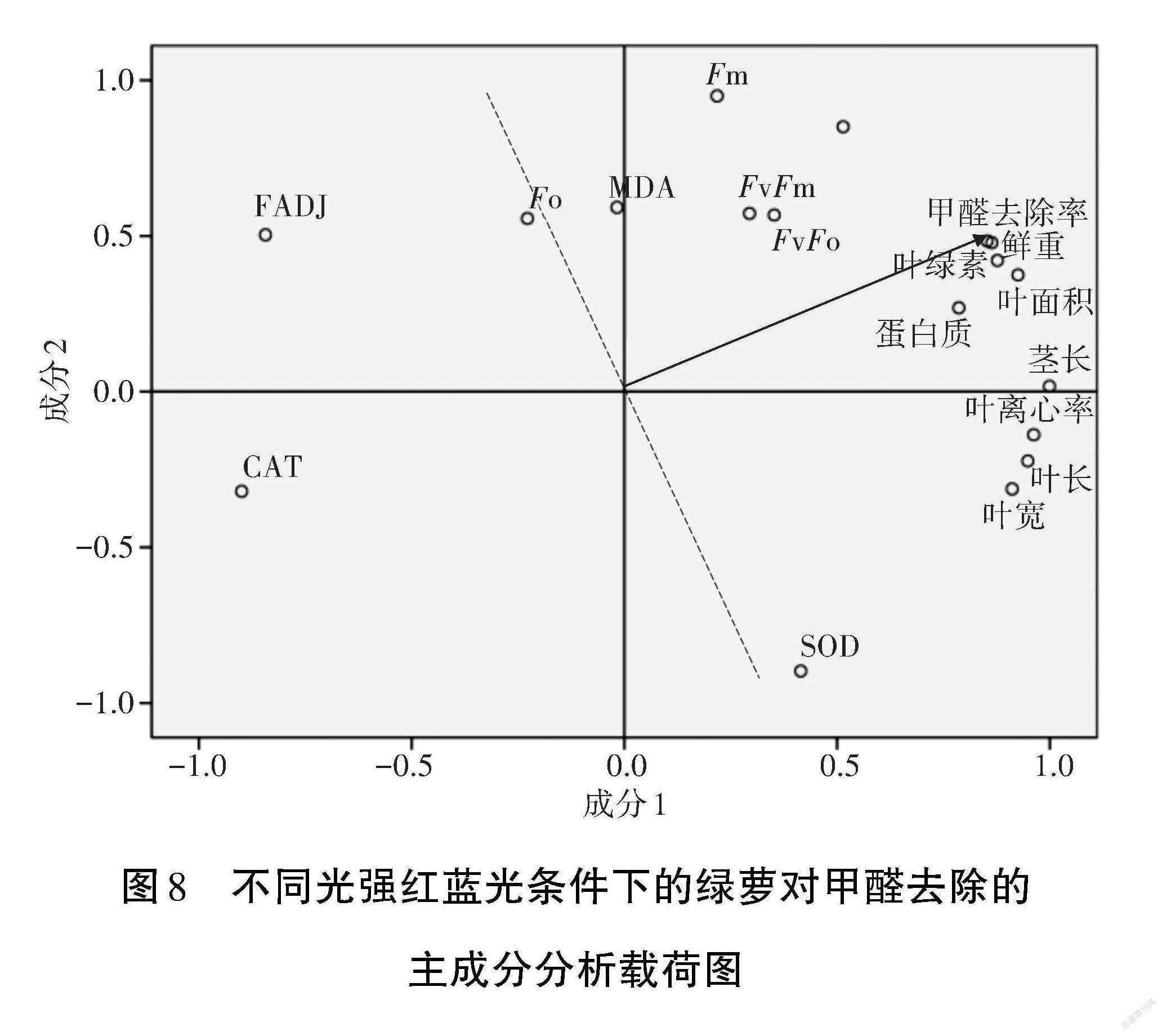
2.5? 不同光強(qiáng)紅藍(lán)光種植的綠蘿生長特征與其對甲醛去除之間的關(guān)系
利用光強(qiáng)原始數(shù)據(jù)矩陣的主成分分析載荷圖考察綠蘿的各項(xiàng)生理參數(shù)與甲醛去除效率之間的關(guān)系。如圖8所示,將甲醛去除率表示點(diǎn)與原點(diǎn)連成1條線,其他點(diǎn)與原點(diǎn)的連線與此線成銳角的表示綠蘿的該項(xiàng)生理參數(shù)與甲醛去除相關(guān)性較大,與此線成鈍角表示綠蘿的該項(xiàng)生理參數(shù)與甲醛去除相關(guān)性不大。分析發(fā)現(xiàn),不同光強(qiáng)紅藍(lán)光種植的綠蘿鮮重、葉面積、葉綠素、蛋白質(zhì)與甲醛去除效率相關(guān)性最大,其他Fm、Fv/Fm、Fv/F0、莖長等參數(shù)與甲醛去除相關(guān)性稍弱,而綠蘿的CAT活性與甲醛去除之間相關(guān)性不大。此外,綠蘿的甲醛脫氫酶與甲醛去除之間相關(guān)性也并不顯著,這可能是由于吸附試驗(yàn)的時(shí)間較短(4 h),而較短時(shí)間內(nèi)綠蘿主要通過植物的表皮去除甲醛,酶活性的影響并不顯著。
3? ?小結(jié)與討論
以LED為照明系統(tǒng),研究了不同光強(qiáng)(25、50、75、100 μmol·m-2·s-1)紅藍(lán)光對綠蘿生長特征及光合作用的影響機(jī)制,探究了不同光強(qiáng)紅藍(lán)光條件下種植的綠蘿對甲醛去除效果的影響,揭示了綠蘿生長特征和光合作用等與甲醛去除之間的關(guān)系。結(jié)果發(fā)現(xiàn),RB100處理組的綠蘿生長情況最好,其鮮重、莖長、根長和葉面積顯著高于其他處理組,綠蘿的鮮重、莖長、根長隨著光照增強(qiáng)呈增大趨勢,并且綠蘿的可溶性蛋白和葉綠素含量在RB100條件下達(dá)到最大,分別為 15.39 mg·g-1和2.54 mg·g-1。此結(jié)果與Cheng等研究結(jié)果相似,其研究表明,光照增強(qiáng)會促進(jìn)植物主莖生長和側(cè)枝伸長[42];相比其他3種較低光強(qiáng),280 μmol·m-2·s-1 紅藍(lán)光能提高紅莧(Amaranthus mangostanus L.)和多葉蔬菜莧的產(chǎn)量,且其體內(nèi)葉綠素a、葉綠素b和類胡蘿卜素含量增加[43];隨著紅藍(lán)光照強(qiáng)度的增加,油菜(Brassica napus L.)幼苗的株高、莖粗、根長、葉面積和干重逐漸增加[44]。本研究表明,在光強(qiáng)100 μmol·m-2·s-1 以下的紅藍(lán)光條件下,光照增強(qiáng)顯著有利于綠蘿的生長。
綠蘿在較低光強(qiáng)(RB25、RB50)下的SOD酶活性高于較高光強(qiáng)(RB100、RB75)下的SOD。CAT酶活性隨光強(qiáng)增大呈下降趨勢,在RB25條件下最高,在RB100條件下最低。綠蘿的MDA含量排序?yàn)镽B75>RB100>RB50>RB25。Gong等發(fā)現(xiàn)在較低的光照強(qiáng)度下柴胡(Bupleurum chinense)的SOD和CAT活性較高,MDA含量較低,與本結(jié)果相似[45],這可能是因?yàn)樵诘凸鈴?qiáng)下,更多的能量被分配給光保護(hù),并且產(chǎn)生了很強(qiáng)的抗氧化性[46]。本研究表明,在100 μmol·m-2·s-1 條件下綠蘿的抗氧化能力表現(xiàn)較好。
葉綠素?zé)晒馀c光合作用密切相關(guān),F(xiàn)m的降低和F0的升高表明植物受到了環(huán)境脅迫[47],F(xiàn)v/Fm、Fv/F0可以反映植物是否受到光抑制[48]。綠蘿的F0隨光強(qiáng)增大呈先增加后減小的趨勢,在RB75條件下達(dá)到最大,其Fm、Fv/Fm、Fv/F0值隨光強(qiáng)增大呈先減小后增加的趨勢,在RB100達(dá)到最大。已有研究表明,西番蓮(Passiflora caerulea L.)的Fm、Fv/Fm、Fv/F0值均隨光強(qiáng)增大而增加[49];但高粱[Sorghum bicolor (L.) Moench]的Fv/Fm隨光照強(qiáng)度增加而降低[50],這與植物適應(yīng)光環(huán)境能力的差異有關(guān)。本結(jié)果表明,RB25條件下的綠蘿受光強(qiáng)脅迫嚴(yán)重,RB100 條件下光合活性最大,利于綠蘿進(jìn)行光合作用。
在試驗(yàn)中RB100的較高光照條件下種植的綠蘿的甲醛去除率最大,達(dá)到 87.20%,這與Porter等研究結(jié)果相似,當(dāng)光強(qiáng)為 35 μmol·m-2·s-1時(shí),前3 h的大王黛粉葉對甲苯的去除率僅為6.17%,當(dāng)光強(qiáng)提高到90 μmol·m-2·s-1 時(shí),甲苯去除率增加了5倍,達(dá)到33%[32];Schmitz研究發(fā)現(xiàn),光照條件下綠蘿和垂葉榕對甲醛的吸收量是黑暗條件下的5倍[51];夾竹桃(Nerium indicum Mill.)對甲醛的吸收速率隨光強(qiáng)增大而增加[52]。因此,較適宜的光照條件能夠有利于綠蘿的生長代謝和光合作用,更加有利于其對室內(nèi)污染物的有效去除[19,52]。
本試驗(yàn)結(jié)果表明,不同光強(qiáng)紅藍(lán)光條件下種植的綠蘿鮮重、葉面積、葉綠素、蛋白質(zhì)與甲醛去除效率顯著相關(guān)。在光強(qiáng)為100 μmol·m-2·s-1的紅藍(lán)光條件下,綠蘿對甲醛的去除效果最佳,去除率達(dá)到87.20%,并且該條件下綠蘿的鮮重、根長、莖長、葉面積等達(dá)到最佳生長效果,CAT酶活性最低,葉綠素含量及熒光參數(shù)Fm、Fv/Fm、Fv/F0值最大,綠蘿的光合作用效率最高。
參考文獻(xiàn):
[1] Hoppe P. Different aspects of assessing indoor and outdoor thermal comfort[J]. Energy and Buildings, 2002, 34(6): 661-665.
[2] M?lhave L, Krzyzanowski M. The right to healthy indoor air: status by 2002[J]. Indoor Air, 2003, 13(13): 50-53.
[3] Mahdi J, Rahimi M S, Mansour B, et al. Occupational exposure to formaldehyde, lifetime cancer probability, and hazard quotient in pathology lab employees in Iran: a quantitative risk assessment[J]. Environmental Science and Pollution Research International, 2020, 28: 1878-1888.
[4] Martín J G, Kraakman N J R, Pérez C, et al. A state-of-the-art review on indoor air pollution and strategies for indoor air pollution control[J]. Chemosphere, 2021, 262:128376.
[5] Zhai L, Zhao J, Xu B, et al. Influence of indoor formaldehyde pollution on respiratory system health in the urban area of Shenyang, China[J]. African Health Sciences, 2013, 13(1):137-143.
[6] Chin J Y, Godwin C, Parker E, et al. Levels and sources of volatile organic compounds in homes of children with asthma[J]. Indoor Air, 2014, 24: 403-415.
[7] Nielsen G D, Wolkoff P. Cancer effects of formaldehyde: a proposal for an indoor air guideline value[J]. Archives of Toxicology, 2010, 84: 423-446.
[8] Guimar?es J R, Turato Farah C R, Maniero M G, et al. Degradation of formaldehyde by advanced oxidation processes[J]. Journal of Environmental Management, 2012, 107: 96-101.
[9] Duan J, Guo S, Tan J, et al. Characteristics of atmospheric carbonyls during haze days in Beijing, China[J]. Atmospheric Research, 2012, 114-115: 17-27.
[10] Lang I, Bruckner T, Triebig G. Formaldehyde and chemosensory irritation in humans: A controlled human exposure study[J]. Regulatory Toxicology and Pharmacology, 2007, 50(1): 23-36.
[11] Molina Aragonés J M, Bausà Peris R, Carreras Valls R, et al. Scoping review about formaldehyde toxicity on occupationally exposed workers[J]. Archivos de Prevención de Riesgos Laborales, 2018, 21(3):128-157.
[12] Ferreira A, Paix?o S, Figueiredo J P, et al. Environment air quality and health[J]. Annals of Medicine, 2019, 51: 70-70.
[13] Wu X M, Apte M G, Maddalena R, et al. Volatile organic compounds in small-and medium-sized commercial buildings in California[J]. Environmental Science & Technology, 2011, 45: 9075-9083.
[14] Saini V K, Pries J. Development of metal organic fromwork-199 immobilizedzeolite foam for adsorption of common indoor VOCs[J]. Journal of Environmental Science, 2017, 5: 321-330.
[15] Ying T, Lei B, Robert J G M, et al. Cryogenic circulation for indoor air pollution control[J]. Science of the Total Environment, 2019, 651(Pt 1): 1451-1456.
[16] Treesubsuntorn C, Thiravetyan P. Botanical biofilter for indoor toluene removal and reduction of carbon dioxide emission under low light intensity by using mixed C3 and CAM plants[J]. Journal of Cleaner Production, 2018, 194: 94-100.
[17] Akira T, Hewitt C N. Uptake of aldehydes and ketones at typical indoor concentrations by houseplants[J]. Environmental Science &Technology, 2009, 43(21): 8338-8343.
[18] Aydogan A, Montoya L D. Formaldehyde removal by common indoor plant species and various growing media[J]. Atmospheric Environment, 2011, 45(16): 2675-2682.
[19] Xu Z J, Wang L, Hou H. Formaldehyde removal by potted plant-soil systems[J]. Journal of Hazardous Materials, 2011, 192(1): 314-318.
[20] Wood R A, Orwell R L, Tarran J, et al. Potted-plant/growth media interactions and capacities for removal of volatiles from indoor air[J]. The Journal of Horticultural Science and Biotechnology, 2002, 77: 120-129.
[21] Sriprapat W, Thiravetyan P. Efficacy of ornamental plants for benzene removal from contaminated[J]. International Biodeterioration & Biodegradation, 2016, 113: 262-268.
[22] Filtration efficiency and physiological responses of selected plant species to indoor air pollutants (toluene and 2-ethylhexanol) under chamber conditions[J]. Environmental Science and Pollution Research, 2018, 25(1): 447-458.
[23] Arena C, Tsonev T, Doneva D, et al. The effect of light quality on growth, photosynthesis, leaf anatomy and volatile isoprenoids of a monoterpene-emitting herbaceous species (Solanum lycopersicum L.) and an isoprene-emitting tree (Platanus orientalis L.)[J]. Environmental and Experimental Botany, 2016, 130: 122-132.
[24] Wu Q, Su N, Shen W, et al. Analyzing photosynthetic activity and growth of Solanum lycopersicum seedlings exposed to different light qualities[J]. Acta Physiologiae Plantarum, 2014, 36(6): 1411-1420.
[25] Hu J, Dai X, Sun G. Morphological and physiological responses of Morus alba seedlings under different light qualities[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2016, 44: 382-392.
[26] 查凌雁,張玉彬,李宗耕,等.LED紅藍(lán)光連續(xù)光照及其光強(qiáng)對生菜生長及礦質(zhì)元素吸收的影響[J]. 光譜學(xué)與光譜分析, 2019, 39(8): 2474-2480.
[27] 王滿蓮,韋霄,唐輝,等.光強(qiáng)對三種喀斯特植物幼苗生長和光合特性的影響[J].生態(tài)學(xué)雜志, 2015, 34(3): 604-610.
[28] Anastasia A, John H G, Costas F, et al. Photoacclimation in spathiphyllum[J]. Journal of Photochemistry and Photobiology B: Biology, 2004, 73(3): 149-158.
[29] Muhetaer G, Asaeda T, Jayasanka S M D H, et al. Effects of light intensity and exposure period on the growth and stress responses of two cyanobacteria species: pseudanabaena galeata and microcystis aeruginosa[J]. Water, 2020, 12(407):1-14.
[30] Wu H, Heng J, Liu C, et al. Growth, pigment composition, chlorophyll fluorescence and antioxidant defenses in the red alga Gracilaria lemaneiformis (Gracilariales, Rhodophyta) under light stress[J]. South African Journal of Botany, 2015, 100: 27-32.
[31] Kim K J, Kil M J, Song J S. Efficiency of volatile formaldehyde removal by indoor plants: contribution of aerial plant parts versus the root zone[J]. Journal of the American Society for Horticultural Science, 2008, 133(4): 521-526.
[32] Porter J R. Toluene removal from air by Dieffenbachia in a closed environment[J]. Advances in Space Research, 1994, 14(11): 99-103.
[33] 陳祥偉,劉世琦,王越,等. 不同LED光源對烏塌菜生長、光合特性及營養(yǎng)品質(zhì)的影響[J]. 應(yīng)用生態(tài)學(xué)報(bào), 2014, 25(7): 1955-1962.
[34] Wang S, Wang X, Shi X, et al. Red and blue lights significantly affect photosynthetic properties and ultrastructure of mesophyll cells in senescing grape leaves[J]. Horticultural Plant Journal, 2016, 2(2): 82-90.
[35] 王希群,馬履一,賈忠奎,等.葉面積指數(shù)的研究和應(yīng)用進(jìn)展[J].生態(tài)學(xué)雜志,2005(5):537-541.
[36] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem,1976, 72(1-2): 248-254.
[37] Koca K, Yurttas Y, Bilgic S, et al. Effect of preconditioned hyperbaric oxygen and ozone on ischemia-reperfusion induced tourniquet in skeletal bone of rats[J]. Journal of Surgical Research, 2010, 164(1): 83-89.
[38] Giannopolitis C N, Ries S K. Superoxide dismutases: II purification and quantitative relationship with water-soluble protein in seedlings[J].Plant Physiology, 1977, 59(2): 315-318.
[39] Aebi H. Catalase in vitro[J]. Methods Enzymol, 1984, 105: 121-126.
[40] D??az M, Achkor H, Titarenko E, et al. The gene encoding glutathione-dependent formaldehyde dehydrogenase/GSNO reductase is responsive to wounding, jasmonic acid and salicylic acid[J]. FEBS Letters, 2003, 543(1): 136-139.
[41] Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton[J]. Biochemie Und Physiologie Der Pflanzen, 1975, 167(2): 191-194.
[42] Cheng X P, Wang Y F, Dong L Q, et al. Effects of light intensity and regeneration mode on stem form and growth of cunninghamia lanceolata saplings[J]. Journal of Sustainable Forestry, 2020, 39(6): 563-573.
[43] Meas S, Luengwilai K, Thongket T. Enhancing growth and phytochemicals of two amaranth microgreens by LEDs light irradiation[J]. Scientia Horticulturae, 2020, 265:109204.
[44] Yao X, Liu X, Xu Z, et al. Effects of light intensity on leaf microstructure and growth of rape seedlings cultivated under a combination of red and blue LEDs[J]. Journal of Integrative Agriculture, 2017, 16(1): 97-105.
[45] Gong J, Liu M, Xu S, et al. Effects of light deficiency on the accumulation of saikosaponins and the ecophysiological characteristics of wild Bupleurum chinense DC. in China[J]. Industrial Crops & Products, 2017, 99: 179-188.
[46] Zhang W, Gong J, Zhao J, et al. What degree of light deficiency is suitable for saikosaponin accumulation by Bupleurum chinense DC[J]. Industrial Crops & Products, 2018, 122: 392-401.
[47] Zhang C, Atherton J, Pe?uelas J, et al. Do all chlorophyll fluorescence emission wavelengths capture the spring recovery of photosynthesis in boreal evergreen foliage[J]. Plant, Cell & Environment, 2019, 42(12): 3264-3279.
[48] 張守仁.葉綠素?zé)晒鈩恿W(xué)參數(shù)的意義及討論[J].植物學(xué)通報(bào),1999(4):444-448.
[49] Ni Y, Lin K, Chen K, et al. Flavonoid compounds and photosynthesisin passiflora plant leaves under varying light intensities[J]. Plants, 2020, 9(5):633.
[50] Maai, Nishimura, Takisawa, et al. Light stress-induced chloroplast movement and midday depression of photosynthesis in sorghum leaves[J]. Plant Production Science, 2020, 23(2): 172-181.
[51] Schmitz H, Hilgers U, Weidner M. Assimilation and metabolism of formaldehyde by leaves appear unlikely to be of value for indoor air purification[J]. New Phytologist, 2000, 147(2): 307-315.
[52] Kondo T, Hasegawa K, Uchida R, et al. Absorption of formaldehyde by oleander (Nerium indicum)[J]. Environmental Science & Technology, 1995, 29(11): 2901-2903.
收稿日期:2021-09-23
基金項(xiàng)目:浙江省自然科學(xué)基金項(xiàng)目(LY17D050002)。
作者簡介:張紫研(1996—),女,浙江工商大學(xué)環(huán)境科學(xué)與工程學(xué)院環(huán)境工程專業(yè)2018級在讀碩士研究生,研究方向?yàn)榄h(huán)境安全評價(jià)與生態(tài)修復(fù)技術(shù)。E-mail: 2448131538@qq.com。
*為通信作者,E-mail: zhgfang77@zjgsu.edu.cn。
- 南方農(nóng)業(yè)·上旬的其它文章
- 生態(tài)環(huán)境部等7部門聯(lián)合印發(fā)《“十四五”土壤、地下水和農(nóng)村生態(tài)環(huán)境保護(hù)規(guī)劃》
- 農(nóng)業(yè)農(nóng)村部公布100個(gè)全國種植業(yè)“三品一標(biāo)”基地
- 重慶璧山:6個(gè)村上榜美麗巴蜀宜居鄉(xiāng)村示范村名單
- 重慶農(nóng)產(chǎn)品及農(nóng)資價(jià)格周報(bào)2021年第五十二期
- 2021年1—12月重慶肉禽蛋及涉畜禽農(nóng)資市場運(yùn)行情況分析
- 觀賞植物類課程實(shí)訓(xùn)課在線教學(xué)探討

