結腸癌組織SATB2、SIRT1、HOTAIR表達及與預后的相關性
吳泉霖,馬福軍,李肖亮
結腸癌目前主要治療方案為根治性手術結合輔助性放化療,但有20%~50%的患者術后出現復發或轉移,5年生存率僅57%,故研究結腸癌復發和轉移危險因素和分子機制對改善預后有重要意義[1-3]。特定富含AT堿基DNA序列結合蛋白2(SATB2)為核基質相關蛋白,對基因重組和染色質重構具有調節作用,近年研究表明其與多種惡性腫瘤發生和進展存在密切聯系[4]。沉默信息調節因子1(SIRT1)可調節哺乳動物體內信號傳導,對腫瘤細胞凋亡具有抑制作用,與結腸癌發病密切相關,且是導致化療耐藥的重要原因,因此可能對結腸癌預后造成影響[5]。同源盒基因轉錄反義RNA(HOTAIR)為首個被發現參與實體腫瘤發生和進展的長鏈非編碼RNA,文獻報道其與腫瘤細胞侵襲能力密切相關并可導致患者預后不良[6]。本研究以結腸癌患者為樣本分析癌組織SATB2、SIRT1和HOTAIR表達水平及其與預后的相關性,為尋找結腸癌分子標志物或治療靶點提供循證醫學證據。
1 資料與方法
1.1一般資料 選取2014年1月—2016年6月我院診治符合納入及排除標準的102例結腸癌,其中男58例,女44例;年齡31~87(58.16±9.45)歲。腫瘤直徑1.2~8.5(3.94±1.27)cm;病理類型:管狀腺癌79例,黏液腺癌23例;分化程度:高分化14例,中分化37例,低分化43例,未分化8例;美國癌癥聯合委員會(AJCC)臨床分期[7]:Ⅰ期20例,Ⅱ期29例,Ⅲ期40例,Ⅳ期13例。納入標準:①符合《中國結直腸癌診療規范(2015版)》[8]且經病理活檢明確診斷;②年齡≥18歲;③入院前未接受手術、放化療或靶向治療者;④基礎健康狀況良好且預計生存期>6個月;⑤患者及家屬完全知曉本研究內容并簽署同意書。排除標準:①合并其他惡性腫瘤者;②合并其他可對患者預后造成影響的重大疾病者;③臨床資料或隨訪結果欠缺者。
1.2研究方法 采集所有患者性別、年齡、既往病史和隨訪等資料,根據隨訪結果將患者分為死亡組和存活組,經手術或腸鏡獲取2組腫瘤組織并檢測SATB2、SIRT1及HOTAIR表達水平,分析SATB2、SIRT1和HOTAIR表達與結腸癌患者預后的關系。
1.3治療和隨訪 所有患者完善相關檢查后根據AJCC分期、基礎健康狀態和自身意愿選擇手術、放化療或靶向治療。采用電話、微信或門診等方式隨訪,隨訪截止時間為2021年6月30日,每3個月隨訪1次,記錄患者預后及總體生存期(OS),OS為從治療開始至因該疾病導致患者死亡的時間。
1.4SATB2和SIRT1表達水平檢測 取部分結腸癌組織經常規固定、脫水和石蠟包埋后采用Finesse 325型切片機(德國Thermo Shandon公司)制作4 μm切片,72 ℃烘烤4 h后高壓抗原修復,蒸餾水沖洗并以過氧化氫封閉6 min,再采用PBS液(北京鼎國生物技術公司)沖洗。向切片滴加SATB2和SIRT1一抗(美國Santa Cruz公司),4 ℃孵育過夜后以PBS液沖洗3次,加入二抗(北京中杉金橋生物技術有限公司)并室溫孵育60 min,然后再采用PBS液沖洗3次,DAB顯色劑(武漢博士德生物工程公司)染色和蘇木素(武漢博士德生物工程公司)復染,蒸餾水沖洗3次后常規脫水、透明和封片,完成后光鏡下觀察SATB2和SIRT1表達水平。SATB2定位于胞核,SIRT1定位于胞質和胞核,觀察10個高倍鏡視野下染色細胞占比和染色強度,并采用半定量法計算。陽性細胞百分比<5%為0分、5%~25%為1分、25%~50%為2分、50%~75%為3分、≥75%為4分,染色強度無色為0分、淺黃色為1分、棕黃色為2分、棕褐色為3分,兩部分得分相乘為總分,以總分0~2分為陰性,≥3分為陽性。陽性對照為美國Santa Cruz公司提供的陽性切片,陰性對照為PBS液代替一抗。
1.5HOTAIR表達水平檢測 將結腸癌組織研碎后加入Trizol試劑(日本寶生物工程株式會社)并在4 ℃環境以12 000 r/min離心15 min,取上清液置于新離心管中,加入異丙醇后靜置8 min,然后再于4 ℃環境以12 000 r/min離心10 min,去除上清液后加入75%乙醇溶液1 ml,混勻后于4 ℃環境以7500 r/min離心5 min,去除上清液并吸取剩余乙醇,加入無DEPC水溶液(天津艾勒科技有限公司)待檢。應用逆轉錄試劑盒(日本TaKaRa公司)將RNA逆轉錄為cDNA,并采用熒光定量PCR技術檢測HOTAIR表達量,反應體系共10 μl,包括Premix Taq 5 μl,上下游引物各0.2 μl,模板2 μl,dNTP 2.4 μl和ROX DyeⅡ 0.2 μl,引物由上海生工生物有限公司設計,上游序列為5'-GCCTGAACTTCCTCCTGCTATT-3',下游序列為5'-ACACAAAGTGCATACCTACCCA-3'。反應條件為95 ℃/2 min,95 ℃/15 s,58 ℃/30 s,共循環40次,反應完成后采用2%瓊脂糖凝膠電泳并繪制PCR產物熔解曲線,以GAPDH為內部參照,采用2-ΔΔCt法計算HOTAIR相對表達量。
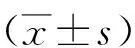
2 結果
2.1不同預后結腸癌患者基本資料比較 本研究中位隨訪時間為72個月,102例隨訪期間死亡67例,病死率為65.69%,中位OS為63個月。死亡組腫瘤最大徑和AJCC分期Ⅲ+Ⅳ期患者占比均大于存活組,腫瘤分化程度低于存活組,差異有統計學意義(P<0.05,P<0.01)。見表1。

表1 不同預后結腸癌患者基本資料比較[例(%)]
2.2不同預后結腸癌患者SATB2、SIRT1及HOTAIR表達情況比較 死亡組SATB2陽性率低于存活組,SIRT1陽性率和HOTAIR mRNA相對表達量高于存活組,差異有統計學意義(P<0.01)。見表2。

表2 不同預后結腸癌患者SATB2、SIRT1及HOTAIR表達情況比較
2.3結腸癌患者預后多因素Cox回歸分析 多因素Cox回歸分析顯示,腫瘤低分化、AJCC分期Ⅲ+Ⅳ期、SIRT1陽性和HOTAIR mRNA為結腸癌患者死亡的危險因素,SATB2陽性為結腸癌患者死亡的保護因素(P<0.05,P<0.01)。見表3。

表3 結腸癌患者預后多因素Cox回歸分析
2.4結腸癌患者生存情況分析 SATB2陽性患者中位OS(69個月)長于SATB2陰性患者(54個月),SIRT1陽性患者中位OS(57個月)短于SIRT1陰性患者(78個月),HOTAIR mRNA≥47.85患者中位OS(57個月)短于HOTAIR mRNA<47.85患者(78個月),差異有統計學意義(P<0.05,P<0.01)。見圖1。

圖1 結腸癌患者生存曲線
3 討論
結直腸癌是胃腸道常見惡性腫瘤[9-11],好發于40~50歲男性,據WHO報道顯示2018年新增和死亡患者數量分別約為180萬人和88萬人,發病率居男性惡性腫瘤第3位,居女性惡性腫瘤第2位[12]。結腸癌發病受基因、環境和飲食習慣等多種因素影響,近年來我國居民因生活水平逐漸改善和飲食結構變化,使得結腸癌發病率明顯升高[13-16]。
目前結腸癌患者整體預后仍不樂觀。本研究隨訪顯示,102例中位OS為63個月,與李榮振等[17]報道結果相近。同時本研究分析顯示,死亡組腫瘤最大徑和AJCC分期Ⅲ+Ⅳ期患者占比大于存活組,腫瘤分化程度明顯低于存活組,提示體積增大、臨床分期增加及分化程度降低均可能導致預后不良。MARKS等[18]分析認為,雖然近年來分子檢測在結直腸癌中的應用逐漸增多,但是臨床和病理資料仍是治療方案選擇和預后判斷的主要依據。本研究多因素Cox回歸分析結果顯示,腫瘤低分化和AJCC分期Ⅲ+Ⅳ期為結腸癌患者死亡的危險因素。
隨著醫學水平快速發展和對結腸癌認識的不斷加深,發現SATB2、SIRT1和HOTAIR與結腸癌存在密切聯系。SATB2包括733個氨基酸,可與富含AT的DNA序列特異性結合并調控基因轉錄和重組,且其作為抑癌基因可參與調節腫瘤細胞免疫、轉移和凋亡等生物學行為,表達缺失可導致結腸癌分化程度降低[19]。本研究結果顯示,死亡組SATB2陽性率低于存活組,多因素Cox回歸分析顯示SATB2為結腸癌患者死亡的保護因素,原因可能與SATB2陽性表達有利于促進腫瘤細胞分化并降低轉移發生風險密切相關。SIMONS等[20]認為SIRT1參與了結腸癌的發展過程,其基因突變可能影響結腸癌發病風險。本研究死亡組SIRT1陽性率明顯高于存活組,且多因素Cox回歸分析顯示SIRT1陽性為結腸癌患者死亡的危險因素,分析原因為SIRT1可通過磷酸化激活腫瘤細胞JNK、ERK和AKT等多種信號通路并促進細胞增殖,從而導致病情進展和預后不良。有研究認為長鏈非編碼RNA在腫瘤發生和進展中發揮重要作用,其中HOTAIR與結腸癌細胞LoVo遷移能力密切相關[21]。本研究結果顯示,死亡組HOTAIR mRNA相對表達量明顯高于存活組,且多因素Cox回歸分析顯示患者死亡風險隨著其表達水平的升高呈上升趨勢。同時本研究采用Log Rank法分析顯示,SATB2陰性、SIRT1陽性和HOTAIR mRNA≥47.85的結腸癌患者中位OS明顯縮短,提示檢測結腸癌組織SATB2、SIRT1和HOTAIR表達水平對判斷患者預后具有一定參考價值。
綜上,結腸癌組織SATB2、SIRT1和HOTAIR表達均為影響患者預后的重要因素。

