ZnO對于CaO吸附CO2性能影響的DFT研究
張友浩 ,徐運飛 ,王菲菲 ,李英杰
(1.山東大學 能源與動力工程學院,山東 濟南,250061;2.山東大學 高效節能及儲能技術與裝備山東省工程實驗室,山東 濟南,250061)
為了盡快實現“雙碳”目標,解決環境問題與能源問題,研究CO2高效捕集與分離技術具有重要意義。目前,CO2捕集方法主要有固體吸附劑、堿性液體洗滌、離子液體吸收等化學方法以及金屬有機框架材料(MOFs)吸附、沸石吸附、膜分離等物理方法[1-3]。其中,CaO基吸附劑的碳酸化/煅燒循環反應捕集CO2是一種具有前景的大規模脫碳技術[4]。因該方法具有能耗低、成本低等優點,目前已經應用于燃燒后捕集CO2[5-6]、熱化學儲能[7-8]、吸收CO2強化制氫[9-11]等技術中,有望在未來廣泛應用于工業生產。
然而,天然CaO 基吸附劑如石灰石、白云石等吸附CO2性能隨著循環次數增加而降低。采用摻雜添加劑對天然CaO 基吸附劑進行改性是提高其吸附CO2性能的有效方法之一[8]。LI等[12]發現MnO和SiC能夠提高CaO吸附CO2的性能,且兩者同時添加時對于CaO 的CO2吸附性能具有協同促進作用,當吸附劑內CaO,MnO 和SiC 的質量比為 100∶5∶5 時,改性CaO 吸附CO2性能最佳;SUN等[13]向CaO 中摻雜CeO2,發現摻加了1%(質量分數)CeO2的CaO 碳酸化轉化率達到0.94,比未改性CaO 提高了35%。WANG等[14]以電石渣為CaO 前驅體制備了多種Ni/CaO 吸附劑,發現Ni/CaO 的CO2吸附率顯著高于天然CaO 吸附劑的CO2吸附率。此外,使用Na,Co,Fe,Zr和La等金屬氧化物對CaO 進行改性,提高其CO2吸附性能,這也被廣泛研究[15-17]。
ZnO 是良好的導熱材料,ZnO 摻雜能夠提升CaO 的導熱性能,有利于CaO 吸附劑的再生過程[18-19]。目前ZnO 已作為添加劑用于提升天然鈣基材料的CO2吸附性能[19-20]。LIU等[20]制備了 ZnO改性CaO吸附劑(CaO/ZnO),研究了ZnO添加量和預處理溫度對于CaO/ZnO 吸附CO2性能的影響,發現當CaO 與ZnO 的物質的量比為8∶1 時,CaO/ZnO的吸附CO2性能最佳,相比于未改性CaO提升23.8%。
然而,目前ZnO 摻雜對于CaO 吸附CO2性能的研究停留在宏觀實驗層面,對于微觀原子層面的機理尚不清楚。因此,有必要通過模擬計算從微觀原子層面揭示ZnO 對CaO 吸附CO2性能的影響機理。本文通過擠出成型法制備ZnO 摻雜CaO吸附劑(ZnO/CaO),研究ZnO/CaO 的CO2吸附性能。基于密度泛函理論(DFT)模擬計算,建立了CaO(0 0 1)和Zn-CaO(0 0 1)表面模型,計算2 種材料吸附CO2的構型、吸附能、分態密度以及差分電子密度,從微觀原子層面揭示ZnO 摻雜對CaO 吸附CO2性能的影響機理。
1 實驗系統與計算方法
1.1 實驗樣品制備
通過等體積浸漬法制備ZnO/CaO。為便于實際工業應用,通過擠出成型法將吸附劑擠壓成型[21]。相比于CaO,Ca(OH)2具有更好的黏性,更易于成型,是一種常用的制備成型鈣基材料的原料[21-23]。而醋酸鹽可在高溫煅燒后形成金屬氧化物,且釋放出的氣體會使材料具有更好的孔隙結構,是應用廣泛的添加劑前驅體[23]。因此,采用Ca(OH)2和醋酸鋅(ZnC4H6O4)(AR,天津市科密歐化學試劑有限公司)作為原材料,制備成型的ZnO摻雜CaO吸附劑。
ZnO 摻雜CaO 吸附劑(ZnO/CaO)制備流程如下:
1) 向一定質量的ZnC4H6O4中加入蒸餾水并充分攪拌至完全溶解,獲得醋酸鋅溶液,其中ZnC4H6O4的質量通過吸附劑內ZnO 質量分數計算得到;
2) 向溶液中加入150 g Ca(OH)2,充分浸漬后置于干燥箱內,在80 ℃下干燥12 h 得到ZnO/ Ca(OH)2粉末;
3) 向ZnO/Ca(OH)2粉末內加入質量分數為3%的聚乙烯吡咯烷酮作為黏結劑,加入少量蒸餾水,充分攪拌至吸附劑形成柔軟膏體,然后利用液壓機擠出成型;
4) 將獲得的ZnO/Ca(OH)2材料在空氣中干燥48 h 后,移至干燥箱內,在80 ℃的條件下干燥8 h;
5) 充分干燥后,將吸附劑置于馬弗爐內,在850 ℃下煅燒15 min,得到ZnO/CaO吸附劑。
KHOSA等[19]研究發現,添加質量分數為5%的ZnO/CaO 具有最佳的儲熱性能。因此,為探究添加ZnO 對于CaO 吸附CO2的作用,制備ZnO 的質量分數分別為1%,3%和5%的ZnO/CaO。為了比較ZnO 摻雜的效果,采用上述步驟(不加入ZnC4H6O4)制備了成型CaO吸附劑。
1.2 實驗流程
利用加壓雙固定床系統進行ZnO/CaO 吸附CO2性能測試實驗。加壓雙固定床系統如圖1 所示。由圖1可見:利用加壓固定床作為碳酸化反應器,常壓固定床作為煅燒反應器。向常壓固定床通入3 L/min 的N2,設定反應器溫度為880 ℃。加壓固定床內通入CO2,并迅速將壓力提升至 0.2 MPa,設定反應器溫度為850 ℃。
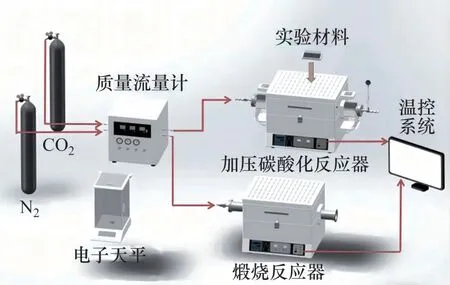
圖1 加壓雙固定床系統Fig.1 Pressurized double fixed bed system
實驗流程如下:取5 g ZnO/CaO樣品置于瓷舟內,將樣品送入碳酸化反應器,密封反應器后增大CO2流量進行加壓,在0.2 MPa 和850 ℃的條件下反應15 min后取出樣品,在干燥皿(充入N2)內冷卻4 min 后稱得反應后樣品質量。稱質量完成后,將樣品送入煅燒反應器內,在純N2、880 ℃的條件下煅燒20 min 后取出樣品,置于干燥皿內冷卻 4 min 后稱質量。以上即為1 次碳酸化/煅燒吸附CO2循環。稱質量完成后,將樣品再次送入碳酸化反應器,進行下一次循環。實驗條件的設定均基于前期研究[21]。
利用碳酸化轉化率評價ZnO/CaO 的吸附CO2性能。XCaCO3,N表示吸附CO2的CaO 質量與樣品內CaO總質量之比,計算式如式(1)所示。
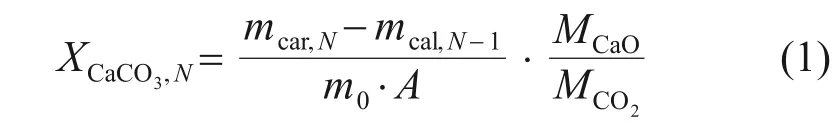
式中:XCaCO3,N為第N次循環后ZnO/CaO 的碳酸化轉化率;mcar,N為第N次碳酸化后的樣品質量,g;mcal,N-1為第N-1次煅燒再生后的樣品質量,g;m0為樣品初始質量,g;A為ZnO/CaO 內ZnO 的質量分數,%;MCaO與MCO2分別為CaO 與CO2的摩爾質量,g/mol。
1.3 計算方法
基于密度泛函理論(DFT)的量子力學方法被普遍認為是一種揭示反應微觀機理的有效途徑。目前,DFT 計算已經被普遍應用于研究添加劑增強CaO吸附CO2機理。近年來,CaO基材料CO2吸附機理的DFT研究總結如表1所示[12,24-28]。
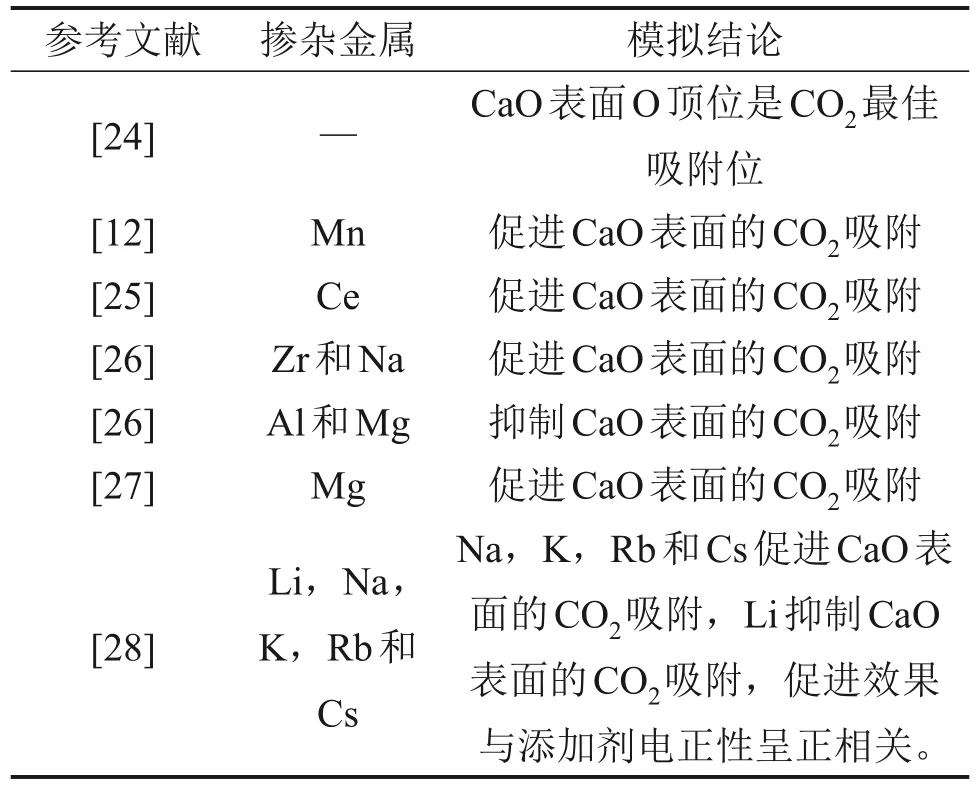
表1 基于DFT計算的摻雜改性對CaO吸附CO2的影響機理[12,24-28]Table 1 CO2 adsorption mechanism of CaO-based adsorbent based on DFT calculation reported in literatures[12,24-28]
為了從原子層面揭示Zn 摻雜對于CaO 吸附CO2性能的影響機理,通過CASTEP程序,采用非限制自旋的Generalized-Gradient-Approximation (GGA)和Perdew-Burke-Ernzerhof (PBE)作為交換相關泛函進行了DFT 計算。基元的原子能量、作用力、壓強和位移的收斂容差分別設置為5×10-6eV,0.1 eV/nm,0.02 GPa 和5×10-5nm。采用BFGS優化算法,電子截斷能設置為630 eV,采用4×4×2的布里淵區的k點取樣,采用OTFG ultrasoft贗勢。
原子替換法是利用添加劑金屬原子替換基底內金屬原子以形成摻雜添加劑基底模型的方法,是通過DFT 計算材料添加金屬氧化物時常用的模型構建方法,YAN等[25]利用原子替換法構建了 Ce-CaO(0 0 1)表面,探究了Ce 摻雜和預先吸附H2O對于CaO基吸附劑CO2吸附性能的影響,計算結果與實驗結果相符合;WANG等[29]利用Ni 替換Ca 構建了Ni-CaO(0 0 1)表面,研究了Ni/CaO 的強化制氫性能;LI等[12]利用原子替換,構建了 Mn-CaO(0 0 1)表面,探究了Mn 對CaO 基吸附劑CO2吸附性能的影響。
研究表明,CaO(0 0 1)表面的表面能為0.647 J/m2,是CaO能量最低、最穩定的表面[30-31],因此,選取CaO(0 0 1)表面作為模型進行計算。以CaO(0 0 1)表面為基礎,通過原子替換法構建了Zn-CaO(0 0 1)表面模型進行計算。利用吸附能Ead評價ZnO/CaO材料表面CO2吸附能力,如式(2)所示。
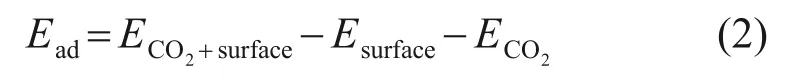
式中:ECO2+surface為CaO 基吸附劑吸附CO2后的系統總能量,eV;Esurface為材料表面能,eV;ECO2為CO2分子的能量,eV。Ead為負值,說明材料表面與CO2之間相互吸引作用較強,Ead越小,說明吸附過程越容易發生;Ead為正值,說明材料表面與CO2分子間相互排斥,吸附過程很難發生或不吸附,Ead越大,說明越難以發生吸附。
2 結果與討論
2.1 ZnO添加量對于CaO吸附CO2性能的影響
不同ZnO 添加量的ZnO/CaO 在5 次循環中的碳酸化轉化率如圖2 所示。從圖2可見:隨著循環反應次數增加,ZnO/CaO的碳酸化轉化率下降,但相同循環次數時ZnO/CaO 的轉化率比CaO 的轉化率更高;隨著ZnO 添加量從1% 增加到5%,ZnO/CaO的循環碳酸化轉化率不斷增大,但當ZnO添加量超過3%時,對于ZnO/CaO的碳酸化轉化率變化不大。因此,3%的ZnO添加量是合適的。
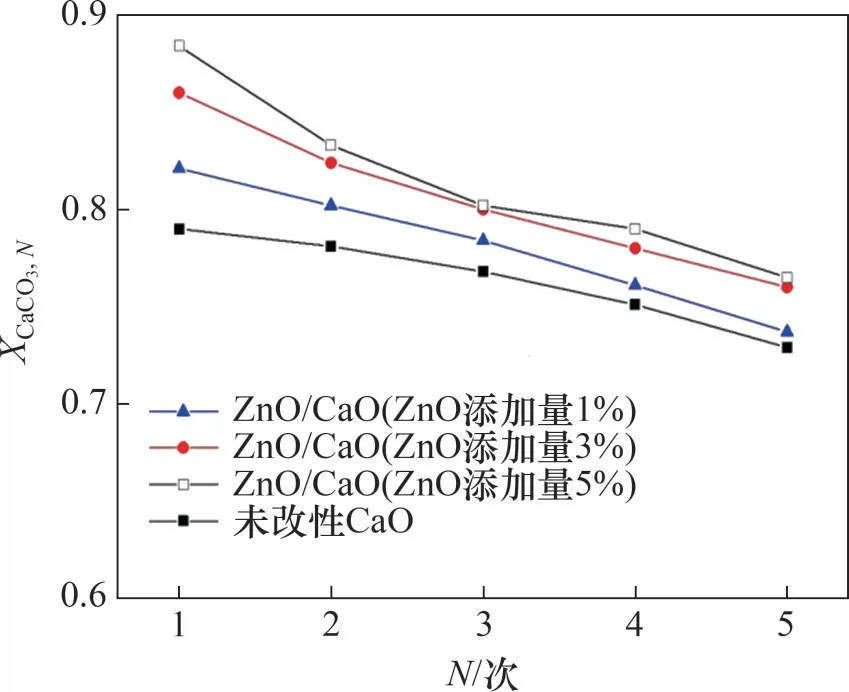
圖2 ZnO添加量對于CaO在多次循環中吸附CO2性能的影響Fig.2 Effect of ZnO addition on CO2 adsorption performance of CaO in multiple carbonation/calcination regeneration cycles
2.2 Zn-CaO(0 0 1)表面吸附CO2構型與吸附能
建立CaO(0 0 1)表面三維周期性結構表面,保留3層原子,其中,底層原子固定,表面2層原子及CO2分子弛豫。其中,建立2×2的超晶胞以更好地展示CaO 表面特性,并在模型上方建立高度為1 nm 的真空層以防止結構周期性對計算結果的影響。
將CO2模型置于邊長為2 nm的立方晶體中進行幾何結構優化。采用原子替換的方式構建Zn- CaO(0 0 1)表面,將CaO(0 0 1)表面頂層的1個Ca原子替換為Zn 原子,優化結構后獲得Zn-CaO(0 0 1)表面模型。O頂位已經被證實是CaO表面CO2最佳吸附位[24]。因此,選擇O 頂位作為CO2吸附位點(對應O原子稱為Oβ),CO2初始位置設置在Oβ原子正上方垂直距離0.3 nm處。優化結構后獲得CO2在CaO(0 0 1)表面及Zn-CaO(0 0 1)表面最佳吸附構型。
CaO(0 0 1)表面與Zn-CaO(0 0 1)表面吸附CO2前后的最佳構型分別如圖3 和圖4 所示。由圖3 可以發現:相比于CaO(0 0 1)表面,Zn-CaO(0 0 1)表面Zn原子處明顯出現塌陷,且O原子向Zn原子方向發生細微偏移。計算結果表明,Zn—O 鍵長度為0.237 nm,低于Ca—O 鍵長度(0.241 nm)。這說明Zn原子與O原子之間的化學鍵比Ca原子與O原子之間更強,鍵能更高,更強的化學鍵也導致 Zn-CaO(0 0 1)表面相比于CaO(0 0 1)表面結構更加穩定。吸附CO2后CaO(0 0 1)表面的Ca 與Zn-CaO (0 0 1)表面的Zn都向遠離Oβ處偏移,但Zn偏移更為明顯。這是由于Oβ在吸附CO2前,僅與Ca和Zn之間存在電子轉移;而吸附CO2后,Oβ與C發生相互作用成鍵,使得Oβ從C 處獲得部分電子,導致Oβ與Ca 或Zn 間的電子轉移數減少,而Zn 與O 間電子轉移量變化更大,導致Oβ與Zn間相互作用力變化更大,因而使得Zn發生明顯偏移。

圖3 CaO基材料表面模型示意圖Fig.3 Surface models of surfaces of CaO-based materials
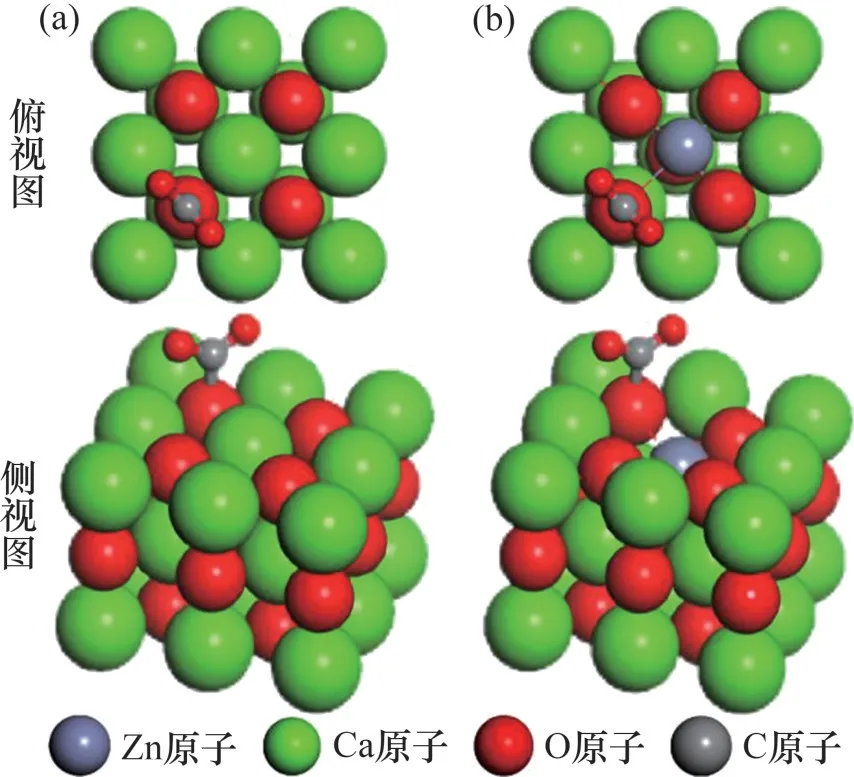
圖4 CaO基材料表面吸附CO2模型示意圖Fig.4 Models of CO2 adsorbed on surfaces of CaO-based materials
表面吸附CO2構型及吸附能的模擬計算結果如C—O 鍵長分別為0.142 nm 與0.141 nm,CO2內 C—O 鍵長均為0.126 nm,鍵角分別為128.96°和128.63°。因此,CaO(0 0 1)與Zn-CaO(0 0 1)表面吸附CO2后的結構較為一致,且均與的結構類似[32],這說明CaO(0 0 1)與Zn-CaO(0 0 1)表面對于CO2均是通過化學反應進行吸附,CO2與表面O原子結合,以結構吸附在材料表面。在吸附能方面,CaO(0 0 1)表面的CO2吸附能為-1.184 eV,而加入Zn 后,Zn-CaO(0 0 1)表面CO2吸附能降低至-1.947 eV,這表明摻雜ZnO 顯著提升了CaO 的CO2吸附性能,Zn-CaO(0 0 1)對于CO2的吸附能力更強,這也與實驗所得結論相符合。
2.3 Zn-CaO(0 0 1)表面吸附CO2的電子特性
電子態的變化可以由CO2吸附前后的分態密度(Projected Dos,PDOS)圖像來揭示。當PDOS圖內2 個原子電子軌道出現共振峰時,說明2 個原子間有化學鍵生成,具有強烈的電子相互作用[33]。圖5所示為CaO基材料表面吸附CO2前的PDOS圖。由表2 所示。由表2 可見:CaO(0 0 1)表面與Zn-CaO(0 0 1)表面吸附CO2后,表面Oβ原子與C原子之間圖5 可見:在吸附CO2前,Zn-CaO(0 0 1)表面Zn原子與O 原子之間出現了更多的共振峰。這表明了相比于Ca原子,Zn原子與O原子之間電子轉移量更多,成鍵能力更強,結構更為緊密,因此,加入Zn 提高了CaO 表面的結構穩定性。此外,與CaO(0 0 1)表面相比,Zn-CaO(0 0 1)中O 原子的態密度峰更低且跨度更大,這表明Zn-CaO(0 0 1)表面中O 原子的離域性更強,Zn 原子摻雜導致O 原子被活化,更易與吸附質發生反應。
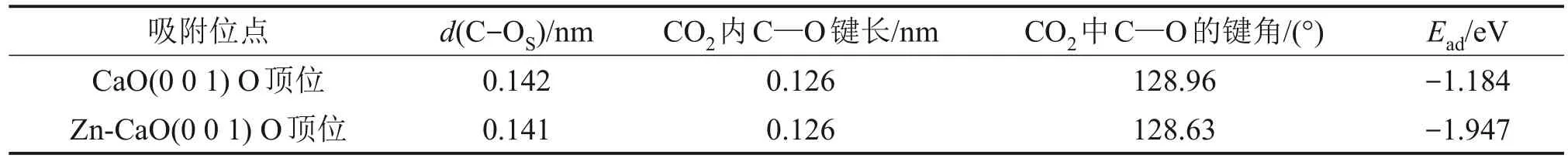
表2 CaO(0 0 1)與Zn-CaO(0 0 1)表面吸附CO2的幾何參數與吸附能Table 2 Geometrical parameters and adsorption energy of CO2 on CaO(0 0 1) and Zn-CaO(0 0 1) surfaces
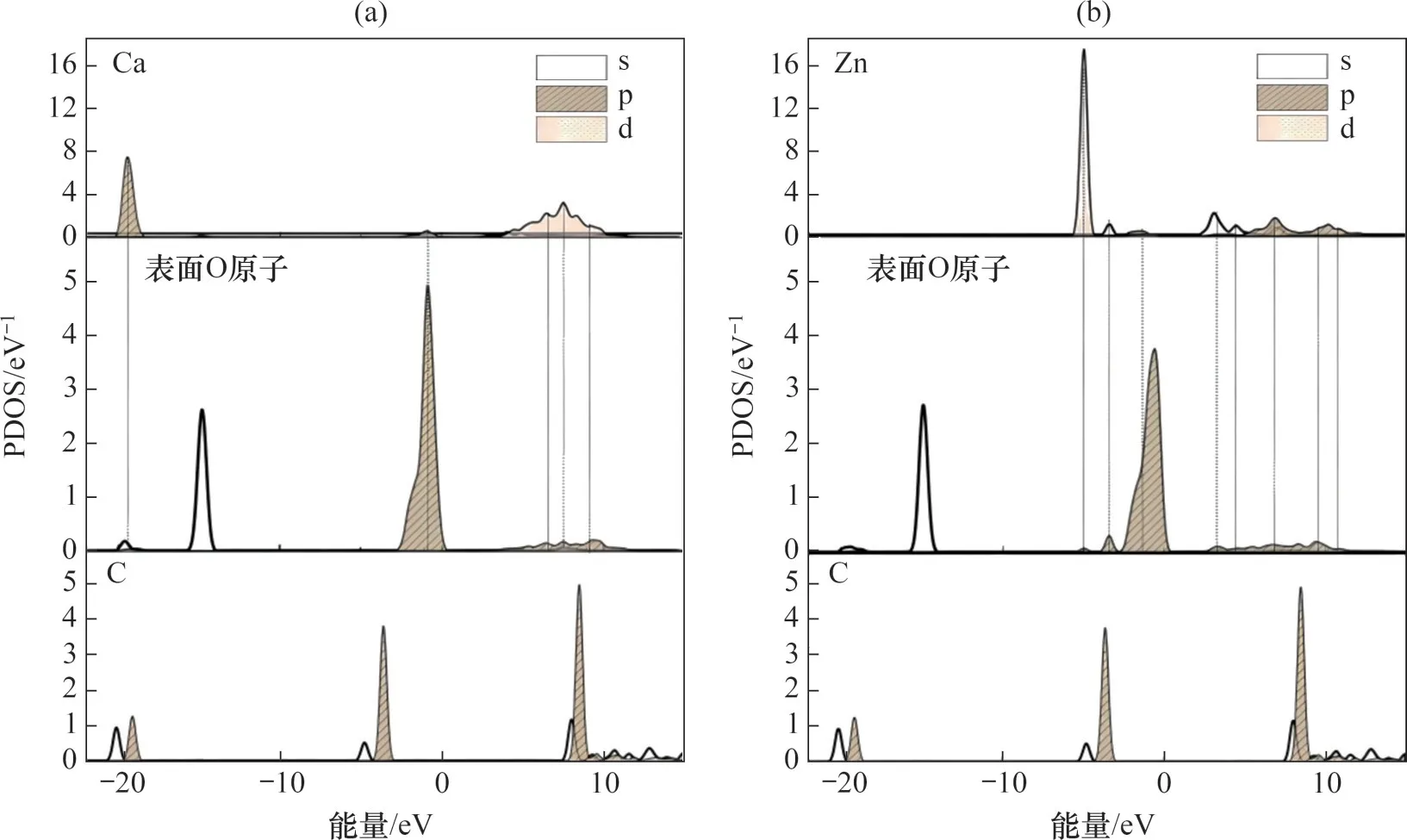
圖5 CaO基材料表面吸附CO2前的PDOS圖Fig.5 PDOS of surfaces of CaO-based materials before adsorption of CO2
吸附CO2后CaO(0 0 1)表面與Zn-CaO(0 0 1)表面模型內各原子PDOS圖如圖6所示。由圖6可見:相比于吸附CO2前,吸附CO2后CaO(0 0 1)表面與Zn-CaO(0 0 1)表面Oβ原子與C 原子之間均明顯呈現出雜化現象,出現大量共振峰。這表明在CaO(0 0 1)表面與Zn-CaO(0 0 1)表面內C原子與Oβ原子均發生強烈的相互作用。相比于吸附前,吸附后的C原子與O原子的態密度峰均明顯向低能區發生偏移,這表明CO2吸附形成的CO32-結構更加穩定,CO2得以穩定吸附在鈣基材料表面。此外,吸附CO2后,Ca原子和Zn原子與C原子和Oβ原子之間均出現3個原子電子軌道共振峰,這說明在CO2吸附過程中,部分電子由Ca原子、Zn原子轉移至Oβ原子將O原子激活,進而轉移至C原子。

圖6 CaO基材料表面吸附CO2后的PDOS圖Fig.6 PDOS of surfaces of CaO-based materials after adsorption of CO2
相比之下,Zn-CaO(0 0 1)表面的Zn 原子與C原子、Oβ原子在-6.06 eV處出現高態密度的3個原子電子軌道共振峰,而CaO(0 0 1)表面內Ca 原子與C原子、Oβ原子的3個原子共振峰普遍較小,態密度較小。這說明Ca 原子與C 原子、Oβ原子之間的電子轉移量較少,相互作用較弱,而Zn 原子與C 原子和Oβ原子之間電子轉移數量明顯偏高。Zn原子與Oβ原子之間更多的電荷轉移導致表面Oβ原子更容易被激活,進而通過與C原子的電子相互轉移吸附CO2,Zn與Oβ原子之間的相互作用是ZnO/CaO具有更強CO2吸附性能的關鍵。
CaO(0 0 1)表面與Zn-CaO(0 0 1)表面內Ca,Zn和O 原子之間的電子轉移情況分別通過差分電子密度(electron density difference,EDD)圖像表示,如圖7 所示,吸附在表面的CO2及表面Oβ原子的EDD圖像如圖8所示。由圖7可以發現:相比于Ca原子,Zn 原子與表面O 原子之間的電子轉移量更多,這表明Zn原子和表面上的O原子之間存在強相互作用。圖8 中,CaO(0 0 1)表面及Zn-CaO(0 0 1)表面Oβ原子與C 原子的電子云出現了明顯重疊,這表明Oβ原子與C 原子之間發生了強烈的電子相互作用并形成化學鍵。相比于CaO(0 0 1)表面,Zn-CaO(0 0 1)表面吸附的CO2內C原子與表面O原子的電子轉移量更多,電子相互作用更加強烈。因此,Zn原子的電子損失導致Zn原子周圍的電子不飽和,這有利于電子從鄰近表面的CO2轉移,并促進CO2與Zn-CaO 表面的鍵合。差分電荷密度和分態密度分析結果都表明,添加ZnO 后吸附劑具有更高的結構穩定性,且ZnO 摻雜引起的電子轉移提高了表面的反應活性。
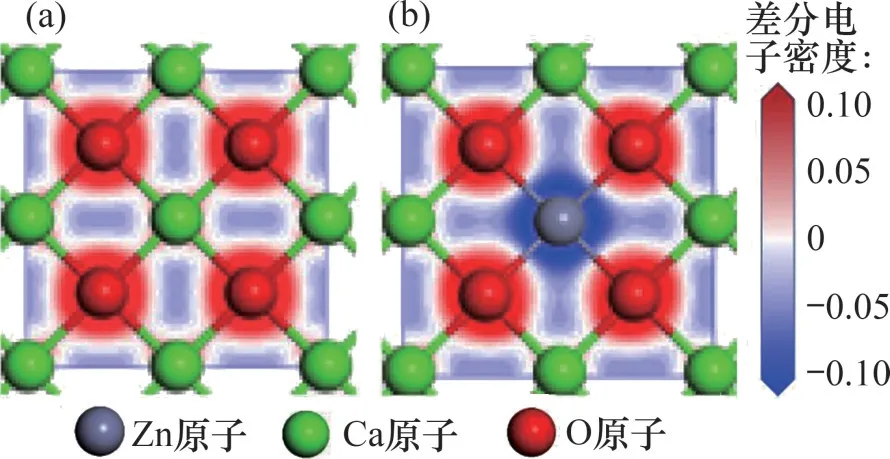
圖7 CaO基材料表面頂層EDD圖Fig.7 EDD of top layer of surfaces of CaO-based materials
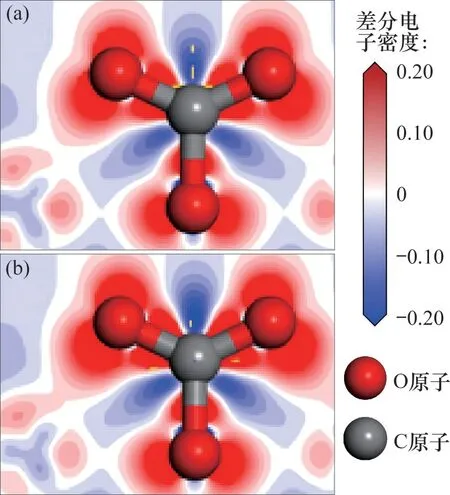
圖8 CaO基材料表面吸附CO2的EDD圖Fig.8 EDD of CO2 adsorbed on surfaces of CaO-based materials
3 結論
1) 添加ZnO增強了CaO的吸附CO2性能,在5次碳酸化/煅燒循環中,相同循環次數時ZnO/CaO的碳酸化轉化率始終高于純CaO。當ZnO 添加量為1%~5%時,隨著ZnO添加量增加,ZnO/CaO的循環碳酸化轉化率不斷增大,但當ZnO 添加量超過3%時,ZnO/CaO的碳酸化轉化率變化不大,因此,3%是較合適的添加量。
2) CaO(0 0 1)與Zn-CaO(0 0 1)表面CO2吸附構型與吸附能計算結果顯示,Zn 原子與O 原子之間的相互作用力顯著強于Ca 原子與O 原子之間的相互作用力,導致Zn-CaO(0 0 1)表面結構更加穩定。同時,加入Zn導致CaO(0 0 1)表面的CO2吸附能由-1.184 eV降低至-1.947 eV,促進了CaO吸附CO2。
3) Zn與O之間的電子轉移量明顯高于Ca原子與O 原子的電子轉移量,且ZnO/CaO 內O 原子的反應活性更高。Zn 原子、Oβ原子和C 原子在 -6.06 eV處存在高態密度的3個原子電子軌道共振峰。Zn 原子與O 原子之間的電子轉移導致O 原子離域性增強,進而更容易與CO2反應成鍵,有利于CO2在CaO 吸附劑表面的吸附。Zn,Oβ和C 之中的電子在3 種原子內連續轉移,Zn 和Oβ原子之間的電子轉移是ZnO/CaO 具有更強CO2吸附性能的關鍵。

