氨摻混丙烷氧化和氮氧化物排放實驗及動力學機理
殷閣媛,肖波,湛昊晨,胡二江,黃佐華
(西安交通大學 動力工程多相流國家重點實驗室,陜西 西安,710049)
“氫基”能源被認為是全球能源結構發展的重要方向[1]。氨氣作為典型的“氫基”能源,是清潔氫的載體和儲氫介質,在發動機中的應用備受關注[2-3]。氨可以作為發動機燃料,并被成功地應用到從輕型到重型各種車輛上。將氨氣與活性較強的燃料摻燒是解決其點火能量高、火焰傳播速度低以及氮氧化物排放高的主要技術途徑[4]。這類燃料燃燒反應活性比氨氣的高,燃燒時能夠提供H,OH 和O 等自由基從而促進氨燃燒,如氫氣、甲烷、合成氣和丙烷等。GROSS等[5]在壓燃式發動機上開發了氨-二甲醚高壓混合噴射系統,實現了成功點火。M?RCH等[6]采用氨-氫燃料,在不同的過量空氣系數和氨氫比條件下,對點燃式發動機上進行試驗,發現氫氣體積分數為10%時發動機的效率和功率最高,活性碳氫燃料的介入能夠使氨燃料發動機實現可靠點火和穩定燃燒。
為了實現新一代氨發動機的高效低排放燃燒,研究中低溫條件下的基礎燃燒特性是必不可少的。研究燃燒生成的微觀物種尤其是含氮化合物摩爾分數,對于深入理解活性燃料和氨的協同作用下N的遷移路徑至關重要,可以用于指導氮氧化物生成路徑微觀調控。氮氧化物(NOx)摩爾分數可以定性或定量表征燃燒過程的排放特性,并且可以作為先進燃燒設備的設計參考指標。
氨燃燒微觀物種摩爾分數實驗及機理研究主要是針對NH3摻混H2和CH4。ZHANG等[7]研究了常壓下NH3/H2中低溫氧化特性,更新了氨模型;ARUNTHANAYOTHIN等[8]研究了NH3/CH4的微觀排放物種摩爾分數機理,基于實驗和模型闡明了影響NOx的關鍵反應和路徑;STAGNI等[9]通過實驗結合模型的手段研究了氨氧化過程的關鍵基元反應;TANG等[10]開展了氨氧化的低溫氧化物種摩爾分數實驗,并發展了動力學模型。上述研究主要針對典型的無碳和低碳活性組分,活性組分通過提供OH,O 和H 自由基促進氨的氧化,而氨與大分子碳氫燃料的交叉作用目前研究較少。碳氫燃料與氨協同作用對NOx生成和抑制效果也缺乏機理研究。液化石油氣被認為是一種極具潛力的低碳燃料,可以用作汽油和柴油的替代燃料,降低碳排放,其主要成分為丙烷,反應活性高于氨氣。因此,氨與丙烷(C3H8)摻混可以提高氨的反應活性,對于發動機減排有重要作用[11]。
本文選擇丙烷這種典型的代用燃料,在射流攪拌器(jet stirred reactor,JSR)中開展了丙烷摻混氨氣在當量比φ為0.5,1.0 和2.0、溫度T為800~ 1 250 K,丙烷體積分數φ(C3H8)為0.5 條件下的低溫氧化實驗及模型研究,深入分析動力學機理,探明氨與丙烷協同作用下的燃燒機制以及一氧化氮(NO)的生成和抑制機理。
1 實驗裝置
射流攪拌器實驗平臺示意圖如圖1所示。實驗裝置主要分為進氣系統、加熱系統、實驗系統和檢測系統。進氣系統由氣體儲存裝置和質量流量控制計組成。實驗系統包括反應器和反應爐。反應器是體積為104 mm3的球體,在球體內部正中位置布置4 個內徑為0.3 mm 的噴嘴,材料為石英,能夠有效減少氨氣吸附以及壁面反應和催化反應。反應器放置在高溫電爐中,可穩定提供298~ 1 500 K 的溫度,并且溫度能夠長時間保持穩定。電爐的加熱長度為220 mm,可以保證氣體在進入反應球體之前預加熱,消除溫度梯度。實際反應溫度由K 型熱電偶配合手持式溫度測量儀測得。在JSR進氣口下方,留有熱電偶進入通道,能夠實時監測實驗實際溫度。在反應劇烈的條件下,實際溫度與設定溫度存在高達5 K的溫差。反應器前后段分別為進氣通路和排氣通路,并利用加熱帶和溫度控制器加熱,防止產物冷凝。
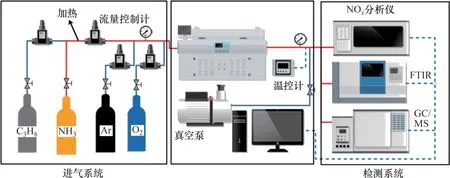
圖1 射流攪拌器實驗裝置圖Fig.1 Experimental setup of JSR
分別利用氫火焰離子化檢測器(flame ionization detector,FID)和熱導檢測器(Thermal Conductivity Detector,TCD)檢測碳氫化合物和無機化合物。氨氣和氮氧化物通過傅里葉變換紅外光譜儀(Fourier-transform infrared spectroscopy,FTIR)定量檢測。其中FID,TCD和FTIR的檢測精度分別為10-6,10-5和10-5,主要物種的測量相對誤差為1%,其他中間物種檢測精度相對誤差為5%。質量流量計的誤差導致測量結果的檢測精度相對誤差為5%,因此,C3H8,O2,CO2,CO,CH4和N2檢測精度的相對誤差為5%,NH3,C3H6,C2H6,C2H4,C2H2和NO檢測精度的相對誤差為10%[7]。
計算當量比采用的全局反應為
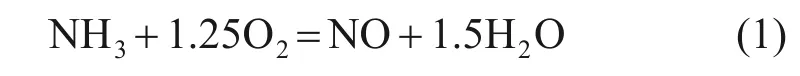
在當量比分別為0.5,1.0 和2.0 的條件下,保持流量0.12 m3/h 不變,燃料摩爾分數固定為0.005,其中丙烷的體積分數φ(C3H8)定義為

式中:V(C3H8)為燃料中丙烷的體積;V(NH3)為燃料中氨氣的體積;本文φ(C3H8)取0.5。
實驗工況如表1所示,得到物種摩爾分數隨溫度變化的曲線。計算滯留時間與溫度的關系式為
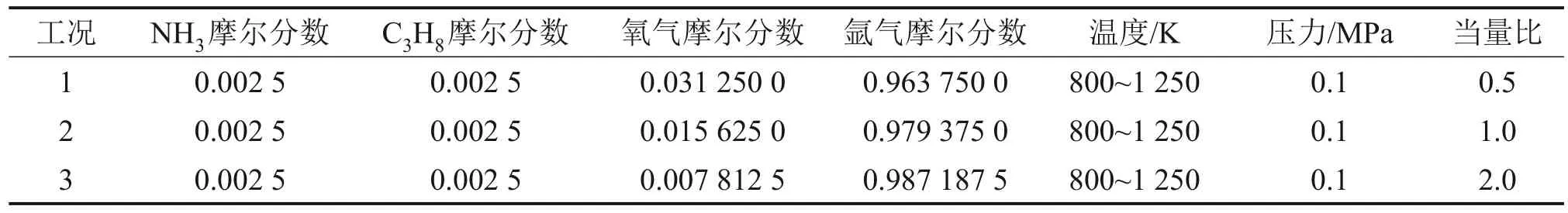
表1 氨氣摻混丙烷的實驗工況表Table 1 Experimental conditions

式中:τ為滯留時間,s;FN為標況下的流量,m3/h;F為實際流量,m3/h;V為反應器的體積,mm3;d為反應器直徑,m;p為實際壓力,MPa。
2 模型構建
丙烷的化學反應動力學模型采用C0-C4模型(NUIG模型[12]),該模型驗證了目前C0-C4相關的基礎燃燒實驗數據,具有較高的可靠性,同時包含了氨的子模型(GLARBORG模型[13])以及C0-C4燃料與NOx交叉反應,碳氫燃料和氨自由基之間的交叉反應。針對氨及氨摻混活性組分構建的化學反應動力學模型如表2所示。

表2 本文研究中驗證的氨的模型以及其特征Table 2 Kinetic model of ammonia validated and its characteristics in this study
本文收集了大量與氨燃燒相關的實驗數據,用于測試最近發布的氨氧化模型。數據包括NH3和NH3/H2激波管中的著火延遲期測量[21](49個數據點)、NH3和NH3/H2在JSR 中氧化的物種摩爾分數[7,10](384 個數據點)以及NH3,NH3/H2和NH3/合成氣的層流火焰速度測量[14,22](89個數據點),實驗工況如表3所示。

表3 氨燃燒實驗數據工況Table 3 Conditions of collected data of ammonia combustion
本文使用OLM等[23]提出的誤差函數統計法研究實驗結果和模擬結果的一致性。
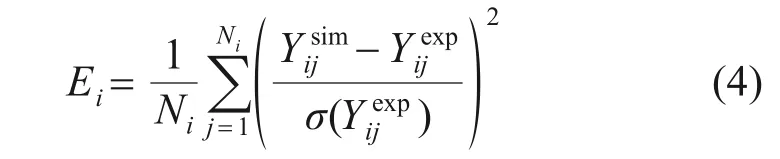
式中:Ei為誤差函數;為實驗數據;為實驗標準差;為模型的模擬值;N和Ni分別為實驗組的數量和該組實驗第i個數據點。模型的誤差函數越接近1,代表模型的準確度越高。著火延遲期、物種摩爾分數和層流火焰速度分別利用Chemkin軟件中的均勻攪拌燃燒器、一維絕熱預混自由傳播火焰和全預混攪拌反應器進行模擬。
表4 所示為不同模型預測NH3/H2激波管中的著火延遲期實驗[21]的誤差函數值。其中,一半模型能夠很好地預測實驗數據。GLARBORG等[13]、ZHANG等[7]和DAI等[20]模型表現良好,并且其誤差函數小于12;其次是OKAFOR等[17]和HAN等[14]模型;表現最差的是WANG等[19]模型。
由表4 可知:GLARBORG等[13]模型只能準確預測H2O 的摩爾分數,而HAN等[14]模型的模擬結果與H2O,N2O和NO的摩爾分數實測值吻合較好。KONNOV等[15]、MEI等[16]、DAI等[20]、OKAFOR等[17]和SHRESTHA等[18]模型表現較差,比其他模型的誤差函數大約高出2個數量級。表現最好的是WANG等[19]模型,整體誤差函數小于100。此外,ZHANG等[7]提出的模型對NH3,H2O 和N2O 的預測能力最好,但對NO的預測效果差。
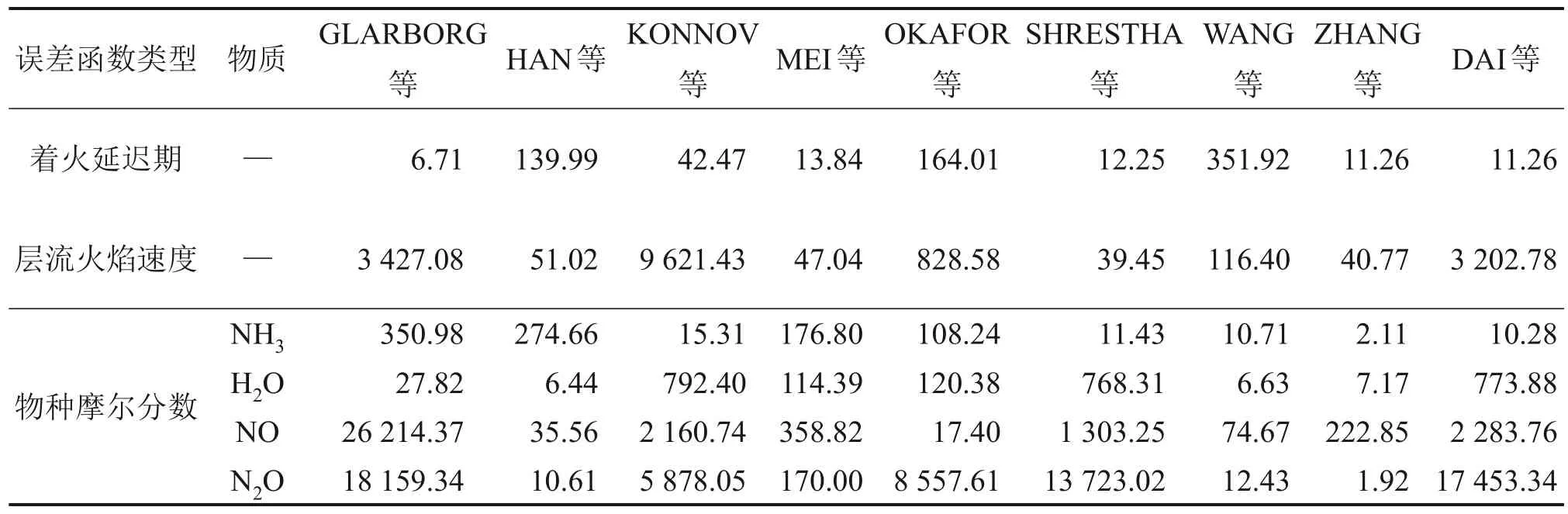
表4 不同模型針對著火延遲期、層流火焰速度和物種摩爾分數的誤差函數值Table 4 Error function value of ignition delay times,laminar flame speeds and mole fractions by using different models
GLARBORG等[13]、KONNOV[15]和DAI等[20]模型的誤差函數比其他模型的高約2個數量級。HAN等[14]、MEI等[16]、SHRESTHA等[18]和ZHANG等[7]模型有相似的規律,能夠準確預測氨摻混不同活性組分的層流火焰速度。總的來說,ZHANG等[7]模型是所有模型中表現最好的,可以準確預測著火延遲期、物種摩爾分數和層流火焰速度。因此,本文選擇ZHANG等[7]模型作為氨的子模型,構建了NUIG-ZHANG模型。
NUIG 與NUIG-ZHANG 模型的結果與氨氣摻混丙烷氧化的物種摩爾分數實驗數據對比如圖2所示。由圖2 可見:NUIG 模型過高預測了氨的反應活性,在更新了氨相關的子模型后,其模擬結果與氨摻混丙烷氧化實驗結果吻合良好。
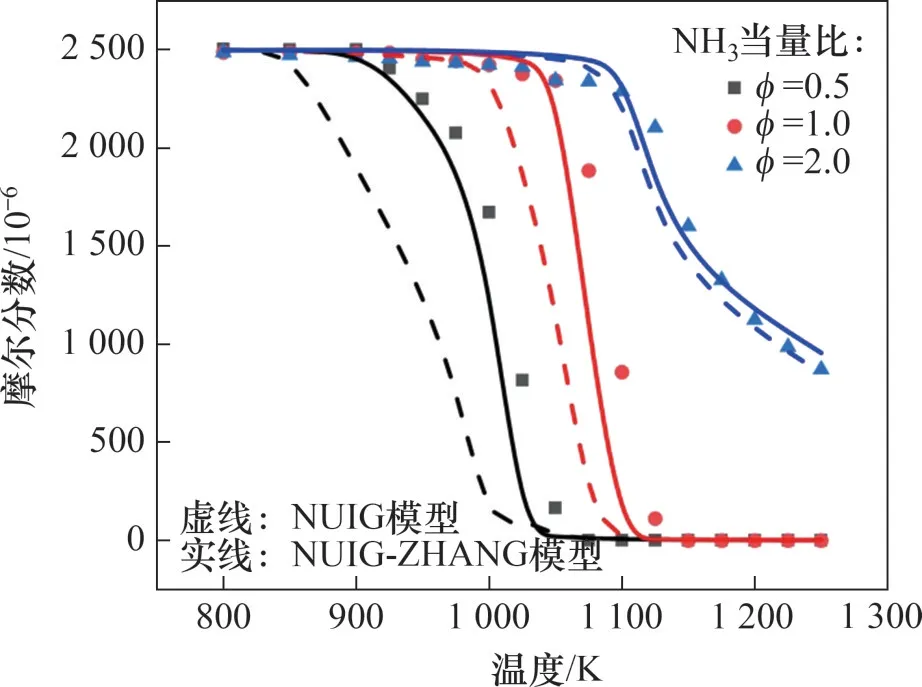
圖2 氨摻混丙烷氧化過程中物種摩爾分數曲線(p=0.1 MPa,φ(C3H8)=0.5,φ=0.5~2.0)Fig.2 Mole fraction profiles of ammonia with propane oxidation when p=0.1 MPa,φ(C3H8)=0.5 and φ=0.5-2.0
圖3所示為不同當量比下氨摻混丙烷的低溫氧化物種摩爾分數以及改進模型的摩爾分數模擬值對比。測得的物種摩爾分數曲線包括NH3,C3H8,O2,C3H6,C2H6,C2H4,C2H2,CH4,CO2,CO,NO,N2和H2。由圖3可見:隨著NH3當量比增加,氨氣的低溫氧化過程減緩,反應開始的溫度增大。NO 生成量隨著溫度上升以及當量比降低而增加,值得注意的是,在φ=0.5,T=900~1 000 K 條件下NO的生成量呈現先上升后下降再上升的趨勢,本文后續會詳細解釋該趨勢的內在機制。NUIGZHANG 模型相比于原模型能夠更好地預測NH3,C3H6,CH4和CO的摩爾分數。
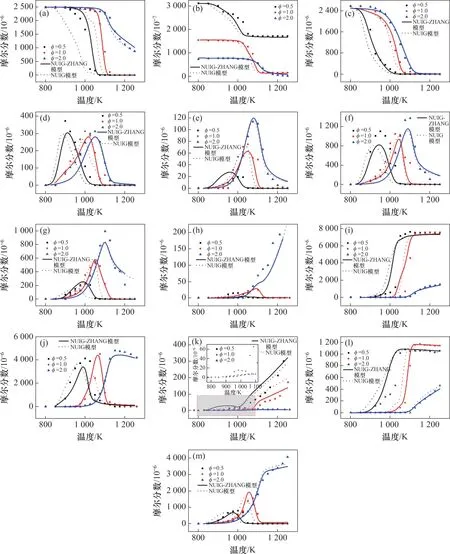
圖3 不同當量比下氨摻混丙烷的低溫氧化物種摩爾分數實驗值及其與改進模型的摩爾分數模擬值的對比Fig.3 Comparison between the measured and simulated mole fractions of ammonia with propane oxidation under different equivalence ratios
3 動力學機理
3.1 氨燃燒的動力學分析
為了探明丙烷調控氨燃燒的內在動力學機制,本文基于NUIG-ZHANG 模型,選擇φ=0.5,T= 950 K條件下氨氣快速消耗的工況,分析氨以及丙烷燃燒的路徑,結果如圖4所示,其中紅色的箭頭標注了氨摻混丙烷氧化過程的交叉反應路徑。由圖4 可見:氨在950 K 條件下消耗的主要路徑為NH3→NH2→H2NO→HNO→NO→N2。超過99%的NH3與OH發生脫氫反應生成NH2。

圖4 φ=0.5,溫度分別為950 K和1 150 K下氨氣反應路徑分析和OH的生成路徑Fig.4 Pathway analysis of ammonia and OH formation at φ=0.5,T=950 K and 1 150 K
NH2主要的反應通道為:
1) 與NO反應生成N2;
2) 與NO2反應生成H2NO;
3) 與甲基反應生成甲胺(CH3NH2);
4) 與HO2,C2H6和C2H4反應生成NH3。
上述4 個分支占比分別為14.2%,46.5%,4.8%和14.9%。
甲胺的后續消耗路徑為CH3NH2→CH2NH2→CH2NH→H2CN/HCNH→HCN。H2NO一部分(38.1%)與HO2反應生成NO+OH,另一部分(4.7%)被氧氣氧化為NO。
950 K時丙烷調控氨燃燒的主要途徑為:
1) 丙烷被氧化后生成HCO,C2H5,IC3H7等,這些自由基后續與O2反應,被氧化生成HO2自由基。HO2自由基是中低溫反應中的關鍵物種,因為HO2可以發生下列反應。
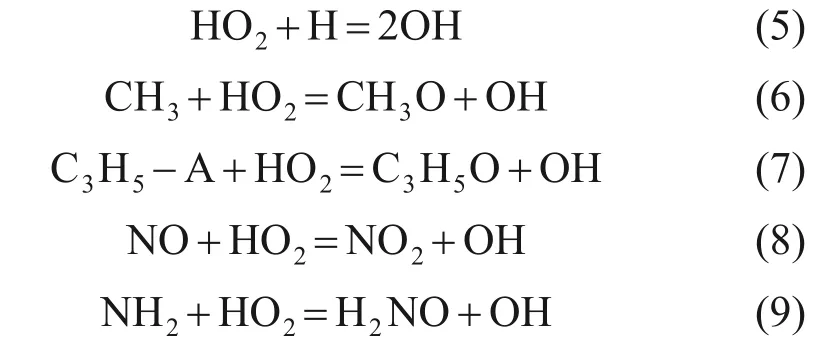
將反應活性較低的HO2自由基轉化為高活性的OH自由基,從而加速反應進程。
2) 另1條調控途徑為上述提到的與甲基反應生成CH3NH2,與HO2,C2H6和C2H4反應生成NH3。
在溫度為1 150 K 時,NH2與HO2自由基反應占比降低,H2NO產物的分支占比下降到5.2%,氨中間組分與O,OH 和O2參與的反應分支占比更高,NH2與O反應生成HNO的反應更加重要(占比37.9%),與H,O 和OH 生成NH 占比9.0%。含碳物種和NH2的交叉反應幾乎可以忽略不計。丙烷對氨燃燒的調控主要通過提供更多的氫原子并觸發鏈分支反應,生成O和OH,促進氨氧化。
3.2 氮氧化物生成的動力學分析
由圖3 可知:稀燃條件下NO 生成量遠比濃燃條件下的高,與ZHANG等[7]的實驗結果不同的是:NO 的生成趨勢并不是隨著溫度單調遞增,NO的生成存在2個階段。
1) 在800~1 050 K 溫度區間,NO 先上升再下降;
2) 溫度高于1 100 K時,呈現單調上升趨勢。
為了探明該趨勢的內在機制,開展了不同溫度下NO 的路徑分析,以獲得NO 生成和消耗的動力學機理。圖5所示為不同溫度條件下NO的路徑分析。從圖5可見:在第1個溫度階段T=900 K時,NO生成的反應路徑為NH3→NH2→H2NO→HNO→NO 和NH3→NH2→NO。NH2自由基與NO2反應生成H2NO,H2NO 一部分與HO2反應生成NO+OH,另一部分生成HNO然后完全轉化為NO。
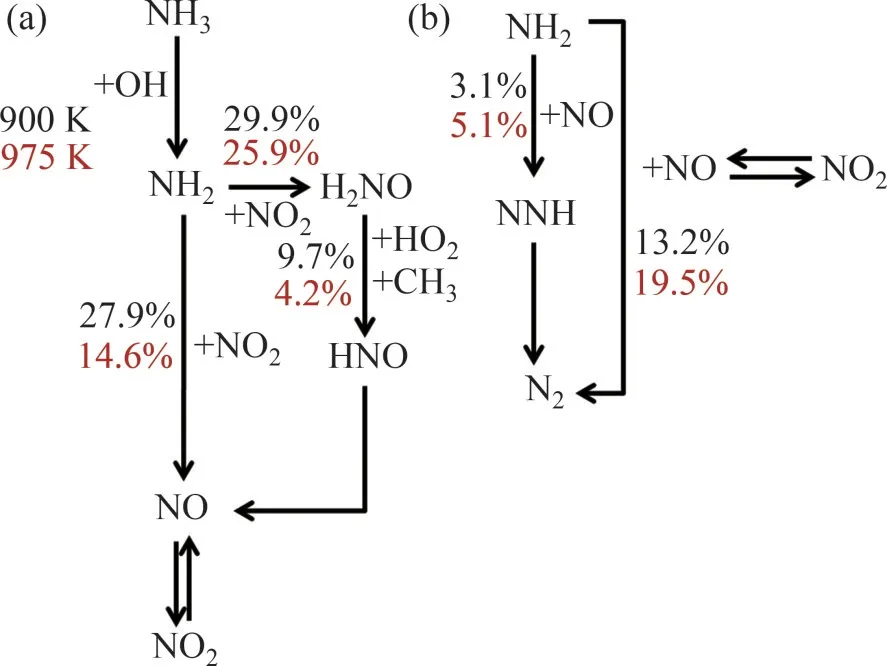
圖5 φ=0.5,溫度分別為900 K(黑色)和975 K(紅色)條件下NO的路徑分析Fig.5 Pathway analysis of NO when φ=0.5,T=900 K(black) and 975 K(red)
NO的消耗路徑主要是與NH2反應生成N2或者NNH自由基。同時,NO會被氧化為NO2,但超過99%的NO2會被還原為NO。因此,前2個反應是該溫度下的消耗NO的關鍵路徑。當溫度升高至975 K時,生成NO 的路徑分支占比降低,而消耗NO 的路徑分支占比升高,因此,NO 在800~1 050 K 溫度范圍呈現先上升后下降的趨勢。
圖6 所示為第2 個溫度階段的NO 生成和消耗反應路徑。在1 100 K 條件下NO 的主要生成路徑有3條:
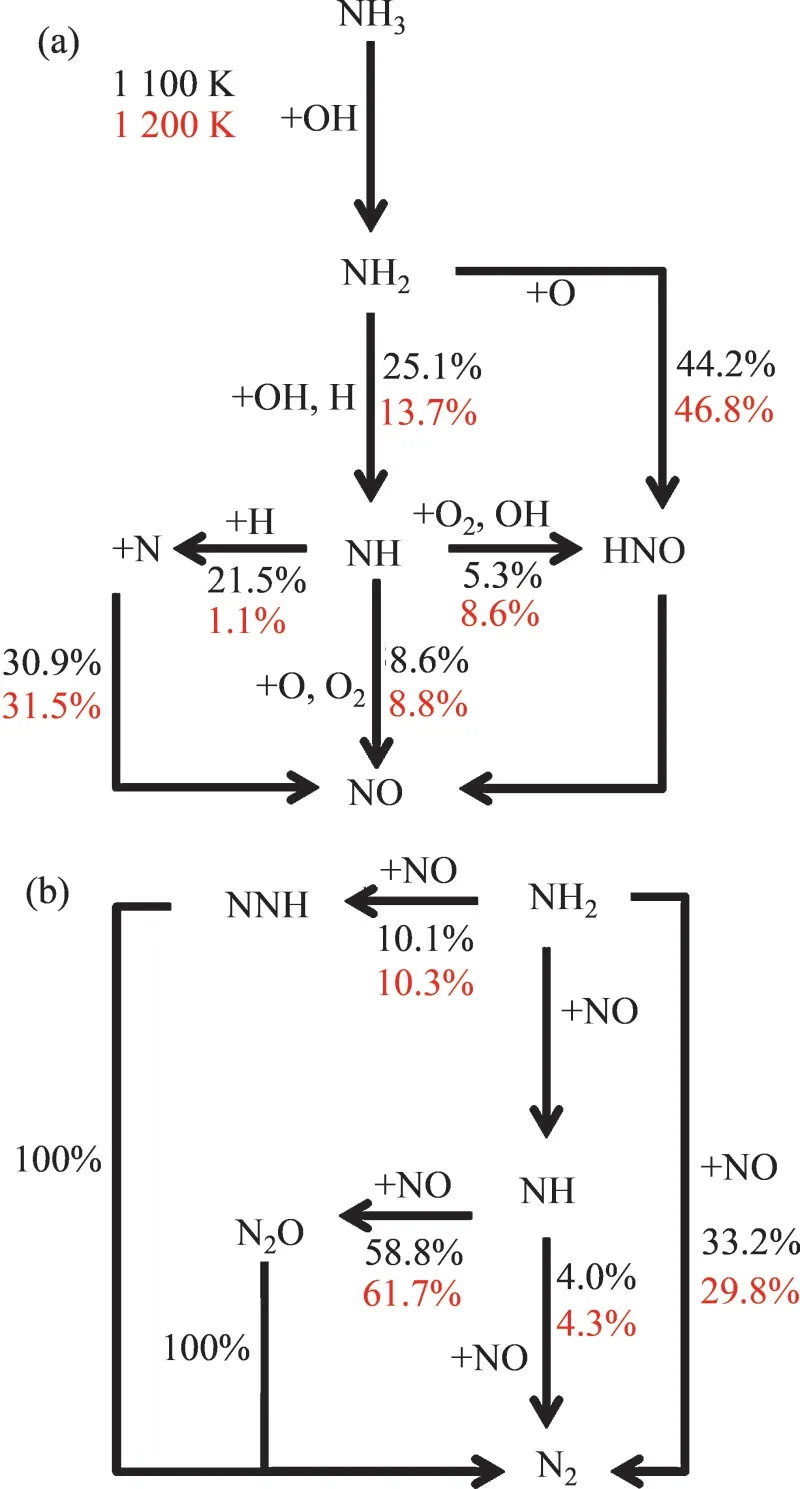
圖6 φ=0.5時溫度分別為1 100 K(黑色)和1 200 K(紅色)條件下的NO的路徑分析Fig.6 Pathway analysis of NO when φ=0.5,T=1 100 K(black) and 1 200 K(red)
其中最關鍵、分支占比最高的路徑為NH2自由基與O 反應生成HNO,HNO 完全轉化為NO。其余路徑先生成NH,然后NH 被轉化為NO,HNO和N。NO的消耗路徑同樣包括與NH2反應生成N2或者NNH 自由基。而在第2 個反應階段,還包括NH 消耗NO 生成N2O 或N2。當溫度升高到 1 200 K后,NO的生成和消耗路徑分支占比無明顯的變化規律。
路徑分析代表反應消耗的相對值,因此,在該溫度區間無法僅通過反應路徑揭示NO摩爾分數上升的內在機制,但通過路徑分析可知:NO的生成與NH2,NH,HNO,H,OH和O等關鍵自由基摩爾分數密切相關。圖7所示為以上物種在不同溫度下的峰值摩爾分數。1 200 K 條件下所有的關鍵物種的摩爾分數均高于1 100 K 條件下的摩爾分數。因此,即使反應路徑的分支占比變化不大,但由于關鍵反應中涉及的自由基摩爾分數增加,NO的摩爾分數隨著溫度升高而增加。

圖7 φ=0.5,溫度分別為1 100 K和1 200 K條件下的生成H,OH,O,NH2,NH和HNO的峰值摩爾分數Fig.7 Peak mole fractions of H,OH,O,NH2,NH and HNO formation at φ=0.5,T=1 100 K and 1 200 K
4 結論
1) 獲得了NH3,C3H8,O2,C3H6,C2H6,C2H4,C2H2,CH4,CO2,CO,NO,N2和H2等關鍵物種的摩爾分數隨溫度T和當量比φ的變化曲線。一氧化氮的摩爾分數在φ=0.5,T=800~1 250 K 條件下呈現先上升后下降再上升的趨勢。
2) 選擇出表現最好的ZHANG 模型,構建了氨/丙烷的動力學模型(NUIG-ZHANG 模型),該模型能夠很好地預測實驗結果。
3) 在950 K 下,氨消耗的主要路徑為NH3→NH2→H2NO→HNO→NO→N2。丙烷調控氨燃燒的主要途徑為2 條,第1 條為甲烷被氧化后生成HCO,C2H5,IC3H7等后續轉化為HO2和OH 自由基,促進反應活性。第2 條途徑為丙烷生成的CH3,C2H6和C2H4等與NH2反應生成NH3,抑制反應活性。
4) NO 的生成存在2 個階段。在1 個溫度階段(800~1 050 K),當溫度升高時生成NO的路徑分支占比先上升后降低,而消耗NO的路徑分支占比先降低后升高,因此,NO 在800~1 050 K 溫度范圍呈現先上升后下降的趨勢。第2 個溫度階段 (>1 100 K),NO 的生成和抑制途徑分支占比無明顯的升降規律。但由于關鍵反應中涉及的自由基,如NH2,NH,HNO,H,OH 和O 等摩爾分數增加,NO的摩爾分數隨著溫度升高而增加。

