液液萃取-高效液相色譜法同時測定植物油中的毒黃素、路霉素和熱誠菌素
王朝霞, 尹芳平, 汪 輝, 周 鵬, 鄧 楠, 曾 輝, 胡宇格
(食品安全監測與預警湖南省重點實驗室1, 長沙 410111) (長沙市食品藥品檢驗所;國家酒類產品質量監督檢驗中心2,長沙 410000)
細菌毒素是由細菌合成產生的,按其毒素的分子性質和結構特征可分為內毒素和外毒素。研究表明內毒素是在革蘭氏陰性菌死亡之后才會產生,且能夠在植物中產生具有毒害性的代謝產物,影響植物的正常生長從而降低植物如水稻這一類農作物的產量[1-3]。由于革蘭氏陰性菌死亡之后產生的具有毒害性的代謝產物極易被人體吸收和利用,若人們攝取吸收富集這類物質達到一定程度就會有不同程度的中毒跡象,輕者會出現嘔吐、全身無力、頭暈等現象;重者會出現內臟腫大、休克等多種嚴重疾病[4-6]。吳小林等[7]研究了細菌毒素對癌癥的潛在作用,明確指出革蘭氏陰性菌具有致癌性。趙乃欣等[4]研究也表明,近年來中國不少地區經常出現由玉米粉、米粉等變質產生革蘭氏陰性菌死亡后產生內毒素進而引起的食物中毒事件,其中報道較多的是由革蘭氏陰性菌死亡產生的毒黃素。毒黃素溶于水,同時也溶于甲醇、乙醇、氯仿、乙酸乙酯等有機溶劑,靜脈注射毒黃素的LD50為1.7 mg/kg,口服的為8.39 mg/kg[8]。龍海等[9]研究發現水稻細菌性谷枯病病菌會產生3種毒素:毒黃素、熱誠菌素和路霉素,其中毒黃素對水稻有極大的毒害作用。熱誠菌素、路霉素與毒黃素分子結構相似,可能存在與之相當的生物活性和毒性。革蘭氏陰性菌產生的某些細菌物質不僅會影響農作物的產量,還對人類身體健康產生不同程度的危害。Zhu 等[10]報道在釀酒大曲中檢出的毒黃素含量高達8.33 mg/kg。因此,植物油相關的原材料如果受到細菌污染,可能會產生毒素,影響植物油的安全。目前,國內外主要以植物油[11]為食用油,關于植物油中真菌毒素的測定報道較多[12,13],而食用植物油中細菌毒素的檢測方法研究卻是處于空白階段,消費者在食用植物油環節存在一定的安全隱患,因此該項研究十分必要。我國食用植物油種類豐富、工藝復雜。常見的食用植物油[14]有菜籽油、玉米油、稻米油、花生油以及大豆油等。根據我國目前因細菌毒素中毒案例[5,6]來分析,本研究選擇了市面上主要流通的幾類食用植物油進行分析檢測,因水稻中產生的細菌毒素誘發的疾病數量最多[15,16],著重以稻米油為研究對象進行展開。
有關毒黃素的分析方法有薄層色譜法[17-19]、高效液相色譜法[8, 10, 20]、高效液相-質譜聯用法[21,22]、分光光度法[23,24]、生物傳感法[25],而對路霉素和熱誠菌素的分析方法報道較少,且鮮有關于植物油中毒黃素、熱誠菌素和路霉素的報道。本研究考察了5種不同前處理條件來提取凈化目標物,采用甲醇液液萃取,高效液相色譜分析檢測,建立了一種快速測定食用植物油中毒黃素、路霉素和熱誠菌素的分析方法。以期填補食用植物油中毒黃素、路霉素和熱誠菌素檢測方法研究的空缺,為今后對細菌毒素的研究提供技術參考。
1 材料與方法
1.1 材料與試劑
毒黃素(Toxoflavin)標準品(純度>95%):CAS號:84-82-2;熱誠菌素(Fervenulin)標準品(純度>99.2%):CAS號:483-57-8;路霉素(reumycin)標準品(純度>99.9%),CAS號:5016-18-2;甲醇、乙腈、乙酸乙酯、環己烷和甲酸均為色譜純;正己烷、三氧化二鋁和無水硫酸鈉為分析純;Al2O3固相萃取柱(22 g/60 mL);植物油均為市售樣品。
1.2 儀器與設備
Agilent1260高效液相色譜儀,SK-I振蕩器;CT14D-高速離心機,Visiprep-DL24固相萃取真空裝置,AS3120超聲波清洗器,超純水儀,N-EVAP116型氮吹儀-34位。
1.3 方法
1.3.1 色譜條件
色譜柱:Ultimate AQ-C18色譜柱(4.6 mm×25 mm,5 μm);流動相:0.1%甲酸-甲醇(90∶10),等度洗脫;柱溫:35 ℃;流速:1.0 mL/min;進樣量:5 μL;檢測波長:240 nm。
1.3.2 標準溶液配制
稱取適量的毒黃素、路霉素和熱誠菌素標準品于燒杯中,加入甲醇溶解并轉移至50 mL容量瓶,再用甲醇定容至刻度,配成質量濃度為0.5 mg/mL的混合標準儲備液,-18 ℃避光保存,用流動相逐級稀釋,配制成0、4、8、10、20、40 μg/mL的標準系列工作溶液,供高效液相色譜儀分析測定。
1.3.3 樣品處理1.3.3.1 液液萃取法1.3.3.1.1 液液萃取-乙腈飽和正己烷[26]
稱取混勻的稻米油樣品0.8 g置于50 mL聚丙烯離心管中,加入0.2 mL由標準母液配制的質量濃度為100 μg/mL的溶液,加入10 mL乙腈的飽和正己烷,混勻超聲15 min,取出下層溶液,加入5 mL乙腈飽和正己烷復提,合并提取液,混勻于45 ℃氮吹濃縮至近干,用流動相定容至2.0 mL,渦旋混勻,溶液經0.45 μm有機膜過濾,并做空白實驗,供液相色譜測定。
1.3.3.1.2 液液萃取-甲醇[27]
稱取混勻后的稻米油樣品4.0 g于50 mL聚丙烯離心管中,樣品加入0.2 mL標準母液,加入10 mL甲醇,室溫振蕩提取15 min,于10 000r/min離心5 min,取出溶劑,再加入6 mL甲醇重復提取,合并提取液并定容至20 mL。準確移取5.0 mL樣液于45 ℃氮吹濃縮至近干,流動相定容至1.0 mL,渦旋混勻,溶液經0.45 μm有機膜過濾,并做空白實驗,供液相色譜測定。
1.3.3.2 固相萃取法
1.3.3.2.1 Al2O3固相萃取柱(30 mL正己烷活化)[28]
稱取混勻的稻米油樣品0.4 g置于50 mL聚丙烯離心管,加入0.1 mL由標準母液配制的質量濃度為100 μg/mL的溶液,加入5 mL正己烷,渦旋混勻,待凈化。采用中性氧化鋁固相萃取柱,用30 mL正己烷活化柱子,將待凈化樣液全部加入固相柱,再加入50 mL正己烷進行洗脫,收集洗脫液于45 ℃氮吹濃縮至近干,用流動相定容至1.0 mL,渦旋混勻,溶液經0.45 μm有機膜過濾,并做空白實驗,供液相色譜測定。
1.3.3.2.2 自填中性氧化鋁固相萃取柱(30 mL石油醚活化)[29]
三氧化二鋁的活化:稱取120 g三氧化二鋁置于坩堝并放入馬弗爐中,用450 ℃進行灼燒,設置程序使其灼燒12 h,降至室溫后取出坩堝,將三氧化二鋁迅速轉入黑色的試劑瓶并加入10 mL水,劇烈振蕩15 min,將其避光靜置24 h。
樣品的處理:稱取0.4 g稻米油樣品,加入0.1 mL由標準母液配制的質量濃度為100 μg/mL的溶液,加入2 mL石油醚,渦旋混勻,待凈化。
三氧化二鋁的填柱:將玻璃層析柱用超純水洗滌3次后,再用無水乙醇洗滌3次,自然晾干。加入40 mL石油醚,打開活塞,放出石油醚至管身的1/2處,旋緊活塞,加入22 g活化的三氧化二鋁和2 g無水硫酸鈉,再次打開活塞,將石油醚放至無水硫酸鈉處旋緊活塞。上樣:將待凈化液全部轉入玻璃層析柱中,分離,純化。收集:加入80 mL石油醚進行洗脫,棄去前20 mL石油醚,收集剩余的石油醚于45 ℃氮吹濃縮至近干,用流動相定容至1.0 mL,渦旋混勻,溶液經0.45 μm有機膜過濾,并做空白實驗,供液相色譜測定。
1.3.3.3 GPC體積排阻法[27, 30]
稱取混勻后的稻米油4.0 g置于50 mL聚丙烯離心管中,加入0.2 mL標準母液,加入20 mL乙酸乙酯+環己烷(1+1),混勻振蕩提取15 min,取出5 mL樣液,供GPC色譜分離,收集樣液于45 ℃氮吹濃縮至近干,用流動相定容至1.0 mL,渦旋混勻,溶液經0.45μm有機濾膜過濾,并做空白實驗,供液相色譜測定。前處理過程比對如表1所示。
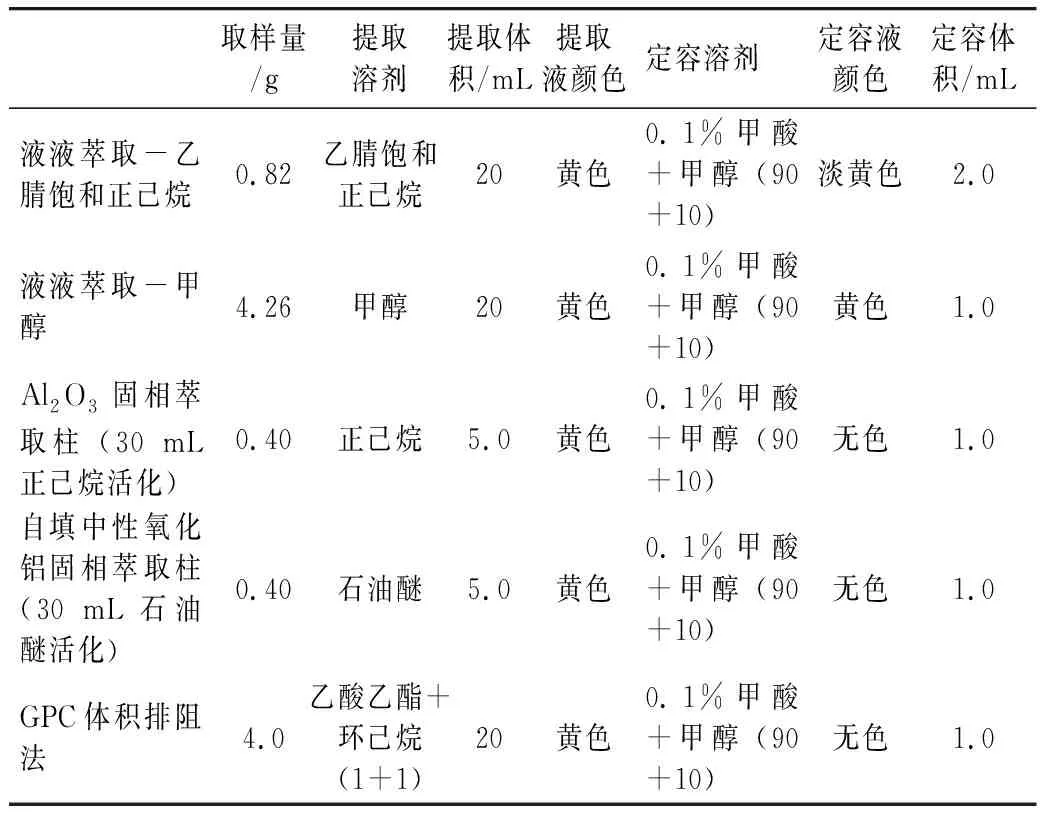
表1 同一樣品的不同前處理過程
2 結果與討論
2.1 色譜條件的優化
毒黃素在258 nm處有最大吸收峰,路霉素在232 nm處有最大吸收峰,熱誠菌素在238 nm處有最大吸收峰,通過對這3種目標物質進行全波長掃描來選擇最佳吸收波長,如圖1所示,當波長為240 nm時,毒黃素、路霉素和熱誠菌素有相對較高的吸光度,因此檢測波長選為240 nm;使用甲醇甲酸為流動相時,可以使路霉素和毒黃素這兩個同時出峰的物質達到相應分離度要求,因此本研究選用0.1%甲酸-甲醇(90∶10)為流動相。
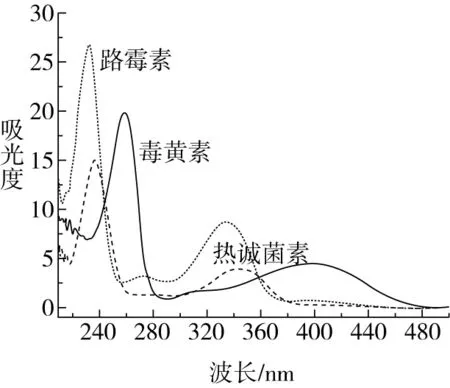
圖1 毒黃素、路霉素和熱誠菌素全波長掃描圖
2.2 前處理條件的選擇
根據食用植物油的大分子特征和目標化合物的性質,采用了5種不同的的前處理提取方法。液液萃取法是利用不同目標物質在試劑中分配系數的差異來實現分離目的。采用有機試劑直接提取目標物質[31],可以節省成本,同時降低其他雜質干擾的風險。考慮到食用植物油不溶于甲醇和乙腈,本研究結合油脂中化合物測定的相關國家檢測方法標準,考察了幾種主要前處理方式。采用了甲醇[27]和正己烷飽和的乙腈[26]進行實驗,在實驗過程中提取溶液出現明顯顏色差異現象,經甲醇提取的溶液顏色是深黃色,而正己烷飽和的乙腈是淡黃色,實驗結果顯示2種試劑的基質干擾都很低,目標物質都能有效分離,區別在于甲醇溶液比正己烷飽和的乙腈溶液的回收率更高、更穩定;本研究中固相萃取法是利用物質在固定相和流動相的分配系數的不同來達到分離[31],采用極易溶解油脂的正己烷[28]和石油醚[29]溶液來進行實驗,比較商用固相萃取和自填柱對物質分離效果的影響,除去植物油中其他雜質的干擾,獲得更穩定的基線。實驗過程中發現,兩者填料柱里有明顯的黃色物質。結果表明,洗脫液中未檢出3種目標化合物,這可能是目標物不溶于正己烷和石油醚,無法從填料柱中洗脫下來;采用GPC體積排阻法[30]是根據溶液中各物質的分子質量不同,經過色譜柱后的停留時間各不一致來實現分離,可知毒黃素、路霉素和熱誠菌素均是小分子化合物,而樣品稻米油是大分子物質,利用這一特性結合GPC的技術原理[31],將雜質和目標化合物在柱前進行分離,得到較為純凈的樣液,再進入液相色譜系統進行分析檢測,可以減少樣品雜質對目標化合物出峰時間和分離情況的干擾,同時,減少樣品雜質對色譜柱和檢測儀器的污染。實驗結果表明該法的基質干擾較低,目標物質可以有效分離,但是回收率效果不理想,可能是由于目標物不易溶于流動相造成的。結果如表2和圖2所示。最終選擇用液液萃取法中甲醇溶液直接提取,實驗的加標回收和穩定性均達到要求,相對其他前處理方法更為方便,能夠節約前處理的時間和成本。
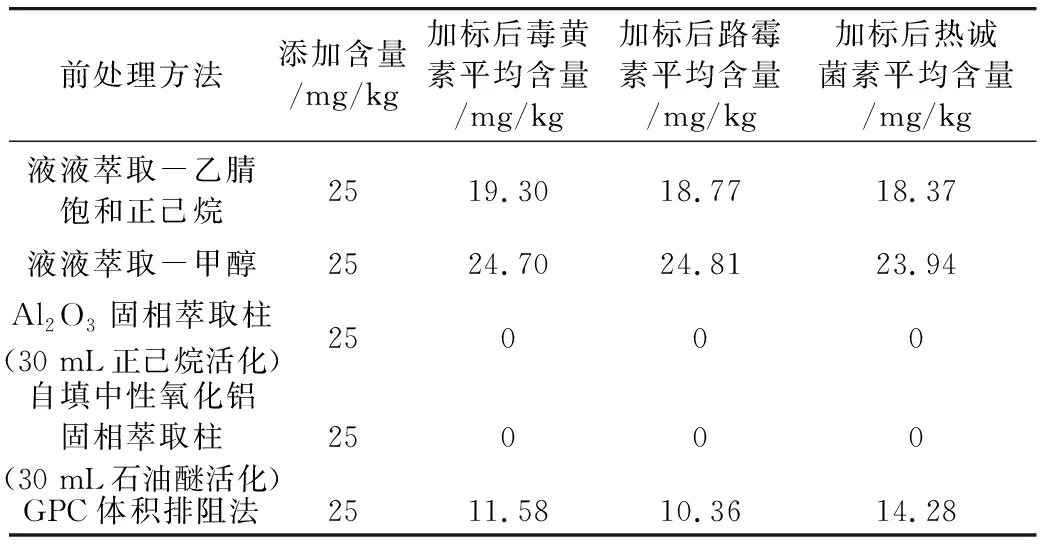
表2 不同前處理方法的回收率
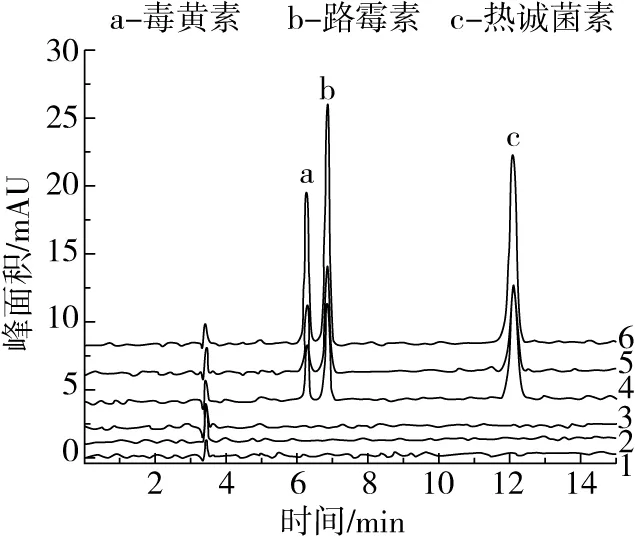
注:1為空白樣品,2為Al2O3固相萃取柱(30 mL正己烷活化),3為自填中性氧化鋁固相萃取柱(30 mL石油醚活化),4為GPC體積排阻法,5為液液萃取-乙腈飽和正己烷,6為液液萃取-甲醇。圖2 不同前處理方法的峰面積
2.3 方法學評價
2.3.1 方法的線性范圍、檢出限和定量限
分別以毒黃素、路霉素和熱誠菌素標準溶液濃度為橫坐標,峰面積為縱坐標繪制標準曲線。結果顯示3種目標化合物在0~40.0 μg/mL質量濃度范圍內具有良好的線性。以信噪比(S/N)為3計算方法檢出限(LOD),以信噪比(S/N)為10計算方法定量限(LOQ),本方法中毒黃素、路霉素和熱誠菌素的LOD與LOQ分別為0.8 mg/kg與3.2 mg/kg,檢測靈敏度較高,結果見表3。

表3 毒黃素、路霉素和熱誠菌素的線性方程和相關系數
2.3.2 回收率實驗和精密度
稱5.0 g空白稻米油樣品于50 mL聚丙烯離心管中,分別添加3.2、6.4、32.0 mg/kg的毒黃素、路霉素和熱誠菌素的混合標準品,充分混勻后,按照樣品前處理方法進行提取,進高效液相色譜分析,將加標后樣品中毒黃素、路霉素和熱誠菌素的含量與加標量相比計算回收率,毒黃素為98.93%~109.44%,路霉素為102.85%~109.77%,熱誠菌素為95.26%~101.54%,數據表明樣品回收率良好,毒黃素方法精密度(RSD)小于6.81%,路霉素方法精密度(RSD)小于4.26%,熱誠菌素方法精密度小于4.30%,結果顯示該方法精密度良好,符合相關標準要求,表明本研究方法能準確檢測食用植物油中的毒黃素、路霉素和熱誠菌素,結果見表4。
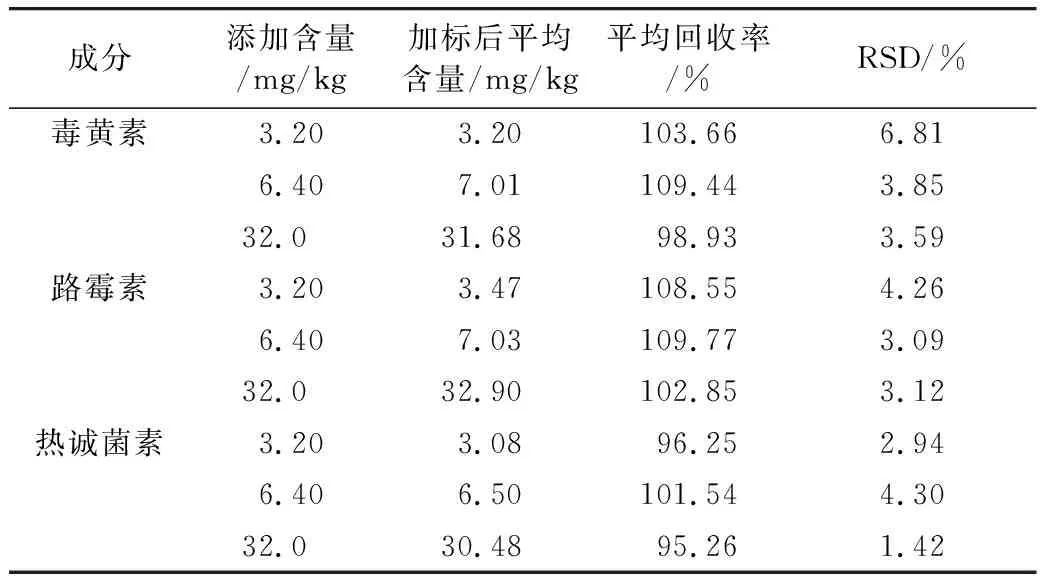
表4 毒黃素、路霉素和熱誠菌素方法回收率和精密度(n=6)
2.3.3 日內精密度和日間精密度
取40 μg/mL的毒黃素、路霉素和熱誠菌素的混合標準溶液,重復進樣6次,考察本方法的日內精密度;將該溶液連續3 d在相同的儀器條件下進行測定,以考察本方法的日間精密度。毒黃素的保留時間與峰面積的日內相對標準偏差(RSD,n=6)分別為0.068%與0.81%,其日間相對標準偏差(RSD,n=3)分別為0.19%與1.21%,路霉素的保留時間與峰面積的日內相對標準偏差(RSD,n=6)分別為0.13%與0.46%,,其日間相對標準偏差(RSD,n=3)分別為0.18%與1.76%,熱誠菌素的保留時間與峰面積的日內相對標準偏差(RSD,n=6)分別為0.19%與0.42%,其日間相對標準偏差(RSD,n=3)分別為0.33%與2.00%,表明該方法具有較好的日內精密度與日間精密度,結果見表5和表6。
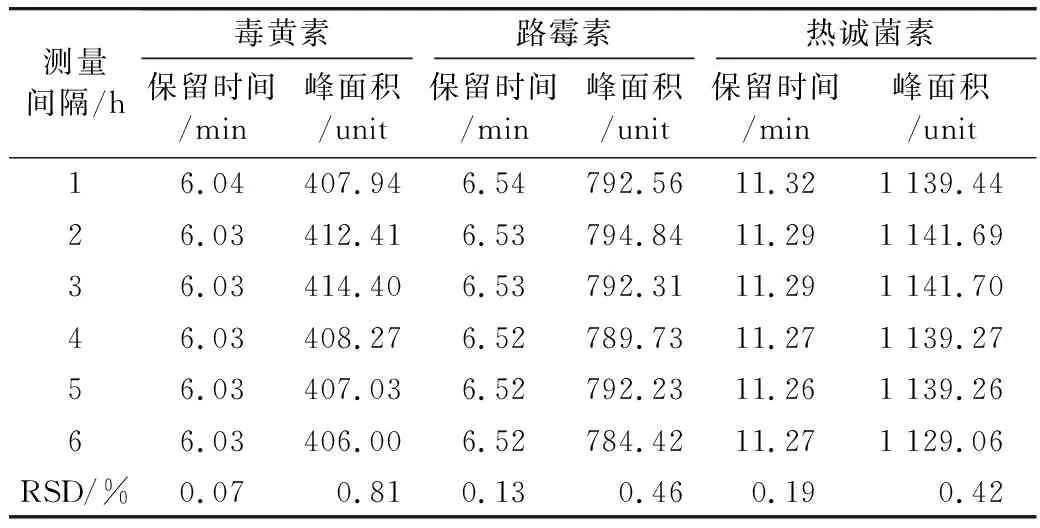
表5 毒黃素、路霉素和熱誠菌素的日內精密度(n=6)
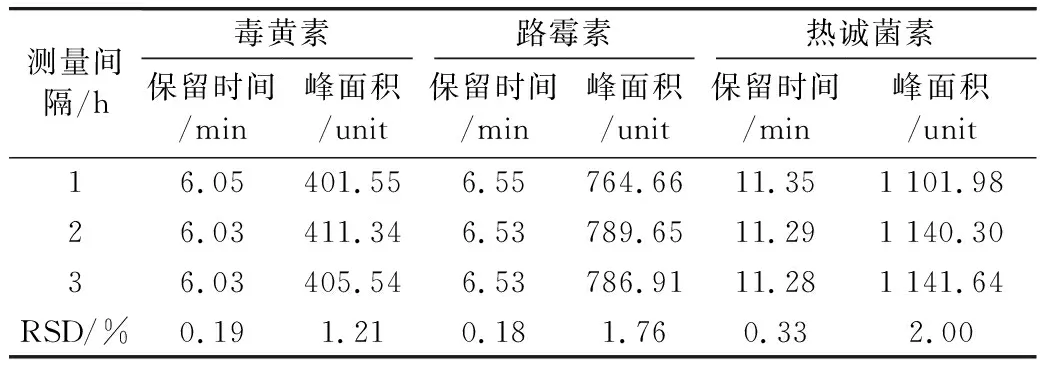
表6 毒黃素、路霉素和熱誠菌素的日間精密度(n=3)
2.4 實際樣品的測定
選取市場上主要流通的食用植物油有菜籽油、稻米油、玉米油、芝麻油、花生油和大豆油等11個樣本,采用高效液相色譜分析測定植物油中的毒黃素、路霉素和熱誠菌素含量,結果顯示11種植物油均未檢出毒黃素(<0.8 mg/kg),路霉素(<0.8 mg/kg)和熱誠菌素(<0.8 mg/kg)。任意選取一稻米油稱取10個平行隨機添加3個試管中模擬盲樣測試,添加水平分別為4、8、32 mg/kg,結果顯示路霉素分別為4.02、7.74、31.18 mg/kg;毒黃素分別為4.13、7.84、30.22 mg/kg;熱誠菌素分別為3.92、7.77、30.55 mg/kg,其他樣品均未檢出,說明該方法可以準確地定性和定量植物油中的毒黃素、路霉素和熱誠菌素。
3 結論
通過對前處理條件和色譜條件的優化,建立一種食用植物油中毒黃素、路霉素和熱誠菌素含量的高效液相色譜檢測方法。該法在0~40 μg/mL范圍內線性良好,毒黃素:y=19.184x-6.00×10-9(r2=0.999 6);路霉素:y=11.273x+3.12 (r2=0.999 4);熱誠菌素:y=29.129x-2.00×10-8(r2=0.999 5)。靈敏度高,當取樣量為5 g時,樣品中的毒黃素、路霉素和熱誠菌素經甲醇提取,以0.1甲酸∶甲醇(90∶10)為流動相,在240 nm波長下檢測。方法的檢出限均為0.8 mg/kg,定量限均為3.2 mg/kg;在食用植物油中進行范圍為3.2~32 mg/kg加標回收實驗,毒黃素的回收率(n=6)為102.85%~109.77%,方法精密度(RSD,n=6)小于6.81%;路霉素的回收率(n=6)為98.93%~109.44%, 方法精密度(RSD,n=6)小于4.26%;熱誠菌素的回收率(n=6)為95.26%~101.54%, 方法的精密度(RSD,n=6)小于4.30%。本方法操作方便,準確度高,可用于植物油中毒黃素、路霉素和熱誠菌素的含量測定,也為其他食品中可能產生的毒黃素、路霉素和熱誠菌素含量測定提供檢測依據。

