hsa_circ_0006370促進高糖誘導的人腎小管上皮細胞(HK?2)鐵死亡
熊軒,嚴躍紅,楊倩,沈美妊,鐘小仕
(1.廣州醫科大學附屬順德醫院腎臟內科,廣東 佛山 528315;2.廣州醫科大學附屬第五醫院腎臟內科,廣東 廣州 510799;3.暨南大學附屬廣州紅十字會醫院腎臟內科,廣東 廣州 510220)
糖尿病腎病(diabetic kidney disease,DKD)一直是導致慢性腎病和腎功能衰竭的主要原因。在過去的20年里,DKD的發病率和死亡率在世界范圍內迅速上升[1]。隨著腎臟的損傷,糖尿病患者經常會出現多種并發癥,如視網膜病變、神經病變和心血管疾病,所有這些因素都會導致死亡的風險升高[2]。DKD除了給患者帶來健康問題外,還會給社會帶來沉重的負擔。目前對DKD的發病機制的研究已大大增加,但引起DKD發生和發展的分子機制仍有待闡明。因此,尋找新發病機制和治療靶點可能為DKD患者治療提供新的方法。研究表明糖尿病腎病中腎小管病變在早期就已經出現,甚至早于腎小球病變,還有研究表明腎小管損傷要早于蛋白尿的出現[3]。腎小管損傷會影響腎小球濾過功能、導致氧化應激、缺氧、慢性炎癥以及纖維化,從而推動糖尿病腎病的進展[4]。以上研究表明腎小管上皮細胞是治療DKD的重要靶點。鐵死亡(ferroptosis)是一種新型的非凋亡調節的細胞死亡,由脂質修復酶谷胱甘肽過氧化物酶4(GPX 4)調控,由嚴重的脂質過氧化所驅動,這依賴于活性氧(ROS)的產生和鐵的超載[5]。雖然鐵死亡的生理功能尚不清楚,但它與多種人類疾病的關系已得到證實,如鐵死亡在缺血再灌注所致的急性腎損傷中起著重要作用,也是其他急性腎損傷模型的致病因素之一[6]。因此,調節腎小管上皮細胞鐵死亡可能具有治療DKD的潛力。環狀RNA(CircRNA)是一類在真核細胞中具有發育/組織特異性表達的非編碼RNA,通過連接3′端和5′端被環化。最近,有證據表明,circRNA在包括DKD在內的各種疾病的發生和發展過程中起著不可或缺的作用[7]。hsa_circ_0006370是一種新發現的circRNA,其表達和其是否通過調節腎小管上皮細胞鐵死亡來參與DKD發生發展的作用尚未見報道。本研究通過分析hsa_circ_0006370在腎小管上皮細胞中的表達,研究其在高糖環境下對細胞鐵死亡作用,尋找調控腎小管上皮細胞的鐵死亡潛在靶點,以期為DKD的臨床治療策略提供重要線索。
1 材料與方法
1.1 主要材料
人近曲腎小管上皮細胞株(HK?2細胞)購于中國科學院上海生命科學研究院細胞資源中心;DMEM培養液、D?葡萄糖(2.5 mol/L)溶液、青?鏈霉素溶液、磷酸鹽緩沖液(PBS)和胎牛血清均購自美國GⅠBCO公司;鐵誘導的細胞死亡激活劑Erastin購于美國Sigma公司;Trizol和Lipofectamine 2000試劑盒購于美國Ⅰnvitrogen公司;Prime Script RT reagent Kit和SYBR Green RealtimePCR試劑盒購自日本TaKaRa公司;MTS細胞增殖檢測試劑盒購于美國Promega公司;hsa_circ_0006370干擾序列(si?hsa_circ_0006370)和對照序列(si?NC)均購于上海吉瑪制藥公司。細胞內ROS檢測試劑盒、鐵離子檢測試劑盒、乳酸脫氫酶(lactate dehydrogenase,LDH)活性檢測試劑盒、丙二醛(malondialdehyde,MDA)含量檢測試劑盒、谷胱甘肽過氧化物酶(GSH?Px)測定試劑盒、RⅠPA lysis buffer均購于上海碧云天生物公司;增強型化學發光試劑(electroche‐miluminescence,ECL)購自美國Sigma公司;抗人GPX4抗體、抗人xCT抗體、抗人FT抗體、抗人TFR抗體、抗人NRF2抗體、抗人HO?1抗體和抗人GAPDH抗體購于美國Santa Cruz公司。
1.2 實驗方法
1.2.1 HK?2細胞培養 采用含有10%(φ)胎牛血清的DMEM培養液進行培養,添加1%青?鏈霉素雙抗溶液,然后置于37℃含5%(φ)CO2的培養箱中培養,待細胞長至對數生長期時用于后續實驗。HK?2細胞培養分為以下4組:(1)正常培養組:細胞在正常條件下培養;(2)PBS培養組:細胞在正常條件下培養同時添加與第(3)和(4)等體積的PBS;(3)高糖培養組:細胞在正常條件下培養同時添加1%的D?葡萄糖(2.5 mol/L)溶液;(4)Erastin培養組:細胞在正常條件下培養同時添加1%的Erastin(100μmol/L)溶液。以上各組細胞培養24 h后,RT?qPCR檢測各組細胞中hsa_circ_0006370相對表達水平。
1.2.2 細胞轉染 HK?2細胞轉染按照Lipo‐fectamine 2000轉染試劑說明書操作,將hsa_circ_0006370干擾序列(si?hsa_circ_0006370)和對照序列(si?NC)轉染進入HK?2細胞。實驗分為4組:(1)高糖+干擾對照組(高糖+si?NC):高糖培養組細胞培養24 h后,轉染si?NC序列;(2)高糖+干擾hsa_circ_0006370組(高糖+si?hsa_circ_0006370):高糖培養組細胞培養24 h后,轉染si?hsa_circ_0006370序列;(3)Erastin+干擾對照組(Erastin+si?NC):Erastin培養組細胞培養24 h后,轉染si?NC序列;(4)Erastin+干擾hsa_circ_0006370組(Erastin+si?hsa_circ_0006370):Erastin培養組細胞培養24 h后,轉染si?hsa_circ_0006370序列。以上各組細胞經37℃含5%CO2條件下培養12 h后,檢測各組細胞中hsa_circ_0006370相對表達水平、細胞增殖水平、細胞ROS、LDH、MDA、GSH?Px水平以及GPX4、xCT、FT、TFR、NRF2、HO?1蛋白表達水平。
1.2.3 RT?qPCR 分別收集各組經培養或轉染后的HK?2細胞,Trizol試劑抽提細胞內的總RNA,采用Prime Script RTreagent Kit將總RNA逆轉錄成cDNA,根據SYBR Green Realtime PCR試劑盒說明書配置qPCR體系進行qPCR,檢測各組細胞中hsa_circ_0006370表達水平。以U6作為內參,根據2-ΔΔCt法計算各組細胞中hsa_circ_0006370相對表達水平。
1.2.4 MTS法檢測細胞增殖 MTS法檢測各組轉染后的HK?2細胞增殖,將上述培養的4組細胞:(1)高糖+si?NC組、(2)高糖+si?hsa_circ_0006370組、(3)Erastin+si?NC組、(4)Erastin+si?hsa_circ_0006370組細胞(1×104個/孔)接種至96孔板中,37℃含5%CO2的條件下培養7 d后,按照MTS檢測試劑盒方法檢測各細胞在490 nm波長下的吸光度(A),計算細胞生存率。細胞生成率=si?hsa_circ_0006370組A/si?NC組A×100%。
1.2.5 細胞內鐵離子、ROS、LDH、MDA、GSH?Px活性水平檢測 將上述培養的4組細胞1×106個/孔接種至12孔板中,37℃含5%CO2的條件下培養12 h后,收集各組細胞,分別按照胞內鐵離子檢測試劑盒、ROS檢測試劑盒、LDH活性檢測試劑盒、MDA含量檢測試劑盒、GSH?Px測定試劑盒說明書操作,檢測各組細胞內ROS、LDH、MDA、GSH?Px活性水平。
1.2.6 Western blot將上述培養的4組細胞1×106個/孔接種至12孔板中,37℃含5%CO2條件下培養12 h后,收集各組細胞,先用RⅠPA裂解緩沖液裂解細胞,離心收集上清,測定蛋白質濃度。各組按等量(30μg)進行上樣,SDS?PAGE電泳分離蛋白,并將蛋白電轉至PVDF膜上,室溫封閉2 h后,分別加入抗人GPX4抗體、抗人xCT抗體、抗人FT抗體、抗人TFR抗體、抗人NRF2抗體、抗人HO?1抗體、抗人GAPDH抗體,4℃孵育過夜。次日洗膜、室溫孵育二抗2 h,經洗膜后化學發光ECL顯影、曝光、成像。
1.2.7 統計學方法 所有實驗數據采用SPSS 22.0軟件進行統計分析,實驗數據以表示,兩組間比較采用t檢驗,多組比較采用單因素方差分析,然后兩兩比較采用LSD?t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 高糖和Erastin處理對HK?2細胞中hsa_circ_0006370表達的影響
和正常培養組相比,PBS培養組細胞中hsa_circ_0006370相對表達水平無明顯差異(P>0.05),高糖培養組和Erastin培養組細胞中hsa_circ_0006370相對表達水平顯著升高(P均<0.01);和PBS培養組相比,高糖培養組和Erastin培養組細胞中hsa_circ_0006370相對表達水平顯著升高(P均<0.01)。見表1。
表1 RT?qPCR檢測高糖和Erastin處理后HK?2細胞中hsa_circ_0006370表達水平Table 1 The expression level of hsa_circ_0006370 detected by RT?qPCRin HK?2 cells after treatment with high glu‐cose and Erastin(±s,n=3)

表1 RT?qPCR檢測高糖和Erastin處理后HK?2細胞中hsa_circ_0006370表達水平Table 1 The expression level of hsa_circ_0006370 detected by RT?qPCRin HK?2 cells after treatment with high glu‐cose and Erastin(±s,n=3)
與正常培養組比較:*P<0.01;與加PBS培養組比較:#P<0.01。
?
2.2 干擾hsa_circ_0006370表達效果檢測
高糖+si?hsa_circ_0006370組細胞中hsa_circ_0006370相對表達水平顯著低于高糖+si?NC組(P<0.01);Erastin+si?hsa_circ_0006370組細胞中hsa_circ_0006370相對表達水平顯著低于Erastin+si?NC組(P<0.01)。見表2。
表2 RT?qPCR檢測細胞中hsa_circ_0006370相對表達水平Table 2 The relative expression of hsa_circ_0006370 in cells detected by RT?qPCR(±s,n=3)

表2 RT?qPCR檢測細胞中hsa_circ_0006370相對表達水平Table 2 The relative expression of hsa_circ_0006370 in cells detected by RT?qPCR(±s,n=3)
與高糖處理si?NC組比較:*P<0.01;與Erastin處理si?NC組比較:#P<0.01。
?
2.3 干擾hsa_circ_0006370表達對細胞增殖以及細胞內鐵離子、ROS、LDH、MDA、GSH?Px活性水平的影響
與 高 糖+si?NC組 相 比,高 糖+si?hsa_circ_0006370組細胞的增殖能力顯著增強(P<0.01),細胞內鐵離子、ROS、LDH和MDA活性水平均顯著降低,而GSH?Px活性水平顯著升高(P<0.01);與Eras‐tin+si?NC組相比,Erastin+si?hsa_circ_0006370組細胞的增殖能力顯著增強(P<0.01),細胞內鐵離子、ROS、LDH和MDA活性水平均顯著降低,而GSH?Px活性水平顯著升高(P<0.01)。見表3。
表3 干擾hsa_circ_0006370表達對細胞增殖以及細胞內鐵離子、ROS、LDH、MDA、GSH?Px活性水平的影響Table 3 Effects of the interference of hsa_circ_0006370 on cell proliferation,intracellular Fe2+,ROS,LDH,MDA and the activity of GSH?Px(±s,n=3)
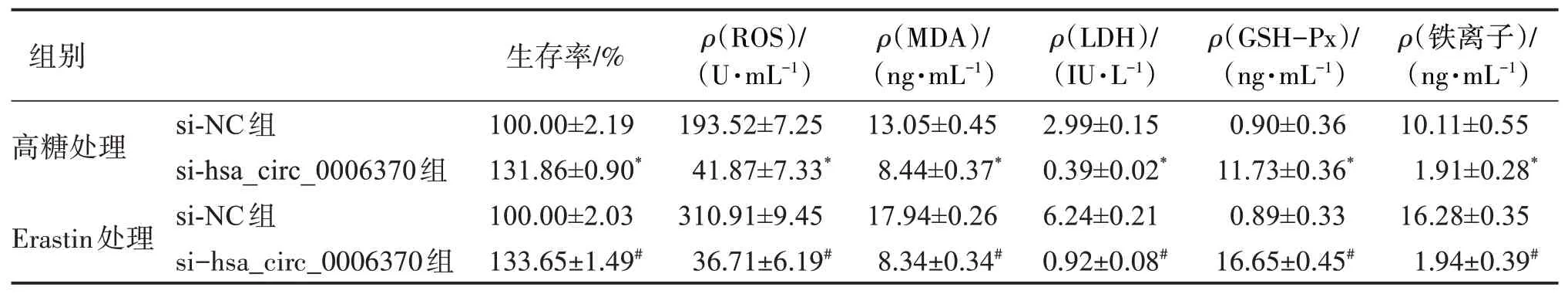
表3 干擾hsa_circ_0006370表達對細胞增殖以及細胞內鐵離子、ROS、LDH、MDA、GSH?Px活性水平的影響Table 3 Effects of the interference of hsa_circ_0006370 on cell proliferation,intracellular Fe2+,ROS,LDH,MDA and the activity of GSH?Px(±s,n=3)
與高糖處理si?NC組比較:*P<0.01;與Erastin處理si?NC組比較:#P<0.01。
?
2.4 干擾hsa_circ_0006370表達對細胞內鐵死亡標志和相關通路蛋白表達的影響
與 高 糖+si?NC組 相 比,高 糖+si?hsa_circ_0006370組細胞中的GPX4、胱氨酸/谷氨酸轉運蛋白(cystine/glutamate antiporter system Xc?,xCT)、鐵蛋白(ferritin,FT)、相關蛋白核因子E2相關因子2(nuclear factor E2?related factor?2,NRF2)和血紅素氧合酶1(hemeoxygenase?1,HO?1)蛋白表達水平明顯上升,轉鐵蛋白受體(transferrin receptor,TFR)蛋白表達水平顯著下降;與Erastin+si?NC組相比,Erastin+si?hsa_circ_0006370組 細 胞 中 的GPX4、xCT、FT、NRF2、HO?1蛋白表達水平明顯上升,TFR蛋白表達水平明顯下降。見圖1和表4。
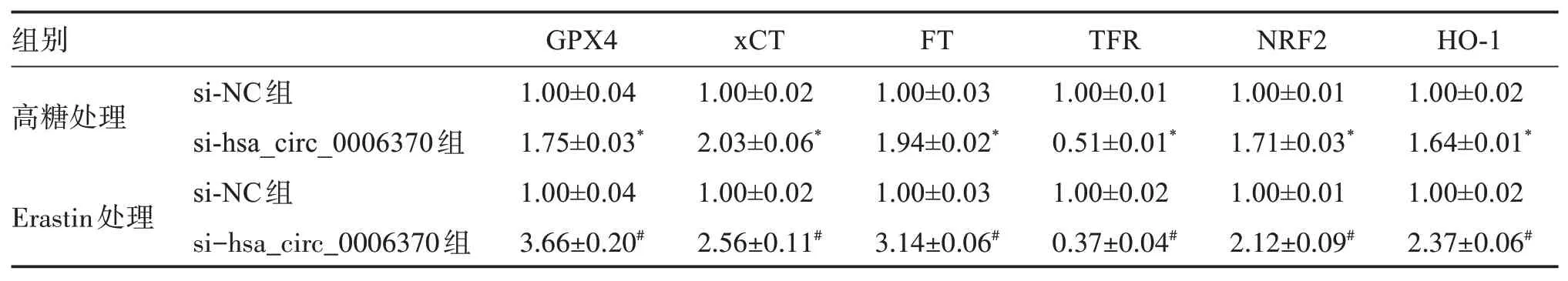
表4 干擾hsa_circ_0006370表達對細胞GPX4、xCT、FT、TFR、NRF2、HO?1蛋白表達的影響Table 4 Effects of the interference of hsa_circ_0006370 on the expression of GPX4,xCT,FT,TFR,NRF2,and HO?1(n=3)
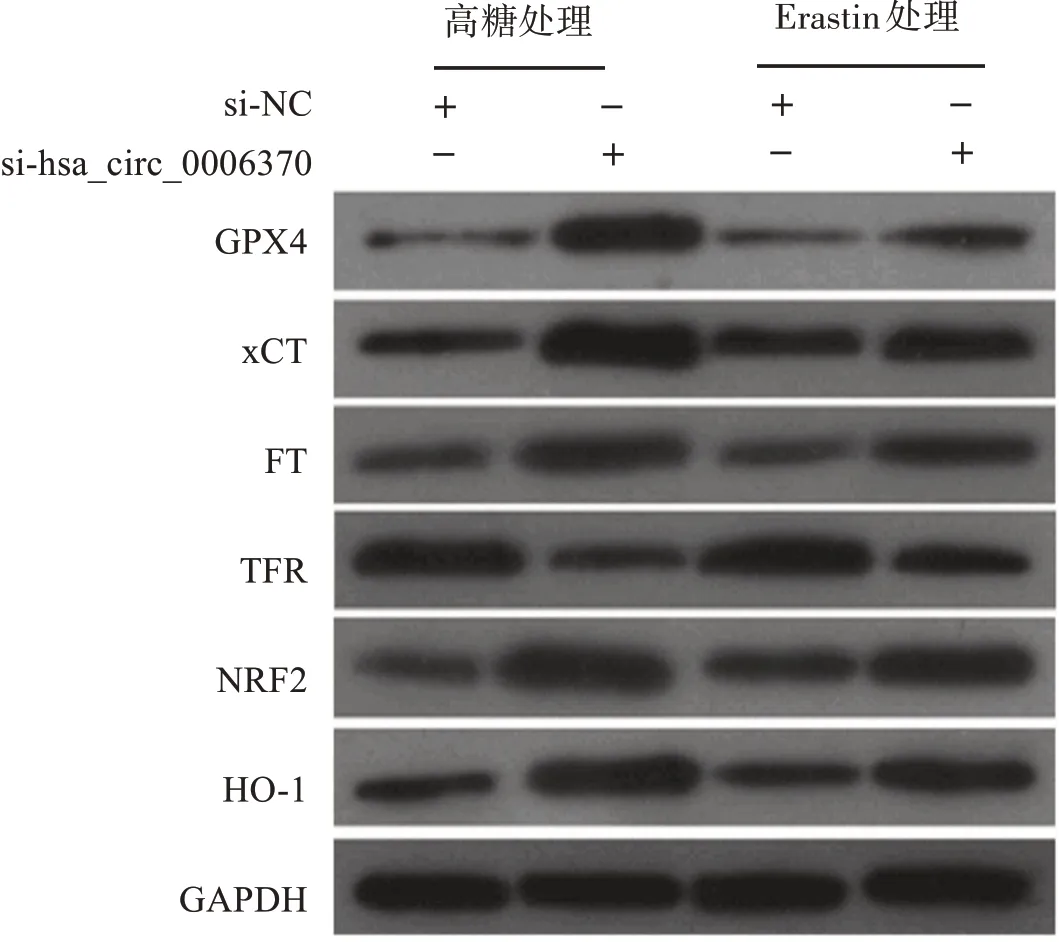
圖1 Western blot檢測各組細胞中GPX4、xCT、FT、TFR、NRF2、HO?1蛋白表達Figure 1 The expressions of GPX4,xCT,FT,TFR,NRF2,and HO?1ineach group detected by Western blot
3 討論
DKD是目前最常見的終末期腎病病因,但DKD的具體機制尚不清楚。由于DKD的進展涉及到許多途徑,因此單純的血糖或血壓控制不足以預防及治療DKD。針對其各種危險因素采用的如血管緊張素轉換酶抑制劑等各種藥物無論是單獨使用還是聯合治療均無法緩解或逆轉DKD[8]。因此,糖尿病腎病的發病機制有待深入研究。
近年來,circRNAs引起了人們的廣泛關注。circRNAs是一類由反向剪接產生的非編碼RNAs,與線性非編碼RNAs相比,circRNAs由于其閉環結構而具有更高的穩定性。越來越多的證據證實,cir‐cRNAs可能通過發揮非編碼或編碼RNA的作用而發揮不同的生物學作用。由于circRNAs比線性RNA更穩定,具有更長的半衰期和對RNase的抗性,它們可以作為線性RNA的競爭對手,在基因表達中發揮調節作用[9],同時也使其成為診斷性生物標記物和治療靶點的潛在候選分子。近年來,大量的研究揭示了它們在人類各種疾病發生和發展過程中的獨特表達特征和重要的生物學作用,如癌癥[10]、心血管疾病[11]、腎病[12]。最近有一些關于異常表達的circRNAs在DKD中的研究,如Peng等[7]研究發現在高糖培養的腎臟系膜細胞和腎小管上皮細胞中,circ_010383的表達明顯下調,circ_010383可以通過下調miR?135a的表達促進DKD腎纖維化的發生。circ_0080425的表達與DKD的進展相關,對系膜細胞的增殖和纖維化有積極作用,其通過海綿化miR?24?3p和靶向成纖維細胞生長因子11抑制DKD細胞增殖和纖維化[13]。hsa_circ_0006370是一種新發現的circRNA,目前與其相關的研究報道較少。本研究發現在高糖培養的HK?2細胞中hsa_circ_0006370表達水平顯著升高,表明hsa_circ_0006370在高糖培養的HK?2細胞中異常表達。Erastin作為細胞鐵死亡的誘導劑,在添加有Erastin培養的HK?2細胞中同樣存在hsa_circ_0006370表達水平異常升高的現象,表明hsa_circ_0006370可能與DKD中調節腎小管上皮細胞鐵死亡的機制有關。此外,本研究還發現在高糖和Erastin培養的HK?2細胞中干擾hsa_circ_0006370表達,能夠促進細胞的增殖,對細胞生長有保護作用,進一步證實hsa_circ_0006370在DKD病理進程中可能有調節腎小管上皮細胞鐵死亡的作用。
鐵死亡是一種新發現的由鐵依賴性脂質過氧化引起的調節性細胞死亡,它在遺傳學、生物化學和形態學上不同于其他調節性細胞死亡[14]。近年來,鐵死亡被發現參與了包括DKD在內許多疾病的發展過程[15?16]。氧化還原性鐵的積累、抗氧化能力的喪失和含有多不飽和脂肪酸的磷脂酶的過氧化都是鐵死亡的特征性變化,這些指標可以用來評估鐵死亡的程度[17]。ROS積聚是導致鐵死亡的主要原因,ROS誘導含磷脂細胞膜發生脂質過氧化,產生MDA,直接引起細胞毒性,進而誘發鐵死亡[18]。本研究發現在高糖和Erastin培養的HK?2細胞中干擾hsa_circ_0006370表達,能夠降低細胞內鐵離子、ROS、LDH和MDA積聚,同時增加GSH?Px水平,從而減輕其對細胞的毒性。GPX4和SLC7A11(xCT的催化亞基)被認為是鐵死亡的重要生物標志物,因為缺乏它們可能導致大量ROS產生和GSH生物合成功能障礙[19]。TFR‐1和FTH‐1是參與鐵代謝穩態的2個關鍵基因,與鐵死亡的發生密切相關[20]。NRF2在轉錄水平上調節與鐵儲存和轉運相關,同時,NRF2通過調節一系列信號蛋白和酶的表達來維持細胞氧化還原穩態和氧化介質的平衡,在抗氧化應激中發揮重要的調節作用[21]。HO?1可由多種線索誘導,包括炎癥介質、氧化劑,是對細胞氧化還原狀態作出反應的關鍵調節物[22]。本研究發現在高糖和Erastin培養的HK?2細胞中干擾hsa_circ_0006370表達能夠增加GPX4、xCT、FTH、NRF2和HO?1蛋白表達水平,抑制TFR蛋白表達水平,進一步證實hsa_circ_0006370在高糖環境中能夠促進腎小管上皮細胞發生鐵死亡。本研究雖然證實了hsa_circ_0006370在高糖環境中能夠促進腎小管上皮細胞發生鐵死亡,但是其具體的分子調控機制仍需進行深入的研究。
綜上所述,本研究證實了hsa_circ_0006370在高糖培養的HK?2細胞中高表達,干擾hsa_circ_0006370表達顯著促進細胞的增殖、減輕細胞內ROS等活性物質產生,提高抗氧化能力,抑制細胞發生鐵死亡。本研究為DKD的診治提供了新的潛在作用靶點,可能具有較好的應用前景。

