陽離子交換樹脂靜態(tài)吸附法特異性分離乳清中乳鐵蛋白的關(guān)鍵技術(shù)
杜健,張光艷,董博,王瑞琦,劉銀雪,劉同杰,易華西,公丕民,張?zhí)m威
(中國海洋大學(xué) 食品科學(xué)與工程學(xué)院,山東 青島,266000)
乳鐵蛋白(lactoferrin,Lf)早在1939年就被分離得到,分子質(zhì)量大約為80 kDa,屬于轉(zhuǎn)鐵蛋白家族的一種非血紅素轉(zhuǎn)鐵蛋白[1]。Lf存在于人體的各種分泌液中,在母乳中含量最高[2],它的生物學(xué)功能尤其是對嬰幼兒的健康和腸道菌群的影響已經(jīng)被廣泛報(bào)道,包括Lf降低嬰兒和兒童腹瀉發(fā)病率[3-4]、降低嬰兒和兒童呼吸道疾病發(fā)病率[5]、降低新生兒敗血癥發(fā)生率[6-7]、對多種致病菌呈現(xiàn)抑菌活性[8-9]、具有促進(jìn)腸道發(fā)育的功能[10]等,因此Lf被廣泛應(yīng)用于嬰幼兒配方奶粉領(lǐng)域中,GB 1903.17—2016 《食品安全國家標(biāo)準(zhǔn) 食品營養(yǎng)強(qiáng)化劑 乳鐵蛋白》對Lf的理化指標(biāo)進(jìn)行明確規(guī)定,其中Lf純度為95%。但Lf價(jià)格昂貴和制造技術(shù)被國外壟斷這些嚴(yán)重制約著我國嬰幼兒配方奶粉產(chǎn)業(yè)的發(fā)展。目前,Lf提取的方法包括凝膠過濾色譜法、親和色譜法、膜過濾法、磁分離法、離子交換色譜法。其中,離子交換色譜法是根據(jù)組分電荷的不同實(shí)現(xiàn)從多組分體系中分離出單一組分常用的方法,LU等[11]采用超濾和強(qiáng)陽離子交換層析相結(jié)合的方法從牛初乳中分離Lf,使用膜進(jìn)行超濾后,再用陽離子交換層析進(jìn)行純化,Lf的純度達(dá)到94.2%;WU等[12]用連續(xù)陽離子-陰離子交換層析從牛初乳中分離到純度為95%的Lf。與其他方法相比,離子交換色譜法分離Lf具有可大規(guī)模實(shí)施、特異性強(qiáng)、分離成本相對較低、效率較高的優(yōu)點(diǎn),但是上述分離Lf方法的缺點(diǎn)是吸附劑價(jià)格昂貴、分離步驟繁雜、分離循環(huán)時(shí)間長、Lf純度較低等,制約著其工業(yè)化的實(shí)現(xiàn)。
針對離子交換色譜法分離Lf存在的上述問題,本文以乳品加工副產(chǎn)物乳清為原料,通過篩選低成本、高效特異性的Lf吸附劑,研究從乳清中高效分離Lf的關(guān)鍵技術(shù)條件,研究可工業(yè)化高效分離Lf的關(guān)鍵技術(shù),降低吸附成本,提高Lf的純度,為推動我國Lf的工業(yè)化生產(chǎn)提供技術(shù)支持。
1 材料和方法
1.1 實(shí)驗(yàn)材料
新鮮牛乳樣品,奧特奶牛良種牧場(中國青島);Lf樣品,Edifice International Trading Pte;SDS-PAGE凝膠制備試劑盒、彩虹180廣譜marker(PR1910),北京索萊寶科技有限公司;陽離子交換樹脂X,利穗科技(蘇州)有限公司;732型陽離子交換樹脂,天津市廣成化學(xué)試劑有限公司;D152大孔陽離子交換樹脂、殼聚糖,上海源葉生物有限公司;C-115E陽離子交換樹脂,上海恩臨環(huán)保科技有限公司;SDS-PAGE蛋白上樣緩沖液(SDS-PAGE sample loading buffer,2X)、BCA蛋白濃度測定試劑盒(BCA protein assay kit),碧云天生物科技公司;牛乳鐵蛋白ELISA檢測試劑盒,上海羽朵生物科技有限公司;鹽酸、氫氧化鈉、冰醋酸,均為分析純,國藥集團(tuán)化學(xué)試劑有限公司;實(shí)驗(yàn)室用水為蒸餾水。
1.2 實(shí)驗(yàn)方法
1.2.1 陽離子交換樹脂及殼聚糖水凝膠處理及吸附Lf能力的研究
(1)陽離子交換樹脂預(yù)處理方法。將C-115E陽離子交換樹脂、D152大孔弱酸性丙乙酸系陽離子交換樹脂、陽離子交換樹脂X、732型陽離子交換樹脂浸泡于飽和食鹽水中18 h后,用蒸餾水洗凈,使水不帶黃色,然后用質(zhì)量分?jǐn)?shù)4%~5%的NaOH溶液和體積分?jǐn)?shù)4%~5%的HCl溶液依次交替浸泡2 h,在堿酸之間用大量清水淋洗至出水接近中性,重復(fù)3次,備用。
(2)殼聚糖水凝膠制備方法。以質(zhì)量濃度為0.04 g/mL殼聚糖水溶液,滴于體積分?jǐn)?shù)為2%的醋酸溶液中,制備殼聚糖水凝膠微球備用。
(3)陽離子交換樹脂及殼聚糖水凝膠吸附Lf能力的研究。用0.02 mol/L磷酸鹽緩沖液(phosphate buffer saline,PBS)(pH 7.2)配制質(zhì)量濃度為1 mg/mL的Lf樣品溶液,分別取2 g已處理好的各種吸附劑于40 mL Lf樣品溶液中靜態(tài)吸附處理12 h后,靜置沉降,取吸附殘液上清液與上樣緩沖液按體積比1∶1混勻,加熱煮沸3 min后通過SDS-PAGE電泳,同時(shí)以未處理Lf樣品為對照,采用ImagJ軟件對圖像進(jìn)行蛋白質(zhì)相對定量檢測(灰度值)。各種吸附劑對Lf的吸附率計(jì)算如公式(1)所示:

(1)
1.2.2 陽離子交換樹脂X對Lf最大吸附量檢測
配制質(zhì)量濃度為1 mg/mL的Lf樣品溶液,取1 g處理好的陽離子交換樹脂X于50 mL Lf樣品溶液中靜態(tài)吸附處理。分別在不同時(shí)間取樣,經(jīng)SDS-PAGE電泳,處理過程同1.2.1,通過最大吸附率計(jì)算陽離子交換樹脂X對Lf樣品的最大吸附量。
1.2.3 陽離子交換樹脂X吸附乳清的時(shí)間曲線
首先取3 g處理好的陽離子交換樹脂X于40 mL乳清中靜態(tài)吸附處理。20 ℃水浴搖床(75 r/min),分別在不同時(shí)間取樣,經(jīng)SDS-PAGE電泳,處理過程同1.2.1,分析樹脂對乳蛋白吸附能力及其對Lf吸附的特異性。
1.2.4 陽離子交換樹脂X吸附不同pH值乳清蛋白特異性檢測
取3 g已處理好的陽離子交換樹脂X分別在pH為4.07、5.17、5.87條件下靜態(tài)吸附乳清3 h,取吸附殘液上清液。將樹脂與乳清分離,采用NaCl+0.02 mol/L PBS緩沖液連續(xù)洗脫3次,分別取上清液經(jīng)SDS-PAGE電泳,處理過程同1.2.1,分析pH值對樹脂吸附Lf特異性影響。
1.2.5 陽離子交換樹脂X與乳清的體積比對吸附Lf效果的影響
取1 mL已處理好的陽離子交換樹脂X分別靜態(tài)吸附10、15、20、25、30、35 mL乳清3 h,取吸附殘液上清液進(jìn)行SDS-PAGE電泳,處理過程同1.2.1,分析樹脂靜態(tài)吸附乳清的最佳體積比。
1.2.6 陽離子交換樹脂X吸附Lf過程攪拌處理
取1.5 mL已處理好的陽離子交換樹脂X靜態(tài)吸附30 mL乳清,磁力攪拌速度分別為100、200、300 r/min,吸附3 h,取吸附殘液上清液,經(jīng)SDS-PAGE電泳,處理過程同1.2.1,分析陽離子交換樹脂X靜態(tài)吸附乳清的最佳攪拌轉(zhuǎn)速。
1.2.7 洗脫液離子濃度對于陽離子交換樹脂X吸附Lf后的洗脫
首先取2 mL處理好的陽離子交換樹脂X在pH 5.20條件下靜態(tài)吸附乳清3 h,將乳清與樹脂分離,得到吸附乳清后的樹脂進(jìn)行洗脫,根據(jù)洗脫液的離子濃度不同分為3種洗脫方法。(1)首先用蒸餾水沖洗,再用0.3 mol/L NaCl+0.02 mol/L PBS洗脫10 min,再用蒸餾水沖洗10 min,最后用0.9 mol/L NaCl+0.02 mol/L PBS洗脫30 min;(2)首先用蒸餾水沖洗,再用0.6 mol/L NaCl+0.02 mol/L PBS洗脫10 min、再用蒸餾水沖洗10 min,最后用0.9 mol/L NaCl+0.02 mol/L PBS洗脫30 min;(3)首先用蒸餾水沖洗,再用0.9 mol/L NaCl+0.02 mol/L PBS洗脫10 min、再用蒸餾水沖洗10 min,最后用0.9 mol/L NaCl+0.02 mol/L PBS洗脫30 min。取洗脫液做SDS-PAGE電泳,處理過程同1.2.1,確定最佳的洗脫工藝。
1.2.8 最佳工藝條件下Lf高效特異性分離效果評價(jià)
取2 mL處理好的陽離子交換樹脂X在pH 5.17靜態(tài)吸附30 mL乳清3 h,使乳清與樹脂分離,樹脂經(jīng)蒸餾水沖洗后通過以下工藝洗脫,首先用10 mL 0.3 mol/L NaCl+0.02 mol/L PBS洗脫10 min,再用30 mL蒸餾水沖洗10 min,最后用10 mL 0.9 mol/L NaCl+0.02 mol/L PBS洗脫30 min,取洗脫液和未處理組乳清留樣檢測。
采用ELISA法測定乳清與洗脫液中Lf的濃度,并根據(jù)乳清與洗脫液的體積計(jì)算Lf的回收率。采用BCA測總蛋白濃度法測定洗脫液中總蛋白濃度,并根據(jù)洗脫液中Lf濃度,計(jì)算出Lf的蛋白質(zhì)純度。采用SDS-PAGE電泳法,輔助檢測洗脫液中各蛋白的相對含量。
2 結(jié)果與分析
2.1 不同陽離子交換樹脂及殼聚糖水凝膠吸附Lf能力
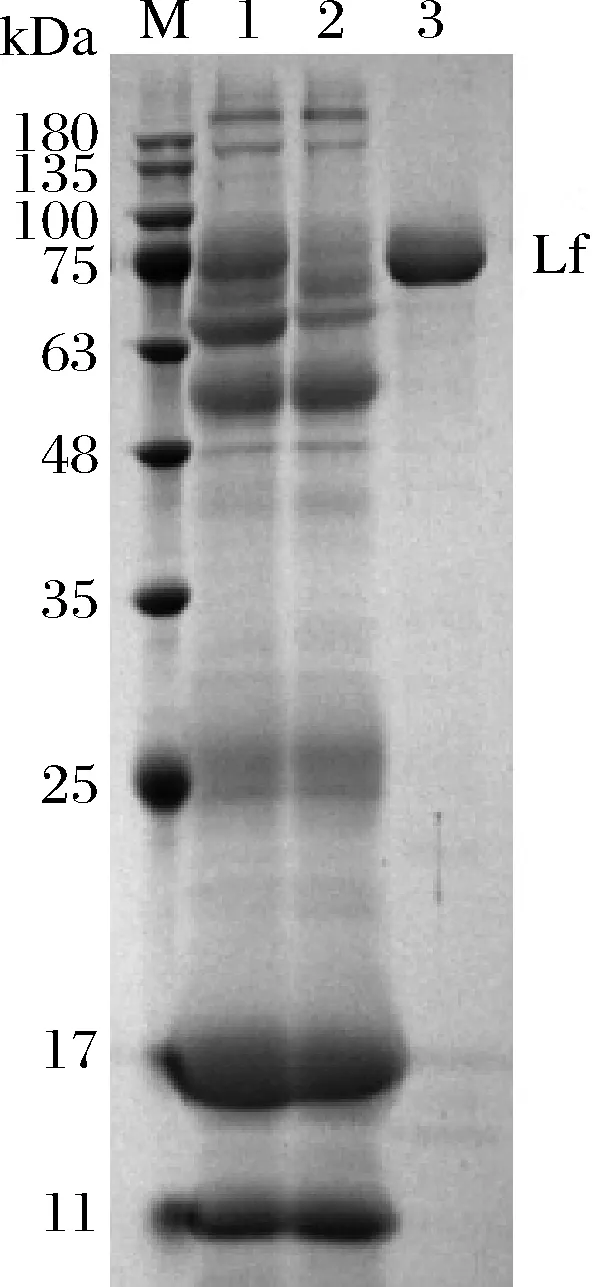
將Lf樣品經(jīng)過不同陽離子交換樹脂及殼聚糖水凝膠吸附后,取各吸附劑吸附后Lf樣品殘液進(jìn)行SDS-PAGE凝膠電泳,結(jié)果見圖1。通過公式(1)計(jì)算各吸附劑對Lf樣品的吸附率,結(jié)果見圖2。
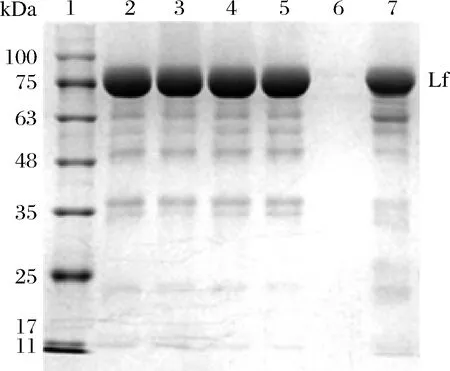
1-蛋白marker;2-未處理組Lf樣品;3-Lf經(jīng)過殼聚糖水凝膠吸附后殘余液;4-Lf經(jīng)過C-115E陽離子交換樹脂吸附后殘余液;5-Lf經(jīng)過D152陽離子交換樹脂吸附后殘余液;6-Lf經(jīng)過陽離子交換樹脂X吸附 后殘余液;7-Lf經(jīng)過732陽離子交換樹脂吸附后殘余液圖1 Lf樣品經(jīng)殼聚糖水凝膠或不同陽離子交換樹脂 處理后SDS-PAGE凝膠電泳圖Fig.1 SDS-PAGE gel electrophoresis of Lf samples after treatment with chitosan hydrogel or different cation exchange resins

1-殼聚糖水凝膠;2-C-115E陽離子交換樹脂;3-D152陽離子 交換樹脂;4-陽離子交換樹脂X;5-732陽離子交換樹脂圖2 殼聚糖水凝膠和不同陽離子交換樹脂對 Lf樣品吸附效果Fig.2 Adsorption effect of chitosan hydrogel and different cation exchange resins on Lf samples
由圖2可知,陽離子交換樹脂X對Lf樣品具有較強(qiáng)的吸附能力,732陽離子交換樹脂對Lf樣品具有一定的吸附能力,殼聚糖水凝膠、C115E陽離子交換樹脂、D152陽離子交換樹脂對Lf樣品幾乎沒有吸附能力。因此陽離子交換樹脂X可作為進(jìn)一步研究Lf分離的吸附劑。
2.2 陽離子交換樹脂X吸附Lf的最大吸附量
將Lf樣品經(jīng)陽離子交換樹脂X靜態(tài)吸附不同時(shí)間后,取吸附殘液進(jìn)行SDS-PAGE凝膠電泳,結(jié)果見圖3,采用ImagJ軟件對圖像進(jìn)行蛋白質(zhì)相對定量檢測,分析吸附殘余液中Lf的相對含量,計(jì)算吸附量,結(jié)果見圖4。1 g陽離子交換樹脂X可吸附大約70 mg的Lf,其對Lf樣品的吸附容量較高,較高吸附容量意味著可以通過相對較少的吸附劑處理等量的原料,有利于低成本高效工業(yè)化生產(chǎn)。
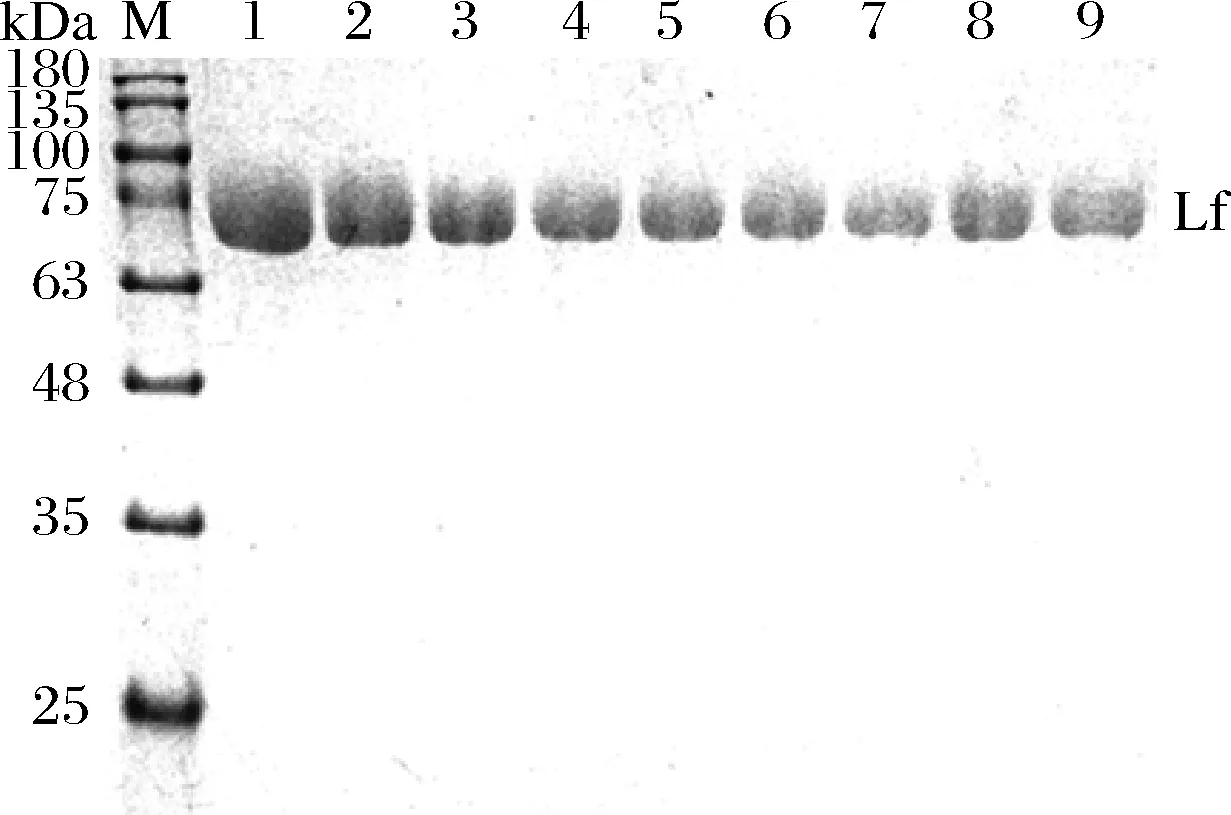
M-蛋白marker;泳道1、2、3、4、5、6、7、8、9分別為Lf樣品 經(jīng)過陽離子交換樹脂X靜態(tài)吸附0、0.25、0.5、1、 1.5、2、3、4、5 h后吸附殘液圖3 Lf樣品經(jīng)陽離子交換樹脂X靜態(tài)吸附不同時(shí)間 后殘液的SDS-PAGE凝膠電泳圖Fig.3 SDS-PAGE gel electrophoresis of Lf samples after static adsorption of cation exchange resin X for different time

圖4 陽離子交換樹脂X對Lf樣品的吸附量與靜態(tài)吸附 時(shí)間的關(guān)系分析Fig.4 Relationship between static adsorption time and adsorption capacity of cation exchange resin x for Lf samples
2.3 不同時(shí)間陽離子交換樹脂X靜態(tài)吸附乳蛋白的效果
將乳清經(jīng)陽離子交換樹脂X靜態(tài)吸附不同時(shí)間后,取吸附殘液進(jìn)行SDS-PAGE凝膠電泳,結(jié)果見圖5。通過公式(1)計(jì)算各乳清蛋白的吸附率,結(jié)果見圖6。陽離子交換樹脂X在pH 4.2條件下對乳清中的Lf的吸附具有一定的特異性,對其他乳蛋白吸附能力比Lf低,因此該樹脂具備從乳清中直接分離Lf的潛力。但是由于其對乳清中其他乳蛋白也具有一定的吸附能力,因此需要優(yōu)化吸附條件,進(jìn)一步提高其對Lf分離的特異性。
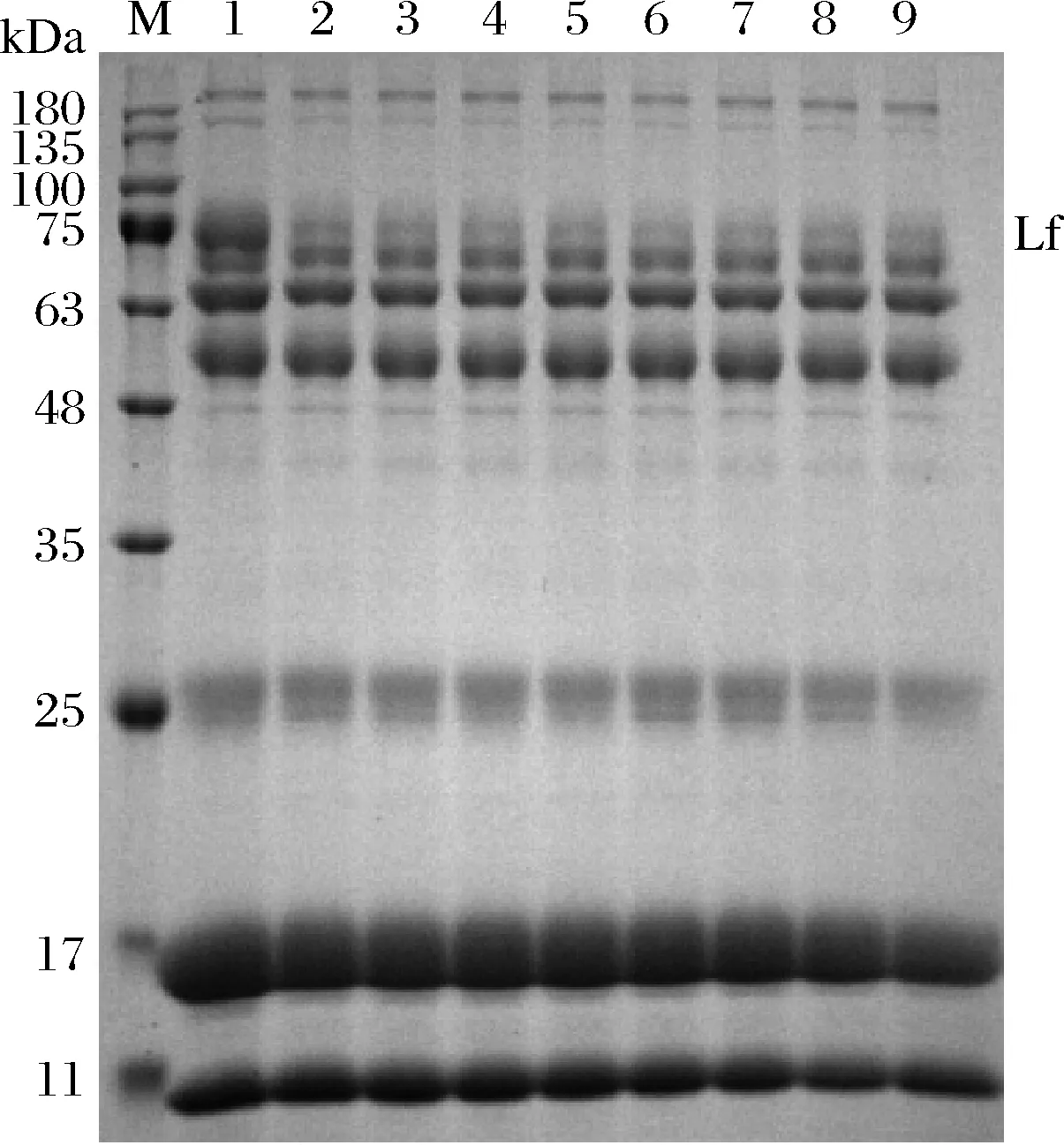
M-蛋白marker;泳道1、2、3、4、5、6、7、8、9分別為乳清 經(jīng)陽離子交換樹脂X吸附0、2、3、4、5、6、7、8、20 h殘液圖5 乳清經(jīng)陽離子交換樹脂X靜態(tài)吸附不同時(shí)間后殘液 蛋白質(zhì)的SDS-PAGE凝膠電泳圖Fig.5 SDS-PAGE gel electrophoresis of protein residue in whey after cation exchange resin X static adsorption at different time
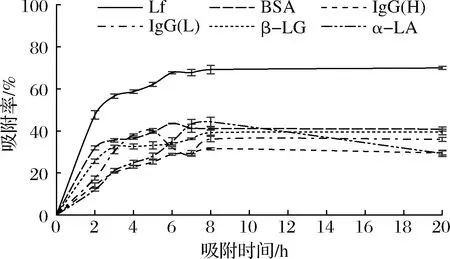
圖6 陽離子交換樹脂X靜態(tài)吸附乳清不同時(shí)間 后各乳蛋白的吸附效果Fig.6 The adsorption effect of each milk protein after cation exchange resin X static adsorption whey different times
2.4 pH值對陽離子交換樹脂X吸附乳清蛋白特異性的影響
將乳清經(jīng)陽離子交換樹脂X分別在pH 4.02、5.17、5.86下靜態(tài)吸附3 h,取上清液進(jìn)行電泳,結(jié)果見圖7。
采用ImagJ軟件對圖像進(jìn)行蛋白質(zhì)相對定量檢測,并將吸附殘余液中各蛋白的相對含量與未處理組乳清中各蛋白的相對含量進(jìn)行比較,通過公式(1)計(jì)算各乳清蛋白的吸附率,結(jié)果見圖8。陽離子交換樹脂X對于乳清中各蛋白質(zhì)的吸附率受pH影響很大。在pH 4.02時(shí),該樹脂對乳清中Lf的吸附率較高,但是由于其對乳清中其他蛋白吸附率也很高,導(dǎo)致其對Lf吸附的特異性并不高。在pH 5.86時(shí),該樹脂對Lf吸附的特異性最高,但其對Lf吸附率有所降低。因此,隨著pH增加,該樹脂對乳清的吸附特異性增加,但是吸附速率降低。綜合看,在pH 5.17時(shí)樹脂對Lf的吸附特異性相對較高,對Lf的吸附率也相對較高。

M-蛋白marker;泳道1、2:pH 4.02時(shí)未處理組乳清、吸附殘余液乳清;泳道3、4、5:吸附pH 4.02時(shí),樹脂經(jīng)0.6 mol/L NaCl PBS溶液連續(xù)洗脫3次洗脫液;泳道6、7:pH 5.17時(shí)未處理組乳清、吸附殘余液乳清;泳道8、9、10:吸附pH 5.17時(shí),樹脂經(jīng)0.6 mol/L NaCl PBS溶液連續(xù)洗脫3次洗脫液;泳道11、12:pH 5.86時(shí)未處理組乳清、吸附殘余液乳清;泳道13、14、15:吸附pH 5.86時(shí),樹脂經(jīng)0.6 mol/L NaCl PBS溶液 連續(xù)洗脫3次洗脫液圖7 不同pH下陽離子交換樹脂X吸附乳清殘余液和 洗脫液的SDS-PAGE凝膠電泳圖Fig.7 SDS-PAGE gel electrophoresis of whey residues and eluent adsorbed by cation exchange resin X at different pH levels
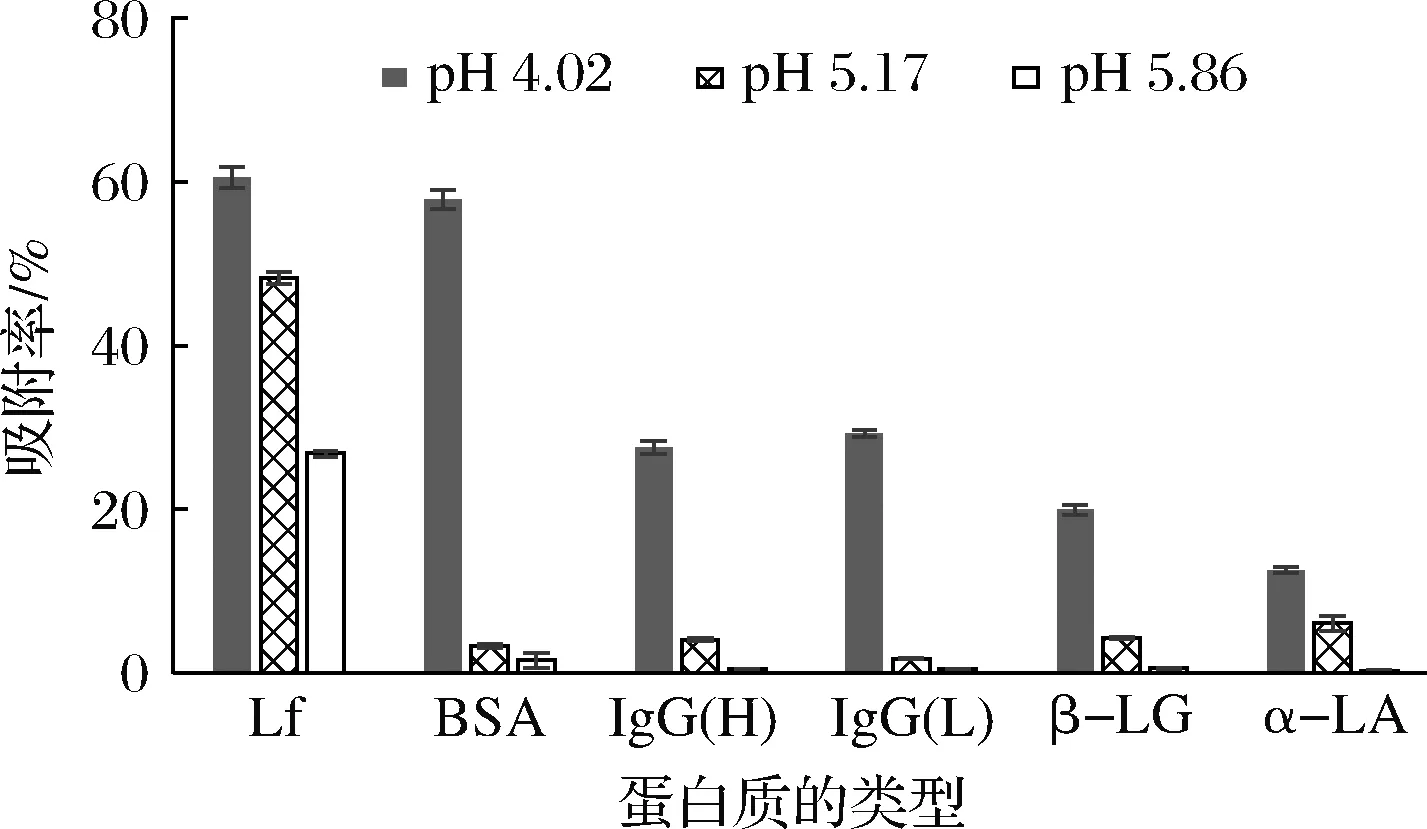
圖8 pH對陽離子交換樹脂X吸附乳清蛋白 特異性的影響分析結(jié)果Fig.8 Effect of pH on the specificity of whey protein adsorbed by cation exchange resin X
2.5 陽離子交換樹脂X與乳清的體積比對Lf吸附率的影響
取1 mL已處理好的陽離子交換樹脂X分別靜態(tài)吸附10、15、20、25、30、35 mL乳清3 h,取吸附殘液上清液留樣,經(jīng)SDS-PAGE凝膠電泳,結(jié)果見圖9。
采用ImagJ軟件對圖像進(jìn)行蛋白質(zhì)相對定量檢測,得到1 mL樹脂靜態(tài)吸附不同體積乳清時(shí),吸附殘余液中Lf的剩余情況,通過公式(1)計(jì)算各乳清蛋白的吸附率,得到不同體積比下的Lf的吸附率。由圖10 可知,靜態(tài)吸附時(shí)間為3 h時(shí),陽離子交換樹脂X對乳清中Lf的吸附率受到樹脂與乳清體積比的影響,1 mL樹脂吸附10~20 mL乳清時(shí),Lf的吸附率保持在60%上下,當(dāng)1 mL樹脂吸附乳清體積大于25 mL時(shí),吸附率開始持續(xù)降低。結(jié)合經(jīng)濟(jì)性考慮,可將1 mL該樹脂吸附乳清體積設(shè)定為15~20 mL,可保持較高的吸附率,更高效地從乳清中吸附Lf。
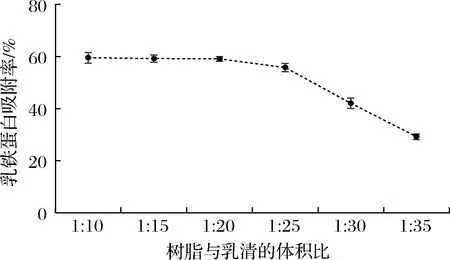
圖10 陽離子交換樹脂X與乳清不同體積比下Lf的吸附率Fig.10 The adsorption rate of Lf on different volume ratio of cation exchange resin X to whey
2.6 攪拌轉(zhuǎn)速對陽離子交換樹脂X吸附Lf吸附率的影響
將陽離子交換樹脂X在100、200、300 r/min下,靜態(tài)吸附乳清3 h取吸附殘液,經(jīng)SDS-PAGE電泳,結(jié)果見圖11。

M-蛋白marker;1-未處理中組乳清;2-攪拌轉(zhuǎn)速為 100 r/min;3-攪拌轉(zhuǎn)速為200 r/min;4-攪拌轉(zhuǎn)速為300 r/min圖11 不同攪拌轉(zhuǎn)速下陽離子交換樹脂X吸附乳清 殘余液SDS-PAGE凝膠電泳圖Fig.11 SDS-PAGE gel electrophoresis of whey residues adsorbed by cation exchange resin X at different stirring speeds
采用ImagJ軟件對圖像進(jìn)行蛋白質(zhì)相對定量檢測,分析吸附殘余液中Lf的剩余情況,通過公式(1)計(jì)算不同吸附轉(zhuǎn)速下,該樹脂對Lf的吸附率,結(jié)果見圖12。該樹脂對于乳清中Lf的吸附率受到吸附轉(zhuǎn)速的影響,隨著吸附轉(zhuǎn)速的增加,Lf的吸附率呈上升趨勢。
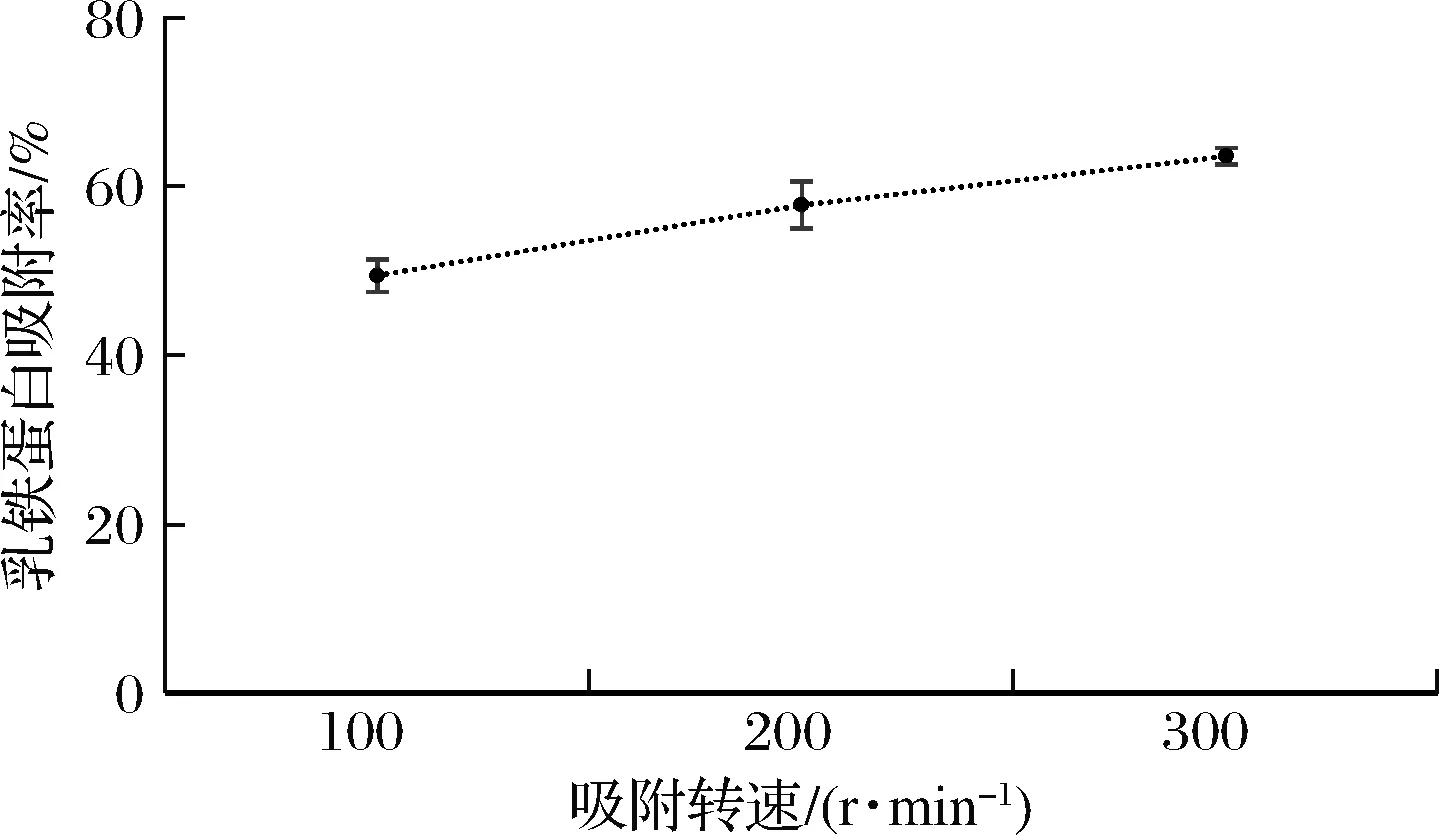
圖12 不同攪拌轉(zhuǎn)速下陽離子交換樹脂X對乳清中 Lf的吸附率分析結(jié)果Fig.12 Analysis of adsorption rate of Lf in whey by ion exchange resin X at different stirring speeds
2.7 洗脫液的離子濃度對于洗脫效果的影響
乳清經(jīng)陽離子交換樹脂X靜態(tài)吸附3 h后,將吸附后的樹脂與乳清分離,用蒸餾水沖洗后,分別用3種洗脫方法進(jìn)行洗脫,取上清液電泳,結(jié)果見圖13。離子交換樹脂X吸附的乳清蛋白的洗脫程度受洗脫液離子濃度的影響,0.3 mol/L NaCl+0.02 mol/L PBS洗脫液可以將陽離子交換樹脂X吸附的大部分除Lf之外的乳蛋白洗脫下來,而保留大部分的Lf,再用0.9 mol/L NaCl+0.02 mol/L PBS進(jìn)行洗脫時(shí),可將Lf高純度的洗脫下來。而如果只單獨(dú)用0.6或0.9 mol/L NaCl+0.02 mol/L PBS洗脫陽離子交換樹脂X,Lf與其他的乳蛋白被一同洗脫下來,Lf純度降低。因此,采用分步洗脫的方法洗脫陽離子交換樹脂X,首先用0.3 mol/L NaCl+0.02 mol/L PBS洗脫液洗脫除Lf之外的其他乳蛋白,再用0.9 mol/L NaCl+0.02 mol/L PBS洗脫液將Lf洗脫下來。

M-蛋白marker;1-未處理中組乳清;2、3、4、5分別為方法1經(jīng)樹脂吸附后的乳清殘液、1次水洗洗脫液、0.3 mol/L NaCl+0.02 mol/L PBS、0.9 mol/L NaCl+0.02 mol/L PBS洗脫液;6、7、8、9分別為方法2經(jīng)樹脂吸附后的乳清殘液、1次水洗洗脫液、0.6 mol/L NaCl+0.02 mol/L PBS、0.9 mol/L NaCl+0.02 mol/L PBS洗脫液;10、11、12、13分別為方法3經(jīng)樹脂吸附后的乳清殘液、1次水洗洗脫液、0.9 mol/L NaCl+0.02 mol/L PBS、0.9 mol/L NaCl+0.02 mol/L PBS洗脫液圖13 不同濃度洗脫液對離子交換樹脂X吸附Lf洗脫 效果的SDS-PAGE凝膠電泳圖Fig.13 SDS-PAGE gel electrophoresis of elution effect of different concentrations of eluent to ion exchange resin X
2.8 最佳吸附洗脫條件下Lf特異性分離效果
將未處理組乳清、經(jīng)樹脂吸附后乳清殘液、Lf洗脫液通過SDS-PAGE凝膠電泳,結(jié)果見圖14,由電泳圖可知,Lf單一條帶較為明顯。
M-蛋白marker;1-未處理組乳清;2-經(jīng)樹脂 吸附后的乳清殘液;3-Lf洗脫液圖14 乳清、吸附殘液、洗脫液SDS-PAGE凝膠電泳圖Fig.14 SDS-PAGE gel electrophoresis of whey,adsorption residue and eluent
通過BCA法檢測洗脫液的總蛋白濃度,BCA標(biāo)準(zhǔn)曲線見圖15,經(jīng)過計(jì)算,洗脫液的總蛋白質(zhì)量濃度為(0.461 8±0.001 8)g/L。
通過ELISA法測乳清與洗脫液的Lf濃度,ELISA標(biāo)準(zhǔn)曲線見圖16,經(jīng)過分析計(jì)算,乳清中Lf質(zhì)量濃度為(0.266±0.001)g/L,洗脫液中Lf質(zhì)量濃度為(0.441±0.002)g/L。通過計(jì)算,洗脫液中Lf的純度為95.5%,回收率為55.3%。

圖16 ELISA法測Lf濃度的標(biāo)準(zhǔn)曲線圖Fig.16 Standard graph for ELISA method to determine Lf concentration
3 結(jié)論
離子交換色譜法在蛋白質(zhì)純化方面表現(xiàn)出很大的潛力,多種陽離子交換樹脂被證明可以實(shí)現(xiàn)Lf的分離純化[11-12],本研究發(fā)現(xiàn)不同吸附劑在Lf吸附率和吸附特異性方面存在很大差異,與其他吸附劑相比,陽離子交換樹脂X對Lf的吸附率更高、吸附特異性更強(qiáng),這可能是陽離子交換樹脂X網(wǎng)絡(luò)骨架的親水性比其他吸附劑強(qiáng),親水性會提高樹脂與水溶性蛋白的結(jié)合力[13],同時(shí)該樹脂較低的價(jià)格也有利于其工業(yè)化應(yīng)用。
有研究表明[11],在動態(tài)吸附中,流速、樹脂與乳清的體積比會對吸附率產(chǎn)生影響,由于Lf等電點(diǎn)為8.5,顯著高于乳清中其他乳蛋白[14],因此可通過調(diào)節(jié)pH值控制Lf與其他乳蛋白的帶電性,進(jìn)而影響陽離子交換樹脂吸附Lf的特異性。本研究發(fā)現(xiàn),隨著pH的升高,陽離子交換樹脂X對Lf的吸附率降低,但是對Lf的吸附特異性升高,這可能是隨著pH的升高,Lf所帶的正電荷總量降低,樹脂與Lf之間的結(jié)合力減弱,導(dǎo)致Lf吸附率降低,與此同時(shí),由于升高pH值后,pH高于大部分乳蛋白等電點(diǎn),使得其他乳蛋白攜帶負(fù)電荷,表現(xiàn)為陰離子狀態(tài),進(jìn)而失去與陽離子交換樹脂的結(jié)合能力[15],而由于Lf表現(xiàn)為陽離子狀態(tài),使得陽離子交換樹脂X對Lf具有吸附作用,使得該樹脂對Lf的吸附特異性增強(qiáng)。進(jìn)一步研究了吸附轉(zhuǎn)速、樹脂與乳清的體積比對陽離子交換樹脂X吸附乳清中Lf吸附率的影響,發(fā)現(xiàn)隨著吸附轉(zhuǎn)速的增加,Lf的吸附率呈上升的趨勢,攪拌轉(zhuǎn)速的升高會對樹脂吸附Lf產(chǎn)生2方面的影響,第一方面是提高樹脂與Lf的碰撞幾率,導(dǎo)致Lf與樹脂結(jié)合的概率增加,進(jìn)而提高Lf吸附率,第二方面是會降低樹脂與Lf結(jié)合的牢固性,進(jìn)而降低Lf吸附率,因此在轉(zhuǎn)速為100~300 r/min時(shí),隨著轉(zhuǎn)速的升高,第一方面的影響大于第二方面,從而表現(xiàn)為Lf的吸附率上升;1 mL樹脂吸附10~20 mL乳清時(shí),Lf的吸附率保持在60%上下,當(dāng)1 mL樹脂吸附乳清體積大于25 mL時(shí),吸附率開始持續(xù)降低,這可能是由于樹脂與乳清的體積比在1∶25時(shí),陽離子交換樹脂X吸附Lf的量已經(jīng)達(dá)到飽和狀態(tài)[16],隨著乳清體積的進(jìn)一步增加,該樹脂無法吸附更多的Lf,從而表現(xiàn)為對Lf的吸附率降低。
前人的研究結(jié)果表明,不同濃度的鹽溶液可以將乳清蛋白從樹脂上洗脫下來,并且隨著鹽濃度的提高,可將更多的蛋白洗脫下來[17]。本文分別以含0.3、0.6、0.9 mol/L NaCl的PBS緩沖液為洗脫液,研究發(fā)現(xiàn),含0.3 mol/L NaCl的PBS可以將陽離子交換樹脂X吸附的大部分除Lf之外的乳蛋白洗脫下來,而保留大部分的Lf,再用含0.9 mol/L NaCl的PBS進(jìn)行洗脫時(shí),可將Lf高純度的洗脫下來,這是由于帶正電荷的Lf與陽離子交換樹脂X之間的結(jié)合力大于其他乳蛋白與該樹脂的結(jié)合力,Lf與陽離子交換樹脂X結(jié)合地更牢固,因此可先用含0.3 mol/L NaCl的PBS將大部分的乳蛋白洗脫下來,再用0.9 mol/L NaCl的PBS將Lf洗脫下來,實(shí)現(xiàn)Lf的高純度洗脫。通過ELISA法檢測Lf的濃度、BCA法檢測總蛋白濃度,計(jì)算洗脫液中Lf的蛋白純度和回收率。本文研究的Lf的蛋白純度為95.5%,達(dá)到GB 1903.17—2016 《食品安全國家標(biāo)準(zhǔn) 食品營養(yǎng)強(qiáng)化劑 乳鐵蛋白》中規(guī)定的95%的要求,并且本工藝的成本較低,符合大規(guī)模實(shí)施的條件,具備工業(yè)化分離Lf的潛力。
總之,本研究結(jié)果表明,陽離子交換樹脂X可以最大量地從乳清中分離Lf,最佳技術(shù)條件為:吸附條件為pH 5.17、攪拌轉(zhuǎn)速為300 r/min、樹脂與乳清的體積比為1∶15、作用時(shí)間3 h;洗脫條件為:0.3 mol/L NaCl+0.02 mol/L PBS、蒸餾水、0.9 mol/L NaCl +0.02 mol/L PBS順次洗脫,獲得Lf的蛋白純度為95.5%,Lf的回收率為55.3%。

