松蘿提取物對CIA大鼠HMGB1介導的炎癥因子表達的影響
雷玉梅,安陽,張軍,徐暉,陸道敏,曹躍朋,寧喬怡,王瑩
(1.貴州中醫藥大學,貴州 貴陽 550025;2.貴州中醫藥大學第二附屬醫院,貴州 貴陽 550002)
類風濕關節炎(rheumatoid arthritis,RA)是一種以關節滑膜炎為主要病理特征的慢性疾病,滑膜炎是RA病情發展致殘的重要因素。
高遷移率族蛋白B1(High mobility group protein,HMGB1)是近年來發現的一種促炎中介,它可誘導及參與炎癥的發生與發展,在自身免疫性疾病中可能具有十分重要的作用。研究證實,HMGB1在類風濕關節炎患者血清、滑膜液中存在且異常增高[1-2];HMGB在RA炎癥的持續過程中發揮著重要作用。HMGB與TLR2、TLR4受體結合,誘導TNF-α、IL-1β等致炎因子釋放[3-4]導致炎癥持續,造成關節破壞,這些炎性因子又能促進HMGB1的釋放[5],以此形成一個正向炎癥反饋通路。
侗醫藥松蘿具有祛風除濕、通絡止痛的功效。經課題組前期研究證實松蘿提取物對RA的治療具有良好療效[6]。經動物實驗證實松蘿能緩解CIA模型大鼠的關節腫脹情況并能抑制NF-κB的蛋白活性[7-8]。因此,在前期研究的基礎上,本研究提出HMGB1介導的細胞炎癥是RA患者關節滑膜炎癥發生、發展的關鍵因素,侗醫“趕邪、消水”理論指導下的侗族藥松蘿提取物可能通過調控HMGB1介導的炎癥反應,抑制RA關節滑膜炎癥的科學假說,具有充分的理論依據和堅實的前期研究基礎。為驗證此假說,本研究從動物實驗探討松蘿提取物通過HMGB1炎癥通路調控RA炎癥因子的分子機制。
1 實驗材料與方法
1.1 實驗器材及試劑
儀器:全自動酶標儀(Thermo scientific,Multiskan MK3),PCR儀(東勝創新生物科技有限公司,EDC-810),垂直電泳槽(北京六一儀器廠,DYCZ-40)等。試劑:磷酸酶抑制劑(碧云天,S1873),BCA蛋白濃度測定試劑盒(碧云天,P0010),RIPA裂解液(碧云天,P0013B)等。
1.2 實驗方法
1.2.1 動物及分組
SPF級5周齡Wistar雌性大鼠54只,體質量150~180 g,購自湖北省實驗動物研究中心,動物合格證號:SCXK(鄂)2020-0018,喂養環境室溫20~25 ℃、濕度70%左右,自由進食、自由飲水,適應環境1周后開始試驗。按隨機數字表進行編號,隨機分為松蘿提取物低、中、高劑量組和羥氯喹組、空白組、模型組[1],每組9只。
1.2.2 模型的制備
將Ⅱ型膠原溶于0.1 mol/L的醋酸中,攪拌溶解,配制成2 mg/mL溶液,置4 ℃冰箱過夜。與弗氏完全佐劑等體積混合,乳化配制成Ⅱ型膠原乳劑,分別于大鼠尾根部多點皮內注射0.1 mL致炎,復制穩定的CIA大鼠模型[9]。造模成功評價:采用關節炎評分法,即造模成功的大鼠趾端至踝關節段紅腫,關節炎癥評分>4分[10]。
1.2.3 給藥劑量
根據課題組前期的藥代動力學研究結果,本研究的給藥劑量為松蘿提取物6 mg/kg為中劑量,其1/3劑量(2 mg/kg)為低劑量,9倍劑量(54 mg/kg)定為高劑量。羥氯喹成人用量400 mg/日,參照60 kg成人與動物藥物劑量換算系數表,大鼠用藥劑量(mg/kg)=5.4×人用藥劑量(mg/kg)[11]。
1.2.4 樣品采集
末次灌胃2 h后,以烏拉坦按0.4 mL/100 g的劑量,經腹腔注射麻醉后,股動脈取血4~6 mL,室溫靜置30 min后3 000 r/min離心15 min,提取血清。處死大鼠后,取大鼠后右足踝關節,取出滑膜組織,提取組織蛋白。
1.2.5 ELISA法檢測血清致炎因子
ELISA法檢測IL-23、IL-6、IL-1β、TNF-α的分泌。按照試劑盒設空白孔、標準孔、待測樣品孔,分別加樣,36 ℃孵育90 min,洗板5次,加入酶標試劑,36 ℃反應,溫育1 h,洗板5次,加入TMB 100 μL,覆膜36 ℃避光,溫育15 min,后加入終止液,測量OD值,進行計算。
1.2.6 HMGB1、TLR4與TLR2 mRNA表達檢測
采用PCR法檢測TLR2、TLR4與HMGB1表達量。提取總RNA,逆轉錄合成cDNA,反應條件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 sec,60 ℃30 sec,40 cycles。引物設計如下,β-actin:(F)5’- CACGATGGAGGGGCCGGACTCATC -3’,(R) 5’- TAAAGACCTCTATGCCAACACAGT -3’;TLR2:(F)5’-GGAAGCAGGTGACAACCATT-3’,(R)5’-CGCCTAAGAGCAGGATCAAC-3’;TLR4:(F)5’-TGGTGGCTGTGGAGACAAAAATGAC-3’(R)5’- CTGAAAGGCTTGGGCTTGAATGGAG-3;每個樣本3個副孔,重復3次。
1.2.7 Western Blot法檢測HMGB1、TLR2與TLR4蛋白表達量
將少量剪碎的組織塊置于2 mL EP管中,加入洗凈的鋼珠,裂解、勻漿,置于冰上30 min。用移液器將裂解液移至1.5 mL離心管中在4 ℃下12 000 r/min離心5 min,取上清分裝于0.5 mL離心管。以BSA為標準,進行蛋白濃度測定。沸水浴10 min將蛋白變性。10% SDS-PVDF電泳,各樣品總蛋白量為40 μg。加樣后先恒壓80 V電泳至溴酚藍指示劑在濃縮膠與分離膠交界處成線狀,改為恒壓120 V至溴酚藍到凝膠底部,此過程約用時1.5 h。封閉2 h。一抗4 ℃過夜,二抗孵育2 h。將ECL試劑中增強液與穩定的過氧化物酶溶液按1∶1比例混勻,滴加工作液于PVDF膜上,反應數分鐘待熒光帶明顯后,用濾紙吸去多余的底物液,覆上保鮮膜,X光膠片壓片后依次放入顯影液顯影、定影液定影,沖洗膠片,晾干膠片,掃描膠片,用BandScan分析膠片灰度值。
1.3 數據分析
2 結果
2.1 松蘿提取物對CIA大鼠血清中HMGB1含量的影響
與空白組比較,松蘿提取物低劑量組、中劑量組、高劑量組、羥氯喹組及模型組的HMGB1含量均增高(P<0.05),與模型組相比較,不同濃度的松蘿提取物、羥氯喹組均可降低HMGB1含量(P<0.05);松蘿中劑量組、高劑量組與羥氯喹組相比降低HMGB1的效果相當,無顯著差異,見表1。

表1 松蘿提取物對CIA大鼠血清中HMGB1含量的影響
2.2 松蘿提取物對CIA大鼠血清中IL-1β、TNF-α、IL-23與IL-6含量的影響
與空白組比較,松蘿提取物低劑量組、中劑量組、高劑量組、模型組、羥氯喹組的IL-1β、IL-6、IL-23、TNF-α含量均增加(P<0.05);與模型組比較,松蘿提取物中劑量組、高劑量組及羥氯喹組均能降低TNF-α、IL-23、IL-1β、IL-6含量(P<0.05),松蘿中劑量組、高劑量組與羥氯喹組相比,差異無統計學意義,見表2。

表2 松蘿提取物對CIA大鼠血清中IL-6、IL-23、IL-1β、TNF-α含量的影響
2.3 RT-PCR法檢測CIA大鼠滑膜組織中HMGB1、TLR4與TLR2 mRNA的表達
與空白組相比較,松蘿提取物低、中、高劑量組與模型組、羥氯喹組HMGB1、TLR4、TLR2 mRNA表達均增加(P<0.05);與模型組相比較,松蘿提取物中、高劑量組及羥氯喹組均能抑制 mRNA表達(P<0.05);與羥氯喹組相比較松蘿提取物中、高劑量組抑制HMGB1、TLR4、TLR2表達的效果相當,見表3。

表3 松蘿提取物對CIA大鼠滑膜組織中HMGB1、TLR2、TLR4 mRNA表達的影響
2.4 Western Blot法檢測CIA大鼠滑膜組織中HMGB1、TLR2與TLR4蛋白的表達量
與空白組相比較,松蘿提取物低、中、高劑量、模型組、羥氯喹組表達均增加(P<0.05);與模型組相比較,松蘿提取物中劑量組、高劑量、羥氯喹組均能抑制HMGB1、TLR4、TLR2表達(P<0.05);與羥氯喹相比較,松蘿中劑量組、高劑量組在抑制蛋白表達上無顯著差異,見圖1,表4。
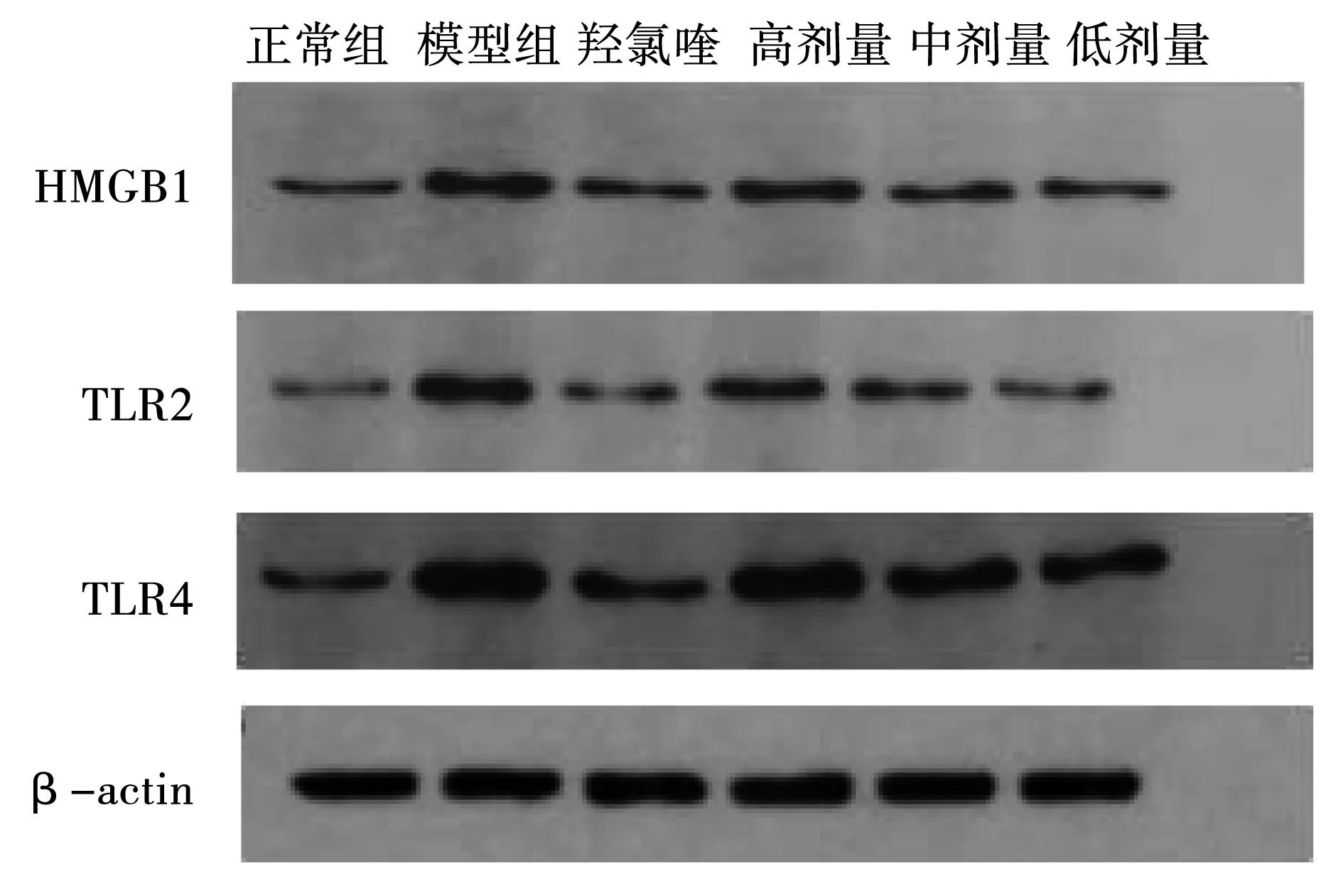
圖1 各組CIA大鼠滑膜組織HMGB1、TLR2與TLR4蛋白表達條帶圖

表4 松蘿提取物對CIA大鼠滑膜組織中HMGB1、TLR2、TLR4蛋白表達的影響
3 討論
RA是一種自身免疫性疾病,發病因素復雜,其中滑膜炎癥是其主要病理表現。當人體出現刺激或免疫損傷的情況下,HMGB1作為促炎因子從細胞核內釋放,通過與RAGE、TLR2及TLR4受體結合,促進IL-6、IL-23等的分泌,誘導TNF-α、IL-1β等致炎因子釋放[3-4],這些炎癥因子又可以反過來促進HMGB1 的釋放而形成持續的炎癥反應。有研究[13]發現 RA 患者與健康人相比較,血清中 HMGB1含量明顯升高,活動期的RA患者與非活動期RA患者相比較,血清中HMGB1水平增高,提示HMGB1可能與疾病活動相關。動物實驗發現將重組HMGB1蛋白注射進大鼠關節腔可引起滑膜炎,給CIA大鼠模型注射HMGB1抗體干預后,滑膜炎癥減輕[1]。TLR屬于跨膜蛋白,是HMGB1的特異性受體,在炎癥信號傳遞中有著重要作用。研究發現,HMGB1可被TLRs識別,參與免疫應答過程[14]。在小鼠或者大鼠關節腔內注射TLR配體如細菌DNA,LPS等可誘導關節炎癥的發生,LPS與Ⅱ型膠原聯合進行關節腔內注射可加重關節炎癥反應,而敲除TLR2、TLR4的動物表現出炎癥程度明顯下降。IL-6、IL-23、TNF-α、IL-1β是RA病程中的主要促炎因子[15-16]。HMGB1可以通過激活NF-κB信號通路誘導炎癥因子的釋放。本研究證實,松蘿提取物具有較好的抗炎作用。中劑量及高劑量組的松蘿提取物可有效減輕CIA大鼠血清中IL-1β、IL-6、IL-23、TNF-α、HMGB1的濃度,以及滑膜細胞中 HMGB1、TLR2、TLR4蛋白表達。
綜上所述,松蘿提取物能降低HMGB1、TLR2、TLR4 mRNA的表達量,并抑制HMGB1、TLR2、TLR4的蛋白表達,減少IL-6等細胞因子的含量,阻斷HMGB1/TLR炎癥通路,從而減輕RA滑膜炎癥,達到控制關節炎的目的。

