基于網絡藥理學和分子對接探討理氣枳殼改善非酒精性脂肪性肝病作用機制
鄭 慧 王思為 藍 天 樓麗君 張 峰
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除過量飲酒和其他明確肝損害因素導致的肝內脂肪過度沉積,與2 型糖尿病、肥胖、代謝綜合征、心血管疾病等多種代謝異常疾病密切相關[1]。中醫認為,NAFLD 主要以肝郁脾虛證和濕熱蘊結證為主,屬于“肝著”“積聚”“肥氣”等范疇[2],治療原則上主要以疏肝、健脾、理氣、化痰、活血為主[3]。枳殼,歸肝、胃、脾經,具有理氣寬中、行滯消脹的功效,經常被用于中醫臨床治療脂肪性肝病[4]。本課題組前期對枳殼替代藥材—衢枳殼防治代謝性疾病進行了研究,證實衢枳殼提取物具有穩定血糖[5]、抑制肥胖[6]、抗肝纖維化[7]、抗氧化[8]、抗炎[9]等作用,且能夠顯著抑制高脂飲食誘導的肥胖小鼠肝臟脂質積累[6],提示衢枳殼可能具有改善NAFLD 的作用,但作用機制尚需進一步研究。本研究基于網絡藥理學方法,預測枳殼改善NAFLD 的潛在靶點和作用機制,為后續實驗研究提供依據。
1 材料與方法
1.1 枳殼相關靶點篩選 通過中醫藥系統藥理學數據庫(TCMSP)檢索枳殼活性成分及其靶點,根據口服生物利用度(oral bioavailability,OB)≥30%且類藥性(drug-likeness,DL)≥0.18 的屬性值對活性成分進行初步篩選,并根據課題組前期對枳殼成分的分析以及既往文獻研究證實枳殼存在的主要成分,將有關化合物納入研究中,獲得候選化合物。再通過TCMSP 數據庫查找到有效成分的靶點,通過Uniprot蛋白質數據庫(https://www.uniprot.org)將收集到的蛋白質靶點信息校正為標準基因名稱。若TCMSP 數據庫無法查找到有效成分的靶點,則以Probability>0為條件通過Swiss Target Prediction 數據庫對該成分進行靶點預測,將兩者匯總后刪除重復值得到該藥物靶標。
1.2 NAFLD 相關靶點篩選 以“non-alcoholic fatty liver disease”為關鍵詞,在GeneCards 數據庫(https://www.genecards.org)、DisGenet 數據庫、OMIM 數據庫(http://www.omim.org)、TTD數據庫(http://bidd.nus.edu.sg/group/cjttd)等疾病基因數據庫檢索與篩選NAFLD 的潛在靶點。在Genecards 數據庫中,Score值越高則代表該靶點與疾病聯系密切,若靶點過多則設定Score 大于中位數的目標靶點為非酒精性脂肪肝的潛在靶點;在DisGenet 數據庫中,根據該數據庫推薦標準,以綜合評分分值≥0.3 為條件,篩選相關靶點,最后將所有疾病數據庫得到的靶點匯總后排除重復值,從而得到NAFLD 靶點。
1.3 枳殼-有效成分-靶點網絡構建與關鍵成分篩選 將枳殼有效成分及靶點通過CytoScape3.7.2 構建有效成分-靶點網絡,通過其內置的Network Analyzer 分析其網絡拓撲學參數。根據degree 值大小來篩選關鍵成分,degree 值越大,說明該成分越重要,越有可能是枳殼治療NAFLD 的主要活性成分。
1.4 枳殼有效成分-NAFLD 靶點PPI 網絡構建與核心網絡篩選 為了明確枳殼治療NAFLD 的潛在靶標間的相互作用,利用STRING 11.0 數據庫(https://string-db.org),構建蛋白互作(PPI)網絡模型。將生物種類設定為“Homo sapiens”,最小互相作用閾值設定為“highest confidence”(>0.4),其余設置均為默認設置,得到PPI 網絡,然后將獲取的PPI 網絡圖通過CytoScape 3.7.2 軟件中內置的Network Analyzer 提取枳殼治療非酒精性脂肪肝核心網絡。
1.5 枳殼有效成分-NAFLD 靶點功能與通路的富集分析 運用Metascape 平臺(http://metascape.org/gp/index.html)對靶點進行通路富集分析。將枳殼治療NAFLD 的潛在靶點錄入Metascape 平臺進行GO 和KEGG 分析。
1.6 活性成分-靶點分子對接驗證 通過PPI 核心網絡篩選獲得核心靶點,根據Degree 值選取排名前6 的靶點,然后選取對應的活性成分,利用分子對接軟件AutoDock Vina1.5.6 驗證預測的枳殼活性成分和關鍵靶點的可信度。首先通過PubChem 數據庫下載活性成分的2D 結構,使用Chem3D 軟件將2D 結構轉換為3D 結構,然后從PDB 數據庫中下載核心靶點的晶體結構,運用Pymlol 軟件刪除晶體結構中的水分和配體,用蛋白受體與活性配體成分進行AutoDock Vina1.5.6 對接,最后,比較結合自由能。
2 結果與分析
2.1 枳殼活性成分靶點獲取 通過TCMSP 數據庫查找到衢枳殼17 個活性成分,再根據OB 和DL 參數篩選后獲得5 種化合物,然后根據課題組前期對枳殼成分的研究以及相關文獻的進一步檢索,其中naringin、hesperidin、L-Limonen、neohesperidin 的OB或DL 較小,但在枳殼中含量豐富,依然列入候選化合物,最終納入9 個活性成分進行研究,見表1。通過TCMSP 數據庫查找到8 個有效成分的靶點,共計96個,其中MOL013383 成分靶點未在TCMSP 中找到,以Probability>0 為條件在Swiss Target Prediction 平臺對該成分進行靶點預測,補充獲得26 個靶點。匯總兩個數據庫的成分靶點,排除重復值后得到衢枳殼有效成分119 個靶點。
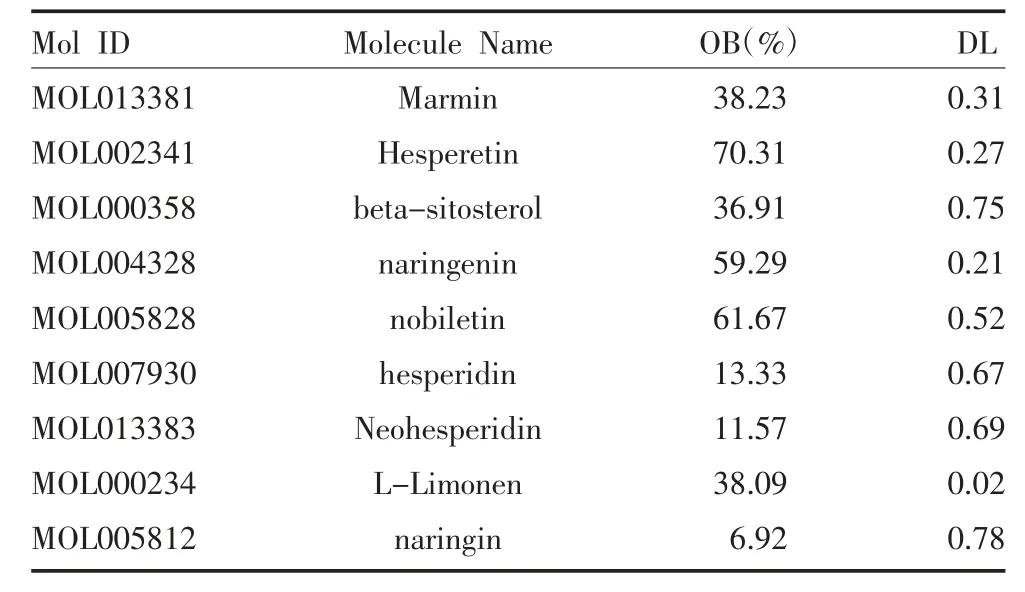
表1 枳殼中經篩選得到的候選化合物
2.2 NAFLD 相關靶點的獲取 從Genecards 數據庫、OMIM 數據庫、DisGenet 數據庫、TTD 數據庫中分別獲得NAFLD 靶點為1612 個、512 個、1059 個、4個。在Genecards 數據庫中,根據經驗設定Score 大于中位數目標靶點為NAFLD 潛在靶點。通過Genecards 查詢到NAFLD 靶點Score 最大值為100.16,最小值為0.33,中位數為4.93,故設定Score>4.93 的條件,最終納入807 個潛在靶點;通過Dis-Genet 數據庫檢索到1059 個疾病相關基因,根據數據庫推薦標準,綜合評分分值≥0.3 的70 個靶點認為與NAFLD 較為密切。合并以上所有數據庫經篩選后的相關靶點,并排除重復值,最終得到1311 個NAFLD 相關靶點。應用Venny 取交集,得到枳殼有效成分-NAFLD 共同靶點56 個。
2.3 枳殼藥物-有效成分-潛在靶點網絡構建 運用Cytoscape3.7.2 軟件將枳殼9 種有效成分及119個潛在靶點導入,得到枳殼有效成分-潛在靶點可視網絡圖(見圖1),其中紅色代表枳殼藥物,深紫色代表其活性成分,藍代表潛在靶點,共得到128 個節點、161 條邊。Degree 值大小通過節點大小反應,節點越大,該成分越重要,所以β-sitosterol、naringenin、nobiletin、neohesperidin 有可能是枳殼干預NAFLD較為重要的活性成分。
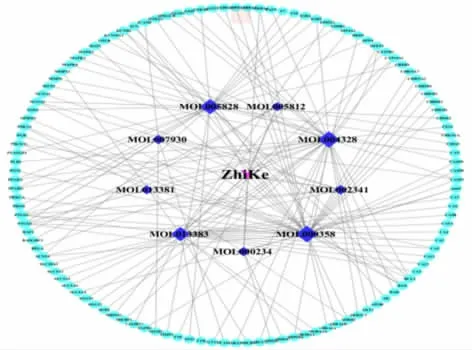
圖1 枳殼-活性成分-靶點網絡圖
2.4 枳殼有效成分-NAFLD 靶點PPI 核心網絡構建將候選基因提交至STRING 11.0 平臺,得到枳殼-NAFLD 靶點PPI,再將該PPI 網絡信息導入Cytoscape3.7.2 軟件,利用Network Analyzer 插件篩選得到該蛋白相互作用核心網絡(見圖2)。圖2 中含有26 個節點和223 條邊。根據節點大小和顏色深淺反映度值大小,Degree 值越大,顏色越亮,表示該靶點越重要,與藥物和疾病的相關性越強。線條的粗細也反映了兩個靶點之前的重要性,線條越粗,說明該連接越重要。排名較前的為AKT1、TNF、TP53、CAT、JUN、MAPK8 等靶點。選取degree 值排名前10 基因靶點,見表2。
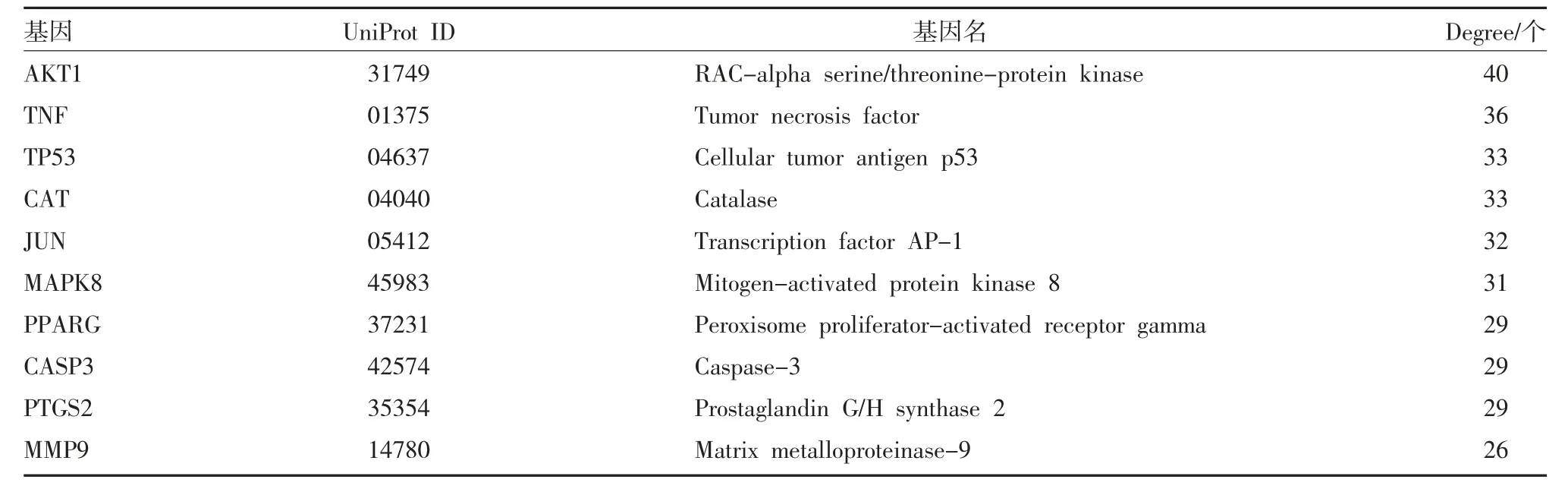
表2 枳殼干預非酒精性脂肪性肝病核心靶點拓撲性質
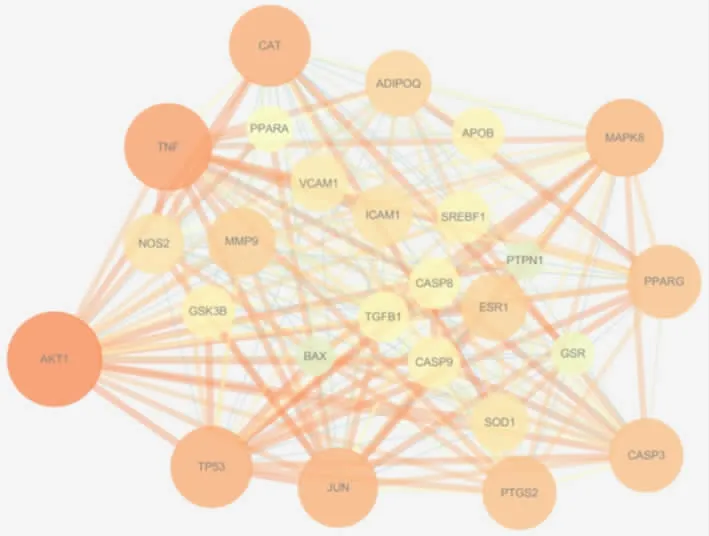
圖2 枳殼干預非酒精性脂肪性肝病核心PPI 網絡
2.5 枳殼主要成分-靶點-疾病氣泡圖 本研究使用Metascape 平臺對56 個關鍵靶點進行GO 富集分析和KEGG 分析,包括生物過程(BP)、細胞組成(CC)和分子功能(MF)3 個分支,共顯示1368 個結果富集,其中BP 為1224 個,CC 為71 個,MF 為73 個,KEGG 富集255 條通路。根據-log10(pvalue)排序,選擇前20 個通過http://www.bioinformatics.com.cn 平臺繪制氣泡圖(見圖3)。圖中P 值的顏色越紅,表示顯著性越強,關系越緊密,氣泡節點大小代表富集在上面的基因數量,氣泡越大,表示相關的基因越多,反之越小。
從圖3 可知,枳殼干預NAFLD 的靶點在生物過程中,主要涉及對有害物質的反應(response to toxic substance)、患者體內營養水平的調節(response to nutrient levels)、對細胞外刺激所產生的反應(response to extracellular stimulus)以及凋亡信號通路(apoptotic signaling pathway)等;從細胞組分結果可以看出,枳殼干預NAFLD 過程中主要通過細胞中脂筏(membrane raft)、膜微區(membrane microdomain)、膜區(membrane region)等細胞膜部位進行;從分子功能結果看,主要與蛋白酶結合(protease binding)、蛋白質均二聚活性(protein homodimerization activity)和氧化還原酶活性(oxidoreductase activity)關系較為密切。在KEGG 通路富集結果中,結果顯示與癌癥途徑(pathways in cancer)、NAFLD、糖尿病并發癥中的AGE-RAGE 信號通路(AGE-RAGE signaling pathway in diabetic complications)、TNF 信號通路(TNF signaling pathway)等枳殼干預NAFLD的作用機制緊密相關。
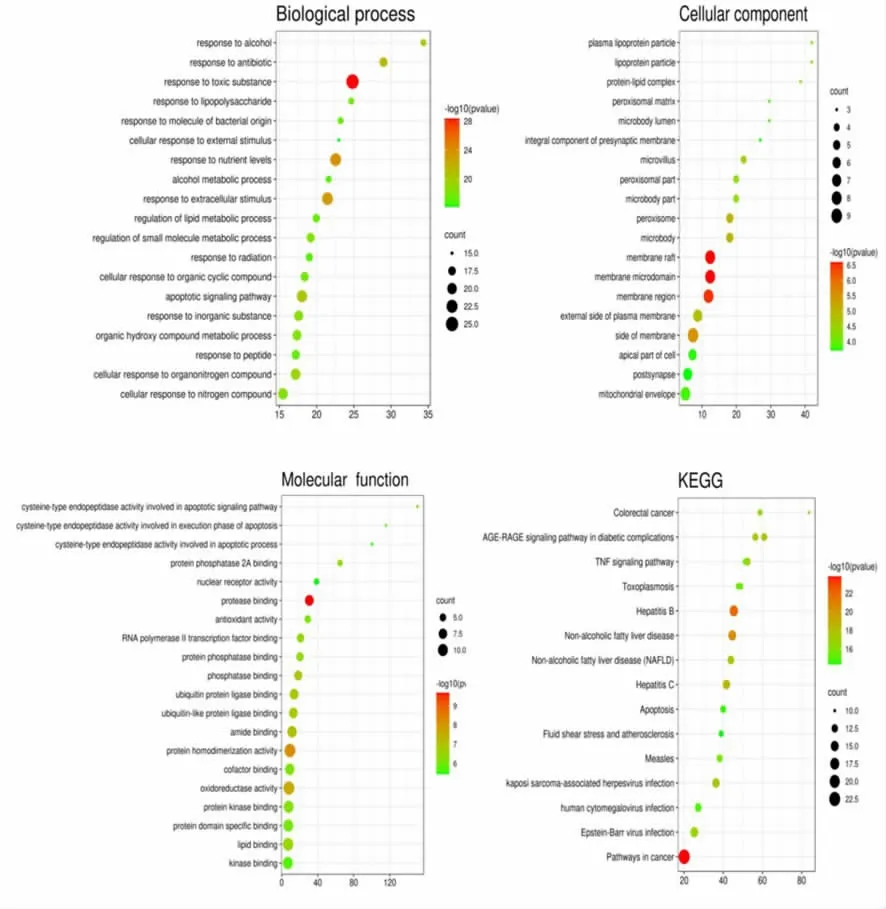
圖3 枳殼干預非酒精性脂肪肝關鍵靶點GO、KEGG 氣泡圖
2.6 分子對接驗證 根據PPI 核心網絡分析選取排名前6的靶點蛋白AKT1、TNF、TP53、CAT、JUN、MAPK8,與對應的活性成分進行分子對接,分子對接自由能越小,則表示構象越穩定,兩者結合程度越高。一般認為,當對接結合能≤-5.0kcal/mol 時,配體與受體有較好的結合活性,因此,本研究中的關鍵靶點與相應的活性成分之間具有較好的結合活性,見表3。

表3 配體與受體對接結合自由能
3 討論
基于枳殼-活性成分-靶點網絡圖,我們發現枳殼干預NAFLD 關鍵成分主要為β-sitosterol(β-谷甾醇)、naringenin(柚皮素)、nobiletin(川陳皮素)、Neohesperidin(新橙皮苷)。研究指出,β-谷甾醇可調節高脂飲食誘導的2 型糖尿病大鼠中IRS-1/AKT 介導的胰島素信號分子,可減弱胰島素抵抗(IR),減輕高脂飲食引起的脂肪組織有害變化[10]。柚皮素能抑制肝細胞Nrf2 蛋白及其下游抗氧化酶表達,抑制肝脂質過度積累的作用[11]。川陳皮素與柚皮素類似,也具有抗氧化[12]、抑制肝細胞脂質沉積和細胞凋亡的作用[13]。我們前期研究發現,新橙皮苷能抑制肝臟氧化應激反應和炎癥反應,有望開發成為肝保護劑[14]。基于關鍵靶基因分析中,AKT1、TNF、TP53、CAT、JUN等靶點有可能在枳殼治療NAFLD 中起到重要作用。通過上述分析,提示枳殼具有多成分、多靶點干預NAFLD 的特點。
富集分析結果顯示,枳殼治療疾病的部位可能發生在細胞膜,主要從對外界有害物質刺激所產生的反應、患者體內營養水平以及氧化還原過程等方面進行干預。NAFLD 在多種細胞外刺激下,磷酸化JNK 等信號通路,引起脂質調節異常,導致IR 發生,促進NAFLD 的發展[15]。不同的飲食模式或營養成分可以通過促進肝臟TG 積累和抑制抗氧化活性直接促進NAFLD 發生,也可以通過影響胰島素敏感性和餐后TG 代謝間接促進NAFLD 發生[16]。我們前期研究表明,衢枳殼提取物能夠改善高脂飲食引起的小鼠肝臟脂質積累,可作為治療NAFLD 的膳食補充劑[6]。KEGG 通路富集分析中NAFLD、AGE-RAGE 信號通路、TNF 信號通路等富集顯著性較高,這些通路能減輕肝臟脂肪變性,減少炎癥反應發生。NAFLD與脂毒性、IR 等緊密相關,IR 會加重疾病的進展。有研究發現,AGEs 水平升高和AGE-RAGE 軸激活會引起氧化應激和肝臟炎癥,與NAFLD 發病機制相關[17]。TNF-α 是促進IR 及NAFLD 發生發展的細胞因子,在NASH 患者肝臟組織表達水平增加,TNF-α 還可通過多途徑參與脂質過氧化和氧化應激,誘發肝臟炎癥反應[18]。相反,通過抑制TNFR1 可使MAP 激酶MKK7 基因及其下調基因JNK 的激活減輕,從而改善IR,延緩NAFLD 的發生[19]。
通過分子對接驗證得到核心靶點蛋白與活性成分結合較強,表明靶點與成分之間較好的結合力是枳殼發揮作用的基礎。其中CAT 與naringenin 結合活性最強。CAT 作為抗氧化因子,可以限制脂肪酸的氧化反應,保護機體免受脂質過氧化物的傷害。唐曉飛等[20]研究證明,柚皮素可能通過促進SOD 和CAT生成,抑制肝細胞氧化應激損傷,從而改善NAFLD。
綜上所述,本研究我們在前期證實枳殼具有改善NAFLD 的實驗基礎上,通過網絡藥理學與分子對接驗證法,收集枳殼治療NAFLD 潛在靶點,預測可能的作用機制,其中主要涉及IR、氧化應激和炎癥反應等機制,為后續實驗研究提供理論指導。

