甘草查爾酮A對副豬嗜血桿菌感染豬肺泡巨噬細胞氧化應激的影響
楊 裕,關文超,崔小珍,賈永鑫,YANG Shiyu
(1.山西農業大學動物醫學學院,太原 030801;2.倫敦大學學院外科和介入科學系,倫敦 WC1E 6BT)
副豬嗜血桿菌是健康豬呼吸道中的常在菌[1]。在一定條件下,副豬嗜血桿菌可導致豬群出現多發性漿膜炎綜合征[2]。到目前為止,已確定副豬嗜血桿菌有15種血清型,但超過20%的臨床分離株還無法確定血清型。雖然已從副豬嗜血桿菌篩選到許多毒力因子[3],但副豬嗜血桿菌致病的確切機制尚未得到詳細闡明。喹諾酮、β-內酰胺、大環內酯和四環素等抗菌藥治療仍然是副豬嗜血桿菌病防控的首要選擇[4],但易增加耐藥株并產生多重耐藥風險,導致可供選擇的治療方案越來越少[5]。當前疫苗存在保護效果低或交叉保護差等缺陷,接種疫苗并不能有效控制副豬嗜血桿菌感染[6],使得控制豬群副豬嗜血桿菌病變得非常困難[7]。副豬嗜血桿菌病給全世界養豬業帶來的經濟負擔仍然是一個嚴重的問題[8]。因此,研發抗副豬嗜血桿菌的新型藥物已成為當務之急。
從植物中分離出的酚類、糖類等物質在體外具有抗菌活性[9]。甘草是多年生植物的根和根狀莖,廣泛應用于微生物感染、癌癥等疾病的治療[10]。甘草的主要成分包括甘草酸、三萜類、多酚類、黃酮類、葡萄糖、氨和蔗糖。甘草查爾酮A是甘草中主要的黃酮類化合物,因其具有抗寄生蟲、抗菌和抗炎等多種藥理作用近年來引起了人們的廣泛關注[11]。以往的研究證實,甘草查爾酮A可提高小鼠抵抗副豬嗜血桿菌感染的能力[12]。副豬嗜血桿菌感染可引起豬肺泡上皮細胞發生氧化損傷[13],甘草查爾酮A可有效抑制乙酰氨基酚氧化損傷小鼠丙二醛(MDA)的形成,并降低肝臟谷胱甘肽過氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的活性[14],說明甘草查爾酮A具有抗氧化作用。因此,本研究擬選取豬肺泡巨噬細胞進行體外研究,探討甘草查爾酮A對副豬嗜血桿菌感染豬肺泡巨噬細胞氧化應激的調節作用,為甘草查爾酮A作為治療副豬嗜血桿菌感染的新型藥物在副豬嗜血桿菌感染的臨床應用提供參考數據。
1 材料與方法
1.1 材料
1.1.1 試驗動物 6周齡健康斷奶雌性仔豬來源于一個過去10年里副豬嗜血桿菌均陰性的養殖場,體重(12.0±1.0) kg,副豬嗜血桿菌檢測為陰性。
1.1.2 主要試劑及儀器 胎牛血清(FBS)和DMEM培養基均購自HyClone公司;CCK-8試劑盒、活性氧(reactive oxygen species,ROS)檢測試劑盒和乳酸脫氫酶(lactate dehydrogenase,LDH)檢測試劑盒均購自上海碧云天生物技術有限公司;MDA、一氧化氮(nitric oxide,NO)、GSH-Px、SOD和總抗氧化能力(total antioxidant capacity,T-AOC)檢測試劑盒均購自南京建成生物工程研究所;甘草查爾酮A購自北京酷來搏科技有限公司。
副豬嗜血桿菌培養液:TSA(tryptic soy agar,TSA)或TSB(tryptic soy broth,TSB)培養基+10 mg/mL煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)+5% FBS。
甘草查爾酮A配制:將甘草查爾酮A溶解于二甲基亞砜(DMSO)配制成20 mg/mL濃儲液,-20 ℃保存備用,臨用時用高糖DMEM進行稀釋。
超凈工作臺(SW-CJ-1F)購自蘇州安泰空氣技術有限公司;恒溫培養箱(HH-B11)購自上海飛越實驗儀器有限公司;CO2培養箱(HERAcell VIOS 160i)購自Thermo Fisher Scientific公司;可見光分光光度計(UV-5100)購自上海精密儀器儀表有限公司;酶標儀(SpectraMax M5)購自TECAN公司;熒光顯微鏡(BX53)購自Olympus公司。
1.2 方法
1.2.1 豬肺泡巨噬細胞的分離與培養 按Shabir等[15]的方法經肺泡灌洗分離豬肺泡巨噬細胞。即通過靜脈注射戊巴比妥對豬進行安樂死,解剖打開胸腔,連同氣管剝離完整肺臟,用100 mL含有70 μg/mL慶大霉素的無菌磷酸鹽緩沖液(PBS,pH 7.4)灌洗支氣管肺泡。500 r/min離心10 min后收集細胞,用含50 μg/mL慶大霉素的高糖DMEM沖洗3次。計數后,細胞在含10%(V/V)熱滅活FBS、100 U/mL青霉素和100 μg/mL鏈霉素的高糖DMEM培養基中37 ℃、5% CO2培養箱中培養。
1.2.2 細胞分組與處理 將豬肺泡巨噬細胞按1×105/孔接種到96孔細胞培養板中,用副豬嗜血桿菌(MOI=10)感染豬肺泡巨噬細胞后,分為6組:陰性對照組(NC),未感染副豬嗜血桿菌的豬肺泡巨噬細胞;陽性對照組(PC),豬肺泡巨噬細胞感染副豬嗜血桿菌后不用藥物處理;DMSO組,豬肺泡巨噬細胞感染副豬嗜血桿菌后給予0.1% DMSO;5、10和20 μg/mL甘草查爾酮A組,豬肺泡巨噬細胞感染副豬嗜血桿菌后給予相應濃度的甘草查爾酮A。 各組細胞在37 ℃、5% CO2培養箱中培養24 h,收集細胞或上清液進行后期檢測。 每組均設置3個重復。
1.2.3 細胞活力檢測 根據Zheng等[16]的報道采用CCK-8法檢測細胞活力。將CCK-8溶液(10 μL)加入到各處理組96孔細胞培養板中,37 ℃繼續孵育2 h后,根據CCK-8檢測試劑盒說明書進行操作,用酶標儀檢測D450 nm值,按如下公式計算各組細胞活力。
細胞活力(%)=(D450 nm試驗組-D450 nm空白組)/(D450 nm對照組-D450 nm空白組)×100%
1.2.4 LDH活性檢測 為分析副豬嗜血桿菌感染豬肺泡巨噬細胞的細胞溶解情況,將各處理組細胞培養板1 000 r/min離心5 min,收集上清液。根據LDH檢測試劑盒說明書進行操作,用酶標儀檢測D490 nm值表示各組細胞外LDH活性。
1.2.5 氧化/抗氧化指標檢測 按Ceker等[17]報道的方法檢測豬肺泡巨噬細胞氧化/抗氧化平衡狀況。收集各處理組豬肺泡巨噬細胞,用PBS洗2次。細胞在頻率為100 Hz下超聲處理2個循環,然后4 ℃、12 000 r/min離心10 min,取上清。按照MDA、NO、GSH-Px、SOD和T-AOC試劑盒說明書進行操作,根據標準曲線計算各組豬肺泡巨噬細胞MDA、NO水平及GSH-Px、SOD和T-AOC活性。
1.2.6 ROS水平檢測 根據Liu等[18]的方法檢測細胞內ROS生成情況。細胞用PBS洗2次,在培養液中加入終濃度為5 μmol/L的2′,7′-二氯熒光素二乙酸酯,37 ℃、5% CO2孵育60 min,用熒光顯微鏡觀察細胞內的綠色熒光并拍照,用Image J 1.48軟件分析熒光強度變化。
1.3 統計分析
用SPSS 19.0軟件進行單因素方差分析(One-Way ANOVA),組間用t檢驗進行比較,結果用平均值±標準差表示,P<0.05表示差異顯著。
2 結 果
2.1 甘草查爾酮A對副豬嗜血桿菌感染豬肺泡巨噬細胞活力的影響
由圖1可知,DMSO組與PC組無明顯變化,說明DMSO對豬肺泡巨噬細胞無毒性作用。副豬嗜血桿菌感染24 h后,與NC組相比,PC組及5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞的活力均顯著降低(P<0.05)。與PC組相比,5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞活力均顯著提高(P<0.05),細胞活力隨著甘草查爾酮A濃度的增加而增加。
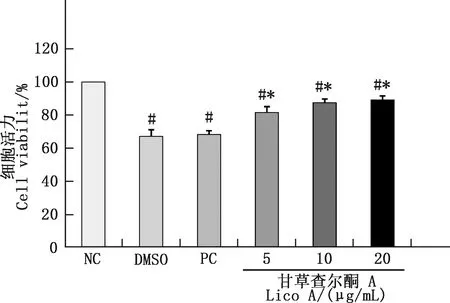
與NC組相比,#,差異顯著(P<0.05);與PC組相比,*,差異顯著(P<0.05)。下同
2.2 甘草查爾酮A對副豬嗜血桿菌感染豬肺泡巨噬細胞LDH活性的影響
由圖2可知,副豬嗜血桿菌感染24 h后,與NC組相比,PC組及5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞上清液LDH活性均顯著提高(P<0.05)。與PC組相比,5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞上清液LDH活性均顯著降低(P<0.05),LDH活性隨著甘草查爾酮A濃度的增加而降低。
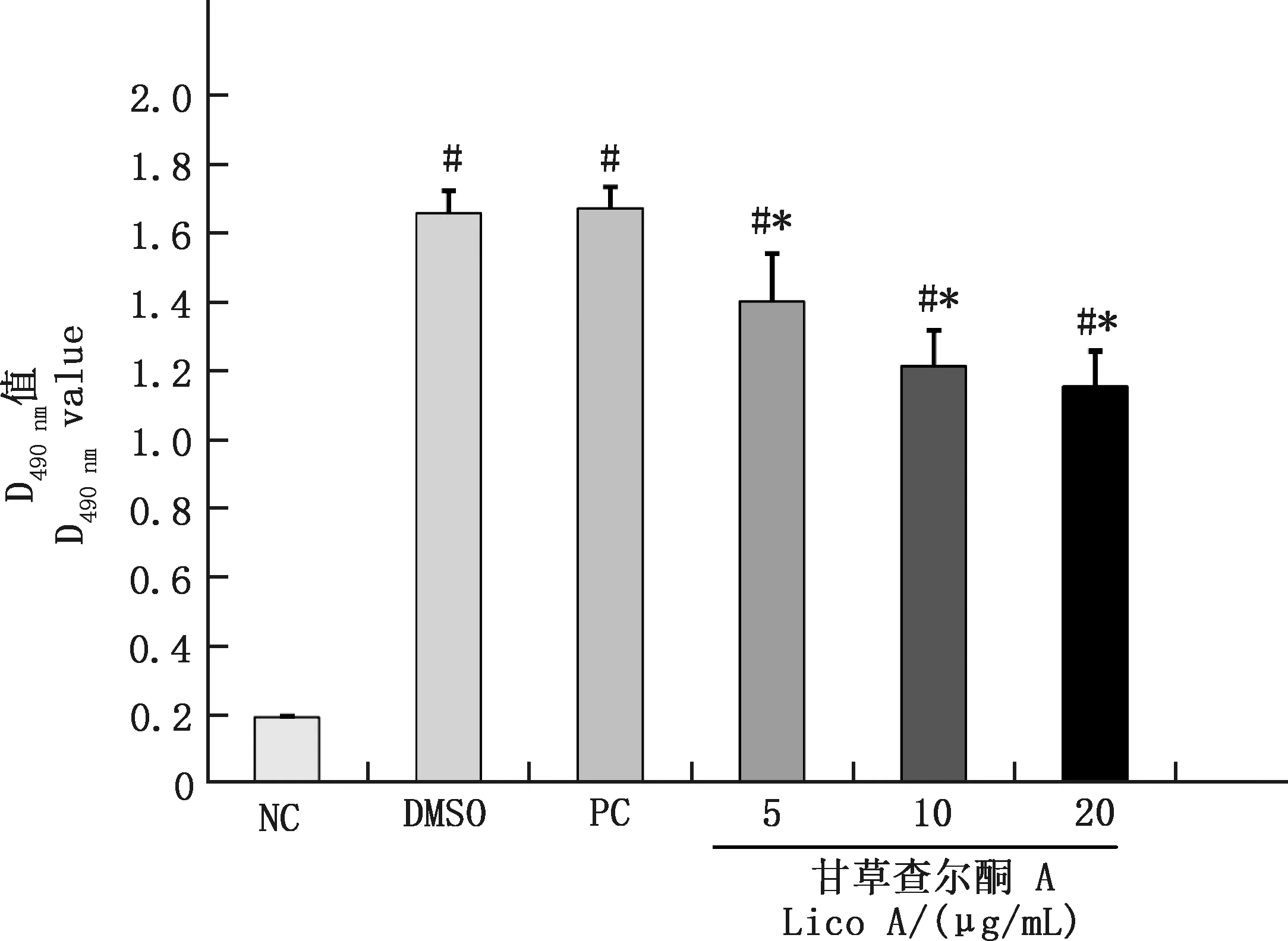
圖2 各組豬肺泡巨噬細胞LDH活性
2.3 甘草查爾酮A對副豬嗜血桿菌感染豬肺泡巨噬細胞氧化/抗氧化指標的影響
由表1可知,副豬嗜血桿菌感染24 h后,與NC組相比,PC組豬肺泡巨噬細胞的MDA和NO水平及SOD活性均顯著增加(P<0.05),而2組之間GSH-Px和T-AOC的活性差異不顯著(P>0.05);5、10和20 μg/mL甘草查爾酮A組MDA和NO水平及GSH-Px、SOD和T-AOC活性均顯著增加(P<0.05)。與PC組相比,5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞的MDA和NO水平呈劑量依賴降低,其中10和20 μg/mL甘草查爾酮A組顯著降低(P<0.05);5、10和20 μg/mL甘草查爾酮A組GSH-Px、SOD和T-AOC活性均呈劑量依賴性顯著升高(P<0.05)。
2.4 甘草查爾酮A對副豬嗜血桿菌感染豬肺泡巨噬細胞ROS產生的影響
由圖3可知,與NC組相比,副豬嗜血桿菌感染24 h后,PC組及5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞均出現較強的綠色熒光信號。與PC組相比,5、10和20 μg/mL甘草查爾酮A組細胞的綠色熒光信號有所降低(圖3D~3F),其中,在20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞綠色熒光信號非常弱。定量分析結果也顯示,與NC組相比,PC組及5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞的ROS水平均顯著增加(P<0.05);與PC組相比,5、10和20 μg/mL甘草查爾酮A組豬肺泡巨噬細胞的ROS水平均顯著降低(P<0.05)(圖4)。
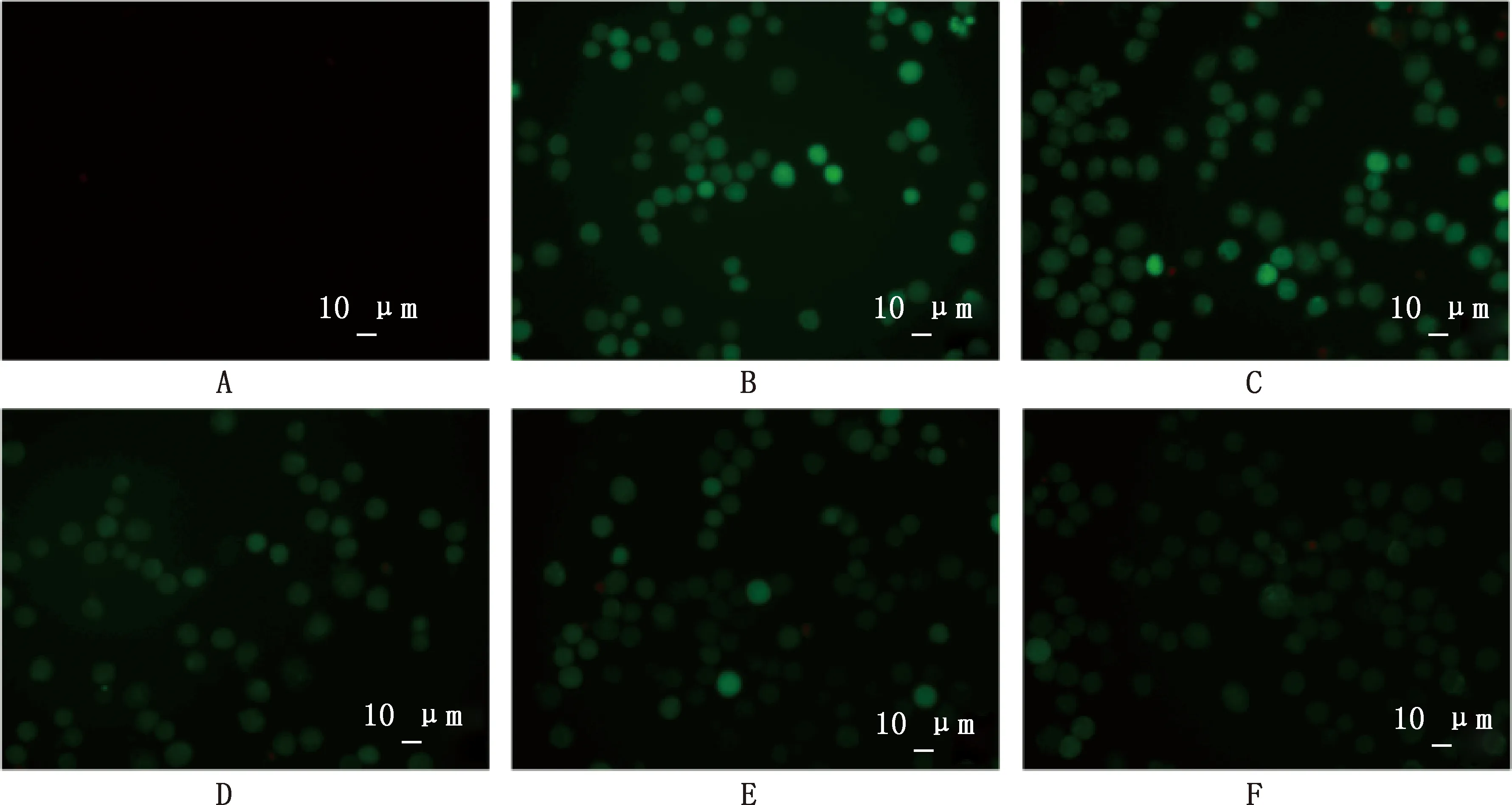
A~F,分別代表NC組、DMSO組、PC組及5、10和20 μg/mL甘草查爾酮A組
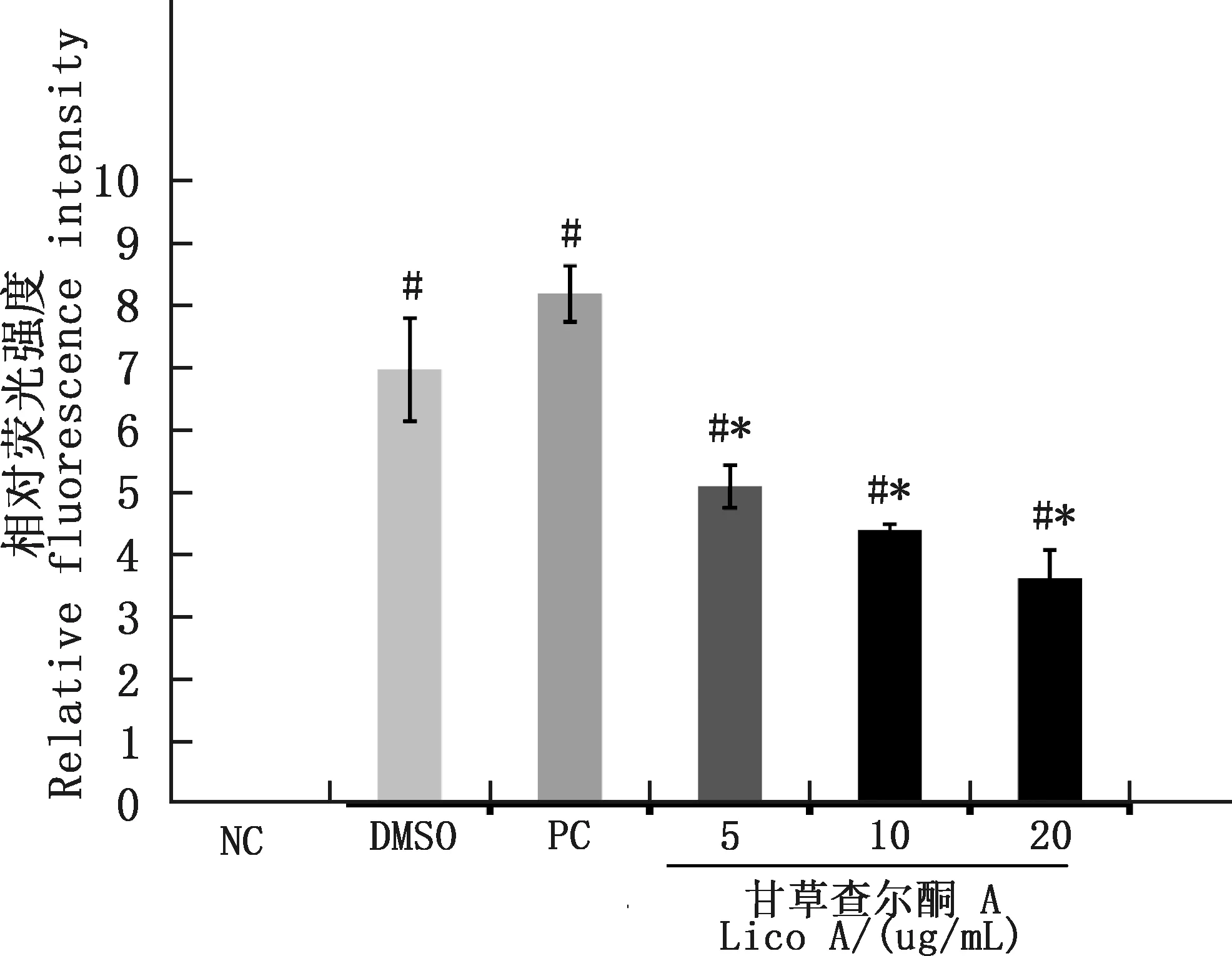
圖4 各組豬肺泡巨噬細胞ROS的定量分析
3 討 論
肺部感染副豬嗜血桿菌時,肺泡巨噬細胞在抵抗細菌致病方面發揮著重要的作用[19]。Olvera等[20]建立了副豬嗜血桿菌感染豬肺泡巨噬細胞的體外模型,為研究副豬嗜血桿菌與宿主免疫細胞的互作提供了重要幫助。本研究結果發現,豬肺泡巨噬細胞感染副豬嗜血桿菌后活力顯著降低,與副豬嗜血桿菌感染豬肺泡上皮細胞導致活性降低的研究結果一致[13]。而甘草查爾酮A處理后,豬肺泡巨噬細胞活力得到明顯提高。
LDH活性被認為是氧化應激條件下檢測細胞狀態的可靠標記[21]。本研究發現,豬肺泡巨噬細胞感染副豬嗜血桿菌后LDH釋放量顯著增加,而張學諒[22]發現副豬嗜血桿菌遼寧分離株感染PK-15細胞后細胞LDH相對釋放量極顯著增加。在H2O2誘導心肌細胞損傷模型中,甘草查爾酮A可抑制LDH的活性[23]。在本研究中,甘草查爾酮A亦可抑制副豬嗜血桿菌感染豬肺泡巨噬細胞LDH的釋放,這說明甘草查爾酮A可緩解副豬嗜血桿菌對巨噬細胞的損傷。
氧化應激標志物MDA是氧化應激代謝過程中評估脂質過氧化狀態的重要指標。以往研究發現,副豬嗜血桿菌感染豬肺泡上皮細胞后豬肺泡上皮細胞MDA和NO氧化水平明顯增高,而GSH-Px、SOD和T-AOC活性顯著降低,豬肺泡上皮細胞出現氧化-抗氧化平衡紊亂[13]。本研究結果表明,與未感染的豬肺泡巨噬細胞相比,副豬嗜血桿菌感染豬肺泡巨噬細胞的MDA和NO水平明顯增加,說明副豬嗜血桿菌感染可引發非免疫細胞和免疫細胞氧化-抗氧化平衡紊亂。細胞中的內源酶和非酶抗氧化劑在防御各種革蘭氏陽性和革蘭氏陰性細菌的氧化損傷中發揮著重要作用[24]。在乙酰氨基酚氧化損傷的小鼠模型中,甘草查爾酮A可有效抑制MDA的形成,并降低肝臟中GSH和SOD的活性[14]。本研究發現,甘草查爾酮A處理后,豬肺泡巨噬細胞中的GSH-Px、SOD和T-AOC活性均顯著提高,同時MDA和NO的水平降低,即甘草查爾酮A在細菌誘發豬肺泡巨噬細胞的氧化-抗氧化平衡紊亂中趨向于提高抗氧化作用。
氧化造成炎癥是疾病發生的重要因素之一。機體免疫細胞或非免疫細胞在受到致病性微生物感染后產生過量ROS,常常引發氧化應激[25],并可能導致持久性細菌感染[26]。本研究發現,副豬嗜血桿菌感染豬肺泡巨噬細胞后細胞內ROS活性明顯升高。副豬嗜血桿菌還可刺激外周血單核細胞產生ROS,導致組織氧化損傷,而預先給予黃芩苷干預,細胞ROS活性明顯降低[27],2~8 μg/mL甘草查爾酮A可以抑制肝細胞的氧化作用[28]。此外,甘草查爾酮A可顯著降低脂多糖(LPS)誘導的小鼠急性氧化性肺損傷[29]。本研究發現,5~20 μg/mL甘草查爾酮A處理豬肺泡巨噬細胞時,副豬嗜血桿菌感染豬肺泡巨噬細胞ROS活性顯著降低,進一步說明甘草查爾酮A可保護細胞免受氧化損傷。
4 結 論
副豬嗜血桿菌感染豬肺泡巨噬細胞后其活力降低,LDH活性及ROS、MDA和NO水平增加,5、10和20 μg/mL甘草查爾酮A均顯著提高副豬嗜血桿菌感染豬肺泡巨噬細胞的活力及GSH-Px、SOD和T-AOC活性,降低LDH和ROS活性以及MDA和NO水平。研究結果可為將甘草查爾酮A應用于抗副豬嗜血桿菌感染制劑的研發奠定基礎。

